このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒト冠動脈のin vivo機械的特性を定量化するための血管内超音波画像ベース有限要素モデリングアプローチ
* これらの著者は同等に貢献しました
要約
In vivo Cine Invascular 超音波画像は、さまざまな圧力負荷条件に対応する冠動脈断面の動きを示しています。有限要素モデルに基づいて、反復スキームを使用して、計算モデルと医用画像からの冠状動脈の動きを一致させることにより、 in vivo で冠状動脈の患者固有の機械的特性を決定しました。
要約
冠動脈壁の機械的特性を定量化することで、冠動脈疾患の診断、管理、治療に有意義な情報を提供できる可能性があります。継続的なモニタリングが必要な患者には、患者固有の冠状動脈サンプルが利用できないため、血管の材料特性を直接実験的に試験することは不可能になります。現在の冠動脈モデルでは、通常、入手可能な文献からの材料パラメータが使用されるため、大きな機械的応力/ひずみ計算エラーが発生します。ここでは、医用画像に基づいて冠動脈の患者特異的な in vivo 材料特性を定量化するための有限要素モデルベース更新アプローチ(FEMBUA)を紹介します。冠動脈の in vivo シネ血管内超音波 (IVUS) および仮想組織学 (VH)-IVUS の冠動脈の画像は、冠動脈疾患の患者から取得されました。1 つの心周期にわたる血管の動きを示す Cine IVUS 画像をセグメント化し、収縮期および拡張期の圧力条件下での冠状動脈の形状を表すために、最大ルーメン周囲長と最小ルーメン円周を持つ 2 つの IVUS フレームを選択しました。また、VH-IVUS画像をセグメント化して血管の輪郭を取得し、VH-IVUSの輪郭に0.05cmの層厚を加えて冠状動脈の形状を再構築しました。異方性Mooney-Rivlin材料モデルを使用して、血管の機械的特性と冠状動脈管腔表面に規定された脈動性血圧条件を記述して、収縮と拡張を行うための計算有限要素モデルを作成しました。次に、反復的な更新アプローチを使用して、計算有限要素モデルの最小ルーメン円周と最大ルーメン円周をCINE IVUS画像からの最小ルーメン円周と最大ルーメン円周を一致させることにより、異方性Mooney-Rivlinモデルの材料パラメータを決定しました。この画像ベースの有限要素モデルベースの更新アプローチは、さまざまな血管床の動脈壁の材料特性を決定するためにうまく拡張でき、心血管疾患のリスク評価の可能性を秘めています。
概要
冠動脈疾患(CAD)は、死亡率と罹患率の主要な原因の1つであり、2019年には世界で914万人以上が死亡しています1,2。アテローム性動脈硬化症や狭窄症などの冠動脈疾患の発症は、しばしば機械的な力の変化や血管壁の材料特性の変化を伴います3。冠状動脈の材料特性は、生理学的負荷に対する機械的応答を決定するための基礎であるだけでなく、血管の機械的挙動をシミュレートし、アテローム性動脈硬化性病変の発症を予測し、さまざまな医療機器の治療効果を評価するための重要な要素でもあります4,5.したがって、冠状動脈材料特性の深い理解と正確な定量化は、早期疾患診断、精密医療、および予後評価にとって最も重要な価値を保持しています6。
平面二軸試験、インデンテーション試験、インフレーション伸長試験、一軸伸展試験など、単離された冠状動脈組織の機械的実験は、冠状血管壁の機械的特性をex vivoで定量化するための一般的なアプローチです7,8,9。これらのアプローチから、患者または実験動物から冠動脈サンプルを採取した。機械的試験を実施して、さまざまな応力条件下での血管壁のひずみ応答を決定し、次に実験データ10を適合させることにより材料パラメータを決定しました。以前の研究では、冠状動脈の特性は非常に非線形で異方性であることが示されています11。ex vivo実験では正確な材料特性データを提供できますが、次のような大きな制限も存在します:まず、生きている被験者から取り出した後のサンプルの機械的挙動は、in vivo条件下での機械的挙動とは異なり、試験結果の精度に影響を与える可能性があります。第二に、倫理的および実際的な制約のために、機械的試験を実施するために冠状動脈の正常組織または病理学的組織の大規模なコレクションを取得することは困難です。
これらの制限を克服するために、研究者は冠状動脈材料特性のin vivo、リアルタイム、および患者固有の定量化のための新しい技術を模索してきました。その中でも、医用画像に基づく有限要素モデルベースの更新アプローチ(FEMBUA)は、これらの困難な問題を解決することが期待されています。このアプローチでは、血管内超音波(IVUS)や仮想組織学(VH)-IVUSなどの高度なイメージング技術を利用して、詳細な冠状動脈の形状、組織組成、およびその動きをキャプチャします12。3D有限要素(FE)モデルを構築し、患者固有の生理学的血圧条件を組み込むことにより、画像データに一致するように材料パラメータを最適化することにより、心周期中の動的な血管挙動を回復し、冠状動脈材料特性を迅速かつ正確に定量化することができました13。ex vivo実験に対するin vivo FE更新アプローチの利点には、組織切除を伴わないin vivo評価、大規模な評価の容易化、冠状動脈疾患の病態生理学的理解を支援するための複雑な条件下での血管動態のシミュレーションなどがあります。
本稿では、CINE IVUSおよびVH-IVUS画像の詳細なセグメンテーションと処理、計算薄層構造のみのモデルの再構成、冠動脈組織の最適な材料パラメータを探索するための反復スキームの実行など、有限要素モデルベースの更新アプローチの主要なステップを紹介する。このプロトコルの目的は、FEMBUA法をデモンストレーションとして、特に段階的な方法の図示として、CADを使用してサンプル患者からの冠状動脈の材料特性を定量化することです。最後に、この in vivo 法の意義などについてお話ししました。
選択された参加者は、冠状動脈疾患の既往歴がない 64 歳の女性です。この患者は、胸痛の症状を呈した後、冠動脈疾患と診断されました。診断を確認するために、冠動脈造影とIVUSスキャンが行われました。60%の狭窄を伴うプラーク病変が左前下行動脈の中央に発見されました。評価後、患者を治療するために最適な内科的療法が採用されました。
プロトコル
in vivo IVUS画像や血圧データなどの匿名化された臨床データは、インフォームドコンセントを得て、東南大学中大病院のCAD患者から取得されました。サンプル患者は、患者特異的な冠状動脈血管の材料特性を定量化する方法を実証するために、中間冠状動脈アテローム性動脈硬化性病変に関する臨床研究の患者プールから選択された14。この研究は、東南大学中大病院の臨床研究倫理委員会によって承認されたプロトコル (承認番号: 2017ZDSYLL023-p01) に従って実施されました。
1. データの取得と処理
- Cine IVUSおよびVH-IVUS画像取得
- 冠動脈造影のガイダンスを使用して、IVUSカテーテルをアテローム性動脈硬化病変の遠位に配置し、近位側に引き戻します。途中でグレースケールIVUS画像を生成し、冠状血管の断面を視覚化します。
- 高性能な20MHz、2.9Fプラチナカテーテルを搭載したIVUSイメージングシステムを使用して、CADで患者からアテローム性動脈硬化性プラークを伴う冠動脈セグメントのIVUS画像を取得します(図1)。
- IVUS 画像取得中に、事前に選択した病変部位でカテーテルを約 2 秒間一時停止して、シネ IVUS と呼ばれる一連の IVUS 画像を取得します。シネIVUS画像は、心周期にわたる特定のプラーク部位での動的な断面変化を明確に示していました。
- 心電図上のRピークの瞬間に取得したIVUSフレームに基づいてVH-IVUS画像を生成し、イメージングシステムを使用してプラーク成分を色分けして視覚化します。
注:VH-IVUS画像は、アテローム性動脈硬化性プラークの4つの主要なプラーク成分の直感的なカラーマップを提供します:赤の脂質リッチ壊死コア(脂質)、白の石灰化、濃い緑色の線維性組織、薄緑色の線維性脂肪組織。 - VH-IVUSおよびシネIVUS画像をDICOM形式で保存し、オフライン分析を行います。
- 画像のセグメンテーションと処理
- ビューアを使用してDICOMファイルを開き、 対応するシーケンス名 をダブルクリックして画像を開き、[ エクスポート]>[画像のエクスポート ]をクリックして、各シネIVUSフレームまたはVH-IVUSフレームを個別の画像としてBMP形式で保存します。各 BMP イメージには、元の DICOM ファイルで示されているように、500 x 500 ピクセルが含まれています。
- シネ IVUS 画像をフレームごとに調べて、1 回の心周期中に事前に選択したプラーク部位で取得された連続フレームを見つけます。このサンプルプラーク部位では、1 回の心周期中に 26 個の cine IVUS フレームが生成されました。
- 生成されたすべてのVH-IVUS画像を調べて、特定のプラークサイトで得られたVH-IVUS画像を見つけます。ここで使用したVH-IVUS画像は、1つの心周期のシネIVUSフレームから1つのIVUSフレームを使用して作成されました。
- ImageJソフトウェアを使用してVH-IVUS画像とCINEIVUS画像をセグメント化し、血管境界とプラーク成分境界の輪郭を取得します( 図1Cを参照)。
- 「Straight > Segmented Line」タブを選択し、シネIVUSおよびVH-IVUS画像上の内腔の輪郭、冠血管の外側境界、およびプラーク成分を手動で描きます。シネ IVUS 画像では、内腔と血管外縁の輪郭のみをセグメント化しますが、VH-IVUS 画像では、内腔、血管外境界、およびプラーク コンポーネントの境界の輪郭をセグメント化します。
- 簡単にするために、有限要素モデルの生成には大きな脂質成分のみを保持し、小さな孤立した脂質成分は無視します。このプラークサンプルには脂質が1つだけ存在していました。「 イメージ>オーバーレイ」>「選択項目を追加 」タブを使用して、線引きされた輪郭を元の画像にオーバーレイします。
- 「ROIマネージャーへ」メニューに移動して、等高線の管理、プロパティの調整、色と線幅の適切な値への設定を行い、視覚化を改善します。[プロパティ] タブを選択し、ストロークの色を別の色に設定し、線幅を幅で塗りつぶします。ここでは、ルーメン、外界、脂質の等高線の線の色をそれぞれ緑、青、赤に設定し、線幅を 3 に設定します。
- 特定の輪郭を選択した後、コマンド バーから >[選択範囲の編集] > [スプラインに合わせる ] を使用して輪郭を滑らかにすると、滑らかな輪郭が得られます。この操作では、スプライン曲線フィッティング技術を使用して、輪郭を自動的に滑らかにします。
- 「ファイル」>「名前を付けて保存」>「XY座標」タブをクリックして、ルーメン、外界、プラークコンポーネントなどの各輪郭の点座標を個別のtxtファイルに保存します。このファイルには、輪郭を構成する点の x 座標値と y 座標値が含まれており、単位はピクセルです。
- DICOM ファイルから cine IVUS および VH-IVUS 画像 (ピクセル サイズで表示) の各ピクセルの実際の物理サイズを記録します。ここで使用したIVUSデータの1ピクセルの実距離は0.002cmです。この情報は、ピクセルを単位とする点座標を、単位として cm を使用する実距離に変換するために使用されます。
- 等高線データ処理
- Cine IVUS輪郭データ処理
- MATLAB を使用して、1 つの心周期のすべての cine IVUS 画像から内腔輪郭の txt ファイルを読み取ります。
- すべてのルーメン輪郭にピクセルサイズを掛けて、ルーメン輪郭の実際のサイズを取得します。
- すべてのルーメン輪郭のルーメン円周を計算し、拡張期と収縮期の状態をそれぞれ表す最大ルーメン円周(Cmax)と最小ルーメン円周(Cmin)を持つIVUSフレームを特定します。
- VH-IVUS輪郭データ処理
- VH-IVUS 画像から内腔、外界、およびプラーク成分の輪郭の txt ファイルを MATLAB で読み取ります。
- すべての輪郭にピクセル サイズを掛けて、すべての輪郭の実際のサイズを取得します。
- 各コンターを等間隔の 100 個のポイントに再分割し、2D スムージングを実行して、古いコンターを置き換える新しい VH-IVUS コンター データを取得します。
- Cine IVUS輪郭データ処理
2. 有限要素モデル
- 冠動脈血管形状再建
- VH-IVUS輪郭のすべての点(ルーメン、外界、脂質を含む)にz座標値を加算し、すべての点にz = 0を設定して、3次元空間に1つの等高線層を作成します(図2)。
- VH-IVUS等高線のすべての点にz座標値を追加し、すべての点についてz = 0.05 cmをリセットすることにより、等高線の別のレイヤーを作成します。
注:これらの2つの等高線層は、VH-IVUSの等高線に固定0.05cmの層厚を追加することにより、薄層構造のみのモデルの3D冠状動脈血管形状を再構築します(図2)。
- 有限要素メッシュの生成
- 各レイヤーの重みが 1/3 と 2/3 のルーメンと外側の境界コンター (図 3A) を線形補間することにより、2 つの補助コンターを作成します。
- 内腔/外側の境界を脂質輪郭上の最も近い点(図3Bの点AとBなど)または放射状の線で2つの補助輪郭に接続することにより、血管領域を8つの円周部分と3つの放射状部分(図3Bを参照)に分割します。
- レイヤー間のすべての点を直線で接続し、3 x 8 のボリュームで 3D 構造を形成します (図 3B)。六面体要素を使用して各ボリュームを分割し、有限要素メッシュ(図 3C)と異なる材料グループ(図 3D)を生成します。
- メッシュ解析を実行するには、解の変化が 5% になるまでメッシュ密度を 10% <細分化します。
- 材料特性の定義
- 修正された異方性 Mooney-Rivlin 材料モデルを使用して、冠状血管壁の材料特性を記述します。冠状血管とプラーク成分は、超弾性、異方性、ほぼ非圧縮性、均質な材料であると仮定され、修正された異方性Mooney-Rivlin材料モデルのひずみエネルギー密度関数は次のとおりです。
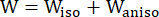 (1)
(1)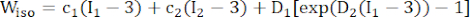 (2)
(2)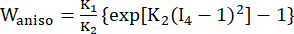 (3)
(3)
ここで、I1 と I2 は、c = [cij] = XTX, X = [Xij] = [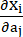 ], (Xi) は現在の位置、I4 = cij(nc)i(nc)j、nc は容器の円周方向の単位ベクトルです。 c1, c2、D1、D2、K1、K2 は、患者固有の材料パラメータでした。
], (Xi) は現在の位置、I4 = cij(nc)i(nc)j、nc は容器の円周方向の単位ベクトルです。 c1, c2、D1、D2、K1、K2 は、患者固有の材料パラメータでした。 - ex vivo 二軸試験結果、つまり c1 = −1,312.9 kPa、c2 = 114.7 kPa、D1 = 629.7 kPa、D2 = 2.0、K1 = 35.9 kPa、K2 = 23.5 に従って、患者固有の冠状血管の材料パラメータの初期値を割り当てます (図 4A-B)13,15。
- プラークコンポーネントが存在する場合は、材料のパラメータを割り当てます。より具体的には、脂質の場合、c1 = 0.5 kPa、c2 = 0、D1 = 0.5 kPa、およびD2 = 1.5;石灰化には、c1=920 kPa、c2=0、D1=360 kPa、およびD2=2.0を使用しました(図4B)16。
注:プラーク成分(脂質および石灰化)は、超弾性、等方性、およびほぼ非圧縮性であると仮定され、それらの機械的特性は、式(2)で与えられるひずみエネルギー密度関数を使用して等方性ムーニー-リブリン材料モデルによって記述されました。
- 修正された異方性 Mooney-Rivlin 材料モデルを使用して、冠状血管壁の材料特性を記述します。冠状血管とプラーク成分は、超弾性、異方性、ほぼ非圧縮性、均質な材料であると仮定され、修正された異方性Mooney-Rivlin材料モデルのひずみエネルギー密度関数は次のとおりです。
- 支配方程式と境界条件の設定
- 運動方程式、非線形 Cauchy-Green ひずみ-変位関係、冠動脈血管材料モデル11 を含む薄層構造のみモデルの支配方程式を定義します。
- ルーメン表面に患者固有の血圧波形を処方して、実際の生理学的状態をシミュレートします(図4C)。患者固有の血圧波形を取得するには、アームカフで測定した収縮期血圧と拡張期血圧の値を使用して、典型的な大動脈圧波形をスケーリングします(図4D)。
3. 患者固有の冠動脈材料特性の有限要素モデルに基づく更新アプローチ
注:患者固有の冠状動脈材料特性を決定するための反復プロセスを 図5に示します。
- VH-IVUS画像から再構成した冠状動脈形状を軸方向に95%の固定収縮率で、円周方向に収縮率(Sと表記)を初期98%として円周方向に縮小することにより、ゼロ圧力条件に対応する無負荷形状を計算モデルの初期形状として決定します。
注:VH-IVUS画像から再構築された冠状動脈形状は、内腔に血圧が規定され、つながれた遠位および近位冠動脈セグメントからの軸方向の伸張を伴う in vivo 条件下であったため、 in vivo 冠状動脈形状は、ゼロ圧力形状を得るために円周方向および軸方向に縮小する必要があります。 - 軸方向の収縮率を 95% に固定し、次の手順で円周方向の収縮を更新します。
- 冠状血管の患者固有の材料特性を割り当てるための材料比率 (k で示される) を次のように定義します: つまり、c1 = k*(-1,312.9) kPa、c2 = k*114.7 kPa、D1 = k*629.7 kPa、K1 = k*35.9 kPa、および固定 D2 = 2.0 および K2 = 23.5 です。
注:未知のパラメータ(Mooney-Rivlinモデルの円周収縮率Sと材料パラメータ)を決定するために、2つのデータポイント(拡張期血圧と収縮期血圧に対応する最小および最大ルーメン円周)のみが得られたため、冠状血管の in vivo 患者固有の材料特性がkとして表される材料比率の初期推定に比例すると仮定して、未知のパラメータの数を減らしました。 すなわち、c1 = k*(−1,312.9) kPa、c2 = k*114.7 kPa、D1 = k*629.7 kPa、K1 = k*35.9 kPa、D2 = 2.0、K2 = 23.5 は固定された。 - 次の反復手順で、初期値 k を 1 に設定した k 値と円周方向の収縮率 S に更新します。
- ソフトウェアを実行して計算モデルを解き、数値結果を取得します。
- 薄層構造のみのモデルを作成するためのすべてのコマンドを、MATLAB を使用してバッチ ファイル (補足ファイル 1) に書き込みます。
- このバッチファイルをアドバンストユーザーインターフェース(AUI)を使用してロードし、モデルを生成します(図6A)。 Data File/Solution をクリックして薄層構造のみのモデルを解き、.datファイルとして保存します(図 6C)。3 つの心周期をシミュレートし、最後の周期の解を採用して数値結果を表示します。
- ノード座標の結果をtxtファイルにエクスポートするには 、[List > Value List > Zone ]に移動し、[Coordinate to List]の下の[Variables to List]で X-POSITION、Y-POSITION、 および Z-POSITION を選択します。 「適用 して エクスポート 」をクリックして、座標結果をエクスポートします。
- 拡張期および収縮期の圧力条件に対応するルーメンコンターデータを、ルーメン円周計算用の.txtファイルに保存します。
- 拡張期血圧条件でのFEモデル(薄層構造のみモデル)で計算した内腔円周とin vivo cine IVUSデータ(Cmin)を比較し、相対誤差が<1%であったか確認します。条件が満たされた場合は、次のステップに進むか、割線法を使用して材料比kを更新し、ステップ3.3に進んで再度実行します17,18。
注: 最初の反復では、割線法の代わりにニュートン法を使用して材料比率を更新しました。 - 収縮期血圧条件でFEモデルによって計算されたルーメン周囲を in vivo cine IVUSデータ(Cmax)と比較し、相対誤差が<1%であったかどうかを確認します。「はい」の場合は、反復手順を停止するか、円周収縮率 S を更新し、ステップ 3.4 にリダイレクトして再実行します。
注:最初の反復では、割線法の代わりにニュートン法を使用して円周収縮率を更新しました。 - 最適な S 値と k 値を記録し、Mooney-Rivlin 材料モデルの対応する材料パラメータを計算します。
- 冠状血管の円周方向および軸方向の応力-伸張比曲線をプロットします(図7)、次のように導き出すことができます。
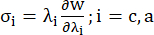 (4)
(4)
ここで、σはコーシー応力、λは伸張率、i = c、aは円周方向と軸方向を表します。- 特定の方向にマテリアル曲線を描くには、他の方向のストレッチ率を 1 に固定します。円周方向と軸方向の実効ヤング率 (それぞれ YMc と YMa とラベル付け) を、伸張率間隔 [1.0, 1.1] での材料曲線のスケール関数の傾きとして計算し、冠状動脈13 の一般的な材料剛性を反映します。
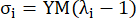 (5)
(5)
- 特定の方向にマテリアル曲線を描くには、他の方向のストレッチ率を 1 に固定します。円周方向と軸方向の実効ヤング率 (それぞれ YMc と YMa とラベル付け) を、伸張率間隔 [1.0, 1.1] での材料曲線のスケール関数の傾きとして計算し、冠状動脈13 の一般的な材料剛性を反映します。
- プラーク応力/ひずみ分布をいつでも抽出し、収縮期および拡張期の節点分布と最大応力値を記録します(図8)。
結果
FEMBUA法について詳細に説明し、リアルタイムIVUSイメージング後の冠状動脈プラークの迅速なプラーク材料および応力分析を可能にし、プラークの in vivo 材料特性および生体力学的結果を決定できる。この冠状血管のMooney-Rivlin材料モデルの in vivo 材料パラメータを 表1に示します。冠状血管内の応力 / ひずみ分布を含む有限要素モデルのシミ...
ディスカッション
プロトコルの重要なステップ
有限要素モデルベースの更新アプローチで最も重要なステップは、反復手順にあります。このアプローチでは、有限要素モデルは、 in vivo CINE IVUS 画像から血管断面積上の冠状血管の動きを正確に回復する必要があります。この目的のために、本研究では、有限要素モデルと in vivo 画像との間のルーメン円周?...
開示事項
著者は、利益相反を宣言しません。
謝辞
本研究の一部は、山東省医療健康科学技術プロジェクト(第202425020256号、第202403010254号)、中国国家自然科学基金会の助成金11972117および11802060、江蘇省自然科学基金会(助成金番号BK20180352)、山東省自然科学基金会(助成金番号ZR2024QA110)の支援を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| Bee DICOM Viewer | SinoUnion Healthcare Inc. | Version 3.5.1 | A DICOM image reader software |
| ADINA | Adina R & D | Version 9.0 | Finite element solver |
| ImageJ | National Institutes of Health | Segmented IVUS contours | |
| MATLAB | MathWorks | Version R2018a | Commercial programming platform |
| Volcano s5 imaging system | Volcano Company | Intravascular ultrasound imaging system |
参考文献
- Roth, G. A., et al. Global burden of cardiovascular diseases and risk factors, 1990-2019: update from the GBD 2019 study. J Am Coll Cardiol. 76 (25), 2982-3021 (2020).
- Kanwar, S. S., et al. Acute coronary syndromes without coronary plaque rupture. Nat Rev Cardiol. 13 (5), 257-265 (2016).
- Milzi, A., et al. Coronary plaque composition influences biomechanical stress and predicts plaque rupture in a morpho-mechanic OCT analysis. Elife. 10, e64020 (2021).
- Stefanati, M., et al. Effect of variability of mechanical properties on the predictive capabilities of vulnerable coronary plaques. Comput Methods Programs Biomed. 254, 108271 (2024).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27 (21), 2588-2605 (2006).
- Daisuke, K., et al. Coronary plaque phenotype associated with positive remodeling. J Cardiovasc Comput Tomogr. 18 (4), 401-407 (2024).
- Macrae, R. A., Miller, K., Doyle, B. J. Methods in mechanical testing of arterial tissue: A review. Strain. 52, 380-399 (2016).
- Hayashi, K. Experimental approaches on measuring the mechanical properties and constitutive laws of arterial walls. J Biomech Eng. 115 (4B), 481-488 (1993).
- Sacks, M. S., Sun, W. Multiaxial mechanical behavior of biological materials. Annu Rev Biomed Eng. 5, 251-284 (2003).
- Charis, C., et al. Impact of combined plaque structural stress and wall shear stress on coronary plaque progression, regression, and changes in composition. Eur Heart J. 40 (18), 1411-1422 (2019).
- Wang, L., et al. Quantifying patient-specific in vivo coronary plaque material properties for accurate stress/strain calculations: An IVUS-based multi-patient study. Front Physiol. 12, 721195 (2021).
- Guo, X. Y., et al. Quantify patient-specific coronary material property and its impact on stress/strain calculations using in vivo IVUS data and 3D FSI models: a pilot study. Biomech Model Mechanobiol. 16 (1), 333-344 (2017).
- Wang, L., et al. Quantification of patient-specific coronary material properties and their correlations with plaque morphological characteristics: An in vivo IVUS study. Int J Cardiol. 371, 21-27 (2023).
- Lu, W., et al. Accurate identification of potential critical coronary lesions for the reduction of risk of cardiovascular events: study protocol for a randomized, open-label, active-controlled multi-center trial. Clin Trial Degenerat Dis. 3 (3), 106-110 (2018).
- Lv, R., et al. Using optical coherence tomography and intravascular ultrasound imaging to quantify coronary plaque cap stress/strain and progression: A follow-up study using 3D thin-layer models. Front Bioeng Biotechnol. 9, 713525 (2021).
- Camasao, D. B., Mantovani, D. The mechanical characterization of blood vessels and their substitutes in the continuous quest for physiological-relevant performances. A critical review. Mater Today Bio. 10, 100106 (2021).
- Holistic Numerical Methods Institute at University of South Florida. . Secant Method. , (2003).
- Barnes, J. An algorithm for solving nonlinear equations based on the secant method. Comp J. 8 (8), 66-72 (1965).
- Liu, M., Liang, L., Sun, W. A new inverse method for estimation of in vivo mechanical properties of the aortic wall. J Mech Behav Biomed Mater. 72, 148-158 (2017).
- Yu, H., et al. Patient-specific in vivo right ventricle material parameter estimation for patients with tetralogy of Fallot using MRI-based models with different zero-load diastole and systole morphologies. Int J Cardiol. 276, 93-99 (2019).
- Meuwissen, M. H. H., Oomens, C. W. J., Baaijens, F. P. T., Petterson, R., Janssen, J. D. Determination of the elasto-plastic properties of aluminium using a mixed numerical-experimental method. J Mater Process Technol. 75, 204-211 (1998).
- Davis, F. M., Luo, Y., Avril, S., Duprey, A., Lu, J. Local mechanical properties of human ascending thoracic aneurysms. J Mech Behav Biomed Mater. 61, 235-249 (2016).
- Fan, L., Wang, H., Kassab, G. S., Lee, L. C. Review of cardiac-coronary interaction and insights from mathematical modeling. WIREs Mech Dis. 16 (3), e1642 (2024).
- Andreas, W., et al. A finite element updating approach for identification of the anisotropic hyperelastic properties of normal and diseased aortic walls from 4D ultrasound strain imaging. J Mech Behav Biomed Mater. 58, 122-138 (2016).
- Liu, M., et al. Identification of in vivo nonlinear anisotropic mechanical properties of ascending thoracic aortic aneurysm from patient-specific CT scans. Sci Rep. 9, 12983 (2019).
- Trabelsi, O., Duprey, A., Favre, J. P., Avril, S. Predictive models with patient specific material properties for the biomechanical behavior of ascending thoracic aneurysms. Ann Biomed Eng. 44, 84-98 (2016).
- Cosentino, F., et al. On the role of material properties in ascending thoracic aortic aneurysms. Comput Biol Med. 109, 70-78 (2019).
- Krauz, K., et al. The role of epicardial adipose tissue in acute coronary syndromes, post-infarct remodeling and cardiac regeneration. Int J Mol Sci. 25 (7), 3583 (2024).
- McCracken, I. R., Smart, N. Control of coronary vascular cell fate in development and regeneration. Semin Cell Dev Biol. 155 (Pt C), 50-61 (2024).
- Holzapfel, G. A., et al. Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling. Am J Physiol Heart Circ Physiol. 289 (5), H2048-H2058 (2005).
- Han, Y., et al. Ventricle stress/strain comparisons between Tertalogy of Fallot patients and healthy using models with different zero-load diastole and systole morphologies. PLoS One. 14 (8), e0220328 (2019).
- Ryo, K., et al. Role of the low-density lipoprotein-cholesterol/high-density lipoprotein-cholesterol ratio in predicting serial changes in the lipid component of coronary plaque. Circ J. 81 (10), 1439-1446 (2017).
- Thomas, T. W., et al. In vivo characterization and quantification of atherosclerotic carotid plaque components with multidetector computed tomography and histopathological correlation. Arterioscler Thromb Vasc Biol. 26 (10), 2366-2372 (2006).
- Masanori, K., et al. In vivo quantitative tissue characterization of human coronary arterial plaques by use of integrated backscatter intravascular ultrasound and comparison with angioscopic findings. Circulation. 105 (21), 2487-2492 (2002).
- Roach, M. R., Burton, A. C. The reason for the shape of the distensibility curves of arteries. Can J Biochem Physiol. 35, 681-690 (1957).
- Fung, Y. C., Liu, S. Q. Strain distribution in small blood vessel with zero-stress state taken into consideration. Am J Physiol. 262, 544-552 (1992).
- Ohayon, J., et al. Influence of residual stress/strain on the biomechanical stability of vulnerable coronary plaques: Potential impact for evaluating the risk of plaque rupture. Am J Physiol Heart Circ Physiol. 293, 1987-1996 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved