È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Approccio di modellazione agli elementi finiti basato su immagini a ultrasuoni intravascolari per quantificare le proprietà meccaniche in vivo dell'arteria coronarica umana
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Le immagini ecografiche intravascolari cine in vivo mostrano il movimento della sezione trasversale coronarica corrispondente a diverse condizioni di carico pressorio. Sulla base di un modello agli elementi finiti, è stato impiegato uno schema iterativo per determinare le proprietà meccaniche specifiche del paziente delle arterie coronarie in vivo abbinando il movimento coronarico dal modello computazionale e dalle immagini mediche.
Abstract
La quantificazione delle proprietà meccaniche delle pareti arteriose coronarie potrebbe fornire informazioni significative per la diagnosi, la gestione e il trattamento delle malattie coronariche. Poiché i campioni coronarici specifici per il paziente non sono disponibili per i pazienti che richiedono un monitoraggio continuo, i test sperimentali diretti delle proprietà dei materiali dei vasi diventano impossibili. Gli attuali modelli coronarici utilizzano in genere i parametri dei materiali disponibili in letteratura, con conseguenti significativi errori di calcolo delle sollecitazioni/deformazioni meccaniche. Qui, introdurremmo un approccio di aggiornamento basato su modelli agli elementi finiti (FEMBUA) per quantificare le proprietà dei materiali in vivo specifiche del paziente delle arterie coronarie sulla base di immagini mediche. Le immagini dell'ecografia intravascolare cine (IVUS) in vivo e dell'istologia virtuale (VH)-IVUS delle arterie coronarie sono state acquisite da un paziente con malattia coronarica. Le immagini IVUS cinetiche che mostrano il movimento vascolare nell'arco di un ciclo cardiaco sono state segmentate e sono stati selezionati due frame IVUS con circonferenze massime e minime del lume per rappresentare la geometria coronarica in condizioni di pressione sistolica e diastolica, rispettivamente. L'immagine VH-IVUS è stata anche segmentata per ottenere i contorni dei vasi e uno spessore dello strato di 0,05 cm è stato aggiunto ai contorni VH-IVUS per ricostruire la geometria coronarica. È stato creato un modello computazionale agli elementi finiti con un modello anisotropo di materiale Mooney-Rivlin utilizzato per descrivere le proprietà meccaniche del vaso e le condizioni di pressione sanguigna pulsatile prescritte alla superficie luminale coronarica per farla contrarre ed espandere. Quindi, è stato impiegato un approccio di aggiornamento iterativo per determinare i parametri del materiale del modello anisotropo di Mooney-Rivlin confrontando le circonferenze minime e massime del lume del modello computazionale agli elementi finiti con quelle delle immagini cine IVUS. Questo approccio di aggiornamento basato su modelli agli elementi finiti basato su immagini potrebbe essere esteso con successo per determinare le proprietà dei materiali delle pareti arteriose in vari letti vascolari e ha il potenziale per la valutazione del rischio di malattie cardiovascolari.
Introduzione
La malattia coronarica (CAD) è una delle principali cause di mortalità e morbilità, rappresentando oltre 9,14 milioni di decessi nel 2019 a livello globale 1,2. Lo sviluppo di malattie coronariche, come l'aterosclerosi e la stenosi, è spesso accompagnato da alterazioni delle forze meccaniche e cambiamenti nelle proprietà del materiale della parete vascolare3. Le proprietà dei materiali delle arterie coronarie non sono solo la pietra angolare per determinare la loro risposta meccanica al carico fisiologico, ma anche gli elementi chiave per simulare il comportamento meccanico dei vasi sanguigni, prevedere lo sviluppo di lesioni aterosclerotiche e valutare l'effetto terapeutico di vari dispositivi medici 4,5. Di conseguenza, una profonda comprensione e una quantificazione accurata delle proprietà del materiale coronarico sono di fondamentale importanza per la diagnosi precoce della malattia, la medicina di precisione e la valutazione della prognosi6.
Gli esperimenti meccanici di tessuti coronarici isolati, come il test biassiale planare, il test di indentazione, il test di inflazione-estensione e il test di estensione uniassiale, sono approcci comuni per quantificare le proprietà meccaniche delle pareti dei vasi coronarici ex vivo 7,8,9. Da questi approcci, sono stati ottenuti campioni di arteria coronarica da pazienti o animali da esperimento. Sono stati eseguiti test meccanici per determinare le risposte alla deformazione della parete del recipiente in diverse condizioni di stress, quindi i parametri del materiale sono stati determinati adattando i dati sperimentali10. Studi precedenti hanno dimostrato che le proprietà coronariche sono altamente non lineari e anisotrope11. Sebbene gli esperimenti ex vivo possano fornire dati accurati sulle proprietà dei materiali, esistono anche limitazioni significative, che sono le seguenti: in primo luogo, il comportamento meccanico del campione dopo l'estrazione dai soggetti vivi sarebbe diverso da quello in condizioni in vivo, il che potrebbe influire sull'accuratezza dei risultati dei test. In secondo luogo, a causa di vincoli etici e pratici, è difficile ottenere una vasta raccolta di tessuti normali o patologici delle arterie coronarie per eseguire i test meccanici.
Per superare queste limitazioni, i ricercatori hanno esplorato nuove tecniche per la quantificazione in vivo, in tempo reale e specifica per il paziente delle proprietà del materiale coronarico. Tra questi, l'approccio di aggiornamento basato su modelli agli elementi finiti (FEMBUA) basato sull'immagine medica promette di affrontare questi problemi impegnativi. Questo approccio si avvale di tecniche di imaging avanzate come l'ecografia intravascolare (IVUS) e l'istologia virtuale (VH)-IVUS per acquisire la geometria coronarica dettagliata, le composizioni tissutali e il suo movimento12. Costruendo modelli 3D agli elementi finiti (FE) e incorporando le condizioni fisiologiche della pressione arteriosa specifiche del paziente, è stato possibile recuperare il comportamento vascolare dinamico durante i cicli cardiaci ottimizzando i parametri dei materiali per abbinare i dati delle immagini per una quantificazione rapida e accurata delle proprietà dei materiali coronarici13. I vantaggi dell'approccio di aggiornamento degli elementi FE in vivo rispetto agli esperimenti ex vivo includono la valutazione in vivo senza escissione tissutale, la facilitazione di valutazioni su larga scala e la simulazione della dinamica vascolare in condizioni complesse per aiutare la comprensione della fisiopatologia delle malattie coronariche.
In questo articolo, vengono introdotti i passaggi chiave dell'approccio di aggiornamento basato su modelli agli elementi finiti, che includono una segmentazione dettagliata e l'elaborazione di immagini cine IVUS e VH-IVUS, la ricostruzione di un modello computazionale di sola struttura a strato sottile, l'esecuzione dello schema iterativo per la ricerca di parametri ottimali del materiale per i tessuti arteriosi coronarici. Lo scopo di questo protocollo è quantificare le proprietà del materiale dell'arteria coronaria da un campione di paziente con CAD utilizzando il metodo FEMBUA come dimostrazione, in particolare l'illustrazione di metodi passo-passo. Abbiamo concluso discutendo il significato e altri aspetti di questo metodo in vivo .
Il partecipante selezionato è una donna di 64 anni senza precedenti clinici di malattia coronarica. A questo paziente è stata diagnosticata una malattia coronarica dopo aver avuto sintomi di dolore toracico. L'angiogramma coronarico e la scansione IVUS sono stati eseguiti per confermare la diagnosi. Una lesione a placche con stenosi del 60% è stata trovata al centro dell'arteria discendente anteriore sinistra. Dopo la valutazione, è stata adottata una terapia medica ottimale per trattare il paziente.
Protocollo
I dati clinici anonimizzati, comprese le immagini IVUS in vivo e i dati sulla pressione sanguigna, sono stati acquisiti da un paziente con CAD presso lo Zhongda Hospital, Southeast University, con il consenso informato ottenuto. Il paziente campione è stato selezionato dal pool di pazienti di uno studio clinico sulle lesioni aterosclerotiche coronariche intermedie per dimostrare il metodo per quantificare le proprietà dei materiali dei vasi coronarici specifici del paziente14. Lo studio è stato condotto seguendo il protocollo approvato dal Comitato etico per la ricerca clinica dell'ospedale Zhongda, Southeast University (numero di approvazione: 2017ZDSYLL023-p01).
1. Acquisizione ed elaborazione dei dati
- Acquisizione immagini Cine IVUS e VH-IVUS
- Posizionare il catetere IVUS distalmente alla lesione aterosclerotica con la guida di un angiogramma coronarico e tirarlo indietro sul lato prossimale. Genera immagini IVUS in scala di grigi lungo il percorso per visualizzare la sezione trasversale del vaso coronarico.
- Utilizzare il sistema di imaging IVUS dotato di un catetere in platino ad alte prestazioni da 20 MHz e 2,9 F per acquisire immagini IVUS del segmento arterioso coronarico con placca aterosclerotica dal paziente con CAD (Figura 1).
- Durante l'acquisizione dell'immagine IVUS, mettere in pausa il catetere nel sito della lesione preselezionato per circa 2 secondi per ottenere una sequenza di immagini IVUS chiamata cine IVUS. Le immagini cine IVUS hanno mostrato chiaramente i cambiamenti dinamici della sezione trasversale nel sito della placca nel corso del ciclo cardiaco.
- Genera immagini VH-IVUS basate su fotogrammi IVUS acquisiti all'istante del picco R su elettrocardiogrammi per visualizzare i componenti della placca in forma codificata a colori utilizzando il sistema di imaging.
NOTA: Le immagini VH-IVUS forniscono una mappa a colori intuitiva per quattro componenti chiave della placca aterosclerotica: nucleo necrotico ricco di lipidi (lipide) in rosso, calcificazione in bianco, tessuto fibroso in verde scuro e tessuto adiposo fibroso in verde chiaro. - Salvataggio delle immagini VH-IVUS e cine IVUS in formato DICOM per l'analisi offline.
- Segmentazione ed elaborazione delle immagini
- Aprire i file DICOM utilizzando il visualizzatore, fare doppio clic sul nome della sequenza corrispondente per aprire l'immagine e fare clic su Esporta > Esporta immagini per salvare ogni fotogramma cine IVUS o VH-IVUS come singola immagine in formato BMP. Ogni immagine BMP contiene 500 x 500 pixel, come indicato dal file DICOM originale.
- Esaminare l'immagine cine IVUS fotogramma per fotogramma per trovare i fotogrammi consecutivi ottenuti nel sito della placca preselezionato durante un ciclo cardiaco. Sono stati generati 26 fotogrammi cine IVUS durante un ciclo cardiaco per questo sito di placca campione.
- Esamina tutte le immagini VH-IVUS generate per trovare l'immagine VH-IVUS ottenuta nel sito della placca dato. Le immagini VH-IVUS qui utilizzate sono state create utilizzando un fotogramma IVUS dai fotogrammi cine IVUS in un ciclo cardiaco.
- Segmentare le immagini VH-IVUS e cine IVUS utilizzando il software ImageJ per ottenere i contorni dei confini dei vasi e dei componenti della placca (vedere la Figura 1C).
- Seleziona la scheda Linea diritta > segmentata e delinea manualmente i contorni del lume, il confine esterno del vaso coronarico e i componenti della placca sulle immagini cine IVUS e VH-IVUS. Per l'immagine cine IVUS, segmentare solo i contorni del lume e del bordo del vaso esterno, mentre per l'immagine VH-IVUS, segmentare i contorni del lume, il confine del vaso esterno e i confini dei componenti della placca.
- Per semplicità, mantieni solo componenti lipidici di grandi dimensioni per generare un modello agli elementi finiti e ignora i componenti lipidici piccoli e isolati. In questo campione di placca era presente un solo lipide. Sovrapponi i contorni delineati alle immagini originali utilizzando la scheda Sovrapposizione > immagine > Aggiungi selezione .
- Passa al menu To ROI Manager per gestire i contorni, regolare le proprietà e impostare i colori e lo spessore delle linee sui valori corretti per una migliore visualizzazione. Seleziona la scheda Proprietà , imposta il colore del tratto su un colore diverso e riempi la larghezza della linea in base alla larghezza. Qui, imposta i colori della linea come verde, blu e rosso rispettivamente per il lume, il bordo esterno e i contorni lipidici e la larghezza della linea su 3.
- Contorni smussati utilizzando Modifica > Selezione > Adatta spline dalla barra dei comandi dopo aver selezionato un contorno specifico per ottenere un contorno uniforme. Questa operazione utilizza tecniche di adattamento della curva spline per smussare automaticamente i contorni.
- Fare clic su File > Salva con nome > scheda Coordinate XY per salvare le coordinate dei punti di ciascun contorno come lumen, contorno esterno e componente placca in un file txt separato. Questo file contiene i valori delle coordinate x e y dei punti che costituiscono il contorno, con i pixel come unità.
- Registra la dimensione fisica reale di ciascun pixel nelle immagini cine IVUS e VH-IVUS (indicate come dimensione dei pixel) dal file DICOM. La distanza reale per un pixel nei dati IVUS utilizzati qui è di 0,002 cm. Queste informazioni verrebbero utilizzate per convertire le coordinate del punto con il pixel come unità di misura in distanza reale con cm come unità.
- Elaborazione dei dati di contorno
- Elaborazione dei dati di contorno Cine IVUS
- Leggi i file txt dei contorni del lume da tutte le immagini cine IVUS in un ciclo cardiaco con MATLAB.
- Moltiplica tutti i contorni del lumen per la dimensione dei pixel per ottenere la dimensione effettiva dei contorni del lumen.
- Calcola le circonferenze del lume per tutti i contorni del lume e identifica le montature IVUS con le circonferenze del lume massime (Cmax) e minime (Cmin), che rappresentano rispettivamente le condizioni diastolica e sistolica.
- Elaborazione dei dati di contorno VH-IVUS
- Leggi i file txt dei contorni del lume, del bordo esterno e dei componenti della placca dall'immagine VH-IVUS con MATLAB.
- Moltiplica tutti i contorni per la dimensione in pixel per ottenere la dimensione effettiva di tutti i contorni.
- Dividi nuovamente ogni contorno in 100 punti equidistanti ed esegui la levigatura 2D per ottenere nuovi dati di contorno VH-IVUS che sostituiscano quelli vecchi.
- Elaborazione dei dati di contorno Cine IVUS
2. Modello agli elementi finiti
- Ricostruzione della geometria dei vasi coronarici
- Crea uno strato di contorni nello spazio tridimensionale aggiungendo il valore della coordinata z per tutti i punti dei contorni VH-IVUS, inclusi lumen, contorno esterno e lipidi, e imposta z = 0 per tutti i punti (Figura 2).
- Creare un altro strato di contorni aggiungendo il valore della coordinata z per tutti i punti dei contorni VH-IVUS e reimpostare z = 0,05 cm per tutti i punti.
NOTA: Questi due strati di contorni ricostruiscono la geometria 3D dei vasi coronarici per il modello con sola struttura a strato sottile aggiungendo uno spessore fisso dello strato di 0,05 cm ai contorni VH-IVUS (Figura 2).
- Generazione di mesh agli elementi finiti
- Crea due contorni ausiliari interpolando linearmente il lume e i contorni del contorno esterno con pesi 1/3 e 2/3 (Figura 3A) per ogni strato.
- Dividere l'area del vaso in 8 parti circonferenziali e 3 parti radiali (vedi Figura 3B) collegando il lume/confine esterno al punto più vicino sul contorno lipidico (ad esempio, i punti A e B nella Figura 3B) o due contorni ausiliari con linee radiali.
- Collega tutti i punti tra gli strati con linee rette, formando una struttura 3D con 3 x 8 volumi (Figura 3B). Dividi ogni volume utilizzando elementi esaedrici per generare la mesh agli elementi finiti (Figura 3C) e diversi gruppi di materiali (Figura 3D).
- Eseguire un'analisi della mesh affinando la densità della mesh del 10% fino a quando le variazioni delle soluzioni < del 5%.
- Definizione delle proprietà dei materiali
- Utilizzare un modello di materiale anisotropo Mooney-Rivlin modificato per descrivere le proprietà del materiale della parete del vaso coronarico. Si è ipotizzato che i vasi coronarici e i componenti della placca fossero materiali iperelastici, anisotropi, quasi incomprimibili e omogenei, e la funzione di densità dell'energia di deformazione del modello di materiale anisotropo modificato di Mooney-Rivlin è:
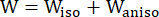 (1)
(1)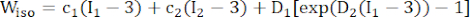 (2)
(2)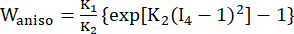 (3)
(3)
dove I1 e I2 sono il primo e il secondo invariante del tensore di deformazione di Cauchy-Green destro C definito come c = [cij] = XTX, X = [Xij] = [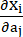 ], (Xi) era la posizione corrente (aj) era la posizione originale, I4 = cij(nc)i(nc)j, nc era il vettore unitario nella direzione circonferenziale del vaso. c1, c2, D1, D2, K1 e K2 erano parametri del materiale specifici per il paziente.
], (Xi) era la posizione corrente (aj) era la posizione originale, I4 = cij(nc)i(nc)j, nc era il vettore unitario nella direzione circonferenziale del vaso. c1, c2, D1, D2, K1 e K2 erano parametri del materiale specifici per il paziente. - Assegnare i valori iniziali dei parametri del materiale per un vaso coronarico specifico per il paziente in base ai risultati dei test biassiali ex vivo, ovvero c1 = −1.312,9 kPa, c2 = 114,7 kPa, D1 = 629,7 kPa, D2 = 2,0, K1 = 35,9 kPa e K2 = 23,5 (Figura 4A-B)13,15.
- Assegnare i parametri del materiale per il componente della placca, se presente. Più specificamente, per i lipidi, c1=0,5 kPa, c2=0, D1=0,5 kPa e D2=1,5; per la calcificazione, abbiamo usato c1=920 kPa, c2=0, D1=360 kPa e D2=2.0 (Figura 4B)16.
NOTA: Si è ipotizzato che i componenti della placca (lipidi e calcificazione) siano iperelastici, isotropi e quasi incomprimibili, e le loro proprietà meccaniche sono state descritte dal modello isotropo del materiale Mooney-Rivlin con le funzioni di densità dell'energia di deformazione fornite nella formula (2).
- Utilizzare un modello di materiale anisotropo Mooney-Rivlin modificato per descrivere le proprietà del materiale della parete del vaso coronarico. Si è ipotizzato che i vasi coronarici e i componenti della placca fossero materiali iperelastici, anisotropi, quasi incomprimibili e omogenei, e la funzione di densità dell'energia di deformazione del modello di materiale anisotropo modificato di Mooney-Rivlin è:
- Governo delle equazioni e impostazione delle condizioni al contorno
- Definisci le equazioni di governo per il modello di sola struttura a strato sottile, che include l'equazione del moto, la relazione deformazione-spostamento di Cauchy-Green non lineare e il modello11 del materiale del vaso coronarico.
- Prescrivere forme d'onda della pressione arteriosa specifiche per il paziente sulla superficie del lume per simulare condizioni fisiologiche reali (Figura 4C). Per ottenere forme d'onda della pressione arteriosa specifiche per il paziente, scalare una tipica forma d'onda della pressione aortica con i valori di pressione sistolica e diastolica misurati dal bracciale (Figura 4D).
3. Approccio di aggiornamento basato su modelli agli elementi finiti per le proprietà dei materiali dell'arteria coronarica specifiche per il paziente
NOTA: Il processo iterativo per determinare le proprietà del materiale coronarico specifiche del paziente è illustrato nella Figura 5.
- Determinare la geometria a vuoto corrispondente alla condizione di pressione zero come geometria iniziale per il modello computazionale riducendo la geometria coronarica ricostruita dall'immagine VH-IVUS assialmente con un tasso di ritiro fisso del 95% e circonferenzialmente con il ritiro circonferenziale (indicato come S) inizialmente impostato come 98%.
NOTA: Poiché la geometria coronarica ricostruita dall'immagine VH-IVUS era in condizioni in vivo con pressione sanguigna prescritta sul lume e tratto assiale dai segmenti arteriosi coronarici distali e prossimali legati, la geometria coronarica in vivo dovrebbe restringersi circonferenzialmente e assialmente per ottenere la geometria a pressione zero. - Fissare il tasso di restringimento assiale al 95% e aggiornare il restringimento circonferenziale durante i passaggi successivi.
- Definire il rapporto del materiale (indicato come k) per assegnare le proprietà del materiale specifiche del paziente del vaso coronarico come: ovvero, c1 = k*(−1.312,9) kPa, c2 = k*114,7 kPa, D1 = k*629,7 kPa, K1 = k*35,9 kPa e fissare D2 = 2,0 e K2 = 23,5.
NOTA: Poiché sono stati ottenuti solo due punti dati (circonferenze minime e massime del lume corrispondenti alle pressioni diastolica e sistolica) per determinare i parametri sconosciuti (tasso di restringimento circonferenziale S e parametri del materiale del modello di Mooney-Rivlin), abbiamo ridotto il numero di parametri sconosciuti assumendo che le proprietà del materiale specifiche del paziente in vivo del vaso coronarico fossero proporzionali all'ipotesi iniziale con il rapporto del materiale indicato come k: cioè, c1 = k*(−1.312,9) kPa, c2 = k*114,7 kPa, D1 = k*629,7 kPa, K1 = k*35,9 kPa, mentre D2 = 2,0 e K2 = 23,5 erano fissi. - Aggiornare il valore k impostato su un valore iniziale k di 1 insieme al tasso di restringimento circonferenziale S durante la procedura iterativa seguente.
- Esegui il software per risolvere il modello computazionale per ottenere i risultati numerici.
- Scrivi tutti i comandi per la creazione del modello di sola struttura a strato sottile in un file batch (File supplementare 1) utilizzando MATLAB.
- Caricare questo file batch utilizzando l'interfaccia utente avanzata (AUI) per generare il modello (Figura 6A). Risolvere il modello di sola struttura a strato sottile facendo clic su File di dati/Soluzione e salvarlo come file di .dat (Figura 6C). Simulare tre cicli cardiaci e adottare la soluzione nell'ultimo ciclo per presentare risultati numerici.
- Esporta i risultati delle coordinate dei nodi in un file txt navigando in Elenco > Elenco valori > Zona e selezionando X-POSITION, Y-POSITION e Z-POSITION in Variabili da elencare in Coordinate. Fare clic su Applica ed esporta per esportare i risultati delle coordinate.
- Salva i dati del contorno del lume corrispondenti alle condizioni di pressione diastolica e sistolica nei file .txt per il calcolo della circonferenza del lume.
- Confrontare le circonferenze del lume calcolate dal modello FE (modello di sola struttura dello strato sottile a fette) in condizioni di pressione diastolica con i dati IVUS cine in vivo (Cmin) e verificare se l'errore relativo era del <1%. Se la condizione è stata soddisfatta, vai al passaggio successivo o aggiorna altrimenti il rapporto del materiale k utilizzando il metodo secante e vai al passaggio 3.3 per eseguire nuovamente17,18.
NOTA: Nella prima iterazione, il metodo di Newton è stato utilizzato per aggiornare il rapporto dei materiali invece del metodo secante. - Confrontare le circonferenze del lume calcolate dal modello FE in condizioni di pressione sistolica con i dati in vivo cine IVUS (Cmax) e verificare se l'errore relativo era del <1%. In caso affermativo, interrompere la procedura iterativa o aggiornare in altro modo il tasso di restringimento circonferenziale S e reindirizzare al passaggio 3.4 per eseguire nuovamente l'esecuzione.
NOTA: Nella prima iterazione, il metodo di Newton è stato utilizzato per aggiornare il tasso di restringimento circonferenziale invece del metodo secante. - Registrare i valori ottimali di S e k e calcolare i parametri del materiale corrispondenti del modello di materiale Mooney-Rivlin.
- Tracciare le curve del rapporto sforzo-stiramento circonferenziale e assiale del vaso coronarico (Figura 7), che possono essere derivate come segue:
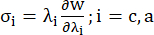 (4)
(4)
dove σ rappresenta lo sforzo di Cauchy, λ rappresenta il rapporto di allungamento, i = c, a rappresenta le direzioni circonferenziali e assiali.- Per disegnare una curva di materiale in una direzione particolare, fissare il rapporto di allungamento nell'altra direzione su 1. Calcolare il modulo di Young efficace nella circonferenza e nell'assiale (etichettati rispettivamente YMc e YMa) come la pendenza della funzione di scala della curva del materiale all'intervallo del rapporto di allungamento [1.0, 1.1] per riflettere la rigidità generale del materiale dell'arteria coronaria13:
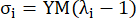 (5)
(5)
- Per disegnare una curva di materiale in una direzione particolare, fissare il rapporto di allungamento nell'altra direzione su 1. Calcolare il modulo di Young efficace nella circonferenza e nell'assiale (etichettati rispettivamente YMc e YMa) come la pendenza della funzione di scala della curva del materiale all'intervallo del rapporto di allungamento [1.0, 1.1] per riflettere la rigidità generale del materiale dell'arteria coronaria13:
- Estrarre le distribuzioni di sollecitazione/deformazione della placca in qualsiasi momento e registrare la distribuzione dei linfonodi e i valori massimi di sollecitazione durante le fasi sistolica e diastolica (Figura 8).
Risultati
Descriviamo in dettaglio il metodo FEMBUA, che consente una rapida analisi del materiale della placca e dello stress delle placche coronariche dopo l'imaging IVUS in tempo reale e può determinare le proprietà del materiale in vivo e i risultati biomeccanici delle placche. I parametri del materiale in vivo del modello di materiale Mooney-Rivlin per questo vaso coronarico sono forniti nella Tabella 1. I risultati della simulazione del modello agli eleme...
Discussione
Passaggi critici nel protocollo
Il passaggio più critico nell'approccio di aggiornamento basato su modelli agli elementi finiti risiede nella procedura iterativa. Nell'approccio, il modello agli elementi finiti dovrebbe recuperare accuratamente il movimento dei vasi coronarici sulla sezione trasversale vascolare dalle immagini IVUS cine in vivo . A tal fine, in questo studio è stata adottata la minimizzazione della differenza di circonferenza del lume tra i...
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questa ricerca è stata supportata in parte dal Shandong Province Medical Health Science and Technology Project (n. 202425020256 e 202403010254), dalla National Natural Science Foundation of China grants 11972117 and 11802060, dalla Natural Science Foundation della provincia di Jiangsu con il numero di sovvenzione BK20180352 e dalla Natural Science Foundation della provincia di Shandong con il numero di sovvenzione ZR2024QA110.
Materiali
| Name | Company | Catalog Number | Comments |
| Bee DICOM Viewer | SinoUnion Healthcare Inc. | Version 3.5.1 | A DICOM image reader software |
| ADINA | Adina R & D | Version 9.0 | Finite element solver |
| ImageJ | National Institutes of Health | Segmented IVUS contours | |
| MATLAB | MathWorks | Version R2018a | Commercial programming platform |
| Volcano s5 imaging system | Volcano Company | Intravascular ultrasound imaging system |
Riferimenti
- Roth, G. A., et al. Global burden of cardiovascular diseases and risk factors, 1990-2019: update from the GBD 2019 study. J Am Coll Cardiol. 76 (25), 2982-3021 (2020).
- Kanwar, S. S., et al. Acute coronary syndromes without coronary plaque rupture. Nat Rev Cardiol. 13 (5), 257-265 (2016).
- Milzi, A., et al. Coronary plaque composition influences biomechanical stress and predicts plaque rupture in a morpho-mechanic OCT analysis. Elife. 10, e64020 (2021).
- Stefanati, M., et al. Effect of variability of mechanical properties on the predictive capabilities of vulnerable coronary plaques. Comput Methods Programs Biomed. 254, 108271 (2024).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27 (21), 2588-2605 (2006).
- Daisuke, K., et al. Coronary plaque phenotype associated with positive remodeling. J Cardiovasc Comput Tomogr. 18 (4), 401-407 (2024).
- Macrae, R. A., Miller, K., Doyle, B. J. Methods in mechanical testing of arterial tissue: A review. Strain. 52, 380-399 (2016).
- Hayashi, K. Experimental approaches on measuring the mechanical properties and constitutive laws of arterial walls. J Biomech Eng. 115 (4B), 481-488 (1993).
- Sacks, M. S., Sun, W. Multiaxial mechanical behavior of biological materials. Annu Rev Biomed Eng. 5, 251-284 (2003).
- Charis, C., et al. Impact of combined plaque structural stress and wall shear stress on coronary plaque progression, regression, and changes in composition. Eur Heart J. 40 (18), 1411-1422 (2019).
- Wang, L., et al. Quantifying patient-specific in vivo coronary plaque material properties for accurate stress/strain calculations: An IVUS-based multi-patient study. Front Physiol. 12, 721195 (2021).
- Guo, X. Y., et al. Quantify patient-specific coronary material property and its impact on stress/strain calculations using in vivo IVUS data and 3D FSI models: a pilot study. Biomech Model Mechanobiol. 16 (1), 333-344 (2017).
- Wang, L., et al. Quantification of patient-specific coronary material properties and their correlations with plaque morphological characteristics: An in vivo IVUS study. Int J Cardiol. 371, 21-27 (2023).
- Lu, W., et al. Accurate identification of potential critical coronary lesions for the reduction of risk of cardiovascular events: study protocol for a randomized, open-label, active-controlled multi-center trial. Clin Trial Degenerat Dis. 3 (3), 106-110 (2018).
- Lv, R., et al. Using optical coherence tomography and intravascular ultrasound imaging to quantify coronary plaque cap stress/strain and progression: A follow-up study using 3D thin-layer models. Front Bioeng Biotechnol. 9, 713525 (2021).
- Camasao, D. B., Mantovani, D. The mechanical characterization of blood vessels and their substitutes in the continuous quest for physiological-relevant performances. A critical review. Mater Today Bio. 10, 100106 (2021).
- Holistic Numerical Methods Institute at University of South Florida. . Secant Method. , (2003).
- Barnes, J. An algorithm for solving nonlinear equations based on the secant method. Comp J. 8 (8), 66-72 (1965).
- Liu, M., Liang, L., Sun, W. A new inverse method for estimation of in vivo mechanical properties of the aortic wall. J Mech Behav Biomed Mater. 72, 148-158 (2017).
- Yu, H., et al. Patient-specific in vivo right ventricle material parameter estimation for patients with tetralogy of Fallot using MRI-based models with different zero-load diastole and systole morphologies. Int J Cardiol. 276, 93-99 (2019).
- Meuwissen, M. H. H., Oomens, C. W. J., Baaijens, F. P. T., Petterson, R., Janssen, J. D. Determination of the elasto-plastic properties of aluminium using a mixed numerical-experimental method. J Mater Process Technol. 75, 204-211 (1998).
- Davis, F. M., Luo, Y., Avril, S., Duprey, A., Lu, J. Local mechanical properties of human ascending thoracic aneurysms. J Mech Behav Biomed Mater. 61, 235-249 (2016).
- Fan, L., Wang, H., Kassab, G. S., Lee, L. C. Review of cardiac-coronary interaction and insights from mathematical modeling. WIREs Mech Dis. 16 (3), e1642 (2024).
- Andreas, W., et al. A finite element updating approach for identification of the anisotropic hyperelastic properties of normal and diseased aortic walls from 4D ultrasound strain imaging. J Mech Behav Biomed Mater. 58, 122-138 (2016).
- Liu, M., et al. Identification of in vivo nonlinear anisotropic mechanical properties of ascending thoracic aortic aneurysm from patient-specific CT scans. Sci Rep. 9, 12983 (2019).
- Trabelsi, O., Duprey, A., Favre, J. P., Avril, S. Predictive models with patient specific material properties for the biomechanical behavior of ascending thoracic aneurysms. Ann Biomed Eng. 44, 84-98 (2016).
- Cosentino, F., et al. On the role of material properties in ascending thoracic aortic aneurysms. Comput Biol Med. 109, 70-78 (2019).
- Krauz, K., et al. The role of epicardial adipose tissue in acute coronary syndromes, post-infarct remodeling and cardiac regeneration. Int J Mol Sci. 25 (7), 3583 (2024).
- McCracken, I. R., Smart, N. Control of coronary vascular cell fate in development and regeneration. Semin Cell Dev Biol. 155 (Pt C), 50-61 (2024).
- Holzapfel, G. A., et al. Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling. Am J Physiol Heart Circ Physiol. 289 (5), H2048-H2058 (2005).
- Han, Y., et al. Ventricle stress/strain comparisons between Tertalogy of Fallot patients and healthy using models with different zero-load diastole and systole morphologies. PLoS One. 14 (8), e0220328 (2019).
- Ryo, K., et al. Role of the low-density lipoprotein-cholesterol/high-density lipoprotein-cholesterol ratio in predicting serial changes in the lipid component of coronary plaque. Circ J. 81 (10), 1439-1446 (2017).
- Thomas, T. W., et al. In vivo characterization and quantification of atherosclerotic carotid plaque components with multidetector computed tomography and histopathological correlation. Arterioscler Thromb Vasc Biol. 26 (10), 2366-2372 (2006).
- Masanori, K., et al. In vivo quantitative tissue characterization of human coronary arterial plaques by use of integrated backscatter intravascular ultrasound and comparison with angioscopic findings. Circulation. 105 (21), 2487-2492 (2002).
- Roach, M. R., Burton, A. C. The reason for the shape of the distensibility curves of arteries. Can J Biochem Physiol. 35, 681-690 (1957).
- Fung, Y. C., Liu, S. Q. Strain distribution in small blood vessel with zero-stress state taken into consideration. Am J Physiol. 262, 544-552 (1992).
- Ohayon, J., et al. Influence of residual stress/strain on the biomechanical stability of vulnerable coronary plaques: Potential impact for evaluating the risk of plaque rupture. Am J Physiol Heart Circ Physiol. 293, 1987-1996 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon