JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
인간 관상동맥의 생체 내 기계적 특성을 정량화하기 위한 혈관 내 초음파 이미지 기반 유한 요소 모델링 접근 방식
* 이 저자들은 동등하게 기여했습니다
요약
생체 내 cine 혈관 내 초음파 이미지는 다양한 압력 부하 조건에 해당하는 관상 동맥 단면 움직임을 보여줍니다. 유한 요소 모델을 기반으로 반복 계획을 사용하여 계산 모델과 의료 이미지의 관상 동맥 움직임을 일치시켜 생체 내에서 관상 동맥의 환자 특정 기계적 특성을 결정했습니다.
초록
관상동맥벽의 기계적 특성을 정량화하면 관상동맥 질환의 진단, 관리 및 치료에 의미 있는 정보를 제공할 수 있습니다. 지속적인 모니터링이 필요한 환자를 위한 환자 맞춤형 관상동맥 샘플이 없기 때문에 혈관 재료 특성에 대한 직접적인 실험적 테스트가 불가능합니다. 현재 관상동맥 모델은 일반적으로 사용 가능한 문헌의 재료 매개변수를 사용하므로 상당한 기계적 응력/변형률 계산 오류가 발생합니다. 여기에서는 의료 이미지를 기반으로 관상동맥의 환자별 생체 내 재료 특성을 정량화하기 위해 FEMBUA(Finite Element Model-Based Updating Approach)를 소개합니다. 관상동맥 질환 환자로부터 관상동맥의 체내 시네 혈관내 초음파(IVUS) 및 가상 조직학(VH)-IVUS 이미지를 획득했습니다. 하나의 심장 주기에 걸친 혈관 움직임을 보여주는 Cine IVUS 이미지를 분할하고, 수축기 및 이완기 압력 조건에서 관상동맥 기하학을 나타내기 위해 각각 최대 및 최소 내강 둘레를 가진 두 개의 IVUS 프레임을 선택했습니다. VH-IVUS 이미지도 분할하여 혈관 윤곽을 얻었고, 관상동맥 기하학을 재구성하기 위해 VH-IVUS 윤곽에 0.05cm의 층 두께를 추가했습니다. 계산 유한 요소 모델은 관상 동맥 내강 표면에 규정된 혈관의 기계적 특성과 박동 혈압 상태를 설명하는 데 사용되는 이방성 Mooney-Rivlin 재료 모델을 사용하여 생성되어 관상 동맥 내강 표면을 수축 및 팽창하게 합니다. 그런 다음 계산 유한 요소 모델의 최소 및 최대 루멘 둘레를 cine IVUS 이미지의 둘레와 일치시켜 이방성 Mooney-Rivlin 모델의 재료 매개변수를 결정하기 위해 반복적인 업데이트 접근 방식을 사용했습니다. 이 이미지 기반 유한 요소 모델 기반 업데이트 접근 방식은 다양한 혈관층에서 동맥 벽의 재료 특성을 결정하기 위해 성공적으로 확장될 수 있으며 심혈관 질환의 위험 평가 가능성을 보유하고 있습니다.
서문
관상동맥질환(CAD)은 사망률과 이환율의 주요 원인 중 하나로, 2019년 전 세계적으로 914만 명 이상이 사망했습니다 1,2. 죽상동맥경화증(atherosclerosis) 및 협착증(stenosis)과 같은 관상동맥질환의 발병은 종종 기계적 힘의 변화와 혈관벽 재료 특성의 변화를 동반한다3. 관상동맥의 물질적 특성은 생리적 부하에 대한 기계적 반응을 결정하는 초석일 뿐만 아니라 혈관의 기계적 거동을 시뮬레이션하고, 죽상경화성 병변의 발달을 예측하고, 다양한 의료기기의 치료 효과를 평가하는 핵심 요소이기도 합니다 4,5. 결과적으로, 관상동맥 물질 특성에 대한 심층적인 이해와 정확한 정량화는 조기 질병 진단, 정밀 의학 및 예후 평가에 가장 중요한 가치를 지닙니다6.
평면 이축 테스트, 압흔 테스트, 인플레이션 확장 및 단축 확장 테스트와 같은 분리된 관상 동맥 조직의 기계적 실험은 생체 외 관상 동맥 혈관 벽의 기계적 특성을 정량화하는 일반적인 접근 방식입니다 7,8,9. 이러한 접근 방식을 통해 환자 또는 실험 동물로부터 관상 동맥 샘플을 얻었습니다. 다양한 응력 조건에서 용기 벽의 변형 반응을 결정하기 위해 기계적 테스트를 수행 한 다음 실험 데이터10을 피팅하여 재료 매개 변수를 결정했다. 선행 연구에서는 관상동맥 특성이 매우 비선형적이고 이방성(anisotropic)인 것으로 나타났다11. 생체 외 실험은 정확한 재료 특성 데이터를 제공할 수 있지만 다음과 같은 중요한 제한 사항도 존재합니다. 첫째, 살아있는 피험자로부터 채취한 후 샘플의 기계적 거동이 생체 내 조건에서와 다를 수 있으며, 이는 테스트 결과의 정확도에 영향을 미칠 수 있습니다. 둘째, 윤리적, 실용적 제약으로 인해 기계적 검사를 수행하기 위해 관상 동맥의 정상 또는 병리학적 조직을 대량으로 확보하기가 어렵습니다.
이러한 한계를 극복하기 위해 연구자들은 관상 동맥 물질 특성의 생체 내, 실시간 및 환자 맞춤형 정량화를 위한 새로운 기술을 탐구했습니다. 그 중 의료 이미지를 기반으로 한 FEMBUA(Finite Element Model Based Updating Approach)는 이러한 도전적인 문제를 해결할 수 있는 가능성을 가지고 있습니다. 이 접근법은 혈관내 초음파(IVUS) 및 가상 조직학(VH)-IVUS와 같은 고급 이미징 기술을 사용하여 상세한 관상동맥 기하학, 조직 구성 및 움직임을 캡처합니다12. 3D 유한 요소(FE) 모델을 구성하고 환자별 생리학적 혈압 상태를 통합함으로써 관상 동맥 재료 특성의 빠르고 정확한 정량화를 위해 이미지 데이터와 일치하도록 재료 매개변수를 최적화하여 심장 주기 동안의 동적 혈관 동작을 복구할 수 있습니다13. 생체 외 실험에 비해 in vivo FE 업데이트 접근 방식의 장점에는 조직 절제 없이 in vivo 평가, 대규모 평가 촉진, 복잡한 조건에서 혈관 역학 시뮬레이션을 포함하여 관상 동맥 질환의 병태 생리학적 이해를 돕는 것이 포함됩니다.
본 논문에서는 cine IVUS 및 VH-IVUS 이미지의 상세한 분할 및 처리, 전산 박층 구조 전용 모델의 재구성, 관상 동맥 조직에 대한 최적의 재료 매개변수를 검색하기 위한 반복 계획 실행을 포함하는 유한 요소 모델 기반 업데이트 접근 방식의 주요 단계를 소개합니다. 이 프로토콜의 목적은 FEMBUA 방법을 시연으로 사용하여 CAD가 있는 샘플 환자의 관상 동맥 동맥의 재료 특성을 정량화하는 것입니다. 우리는 이 in vivo 방법의 중요성과 다른 측면에 대해 논의함으로써 결론을 내렸습니다.
선정된 참가자는 관상동맥 질환의 이전 임상 병력이 없는 64세 여성입니다. 이 환자는 흉통 증상을 보인 후 관상동맥 질환 진단을 받았습니다. 진단을 확인하기 위해 관상동맥 조영술과 IVUS 스캔을 수행했습니다. 60%의 협착을 동반한 플라크 병변이 좌측 전방 하행 동맥의 중앙에서 발견되었습니다. 평가 후 환자를 치료하기 위해 최적의 의학적 요법이 채택되었습니다.
프로토콜
in vivo IVUS 이미지 및 혈압 데이터를 포함한 비식별화된 임상 데이터는 정보에 입각한 동의를 얻은 상태에서 Southeast University의 Zhongda Hospital의 CAD 환자로부터 획득했습니다. 샘플 환자는 환자 특이적 관상동맥 혈관의 재료 특성을 정량화하는 방법을 입증하기 위해 중간 관상동맥경화성 병변에 대한 임상 연구의 환자 풀에서 선택되었습니다14. 본 연구는 동남대학교 중다병원 임상연구윤리위원회(Clinical Research Ethics Committee)에서 승인한 프로토콜(승인번호: 2017ZDSYLL023-p01)에 따라 수행되었다.
1. 데이터 수집 및 처리
- Cine IVUS 및 VH-IVUS 이미지 획득
- 관상동맥 혈관 조영술의 안내에 따라 IVUS 카테터를 죽상경화성 병변 원위부에 배치하고 근위부로 다시 당깁니다. 그 과정에서 회색조 IVUS 이미지를 생성하여 관상동맥 혈관의 단면을 시각화할 수 있습니다.
- 고성능 20MHz, 2.9F 백금 카테터가 장착된 IVUS 이미징 시스템을 사용하여 CAD가 있는 환자로부터 죽상경화성 플라크가 있는 관상동맥 분절의 IVUS 이미지를 획득합니다(그림 1).
- IVUS 이미지를 획득하는 동안 미리 선택된 병변 부위에서 카테터를 약 2초 동안 일시 중지하여 cine IVUS라고 하는 일련의 IVUS 이미지를 얻습니다. cine IVUS 이미지는 심장 주기에 걸쳐 주어진 플라크 부위의 동적 단면 변화를 명확하게 보여주었습니다.
- 심전도에서 R이 최고조에 도달하는 순간에 획득한 IVUS 프레임을 기반으로 VH-IVUS 이미지를 생성하고, 이미징 시스템을 사용하여 플라크 성분을 색상으로 구분된 형태로 시각화할 수 있습니다.
참고: VH-IVUS 이미지는 죽상경화성 플라크의 4가지 주요 플라크 구성 요소, 즉 빨간색의 지질이 풍부한 괴사 코어(지질), 흰색의 석회화, 짙은 녹색의 섬유 조직, 연한 녹색의 섬유 지방 조직에 대한 직관적인 컬러 맵을 제공합니다. - 오프라인 분석을 위해 VH-IVUS 및 cine IVUS 이미지를 DICOM 형식으로 저장할 수 있습니다.
- 이미지 세분화 및 처리
- 뷰어를 사용하여 DICOM 파일을 열고 해당 시퀀스 이름을 두 번 클릭하여 이미지를 연 다음 내보내기 > 내보내기 이미지를 클릭하여 각 cine IVUS 프레임 또는 VH-IVUS 프레임을 BMP 형식의 개별 이미지로 저장합니다. 각 BMP 이미지에는 원본 DICOM 파일에 표시된 대로 500 x 500 픽셀이 포함되어 있습니다.
- cine IVUS 이미지를 프레임별로 검사하여 한 번의 심장 주기 동안 미리 선택된 플라크 부위에서 얻은 연속적인 프레임을 찾습니다. 이 샘플 플라크 부위에 대해 한 번의 심장 주기 동안 26개의 cine IVUS 프레임이 생성되었습니다.
- 주어진 플라크 부위에서 얻어진 VH-IVUS 이미지를 찾기 위해 생성된 모든 VH-IVUS 이미지를 검사합니다. 여기에 사용된 VH-IVUS 이미지는 한 번의 심장 주기에서 cine IVUS 프레임의 단일 IVUS 프레임을 사용하여 생성되었습니다.
- ImageJ 소프트웨어를 사용하여 VH-IVUS 및 cine IVUS 이미지를 분할하여 혈관 경계와 플라크 구성 요소 경계의 윤곽을 얻습니다( 그림 1C 참조).
- Straight > Segmented Line 탭을 선택하고 cine IVUS 및 VH-IVUS 이미지에서 내강의 윤곽, 관상동맥 혈관의 외부 경계 및 플라크 구성 요소를 수동으로 묘사합니다. cine IVUS 이미지의 경우 내강과 외부 혈관 경계의 윤곽만 분할하고 VH-IVUS 이미지의 경우 내강, 외부 혈관 경계 및 플라크 구성 요소 경계의 윤곽을 분할합니다.
- 단순화를 위해 유한 요소 모델을 생성하기 위해 큰 지질 성분만 유지하고 작고 분리된 지질 성분은 무시하십시오. 이 플라크 샘플에는 지질이 하나만 존재했습니다. Image > Overlay > Add Selection 탭을 사용하여 윤곽선을 원본 이미지에 오버레이합니다.
- To ROI Manager 메뉴로 이동하여 윤곽을 관리하고, 속성을 조정하고, 더 나은 시각화를 위해 색상과 선 너비를 적절한 값으로 설정합니다. Properties 탭을 선택하고, 획 색상을 다른 색상으로 설정하고, 선 너비를 너비로 채웁니다. 여기서 선 색상은 루멘, 외부 경계 및 지질 윤곽에 대해 각각 녹색, 파란색 및 빨간색으로 설정하고 선 너비를 3으로 설정합니다.
- 특정 윤곽을 선택한 후 명령 모음에서 Edit > Selection > Fit Spline 을 사용하여 윤곽을 매끄럽게 만들어 윤곽을 매끄럽게 만듭니다. 이 작업은 스플라인 곡선 피팅 기술을 사용하여 윤곽을 자동으로 매끄럽게 합니다.
- 파일 > >XY 좌표 탭을 클릭하여 루멘, 외부 경계 및 플라크 구성 요소와 같은 각 윤곽의 점 좌표를 별도의 txt 파일에 저장합니다. 이 파일에는 윤곽을 구성하는 점의 x 및 y 좌표 값이 포함되어 있으며 픽셀을 단위로 합니다.
- DICOM 파일의 cine IVUS 및 VH-IVUS 이미지(픽셀 크기로 표시)에 있는 각 픽셀의 실제 물리적 크기를 기록합니다. 여기에 사용된 IVUS 데이터에서 1픽셀의 실제 거리는 0.002cm입니다. 이 정보는 픽셀을 단위로 사용하는 점 좌표를 cm를 단위로 하는 실제 거리로 변환하는 데 사용됩니다.
- Contour 데이터 처리
- Cine IVUS 윤곽 데이터 처리
- MATLAB을 사용하여 한 번의 심장 주기에서 모든 cine IVUS 이미지에서 내강 윤곽의 txt 파일을 읽을 수 있습니다.
- 모든 루멘 윤곽에 픽셀 크기를 곱하여 루멘 윤곽의 실제 크기를 구합니다.
- 모든 루멘 윤곽에 대한 루멘 둘레를 계산하고 IVUS 프레임을 각각 이완기 및 수축기 상태를 나타내는 최대(Cmax) 및 최소(Cmin) 루멘 둘레로 식별합니다.
- VH-IVUS 윤곽 데이터 처리
- MATLAB을 사용하여 VH-IVUS 영상에서 내강, 외부 경계 및 플라크 성분의 윤곽에 대한 txt 파일을 읽어 들입니다.
- 모든 윤곽선에 픽셀 크기를 곱하면 모든 윤곽선의 실제 크기를 구할 수 있습니다.
- 각 윤곽을 100개의 동일한 간격의 점으로 다시 나누고 2D 평활화를 수행하여 이전 윤곽을 대체할 새로운 VH-IVUS 윤곽 데이터를 얻습니다.
- Cine IVUS 윤곽 데이터 처리
2. 유한 요소 모델
- 관상동맥 혈관 기하학 재구성
- 루멘, 외부 경계 및 지질을 포함한 VH-IVUS 윤곽의 모든 점에 대해 z 좌표 값을 추가하여 3차원 공간에 하나의 윤곽선 레이어를 만들고 모든 점에 대해 z = 0을 설정합니다(그림 2).
- VH-IVUS 등고선의 모든 점에 대해 z 좌표 값을 추가하여 윤곽선의 다른 레이어를 만들고 모든 점에 대해 z = 0.05cm를 재설정합니다.
참고: 이 두 층의 윤곽선은 VH-IVUS 윤곽선에 0.05cm의 고정된 층 두께를 추가하여 박층 구조 전용 모델의 3D 관상동맥 혈관 형상을 재구성합니다(그림 2).
- 유한 요소 메쉬 생성
- 각 계층에 대해 가중치가 1/3 및 2/3인 루멘 및 외부 경계 윤곽선을 선형 보간하여 두 개의 보조 윤곽을 만듭니다(그림 3A).
- 내강/외부 경계를 지질 윤곽에서 가장 가까운 지점(예: 그림 3B의 점 A 및 B) 또는 방사형 선이 있는 2개의 보조 윤곽에 연결하여 혈관 면적을 8개의 원주 부분과 3개의 방사형 부분(그림 3B 참조)으로 나눕니다.
- 레이어 사이의 모든 점을 직선으로 연결하여 3 x 8 볼륨의 3D 구조를 형성합니다(그림 3B). 육면체 요소를 사용하여 각 볼륨을 나누어 유한 요소 메시(그림 3C)와 다른 재료 그룹(그림 3D)을 생성합니다.
- 솔루션의 변화가 5%가 될 때까지 메쉬 밀도를 10% 미세 조정하여 메쉬 해석< 수행합니다.
- 재료 속성 정의
- 수정된 이방성 Mooney-Rivlin 재질 모델을 사용하여 관상동맥 혈관 벽의 재질 특성을 설명합니다. 관상동맥 혈관 및 플라크 구성 요소는 초탄성, 이방성, 거의 비압축성 및 균질한 재료로 가정되었으며 수정된 이방성 Mooney-Rivlin 재료 모델의 변형 에너지 밀도 함수는 다음과 같습니다.
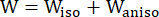 (1)
(1)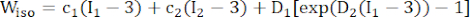 (2)
(2)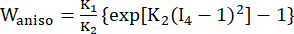 (3)
(3)
여기서, I1 및 I2 는 c = [cij] = xtx, x = [Xij] = [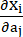 ], (X,i)는 현재 위치 (a,j)는 원래 위치, I4 = cij(nc) i (nc) j, nc는 혈관의 원주 방향의 단위 벡터입니다. C1, c2, D1, D2, K1 및 K2는 환자별 재료 매개변수였습니다.
], (X,i)는 현재 위치 (a,j)는 원래 위치, I4 = cij(nc) i (nc) j, nc는 혈관의 원주 방향의 단위 벡터입니다. C1, c2, D1, D2, K1 및 K2는 환자별 재료 매개변수였습니다. - 생체 외 이축 테스트 결과에 따라 환자별 관상동맥 혈관에 대한 재료 매개변수의 초기 값, 즉 c1 = -1,312.9kPa, c2 = 114.7kPa, D1 = 629.7kPa, D2 = 2.0, K1 = 35.9kPa 및 K2 = 23.5(그림 4A-B)13,15.
- 플라크 구성 요소가 있는 경우 재료 매개변수를 할당합니다. 보다 구체적으로, 지질의 경우 c1 = 0.5 kPa, c2 = 0, D1 = 0.5 kPa 및 D2 = 1.5; 석회화를 위해 c1 = 920 kPa, c2 = 0, D1 = 360 kPa 및 D2 = 2.0을 사용했습니다 (그림 4B) 16.
참고: 플라크 성분(지질 및 석회화)은 초탄성, 등방성 및 거의 압축성이 없는 것으로 가정되었으며, 기계적 특성은 공식 (2)에 주어진 변형 에너지 밀도 함수를 사용하여 등방성 Mooney-Rivlin 재료 모델에 의해 설명되었습니다.
- 수정된 이방성 Mooney-Rivlin 재질 모델을 사용하여 관상동맥 혈관 벽의 재질 특성을 설명합니다. 관상동맥 혈관 및 플라크 구성 요소는 초탄성, 이방성, 거의 비압축성 및 균질한 재료로 가정되었으며 수정된 이방성 Mooney-Rivlin 재료 모델의 변형 에너지 밀도 함수는 다음과 같습니다.
- 지배 방정식 및 경계 조건 설정
- 박막 구조 전용 모델에 대한 지배 방정식을 정의하며, 여기에는 모션 방정식, 비선형 Cauchy-Green 변형-변위 관계 및 관상동맥 혈관 재료 모델11이 포함됩니다.
- 실제 생리학적 상태를 시뮬레이션하기 위해 내강 표면에 환자별 혈압 파형을 처방합니다(그림 4C). 환자별 혈압 파형을 얻으려면 팔 커프로 측정한 수축기 및 이완기 압력 값으로 일반적인 대동맥 압력 파형을 조정합니다(그림 4D).
3. 환자별 관상동맥 재료 특성에 대한 유한 요소 모델 기반 업데이트 접근 방식
참고: 환자별 관상동맥 재료 특성을 결정하는 반복적인 프로세스는 그림 5에 설명되어 있습니다.
- VH-IVUS 이미지에서 재생성된 관상동맥 형상을 95%의 고정 수축률로 축 방향으로 축소하고 초기에 98%로 설정된 원주 수축(S로 표시)으로 원주 방향으로 수축하여 제로 압력 조건에 해당하는 무부하 형상을 계산 모델의 초기 형상으로 결정합니다.
참고: VH-IVUS 이미지에서 재구성된 관상동맥 기하학은 내강에 규정된 혈압과 테더링된 원위 및 근위 관상동맥 분절에서 축 방향으로 늘어난 생체 내 조건에서 이루어졌 기 때문에 생체 내 관상동맥 기하학은 제로 압력 기하학을 얻기 위해 원주 및 축 방향으로 축소되어야 합니다. - 축 수축률을 95%로 고정하고 다음 단계를 수행하는 동안 원주 수축을 업데이트합니다.
- 관상동맥 혈관의 환자별 재료 특성을 다음과 같이 할당하기 위해 재료 비율(k로 표시)을 정의합니다: 즉, c1 = k*(−1,312.9) kPa, c2 = k*114.7 kPa, D1 = k*629.7 kPa, K1 = k*35.9 kPa, 고정 D2 = 2.0 및 K2 = 23.5.
참고: 알려지지 않은 매개변수(원주 수축률 S 및 Mooney-Rivlin 모델의 재료 매개변수)를 결정하기 위해 두 개의 데이터 포인트(이완기 혈압 및 수축기 혈압에 해당하는 최소 및 최대 루멘 둘레)만 얻었기 때문에 관상동맥 혈관의 생체 내 환자별 재료 특성이 k로 표시된 재료 비율의 초기 추정값에 비례한다고 가정하여 알려지지 않은 매개변수의 수를 줄였습니다. 즉,c1 = k*(−1,312.9) kPa,c2 = k*114.7 kPa,D1 = k*629.7 kPa,K1 = k*35.9 kPa,D2 = 2.0 및K2 = 23.5는 고정되었다. - 다음 반복 절차를 수행하는 동안 초기 값 k 1로 설정된 k 값을 원주 수축률 S와 함께 업데이트합니다.
- 소프트웨어를 실행하여 계산 모델을 풀고 수치 결과를 얻습니다.
- MATLAB을 사용하여 박막 구조 전용 모델을 만들기 위한 모든 명령을 배치 파일(보충 파일 1)에 작성합니다.
- 고급 사용자 인터페이스(AUI)를 사용하여 이 배치 파일을 로드하여 모델을 생성합니다(그림 6A). 데이터 파일/솔루션을 클릭하여 박막 구조 전용 모델을 해결하고 .dat 파일로 저장합니다(그림 6C). 세 번의 심장 주기를 시뮬레이션하고 마지막 주기의 해를 채택하여 수치 결과를 제시합니다.
- Zone > List Value >List를 탐색하고 Coordinate(좌표) 아래의 Variables to List(나열할 변수)에서 X-POSITION, Y-POSITION 및 Z-POSITION을 선택하여 노드 좌표의 결과를 txt 파일로 내보냅니다. Apply and Export를 클릭하여 좌표 결과를 내보냅니다.
- 이완기 및 수축기 압력 조건에 해당하는 루멘 등고선 데이터를 루멘 둘레 계산을 위한 .txt 파일에 저장합니다.
- 확장기 압력 조건에서 FE 모델(thin-slice layer structure-only model)로 계산한 내강 둘레를 in vivo cine IVUS 데이터(Cmin)와 비교하고 상대 오차가 <1%인지 확인합니다. 조건이 충족되면 다음 단계로 이동하거나 시컨트 방법을 사용하여 재료 비율 k를 업데이트하고 3.3단계로 이동하여다시 실행하십시오 17,18.
참고: 첫 번째 반복에서는 시컨트 방법 대신 Newton 방법을 사용하여 재료 비율을 업데이트했습니다. - 수축기 압력 조건에서 FE 모델로 계산한 루멘 둘레를 in vivo cine IVUS 데이터(Cmax)와 비교하고 상대 오차가 <1%인지 확인합니다. 대답이 "예"인 경우 반복 절차를 중지하거나 원주 수축률 S를 업데이트하고 3.4단계로 리디렉션하여 다시 실행합니다.
참고: 첫 번째 반복에서는 시컨트 방법 대신 원주 수축률을 업데이트하는 데 뉴턴 방법이 사용되었습니다. - 최적의 S 및 k 값을 기록하고 Mooney-Rivlin 재료 모델의 해당 재료 매개변수를 계산합니다.
- 관상동맥 혈관의 원주 및 축 방향 응력-신장 비율 곡선을 플롯하며(그림 7), 이는 다음과 같이 파생될 수 있습니다.
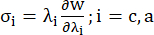 (4)
(4)
여기서 σ은 코시 응력을 나타내고, λ는 신축 비율을 나타내고, i = c는 원주 방향 및 축 방향을 나타냅니다.- 특정 방향으로 재료 곡선을 그리려면 다른 방향의 신축 비율을 1로 고정합니다. 원주 및 축(각각 YMc 및 YMa로 표시됨)에서 유효 영률(Young's modulus)을 스트레치 비율 구간 [1.0, 1.1]에서 재료 곡선의 스케일 함수의 기울기로 계산하여 관상 동맥13의 일반적인 재료 강성을 반영합니다.
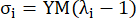 (5)
(5)
- 특정 방향으로 재료 곡선을 그리려면 다른 방향의 신축 비율을 1로 고정합니다. 원주 및 축(각각 YMc 및 YMa로 표시됨)에서 유효 영률(Young's modulus)을 스트레치 비율 구간 [1.0, 1.1]에서 재료 곡선의 스케일 함수의 기울기로 계산하여 관상 동맥13의 일반적인 재료 강성을 반영합니다.
- 언제든지 플라크 응력/변형률 분포를 추출하고 수축기 및 이완기 단계 동안 노드 분포와 최대 응력 값을 기록합니다(그림 8).
결과
실시간 IVUS 이미징 후 관상동맥 플라크의 신속한 플라크 재료 및 응력 분석을 가능하게 하고 플라크의 생체 내 재료 특성 및 생체 역학적 결과를 결정할 수 있는 FEMBUA 방법에 대해 자세히 설명합니다. 이 관상동맥 혈관에 대한 Mooney-Rivlin 재료 모델의 생체 내 재료 매개변수는 표 1에 나와 있습니다. 관상동맥 혈관의 응력/변형률 분포를 포함한 유?...
토론
프로토콜의 중요한 단계
유한 요소 모델 기반 업데이트 접근 방식에서 가장 중요한 단계는 반복 절차에 있습니다. 이 접근법에서 유한 요소 모델은 in vivo cine IVUS 이미지에서 혈관 단면의 관상동맥 혈관 움직임을 정확하게 복구해야 합니다. 이를 위해 본 연구에서는 유한 요소 모델과 생체 내 이미지 간의 루멘 둘레 차이를 최소화하여 적절한 ?...
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 산둥성 의료보건과학기술프로젝트(202425020256호, 202403010254호), 중국국립자연과학재단(National Natural Science Foundation of China)의 11972117 및 11802060, 장쑤성 자연과학재단(BK20180352번), 산둥성 자연과학재단(ZR2024QA110)의 지원으로 이루어졌다.
자료
| Name | Company | Catalog Number | Comments |
| Bee DICOM Viewer | SinoUnion Healthcare Inc. | Version 3.5.1 | A DICOM image reader software |
| ADINA | Adina R & D | Version 9.0 | Finite element solver |
| ImageJ | National Institutes of Health | Segmented IVUS contours | |
| MATLAB | MathWorks | Version R2018a | Commercial programming platform |
| Volcano s5 imaging system | Volcano Company | Intravascular ultrasound imaging system |
참고문헌
- Roth, G. A., et al. Global burden of cardiovascular diseases and risk factors, 1990-2019: update from the GBD 2019 study. J Am Coll Cardiol. 76 (25), 2982-3021 (2020).
- Kanwar, S. S., et al. Acute coronary syndromes without coronary plaque rupture. Nat Rev Cardiol. 13 (5), 257-265 (2016).
- Milzi, A., et al. Coronary plaque composition influences biomechanical stress and predicts plaque rupture in a morpho-mechanic OCT analysis. Elife. 10, e64020 (2021).
- Stefanati, M., et al. Effect of variability of mechanical properties on the predictive capabilities of vulnerable coronary plaques. Comput Methods Programs Biomed. 254, 108271 (2024).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27 (21), 2588-2605 (2006).
- Daisuke, K., et al. Coronary plaque phenotype associated with positive remodeling. J Cardiovasc Comput Tomogr. 18 (4), 401-407 (2024).
- Macrae, R. A., Miller, K., Doyle, B. J. Methods in mechanical testing of arterial tissue: A review. Strain. 52, 380-399 (2016).
- Hayashi, K. Experimental approaches on measuring the mechanical properties and constitutive laws of arterial walls. J Biomech Eng. 115 (4B), 481-488 (1993).
- Sacks, M. S., Sun, W. Multiaxial mechanical behavior of biological materials. Annu Rev Biomed Eng. 5, 251-284 (2003).
- Charis, C., et al. Impact of combined plaque structural stress and wall shear stress on coronary plaque progression, regression, and changes in composition. Eur Heart J. 40 (18), 1411-1422 (2019).
- Wang, L., et al. Quantifying patient-specific in vivo coronary plaque material properties for accurate stress/strain calculations: An IVUS-based multi-patient study. Front Physiol. 12, 721195 (2021).
- Guo, X. Y., et al. Quantify patient-specific coronary material property and its impact on stress/strain calculations using in vivo IVUS data and 3D FSI models: a pilot study. Biomech Model Mechanobiol. 16 (1), 333-344 (2017).
- Wang, L., et al. Quantification of patient-specific coronary material properties and their correlations with plaque morphological characteristics: An in vivo IVUS study. Int J Cardiol. 371, 21-27 (2023).
- Lu, W., et al. Accurate identification of potential critical coronary lesions for the reduction of risk of cardiovascular events: study protocol for a randomized, open-label, active-controlled multi-center trial. Clin Trial Degenerat Dis. 3 (3), 106-110 (2018).
- Lv, R., et al. Using optical coherence tomography and intravascular ultrasound imaging to quantify coronary plaque cap stress/strain and progression: A follow-up study using 3D thin-layer models. Front Bioeng Biotechnol. 9, 713525 (2021).
- Camasao, D. B., Mantovani, D. The mechanical characterization of blood vessels and their substitutes in the continuous quest for physiological-relevant performances. A critical review. Mater Today Bio. 10, 100106 (2021).
- Holistic Numerical Methods Institute at University of South Florida. . Secant Method. , (2003).
- Barnes, J. An algorithm for solving nonlinear equations based on the secant method. Comp J. 8 (8), 66-72 (1965).
- Liu, M., Liang, L., Sun, W. A new inverse method for estimation of in vivo mechanical properties of the aortic wall. J Mech Behav Biomed Mater. 72, 148-158 (2017).
- Yu, H., et al. Patient-specific in vivo right ventricle material parameter estimation for patients with tetralogy of Fallot using MRI-based models with different zero-load diastole and systole morphologies. Int J Cardiol. 276, 93-99 (2019).
- Meuwissen, M. H. H., Oomens, C. W. J., Baaijens, F. P. T., Petterson, R., Janssen, J. D. Determination of the elasto-plastic properties of aluminium using a mixed numerical-experimental method. J Mater Process Technol. 75, 204-211 (1998).
- Davis, F. M., Luo, Y., Avril, S., Duprey, A., Lu, J. Local mechanical properties of human ascending thoracic aneurysms. J Mech Behav Biomed Mater. 61, 235-249 (2016).
- Fan, L., Wang, H., Kassab, G. S., Lee, L. C. Review of cardiac-coronary interaction and insights from mathematical modeling. WIREs Mech Dis. 16 (3), e1642 (2024).
- Andreas, W., et al. A finite element updating approach for identification of the anisotropic hyperelastic properties of normal and diseased aortic walls from 4D ultrasound strain imaging. J Mech Behav Biomed Mater. 58, 122-138 (2016).
- Liu, M., et al. Identification of in vivo nonlinear anisotropic mechanical properties of ascending thoracic aortic aneurysm from patient-specific CT scans. Sci Rep. 9, 12983 (2019).
- Trabelsi, O., Duprey, A., Favre, J. P., Avril, S. Predictive models with patient specific material properties for the biomechanical behavior of ascending thoracic aneurysms. Ann Biomed Eng. 44, 84-98 (2016).
- Cosentino, F., et al. On the role of material properties in ascending thoracic aortic aneurysms. Comput Biol Med. 109, 70-78 (2019).
- Krauz, K., et al. The role of epicardial adipose tissue in acute coronary syndromes, post-infarct remodeling and cardiac regeneration. Int J Mol Sci. 25 (7), 3583 (2024).
- McCracken, I. R., Smart, N. Control of coronary vascular cell fate in development and regeneration. Semin Cell Dev Biol. 155 (Pt C), 50-61 (2024).
- Holzapfel, G. A., et al. Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling. Am J Physiol Heart Circ Physiol. 289 (5), H2048-H2058 (2005).
- Han, Y., et al. Ventricle stress/strain comparisons between Tertalogy of Fallot patients and healthy using models with different zero-load diastole and systole morphologies. PLoS One. 14 (8), e0220328 (2019).
- Ryo, K., et al. Role of the low-density lipoprotein-cholesterol/high-density lipoprotein-cholesterol ratio in predicting serial changes in the lipid component of coronary plaque. Circ J. 81 (10), 1439-1446 (2017).
- Thomas, T. W., et al. In vivo characterization and quantification of atherosclerotic carotid plaque components with multidetector computed tomography and histopathological correlation. Arterioscler Thromb Vasc Biol. 26 (10), 2366-2372 (2006).
- Masanori, K., et al. In vivo quantitative tissue characterization of human coronary arterial plaques by use of integrated backscatter intravascular ultrasound and comparison with angioscopic findings. Circulation. 105 (21), 2487-2492 (2002).
- Roach, M. R., Burton, A. C. The reason for the shape of the distensibility curves of arteries. Can J Biochem Physiol. 35, 681-690 (1957).
- Fung, Y. C., Liu, S. Q. Strain distribution in small blood vessel with zero-stress state taken into consideration. Am J Physiol. 262, 544-552 (1992).
- Ohayon, J., et al. Influence of residual stress/strain on the biomechanical stability of vulnerable coronary plaques: Potential impact for evaluating the risk of plaque rupture. Am J Physiol Heart Circ Physiol. 293, 1987-1996 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유