Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Approche de modélisation par éléments finis basée sur l’image de l’échographie intravasculaire pour quantifier les propriétés mécaniques in vivo de l’artère coronaire humaine
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les images échographiques intravasculaires in vivo montrent le mouvement de la section transversale coronaire correspondant à différentes conditions de charge de pression. Sur la base d’un modèle d’éléments finis, un schéma itératif a été utilisé pour déterminer les propriétés mécaniques spécifiques au patient des artères coronaires in vivo en faisant correspondre le mouvement coronaire du modèle computationnel et des images médicales.
Résumé
La quantification des propriétés mécaniques des parois artérielles coronaires pourrait fournir des informations significatives pour le diagnostic, la prise en charge et le traitement des maladies coronariennes. Étant donné qu’il n’existe pas d’échantillons coronaires spécifiques aux patients nécessitant une surveillance continue, il devient impossible de tester directement les propriétés des matériaux des vaisseaux. Les modèles coronaires actuels utilisent généralement des paramètres de matériaux provenant de la littérature disponible, ce qui entraîne des erreurs de calcul de contrainte/déformation mécaniques importantes. Ici, nous introduirons une approche de mise à jour basée sur un modèle d’éléments finis (FEMBUA) pour quantifier les propriétés matérielles in vivo spécifiques au patient des artères coronaires sur la base d’images médicales. Des images d’échographie intravasculaire (IVUS) in vivo et d’histologie virtuelle (VH)-IVUS des artères coronaires ont été acquises auprès d’un patient atteint de maladie coronarienne. Des images IVUS cinétiques montrant le mouvement vasculaire sur un cycle cardiaque ont été segmentées, et deux trames IVUS avec des circonférences de lumière maximale et minimale ont été sélectionnées pour représenter la géométrie coronaire dans des conditions de pression systolique et diastolique, respectivement. L’image VH-IVUS a également été segmentée pour obtenir les contours des vaisseaux, et une épaisseur de couche de 0,05 cm a été ajoutée aux contours VH-IVUS pour reconstruire la géométrie coronaire. Un modèle informatique par éléments finis a été créé à l’aide d’un modèle de matériau anisotrope de Mooney-Rivlin utilisé pour décrire les propriétés mécaniques du vaisseau et les conditions de pression artérielle pulsatile prescrites à la surface luminale coronaire pour le faire se contracter et se dilater. Ensuite, une approche de mise à jour itérative a été utilisée pour déterminer les paramètres matériels du modèle anisotrope de Mooney-Rivlin en faisant correspondre les circonférences minimales et maximales de la lumière du modèle d’éléments finis computationnel avec celles des images IVUS ciné. Cette approche de mise à jour basée sur l’image, basée sur un modèle d’éléments finis, pourrait être étendue avec succès pour déterminer les propriétés matérielles des parois artérielles dans divers lits vasculaires et présente un potentiel d’évaluation du risque de maladies cardiovasculaires.
Introduction
La maladie coronarienne est l’une des principales causes de mortalité et de morbidité, avec plus de 9,14 millions de décès en 2019 dans le monde. Le développement de maladies coronariennes, telles que l’athérosclérose et la sténose, s’accompagne souvent d’altérations des forces mécaniques et de modifications des propriétés des matériaux de la paroi vasculaire3. Les propriétés matérielles des artères coronaires sont non seulement la pierre angulaire pour déterminer leur réponse mécanique à la charge physiologique, mais aussi les éléments clés pour simuler le comportement mécanique des vaisseaux sanguins, prédire le développement de lésions athéroscléreuses et évaluer l’effet thérapeutique de divers dispositifs médicaux 4,5. Par conséquent, une compréhension approfondie et une quantification précise des propriétés du matériau coronaire sont d’une valeur primordiale pour le diagnostic précoce des maladies, la médecine de précision et l’évaluation du pronostic6.
Les expériences mécaniques de tissus coronaires isolés, telles que les tests biaxiaux planaires, les tests d’indentation, les tests d’inflation-extension et les tests d’extension uniaxiale, sont des approches courantes pour quantifier les propriétés mécaniques des parois des vaisseaux coronaires ex vivo 7,8,9. À partir de ces approches, des échantillons d’artères coronaires ont été obtenus chez des patients ou des animaux de laboratoire. Des essais mécaniques ont été effectués pour déterminer les réponses à la déformation de la paroi de la cuve dans différentes conditions de contrainte, puis les paramètres du matériau ont été déterminés en ajustant les données expérimentales10. Des études antérieures ont montré que les propriétés coronaires sont hautement non linéaires et anisotropes11. Bien que les expériences ex vivo puissent fournir des données précises sur les propriétés des matériaux, il existe également des limites importantes, qui sont les suivantes : premièrement, le comportement mécanique de l’échantillon après prélèvement sur les sujets vivants serait différent de celui dans des conditions in vivo, ce qui peut affecter la précision des résultats des tests. Deuxièmement, en raison de contraintes éthiques et pratiques, il est difficile d’obtenir une grande collection de tissus normaux ou pathologiques d’artères coronaires pour effectuer les tests mécaniques.
Pour surmonter ces limites, les chercheurs ont exploré de nouvelles techniques de quantification in vivo, en temps réel et spécifique au patient des propriétés des matériaux coronaires. Parmi elles, l’approche de mise à jour basée sur le modèle d’éléments finis (FEMBUA) basée sur l’image médicale promet de résoudre ces problèmes difficiles. Cette approche utilise des techniques d’imagerie avancées telles que l’échographie intravasculaire (IVUS) et l’histologie virtuelle (VH)-IVUS pour capturer en détail la géométrie coronaire, la composition des tissus et son mouvement12. En construisant des modèles d’éléments finis (EF) 3D et en incorporant des conditions de pression artérielle physiologiques spécifiques au patient, le comportement vasculaire dynamique pendant les cycles cardiaques a pu être récupéré en optimisant les paramètres du matériau pour correspondre aux données d’image afin de quantifier rapidement et précisément les propriétés du matériau coronaire13. Les avantages de l’approche de mise à jour de l’EF in vivo par rapport aux expériences ex vivo comprennent l’évaluation in vivo sans excision tissulaire, la facilitation des évaluations à grande échelle et la simulation de la dynamique vasculaire dans des conditions complexes pour aider à la compréhension de la physiopathologie des maladies coronariennes.
Dans cet article, les étapes clés de l’approche de mise à jour basée sur le modèle d’éléments finis sont présentées, qui comprennent une segmentation et un traitement détaillés de l’image CINE IVUS et VH-IVUS, la reconstruction d’un modèle computationnel de structure de couche mince uniquement, l’exécution du schéma itératif pour rechercher des paramètres de matériau optimaux pour les tissus artériels coronaires. L’objectif de ce protocole est de quantifier les propriétés matérielles de l’artère coronaire d’un patient patient atteint de coronaropathie en utilisant la méthode FEMBUA comme démonstration, en particulier l’illustration de méthodes étape par étape. Nous avons conclu en discutant de l’importance et d’autres aspects de cette méthode in vivo .
La participante sélectionnée est une femme de 64 ans sans antécédents cliniques de maladie coronarienne. Ce patient a été diagnostiqué avec une maladie coronarienne après avoir présenté des symptômes de douleur thoracique. L’angiographie coronaire et la scintigraphie IVUS ont été réalisées pour confirmer le diagnostic. Une lésion de plaque avec 60 % de sténose a été trouvée au milieu de l’artère descendante antérieure gauche. Après évaluation, un traitement médical optimal a été adopté pour traiter le patient.
Protocole
Des données cliniques anonymisées, y compris des images IVUS in vivo et des données sur la pression artérielle, ont été obtenues auprès d’un patient atteint de coronaropathie à l’hôpital Zhongda de l’Université du Sud-Est, avec l’obtention d’un consentement éclairé. Le patient échantillon a été sélectionné dans le groupe de patients d’une étude clinique sur des lésions athéroscléreuses coronaires intermédiaires afin de démontrer la méthode de quantification des propriétés matérielles des vaisseaux coronaires spécifiques au patient14. L’étude a été menée conformément au protocole approuvé par le Comité d’éthique de la recherche clinique de l’hôpital Zhongda, Université du Sud-Est (numéro d’approbation : 2017ZDSYLL023-p01).
1. Acquisition et traitement des données
- Acquisition d’images Cine IVUS et VH-IVUS
- Placez le cathéter IVUS distal à la lésion athéroscléreuse en le guidant d’une angiographie coronaire et ramenez-le vers le côté proximal. Générez des images IVUS en niveaux de gris en cours de route pour visualiser la section transversale du vaisseau coronaire.
- Utilisez le système d’imagerie IVUS équipé d’un cathéter en platine haute performance de 20 MHz, 2,9F pour acquérir des images IVUS du segment artériel coronaire avec plaque d’athérosclérose du patient atteint de coronaropathie (Figure 1).
- Pendant l’acquisition d’images IVUS, mettez le cathéter en pause au site de lésion présélectionné pendant environ 2 s pour obtenir une séquence d’images IVUS appelée IVUS cine. Les images ciné IVUS ont clairement montré les changements dynamiques de section transversale au site de plaque donné au cours du cycle cardiaque.
- Générez des images VH-IVUS basées sur des trames IVUS acquises à l’instant du pic R sur des électrocardiogrammes pour visualiser les composants de la plaque sous forme de code couleur à l’aide du système d’imagerie.
REMARQUE : Les images VH-IVUS fournissent une carte colorimétrique intuitive pour quatre composants clés de la plaque d’athérosclérose : le noyau nécrotique riche en lipides (lipide) en rouge, la calcification en blanc, le tissu fibreux en vert foncé et le tissu adipeux fibreux en vert clair. - Enregistrez des images VH-IVUS et cinéma IVUS au format DICOM pour une analyse hors ligne.
- Segmentation et traitement des images
- Ouvrez les fichiers DICOM à l’aide du visualiseur, double-cliquez sur le nom de la séquence correspondante pour ouvrir l’image, puis cliquez sur Exporter > Exporter les images pour enregistrer chaque image cinéma IVUS ou image VH-IVUS en tant qu’image individuelle au format BMP. Chaque image BMP contient 500 x 500 pixels, comme indiqué par le fichier DICOM d’origine.
- Examinez l’image IVUS ciné image par image pour trouver les images consécutives obtenues au site de la plaque présélectionnée au cours d’un cycle cardiaque. 26 images IVUS ciné ont été générées au cours d’un cycle cardiaque pour ce site de plaque d’échantillon.
- Examinez toutes les images VH-IVUS générées pour trouver l’image VH-IVUS obtenue à l’endroit indiqué. Les images VH-IVUS utilisées ici ont été créées à l’aide d’une trame IVUS à partir des trames CINE IVUS dans un cycle cardiaque.
- Segmentez les images VH-IVUS et cine IVUS à l’aide du logiciel ImageJ pour obtenir les contours des limites des vaisseaux et des limites des composants de la plaque (voir Figure 1C).
- Sélectionnez l’onglet Ligne droite > segmentée et délimitez manuellement les contours de la lumière, la limite externe du vaisseau coronaire et les composants de la plaque sur les images cinéma IVUS et VH-IVUS. Pour l’image IVUS ciné, segmentez uniquement les contours de la lumière et de la limite du vaisseau externe, tandis que pour l’image VH-IVUS, segmentez les contours de la lumière, de la limite du vaisseau externe et des limites des composants de la plaque.
- Pour simplifier, ne conservez que les grands composants lipidiques pour générer un modèle d’éléments finis et ignorez les petits composants lipidiques isolés. Un seul lipide était présent dans cet échantillon de plaque. Superposez les contours délimités sur les images d’origine à l’aide de l’onglet Image > Overlay > Add Selection .
- Accédez au menu Vers le gestionnaire de retour sur investissement pour gérer les contours, ajuster les propriétés et définir les couleurs et la largeur de ligne aux valeurs appropriées pour une meilleure visualisation. Sélectionnez l’onglet Propriétés , définissez la couleur du trait sur une autre couleur et indiquez la largeur de la ligne par la largeur. Ici, définissez les couleurs de ligne sur le vert, le bleu et le rouge pour les contours de lumière, de limite externe et de lipide, respectivement, et la largeur de ligne sur 3.
- Lisser les contours à l’aide de Modifier > sélection > Ajuster la spline à partir de la barre de commandes après avoir sélectionné un contour spécifique pour obtenir un contour lisse. Cette opération utilise des techniques d’ajustement de courbes splines pour lisser automatiquement les contours.
- Cliquez sur Fichier > Enregistrer sous >onglet Coordonnées XY pour enregistrer les coordonnées ponctuelles de chaque contour comme la lumière, la limite extérieure et le composant de plaque dans un fichier txt distinct. Ce fichier contient les valeurs des coordonnées x et y des points constituant le contour, avec les pixels comme unité.
- Enregistrez la taille physique réelle de chaque pixel dans les images cinéma IVUS et VH-IVUS (indiquée par la taille de pixel) à partir du fichier DICOM. La distance réelle d’un pixel dans les données IVUS utilisées ici est de 0,002 cm. Cette information serait utilisée pour convertir les coordonnées du point avec le pixel comme unité en distance réelle avec cm comme unité.
- Traitement des données de contour
- Traitement des données de contour Cine IVUS
- Lisez les fichiers txt des contours lumineux à partir de toutes les images IVUS ciné d’un cycle cardiaque avec MATLAB.
- Multipliez tous les contours de la lumière par la taille du pixel pour obtenir la taille réelle des contours de la lumière.
- Calculez les circonférences de lumière pour tous les contours de lumière et identifiez les cadres IVUS avec des circonférences de lumière maximale (Cmax) et minimale (Cmin), représentant respectivement les conditions diastoliques et systoliques.
- Traitement des données de contour VH-IVUS
- Lisez les fichiers txt des contours de la lumière, de la limite extérieure et des composants de la plaque à partir de l’image VH-IVUS avec MATLAB.
- Multipliez tous les contours par la taille des pixels pour obtenir la taille réelle de tous les contours.
- Redivisez chaque contour en 100 points équidistants et effectuez un lissage 2D pour obtenir de nouvelles données de contour VH-IVUS pour remplacer les anciennes.
- Traitement des données de contour Cine IVUS
2. Modèle d’éléments finis
- Reconstruction de la géométrie des vaisseaux coronaires
- Créez une couche de contours dans un espace tridimensionnel en ajoutant la valeur de la coordonnée z pour tous les points des contours VH-IVUS, y compris la lumière, la limite externe et le lipide, et définissez z = 0 pour tous les points (Figure 2).
- Créez une autre couche de contours en ajoutant la valeur de la coordonnée z pour tous les points des contours VH-IVUS et réinitialisez z = 0,05 cm pour tous les points.
REMARQUE : Ces deux couches de contours reconstruisent la géométrie 3D des vaisseaux coronaires pour le modèle à structure mince uniquement en ajoutant une épaisseur de couche fixe de 0,05 cm aux contours VH-IVUS (Figure 2).
- Génération de maillage par éléments finis
- Créez deux contours auxiliaires en interpolant linéairement la lumière et les contours de la limite extérieure avec des poids 1/3 et 2/3 (Figure 3A) pour chaque couche.
- Divisez la surface du vaisseau en 8 parties circonférentielles et 3 parties radiales (voir Figure 3B) en connectant la limite lumineuse/externe au point le plus proche du contour lipidique (par exemple, les points A et B de la figure 3B) ou à deux contours auxiliaires avec des lignes radiales.
- Reliez tous les points entre les couches par des lignes droites, formant une structure 3D de 3 x 8 volumes (Figure 3B). Divisez chaque volume à l’aide d’éléments hexaédriques pour générer le maillage d’éléments finis (Figure 3C) et différents groupes de matériaux (Figure 3D).
- Effectuez une analyse de maillage en affinant la densité du maillage de 10 % jusqu’à ce que les changements dans les solutions < 5 %.
- Définition des propriétés des matériaux
- Utilisez un modèle de matériau Mooney-Rivlin anisotrope modifié pour décrire les propriétés matérielles de la paroi des vaisseaux coronaires. On a supposé que les vaisseaux coronaires et les composants de la plaque étaient des matériaux hyperélastiques, anisotropes, presque incompressibles et homogènes, et que la fonction de densité d’énergie de déformation du modèle de matériau anisotrope modifié de Mooney-Rivlin est la suivante :
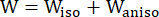 (1)
(1)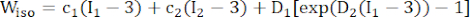 (2)
(2)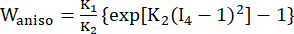 (3)
(3)
où I1 et I2 sont les premier et second invariants du tenseur de déformation de Cauchy-Green droit C défini comme c = [cij] = XTX, X = [Xij] = [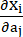 ], (Xi) était la position actuelle (aj) était la position d’origine, I4 = cij(nc)i(nc)j, nc était le vecteur unitaire dans la direction circonférentielle du vaisseau. c1, c2, D1, D2, K1 et K2 étaient des paramètres matériels spécifiques au patient.
], (Xi) était la position actuelle (aj) était la position d’origine, I4 = cij(nc)i(nc)j, nc était le vecteur unitaire dans la direction circonférentielle du vaisseau. c1, c2, D1, D2, K1 et K2 étaient des paramètres matériels spécifiques au patient. - Attribuez les valeurs initiales des paramètres matériels pour un vaisseau coronaire spécifique au patient en fonction des résultats des tests biaxiaux ex vivo, c’est-à-dire c1 = −1 312,9 kPa, c2 = 114,7 kPa, D1 = 629,7 kPa, D2 = 2,0, K1 = 35,9 kPa et K2 = 23,5 (Figure 4A-B)13,15.
- Attribuez les paramètres de matériau pour le composant de la plaque, le cas échéant. Plus précisément, pour les lipides, c1 = 0,5 kPa, c2 = 0, D1 = 0,5 kPa et D2 = 1,5 ; pour la calcification, nous avons utilisé c1 = 920 kPa, c2 = 0, D1 = 360 kPa et D2 = 2,0 (Figure 4B)16.
REMARQUE : Les composants de la plaque (lipide et calcification) ont été supposés être hyperélastiques, isotropes et presque incompressibles, et leurs propriétés mécaniques ont été décrites par le modèle de matériau isotrope de Mooney-Rivlin avec les fonctions de densité d’énergie de déformation données dans la formule (2).
- Utilisez un modèle de matériau Mooney-Rivlin anisotrope modifié pour décrire les propriétés matérielles de la paroi des vaisseaux coronaires. On a supposé que les vaisseaux coronaires et les composants de la plaque étaient des matériaux hyperélastiques, anisotropes, presque incompressibles et homogènes, et que la fonction de densité d’énergie de déformation du modèle de matériau anisotrope modifié de Mooney-Rivlin est la suivante :
- Définition d’équations et de conditions aux limites
- Définissez les équations directrices pour le modèle de structure de couche mince uniquement, qui comprend l’équation de mouvement, la relation déformation-déplacement non linéaire de Cauchy-Green et le modèle de matériau de vaisseau coronaire11.
- Prescrire des formes d’onde de pression artérielle spécifiques au patient à la surface de la lumière pour simuler des conditions physiologiques réelles (Figure 4C). Pour obtenir des formes d’onde de pression artérielle spécifiques au patient, mettez à l’échelle une forme d’onde de pression aortique typique avec des valeurs de pression systolique et diastolique mesurées par le brassard (Figure 4D).
3. Approche de mise à jour basée sur un modèle d’éléments finis pour les propriétés des matériaux des artères coronaires spécifiques au patient
REMARQUE : Le processus itératif de détermination des propriétés des matériaux coronaires spécifiques au patient est illustré à la figure 5.
- Déterminez la géométrie à vide correspondant à la condition de pression nulle comme géométrie initiale pour le modèle de calcul en réduisant la géométrie coronaire reconstruite à partir de l’image VH-IVUS axialement avec un taux de retrait fixe de 95 % et circonférentiellement avec un retrait circonférentiel (noté S) initialement défini à 98 %.
REMARQUE : Étant donné que la géométrie coronaire reconstruite à partir de l’image VH-IVUS était dans des conditions in vivo avec une pression artérielle prescrite sur la lumière et un étirement axial à partir de segments artériels coronaires distaux et proximaux attachés, la géométrie coronaire in vivo doit se rétrécir circonférentiellement et axialement pour obtenir la géométrie à pression nulle. - Fixez le taux de retrait axial à 95 % et mettez à jour le retrait circonférentiel au cours des étapes suivantes.
- Définissez le rapport de matériau (noté k) pour attribuer les propriétés matérielles spécifiques au patient du vaisseau coronaire comme suit : c’est-à-dire c1 = k*(−1 312,9) kPa, c2 = k*114,7 kPa, D1 = k*629,7 kPa, K1 = k*35,9 kPa, et fixez D2 = 2,0 et K2 = 23,5.
REMARQUE : Étant donné que seuls deux points de données (circonférences minimale et maximale de la lumière correspondant aux pressions diastolique et systolique) ont été obtenus pour déterminer les paramètres inconnus (taux de rétrécissement circonférentiel S et paramètres de matériau du modèle Mooney-Rivlin), nous avons réduit le nombre de paramètres inconnus en supposant que les propriétés matérielles spécifiques au patient in vivo du vaisseau coronaire étaient proportionnelles à l’estimation initiale, le rapport de matériau étant noté k : c’est-à-dire que c1 = k*(−1 312,9) kPa, c2 = k*114,7 kPa, D1 = k*629,7 kPa, K1 = k*35,9 kPa, tandis que D2 = 2,0 et K2 = 23,5 étaient fixes. - Mettez à jour la valeur k définie sur une valeur initiale k de 1 avec le taux de rétrécissement circonférentiel S au cours de la procédure itérative suivante.
- Exécutez un logiciel pour résoudre le modèle de calcul afin d’obtenir les résultats numériques.
- Écrivez toutes les commandes permettant de créer le modèle de structure de couche mince uniquement dans un fichier batch (Supplementary File 1) à l’aide de MATLAB.
- Chargez ce fichier de commandes à l’aide de l’interface utilisateur avancée (AUI) pour générer le modèle (Figure 6A). Résolvez le modèle de structure de couche mince uniquement en cliquant sur Fichier de données/Solution et enregistrez-le en tant que fichier .dat (Figure 6C). Simulez trois cycles cardiaques et adoptez la solution du dernier cycle pour présenter des résultats numériques.
- Exportez les résultats des coordonnées de nœud dans un fichier txt en accédant à la liste des > à la liste des valeurs > à la zone et en sélectionnant X-POSITION, Y-POSITION et Z-POSITION dans les variables à répertorier sous Coordonnées. Cliquez sur Appliquer et exporter pour exporter les résultats des coordonnées.
- Enregistrez les données de contour lumineux correspondant aux conditions de pression diastolique et systolique dans des fichiers .txt pour le calcul de la circonférence du lumen.
- Comparez les circonférences lumineuses calculées par le modèle EF (modèle de structure de couche mince uniquement) à la condition de pression diastolique avec les données IVUS in vivo cine (Cmin) et vérifiez si l’erreur relative était de <1 %. Si la condition a été remplie, passez à l’étape suivante, ou mettez à jour le rapport de matière k à l’aide de la méthode sécante et passez à l’étape 3.3 pour relancer17,18.
REMARQUE : Dans la première itérative, la méthode de Newton a été utilisée pour mettre à jour le rapport de matériau au lieu de la méthode sécante. - Comparez les circonférences lumineuses calculées par le modèle EF dans des conditions de pression systolique avec les données IVUS in vivo cine (Cmax) et vérifiez si l’erreur relative était de <1 %. Si c’est le cas, arrêtez la procédure itérative ou mettez à jour le taux de rétrécissement circonférentiel S et redirigez-vous vers l’étape 3.4 pour réexécuter.
REMARQUE : Dans la première itérative, la méthode de Newton a été utilisée pour mettre à jour le taux de rétrécissement circonférentiel au lieu de la méthode sécante. - Enregistrez les valeurs optimales S et k et calculez les paramètres de matériau correspondants du modèle de matériau Mooney-Rivlin.
- Tracez les courbes circonférentielles et axiales du rapport contrainte-étirement du vaisseau coronaire (figure 7), qui peuvent être dérivées comme suit :
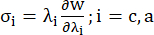 (4)
(4)
où σ représente la contrainte de Cauchy, λ représente le rapport d’étirement, i = c, a représente les directions circonférentielle et axiale.- Pour dessiner une courbe de matériau dans une direction particulière, fixez le rapport d’étirement dans l’autre sens à 1. Calculez le module de Young effectif dans la circonférence et l’axe (étiquetés YMc et YMa, respectivement) comme la pente de la fonction d’échelle de la courbe du matériau à l’intervalle de rapport d’étirement [1,0, 1,1] pour refléter la rigidité générale du matériau de l’artère coronaire13 :
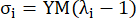 (5)
(5)
- Pour dessiner une courbe de matériau dans une direction particulière, fixez le rapport d’étirement dans l’autre sens à 1. Calculez le module de Young effectif dans la circonférence et l’axe (étiquetés YMc et YMa, respectivement) comme la pente de la fonction d’échelle de la courbe du matériau à l’intervalle de rapport d’étirement [1,0, 1,1] pour refléter la rigidité générale du matériau de l’artère coronaire13 :
- Extrayez les distributions de contraintes/déformations de plaque à tout moment et enregistrez la distribution des nœuds et les valeurs de contrainte maximale pendant les phases systolique et diastolique (Figure 8).
Résultats
Nous décrivons en détail la méthode FEMBUA, qui permet une analyse rapide du matériau des plaques et des contraintes des plaques coronaires après imagerie IVUS en temps réel et peut déterminer les propriétés des matériaux in vivo et les résultats biomécaniques des plaques. Les paramètres matériels in vivo du modèle de matériau Mooney-Rivlin pour ce vaisseau coronaire sont présentés dans le tableau 1. Les résultats de simulation du mod...
Discussion
Étapes critiques du protocole
L’étape la plus critique de l’approche de mise à jour basée sur un modèle d’éléments finis réside dans la procédure itérative. Dans cette approche, le modèle d’éléments finis devrait récupérer avec précision le mouvement des vaisseaux coronaires sur la section efficace vasculaire à partir d’images IVUS in vivo . À cette fin, la minimisation de la différence de circonférence de la lumière entre le mo...
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Cette recherche a été financée en partie par le projet de science et de technologie de la santé médicale de la province du Shandong (n° 202425020256 et 202403010254), les subventions de la Fondation nationale des sciences naturelles de Chine 11972117 et 11802060, la Fondation des sciences naturelles de la province du Jiangsu sous le numéro de subvention BK20180352 et la Fondation des sciences naturelles de la province du Shandong sous le numéro de subvention ZR2024QA110.
matériels
| Name | Company | Catalog Number | Comments |
| Bee DICOM Viewer | SinoUnion Healthcare Inc. | Version 3.5.1 | A DICOM image reader software |
| ADINA | Adina R & D | Version 9.0 | Finite element solver |
| ImageJ | National Institutes of Health | Segmented IVUS contours | |
| MATLAB | MathWorks | Version R2018a | Commercial programming platform |
| Volcano s5 imaging system | Volcano Company | Intravascular ultrasound imaging system |
Références
- Roth, G. A., et al. Global burden of cardiovascular diseases and risk factors, 1990-2019: update from the GBD 2019 study. J Am Coll Cardiol. 76 (25), 2982-3021 (2020).
- Kanwar, S. S., et al. Acute coronary syndromes without coronary plaque rupture. Nat Rev Cardiol. 13 (5), 257-265 (2016).
- Milzi, A., et al. Coronary plaque composition influences biomechanical stress and predicts plaque rupture in a morpho-mechanic OCT analysis. Elife. 10, e64020 (2021).
- Stefanati, M., et al. Effect of variability of mechanical properties on the predictive capabilities of vulnerable coronary plaques. Comput Methods Programs Biomed. 254, 108271 (2024).
- Laurent, S., et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 27 (21), 2588-2605 (2006).
- Daisuke, K., et al. Coronary plaque phenotype associated with positive remodeling. J Cardiovasc Comput Tomogr. 18 (4), 401-407 (2024).
- Macrae, R. A., Miller, K., Doyle, B. J. Methods in mechanical testing of arterial tissue: A review. Strain. 52, 380-399 (2016).
- Hayashi, K. Experimental approaches on measuring the mechanical properties and constitutive laws of arterial walls. J Biomech Eng. 115 (4B), 481-488 (1993).
- Sacks, M. S., Sun, W. Multiaxial mechanical behavior of biological materials. Annu Rev Biomed Eng. 5, 251-284 (2003).
- Charis, C., et al. Impact of combined plaque structural stress and wall shear stress on coronary plaque progression, regression, and changes in composition. Eur Heart J. 40 (18), 1411-1422 (2019).
- Wang, L., et al. Quantifying patient-specific in vivo coronary plaque material properties for accurate stress/strain calculations: An IVUS-based multi-patient study. Front Physiol. 12, 721195 (2021).
- Guo, X. Y., et al. Quantify patient-specific coronary material property and its impact on stress/strain calculations using in vivo IVUS data and 3D FSI models: a pilot study. Biomech Model Mechanobiol. 16 (1), 333-344 (2017).
- Wang, L., et al. Quantification of patient-specific coronary material properties and their correlations with plaque morphological characteristics: An in vivo IVUS study. Int J Cardiol. 371, 21-27 (2023).
- Lu, W., et al. Accurate identification of potential critical coronary lesions for the reduction of risk of cardiovascular events: study protocol for a randomized, open-label, active-controlled multi-center trial. Clin Trial Degenerat Dis. 3 (3), 106-110 (2018).
- Lv, R., et al. Using optical coherence tomography and intravascular ultrasound imaging to quantify coronary plaque cap stress/strain and progression: A follow-up study using 3D thin-layer models. Front Bioeng Biotechnol. 9, 713525 (2021).
- Camasao, D. B., Mantovani, D. The mechanical characterization of blood vessels and their substitutes in the continuous quest for physiological-relevant performances. A critical review. Mater Today Bio. 10, 100106 (2021).
- Holistic Numerical Methods Institute at University of South Florida. . Secant Method. , (2003).
- Barnes, J. An algorithm for solving nonlinear equations based on the secant method. Comp J. 8 (8), 66-72 (1965).
- Liu, M., Liang, L., Sun, W. A new inverse method for estimation of in vivo mechanical properties of the aortic wall. J Mech Behav Biomed Mater. 72, 148-158 (2017).
- Yu, H., et al. Patient-specific in vivo right ventricle material parameter estimation for patients with tetralogy of Fallot using MRI-based models with different zero-load diastole and systole morphologies. Int J Cardiol. 276, 93-99 (2019).
- Meuwissen, M. H. H., Oomens, C. W. J., Baaijens, F. P. T., Petterson, R., Janssen, J. D. Determination of the elasto-plastic properties of aluminium using a mixed numerical-experimental method. J Mater Process Technol. 75, 204-211 (1998).
- Davis, F. M., Luo, Y., Avril, S., Duprey, A., Lu, J. Local mechanical properties of human ascending thoracic aneurysms. J Mech Behav Biomed Mater. 61, 235-249 (2016).
- Fan, L., Wang, H., Kassab, G. S., Lee, L. C. Review of cardiac-coronary interaction and insights from mathematical modeling. WIREs Mech Dis. 16 (3), e1642 (2024).
- Andreas, W., et al. A finite element updating approach for identification of the anisotropic hyperelastic properties of normal and diseased aortic walls from 4D ultrasound strain imaging. J Mech Behav Biomed Mater. 58, 122-138 (2016).
- Liu, M., et al. Identification of in vivo nonlinear anisotropic mechanical properties of ascending thoracic aortic aneurysm from patient-specific CT scans. Sci Rep. 9, 12983 (2019).
- Trabelsi, O., Duprey, A., Favre, J. P., Avril, S. Predictive models with patient specific material properties for the biomechanical behavior of ascending thoracic aneurysms. Ann Biomed Eng. 44, 84-98 (2016).
- Cosentino, F., et al. On the role of material properties in ascending thoracic aortic aneurysms. Comput Biol Med. 109, 70-78 (2019).
- Krauz, K., et al. The role of epicardial adipose tissue in acute coronary syndromes, post-infarct remodeling and cardiac regeneration. Int J Mol Sci. 25 (7), 3583 (2024).
- McCracken, I. R., Smart, N. Control of coronary vascular cell fate in development and regeneration. Semin Cell Dev Biol. 155 (Pt C), 50-61 (2024).
- Holzapfel, G. A., et al. Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling. Am J Physiol Heart Circ Physiol. 289 (5), H2048-H2058 (2005).
- Han, Y., et al. Ventricle stress/strain comparisons between Tertalogy of Fallot patients and healthy using models with different zero-load diastole and systole morphologies. PLoS One. 14 (8), e0220328 (2019).
- Ryo, K., et al. Role of the low-density lipoprotein-cholesterol/high-density lipoprotein-cholesterol ratio in predicting serial changes in the lipid component of coronary plaque. Circ J. 81 (10), 1439-1446 (2017).
- Thomas, T. W., et al. In vivo characterization and quantification of atherosclerotic carotid plaque components with multidetector computed tomography and histopathological correlation. Arterioscler Thromb Vasc Biol. 26 (10), 2366-2372 (2006).
- Masanori, K., et al. In vivo quantitative tissue characterization of human coronary arterial plaques by use of integrated backscatter intravascular ultrasound and comparison with angioscopic findings. Circulation. 105 (21), 2487-2492 (2002).
- Roach, M. R., Burton, A. C. The reason for the shape of the distensibility curves of arteries. Can J Biochem Physiol. 35, 681-690 (1957).
- Fung, Y. C., Liu, S. Q. Strain distribution in small blood vessel with zero-stress state taken into consideration. Am J Physiol. 262, 544-552 (1992).
- Ohayon, J., et al. Influence of residual stress/strain on the biomechanical stability of vulnerable coronary plaques: Potential impact for evaluating the risk of plaque rupture. Am J Physiol Heart Circ Physiol. 293, 1987-1996 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon