A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحضير الصفائح الدموية البشرية المغسولة لدراسات التدفق الأيضي الكمي
In This Article
Summary
يعتبر استقلاب الصفائح الدموية ذا أهمية ، لا سيما فيما يتعلق بدور فرط الصفائح الدموية ونقص النشاط في النزيف واضطرابات التخثر. يعد عزل الصفائح الدموية من البلازما ضروريا لبعض فحوصات التمثيل الغذائي. معروضة هنا هي طريقة لعزل المستقلبات داخل الخلايا من الصفائح الدموية المغسولة.
Abstract
الصفائح الدموية هي خلايا الدم التي تلعب دورا أساسيا في الإرقاء والاستجابة المناعية الفطرية. تورط فرط الصفائح الدموية ونقص النشاط في اضطرابات التمثيل الغذائي ، مما يزيد من خطر الإصابة بالجلطات والنزيف. يرتبط تنشيط الصفائح الدموية والتمثيل الغذائي ارتباطا وثيقا ، مع الطرق العديدة لقياس الأول ولكن قليلة نسبيا للأخير. لدراسة استقلاب الصفائح الدموية دون تدخل خلايا الدم الأخرى ومكونات البلازما ، يجب عزل الصفائح الدموية ، وهي عملية ليست تافهة بسبب حساسية قص الصفائح الدموية والقدرة على التنشيط بشكل لا رجعة فيه. يعرض هنا بروتوكول لعزل الصفائح الدموية (الغسيل) الذي ينتج الصفائح الدموية الهادئة الحساسة للتحفيز بواسطة ناهضات الصفائح الدموية. يتم استخدام خطوات الطرد المركزي المتتالية مع إضافة مثبطات الصفائح الدموية لعزل الصفائح الدموية من الدم الكامل وإعادة تعليقها في مخزن مؤقت متساوي التنافر الخاضع للرقابة. تنتج هذه الطريقة بشكل متكرر 30٪ -40٪ من استعادة الصفائح الدموية من الدم الكامل مع تنشيط منخفض كما تم قياسه بواسطة علامات إفراز الحبيبات ونشاط الإنتجرين. يمكن التحكم في عدد الصفائح الدموية وتركيز الوقود بدقة للسماح للمستخدم بالتحقيق في مجموعة متنوعة من حالات التمثيل الغذائي.
Introduction
الصفائح الدموية صغيرة (قطرها 2-4 ميكرومتر) ، والخلايا التي تلعب دورا مهما في الإرقاء ، وهي عملية منظمة بإحكام لتكوينالجلطة 1. في حين أن الصفائح الدموية حيوية لسلامة الأوعية الدموية ، إلا أنها متورطة أيضا في الأحداث الصحية الضارة. تشارك الصفائح الدموية في تجلط الأوردة العميقة (DVT) وتجلط الشرايين (AT) ، وهي جلطات تسد الأوعية الدموية ، مما يؤدي إلى انخفاض إمدادات الدم محليا ، أو إذا انفصلت أجزاء من الجلطة (تجسد) ، فإنها يمكن أن تمنع تدفق الدم إلى الرئتين أو القلب أوالدماغ 2،3،4،5،6،7. فرط نشاط الصفائح الدموية هو اعتلال مشترك لارتفاع ضغط الدم والسكري والسرطان ، مما يؤدي إلى زيادة حدوث DVT و AT8،9،10. يرتبط تنشيط الصفائح الدموية والتمثيل الغذائي ارتباطا وثيقا11،12 ، مما يؤدي إلى زيادة الاهتمام باستهداف استقلاب الصفائح الدموية كاستراتيجية علاجية13،14. هناك جدل حول إعادة الأسلاك الأيضية الدقيقة التي تحدث عند التنشيط ، وهذا مجال نشط للدراسة15. يؤكد هذا الاهتمام المتزايد بخلل الصفائح الدموية في المرض وعلاقاته بالتمثيل الغذائي الحاجة إلى طريقة قابلة للتكرار لعزل الصفائح الدموية ودراسة عملية التمثيل الغذائي لها.
عادة ما يتم الحصول على الصفائح الدموية البشرية عن طريق بزل الوريد ثم يتم عزلها عن الدم الكامل. يتم فصل الصفائح الدموية المغسولة عن الدم الكامل عن طريق خطوات الغسيل والطرد المركزي المتتالية16. تم إجراء ذلك في الأصل من قبل مجموعة الخردل17 ، وتم تعديله قليلا بواسطة مجموعة كازيناف18. بديل آخر هو الصفائح الدموية المصفاة بالهلام ، والتي يمكن الحصول عليها من البلازما الغنية بالصفائح الدموية (PRP) عن طريق كروماتوغرافيا استبعاد الحجم باستخدام عمود معبأ من حبات هلام الاغاروز19. توجد العديد من بروتوكولات الغسيل لكل من الدم البشري والدم القوارض ، وهي محسنة لمختلف المقايسات20،21،22،23 ، ولكن ليس لقياس التمثيل الغذائي للصفائح الدموية.
تشمل تقنيات دراسة استقلاب الصفائح الدموية قياسات الطاقة الحيوية عبر محلل Seahorse XF11،24،25،26،27 ، وقياسات التدفق خارج الخلية11،13،24 ، والتمثيل الغذائي14،28 ، وتحليل التدفق الأيضي بمساعدة النظائر (13C-MFA) 29. في الدراسات الأيضية ، يكون الهدف عادة هو تحديد المسارات المتغيرة بين حالتين مختلفتين (على سبيل المثال ، الراحة مقابل الصفائح الدموية المنشطة14). تتضمن الدراسات الأيضية استخدام قياس الطيف الكتلي الكروماتوغرافيا السائلة (LC-MS). يمكن إجراء هذه الدراسات للمستقلبات داخل الخلية أو خارجها وغالبا ما تقترن بتحليل المسار أو تحليل المكون الرئيسي (PCA) 14،28. يتضمن تحليل التدفق الأيضي بمساعدة النظائر (13C-MFA) تغذية الخلايا بركيزة مصنفة تعرف باسم التتبع ، وقياس كيفية انتشار هذا التتبع من خلال شبكة تفاعل مع LC-MS. تسمح هذه التقنية بحساب التدفقات من خلال مسارات التمثيل الغذائي بدقة مستوىالتفاعل 29،30. في الدم الكامل والبلازما الغنية بالصفائح الدموية (PRP) ، يخضع تركيز الوقود (الجلوكوز والجلوتامين والأسيتات وما إلى ذلك) للتباين من متبرع إلى متبرع ، ويمكن أن يغير الألبومين والجلوبولين المرتبط بالهرمونات الجنسية الموجود في البلازما التركيز النشط للهرمونات والأدوية والجزيئات الأخرى ذات الصلةبيولوجيا 31. توفر الصفائح الدموية المغسولة طريقة لتعليق الصفائح الدموية في وسط محدد من قبل المستخدم ، بما في ذلك تركيزات الوقود المعروفة ، والتي تتوافق مع 13C-MFA32.
موصوفة هنا هي طريقة لغسل الصفائح الدموية لإنتاج الصفائح الدموية التي يمكن استخدامها في فحوصات التمثيل الغذائي. ينتج البروتوكول الصفائح الدموية الهادئة ذات انخفاض خلايا الدم الحمراء وتلوث خلايا الدم البيضاء. تمت مراقبة حالة تنشيط الصفائح الدموية عن طريق قياس التدفق الخلوي لعلامات تنشيط الصفائح الدموية. يحقق هذا البروتوكول بشكل متكرر ما لا يقل عن 30٪ -40٪ من استعادة الصفائح الدموية بالنسبة لعدد الصفائح الدموية في الدم الكامل. الصفائح الدموية المغسولة التي تم الحصول عليها بهذه التقنية مناسبة لتقنيات تحليل التمثيل الغذائي ، ويمكن تصميم طريقة استخراج المستقلب داخل الخلايا لتحليل اختيار المستخدم (LC-MS ، GC-MS ، الفحص الضوئي ، إلخ).
Protocol
حصلت الدراسة على موافقة مجلس المراجعة المؤسسية من الحرم الجامعي الطبي بجامعة كولورادو أنشوتز. تم الحصول على موافقة كتابية من جميع المشاركين في الدراسة. أفاد المشاركون أنهم لم يستهلكوا الكحول لمدة 48 ساعة السابقة أو العقاقير غير الستيرويدية المضادة للالتهابات (NSAIDs) خلال الأيام العشرة السابقة. يتم دعم هذا المشروع من قبل المعهد الوطني للقلب والرئة والدم التابع للمعاهد الوطنية للصحة بموجب الجائزة رقم R61HL141794.
1. جمع الدم
- إعداد لسحب الدم. يوصى بجمع الدم بواسطة أخصائي فصد مدرب.
- قم بإجراء بزل الوريد على الذراع الداخلي باستخدام إبرة 19 جراما.
- اجمع أول ~ 2 مل في مكنسة كهربائية خالية من الإضافات وتخلص منها. هذا لإزالة جزيئات الإشارات الكيميائية من الخلايا البطانية التالفة التي قد تنشط الصفائح الدموية. بعد جمع 2 مل الأولي ، قم بإزالة العاصبة لتقليل إجهاد القص على الصفائح الدموية.
- اجمع باقي الدم في فراغات سكر العنب المضادة للتخثر (ACD-A) بنسبة 14: 3 (الدم: ACD-A). اقلب كل مكنسة كهربائية برفق بعد جمع الدم لخلط الدم ومضادات التخثر.
2. غسل الصفائح الدموية
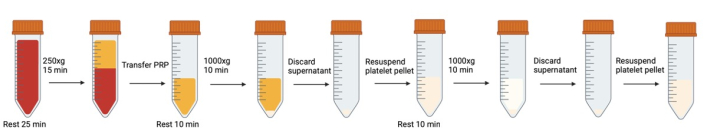
الشكل 1: خطوات الطرد المركزي وإعادة التعليق المتتالية المتضمنة في غسل الصفائح الدموية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
ملاحظة: تجنب توليد فقاعة الهواء. استخدم ماصات النقل لإزالة الفقاعات عند تكوينها، خاصة قبل الطرد المركزي. في كل مرة تكون فيها أنابيب الدم / الصفائح الدموية مفتوحة / مغلقة ، يوصى بالتنفس في الأنبوب قبل إغلاق الغطاء لزيادة مستوى ثاني أكسيد الكربون2 .
- قم بتسخين جهاز الطرد المركزي مسبقا إلى 37 درجة مئوية لتقليل تأثيرات درجة الحرارة. بين كل خطوة من خطوات الطرد المركزي في البروتوكول ، حافظ على جهاز الطرد المركزي عند 37 درجة مئوية.
- سخن حمام مائي إلى 37 درجة مئوية. ضع عازلة Tyrode المعدلة مع الجلوكوز في الحمام المائي.
ملاحظة: يمكن العثور على وصفة المخزن المؤقت ل Tyrode المعدلة في الملف التكميلي 1. - اجمع الدم الكامل الذي تم جمعه من جميع المكانس الكهربائية في أنابيب مخروطية من مادة البولي بروبيلين سعة 50 مل. باستخدام طرف ماصة مقطوع بزاوية 45 درجة، خذ حجم العينة المناسب لإجراء عد الخلايا (انظر عد الخلايا).
- قم بإزالة أي فقاعات ناتجة عن الشفط بعناية باستخدام ماصة نقل ضيقة التجويف.
- دع الدم يرتاح في حمام مائي لمدة 25 دقيقة عند 37 درجة مئوية وهذا يسمح للصفائح الدموية في حالة تنشيط عكسي (من إزالتها من الجسم ، ونقلها من أنبوب إلى آخر ، وما إلى ذلك) بالعودة إلى حالة الراحة.
- لمنع التنشيط أثناء الطرد المركزي، أضف 500 نانومتر من البروستاجلاندين I2 (PGI2) و 0.02 وحدة / مل من الأبيراز إلى الدم الكامل واخلطه برفق عن طريق التقليب مرة واحدة. قم بإزالة أي فقاعات متولدة باستخدام ماصة نقل التجويف الضيق.
ملاحظة: يمكن العثور على تعليمات الوصفة المناسبة ل PGI2 و apyrase في الملف التكميلي 1. - جهاز الطرد المركزي الدم الكامل للحصول على البلازما الغنية بالصفائح الدموية (PRP) (15 دقيقة عند 250 × جم ل 42 مل من الدم الكامل) بدون فرامل (37 درجة مئوية).
- اجمع البلازما الغنية بالصفائح الدموية برفق (الطبقة الصفراء العلوية فوق الطبقة المصفرية وطبقة الدم الحمراء) في أنبوب مخروطي جديد سعة 50 مل باستخدام ماصة نقل التجويف العريض.
- عند النقل ، قم بإمالة أنبوب مخروطي نظيف وقم بتشغيل البلازما الغنية بالصفائح الدموية برفق أسفل جانب الأنبوب. تجنب فقاعات الهواء.
- اترك ما يقرب من 3 مم من البلازما الغنية بالصفائح الدموية خلفك لتجنب إزعاج الطبقة المصقولة (طبقة خلايا الدم البيضاء بين البلازما الغنية بالصفائح الدموية والدم الأحمر). إذا تم إزعاجك ، سيبدو هذا وكأنه دوامة بيضاء مفاجئة في ماصة النقل.
- خذ عدد الخلايا (انظر عد الصفائح الدموية) لتحديد حجم إعادة التعليق لخطوة الغسيل التالية.
- اتركيه يرتاح لمدة 10 دقائق عند 37 درجة مئوية.
- باستخدام طرف ماصة مقطوع مائل ، خذ عينة لقياس التدفق الخلوي (انظر قياس التدفق الخلوي).
- أضف 500 نانومتر PGI2 و 0.02 U / مل من الأبيراز إلى PRP واخلطه عن طريق الانقلاب برفق مرة واحدة.
- جهاز طرد مركزي لمدة 10 دقائق عند 1000 × جم عند 37 درجة مئوية (التسارع: 0 الفرامل: 0). لا تستخدم الفرامل. الحبيبات ليست مضغوطة ، ويمكن أن تتسبب الفرامل المفاجئة في إعادة الخلط.
- أثناء الطرد المركزي ، حدد حجم إعادة التعليق. افترض استرداد 75٪. اجعل كثافة الخلية حوالي 3 × 105 خلايا / ميكرولتر.
- شفط مطاف باستخدام ماصة نقل بلاستيكية عريضة التجويف للحجم السائب وماصة 1 مل (طرف غير مقطوع) لبقية السائل بالقرب من الحبيبات. تجنب لمس الحبيبات في قاع الأنبوب.
- أضف 500 نانومتر PGI2 و 0.02 وحدة / مل من الأبيراز إلى المخزن المؤقت لتيرود المعدل. أضف ببطء كمية محسوبة من المخزن المؤقت من الخطوة 16 عن طريق التدفق إلى أسفل جانب الأنبوب المخروطي.
- باستخدام طرف مائل مائل وطرف ماصة سعة 1 مل ، أعد تعليق الحبيبات برفق عن طريق سحب العينة برفق لأعلى ولأسفل عدة مرات.
- اضبط الحجم على 300 ميكرولتر، واضغط على المكبس بالكامل فوق خط السائل، ثم ضع الماصة أسفل السائل واتوقف لأول مرة. سيسمح ذلك للعالم بإعادة تعليق الحبيبات دون إنشاء فقاعات هواء عن طريق الخطأ قد تنشط الصفائح الدموية.
- من حين لآخر ، توجد حلقة من خلايا الدم الحمراء المرئية في الجزء السفلي من الحبيبات. تجنب تعليق هذا.
- بمجرد إعادة تعليق الحبيبات ، استخدم ماصة نقل ذات تجويف عريض لنقل الحبيبات المعلقة إلى أنبوب مخروطي جديد ، تاركا وراءها أي خلايا حمراء أو خلايا متكتلة بشكل واضح.
- كرر الخطوات من 11 إلى 20. تأكد من إضافة 500 نانومتر PGI2 و 0.02 وحدة / مل من حصة جديدة إلى المخزن المؤقت ل Tyrode المعدل (لا تقم بإعادة استخدام المخزن المؤقت ل Tyrode المعدل من الخطوة 18 ، PGI2 غير مستقر للغاية).
- خذ عينة لعدد الخلايا. اضبط تركيز الصفائح الدموية حسب الضرورة باستخدام عازلة Tyrode المعدلة.
- استخدم طرف ماصة مقطوع مائل لأخذ عينة لقياس التدفق الخلوي.
- اسمح للصفائح الدموية بالراحة لمدة ساعة واحدة عند 37 درجة مئوية لإتاحة الوقت للمثبطات للتآكل والسماح لأي صفائح دموية يتم تنشيطها بشكل عكسي بالعودة إلى حالة الراحة.
- تخلط برفق باستخدام ماصة واسعة التجويف. خذ عينات لقياس التدفق الخلوي.
- الصفائح الدموية المغسولة والمريحة جاهزة الآن للاستخدام في تحليل التمثيل الغذائي.
3. عد الصفائح الدموية
- يمكن حساب الصفائح الدموية إما باستخدام عداد خلايا الدم الآلي (اتبع تعليمات الشركة المصنعة) أو مقياس الدم33.
4. قياس التدفق الخلوي
- اعداد
- يمكن العثور على بروتوكولات ومراجعات مفصلة لأفضل الممارسات لإعداد خلطات الأجسام المضادة وإعداد مقياس التدفق الخلوي لقياس تنشيط الصفائح الدموية في مكان آخر34،35.
- أخذ العينات
- عند أخذ عينة لقياس التدفق الخلوي، اجمع تعليق الصفائح الدموية باستخدام طرف ماصة مقطوع مخروطية. أضف هذا ببطء إلى أنبوب الطرد المركزي الدقيق مع الأجسام المضادة ، ثم انقر برفق للخلط. اتركيه للاحتضان لمدة 30 ثانية.
- باستخدام طرف الماصة المخروطية ، انقل مزيج تعليق الصفائح الدموية / الأجسام المضادة إلى الدرجة المناسبة على لوحة 96 بئر.
- أضف المثبت على الفور إلى البئر لإصلاح الخلايا.
- قم بتشغيل مقياس التدفق الخلوي في غضون 8 ساعات من التثبيت.
- اختبارات حساسية ناهض
- بعد الغسيل ، ضع جانبا 2 15 مل من الأنابيب المخروطية ، واحدة للتحكم في الراحة والأخرى كعنصر تحكم منشط بالثرومبين.
- ضع الماصة برفق 100 ميكرولتر من تعليق الصفائح الدموية في كل أنبوب مخروطي باستخدام طرف ماصة مائل مقطوع. اتركيه يرتاح عند 37 درجة مئوية لمدة 1 ساعة.
- بعد ساعة من الراحة ، أضف 0.1 وحدة / مل من الثرومبين إلى أنبوب واحد (يمكن العثور على تعليمات تحضير الثرومبين في الملف التكميلي 1) ، والمركبة إلى الأنبوب الآخر. احتضان عند 37 درجة مئوية لمدة 15 دقيقة.
- خذ عينة من قياس التدفق الخلوي لكل أنبوب لتحديد حساسية الصفائح الدموية للناهض.
5. أخذ العينات لتحليل التدفق الأيضي الكمي
- التبريد
ملاحظة: يعد إخماد التمثيل الغذائي خطوة ضرورية لقياس التدفقات الأيضية الدقيقة. يؤدي تبريد الخلايا بسرعة والحفاظ على درجة حرارتها عند أو أقل من 4 درجات مئوية إلى إبطاء عملية التمثيل الغذائي بدرجة كافية بحيث يمكن افتراض إيقافها بشكل أساسي بحيث تعكس الخلايا التي تم أخذ عينات منها بدقة عملية التمثيل الغذائي للخلايا من الجزء الأكبر. هناك مجموعة متنوعة من الطرق التي يمكن استخدامها ، ولكن لتحقيق التوازن بين الحاجة إلى التبريد السريع وتقليل التسرب ، استخدم محلول ملحي عادي بارد (-4 درجة مئوية)36. إذا كان الملح يتداخل مع التحليل اللاحق ، فيمكن استخدام سائل آخر (الميثانول / الماء ، الإيثانول ، إلخ.)37.- تحضير وتجميد كميات من المحلول الملحي العادي. اجعل كل كمية ملحية بحجم 6 أضعاف حجم العينة المطلوبة.
ملاحظة: يمكن العثور على وصفة المحلول الملحي العادية في الملف التكميلي 1. - جهاز طرد مركزي دقيق مسبق للبرودة إلى 0 درجة مئوية.
- اجمع تعليق الصفائح الدموية في محلول ملحي عادي مجمد جزئيا (< -4 درجة مئوية) بنسبة 1: 6 (على سبيل المثال ، اجمع 150 ميكرولتر من تعليق الصفائح الدموية في 750 ميكرولتر من المحلول الملحي في أنابيب الطرد المركزي الدقيقة).
ملاحظة: لا تترك محلول الصفائح الدموية / المحلول الملحي على الجليد لأكثر من 15 دقيقة. - جهاز طرد مركزي عند 16,000 × جم ، 0 درجة مئوية لمدة 10 دقائق.
- احفظ المادة الطافية لتحليل المستقلب الخارجي ، والحبيبات لاستخراج وقياس المستقلب داخل الخلايا. يحفظ كلاهما عند -20 درجة مئوية حتى يصبح جاهزا للتحليل.
- كرر هذه العملية خلال الفاصل الزمني المطلوب وعدد النقاط الزمنية للعينة.
- تحضير وتجميد كميات من المحلول الملحي العادي. اجعل كل كمية ملحية بحجم 6 أضعاف حجم العينة المطلوبة.
- استخراج المستقلب داخل الخلايا
- أضف 0.5 مل من ماء الميثانول المبرد مسبقا 7: 3 عند -20 درجة مئوية إلى الحبيبات المروية. دوامة بقوة لمدة 1 دقيقة.
- قم بالتجميد في النيتروجين السائل ، ثم قم بإذابة الثلج عند 0 درجة مئوية ، ثم كرر ذلك لمدة دورتين أخريين.
- جهاز الطرد المركزي المعلق عند 16,000 × جم لمدة 10 دقائق عند -4 درجة مئوية.
- اجمع المادة الطافية في أنبوب طرد مركزي دقيق جديد.
- استخدم الحبيبات من الخطوة 3 وكرر بروتوكول الاستخراج (الخطوات 1-3) مع 50:50 الميثانول: الماء. أضف المستخلص الثاني الذي تم جمعه إلى الأول. يجف طوال الليل.
- أعد تعليق المستخلص المجفف في 150 ميكرولتر من الماء من الدرجة LC-MS (أو مذيب آخر مناسب للتحليل المقصود). تخلط لمدة 15 دقيقة عند 4 درجات مئوية. دوامة لفترة وجيزة ونقلها إلى أنابيب الطرد المركزي الدقيقة 0.22 ميكرومتر لإزالة بقايا الخلايا. جهاز طرد مركزي لمدة 5 دقائق عند 16,000 × جم و 4 درجات مئوية.
- أخرجه من جهاز الطرد المركزي، وقم بإدخال 50 ميكرولتر إضافي من الماء الأمثل على الفلتر، وجهاز الطرد المركزي مرة أخرى (5 دقائق و16,000 × جم و4 درجات مئوية) لشطف الفلتر. اجمع للتحليل.
النتائج
تمثل النتائج التمثيلية في الشكل 2 6 متبرعين مختلفين بالدم ، بما في ذلك 3 ذكور و 3 إناث. يظهر محصول الصفائح الدموية بالنسبة للدم الكامل في الشكل 2 أ. كان الاسترداد النهائي للصفائح الدموية في المتوسط 52٪ ± 3٪ (الانحراف المعياري ، العدد = 6). تم قياس...
Discussion
الصفائح الدموية حساسة جدا لبيئتها ، بما في ذلك إجهاد القص ووجود ناهضات38،39. وهذا يجعل التعامل مع الصفائح الدموية وعزلها أمرا صعبا، مما يجعل استخدام المثبطات والماصات ذات التجويف العريض أمرا بالغ الأهمية40. يعد التخزين والإعدا...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإبلاغ عنهم.
Acknowledgements
يود المؤلفون أن يقدروا الدكتورة إميلي جانوس بيل وكلاريس موريو من مختبر الدكتور بيير مانجين وكاترينا بارك من مختبر الدكتور خورخي ديباولا على توجيهاتهم ونصائحهم.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µM filter Spin-X tubes | Millapore-Sigma | CLS8160 | Reagent prep |
| 19 G x 3/4" needle | McKesson Corporation | 448406 | Phlebotomy |
| 21 G 1.5 inch needle with luer lock | Amazon | B0C39PJD23 | Reagent prep |
| 96 well plate, half area | Greiner Bio-One | 675101 | Flow cytometry |
| ACD-A vaccutainers | Fisher Scientific | 364606 | Phlebotomy |
| Adapter | McKesson Corporation | 609 | Phlebotomy |
| Alcohol swab | VWR | 15648-916 | Phlebotomy |
| Apyrase from potatoes | Sigma | A6410-100UN | Reagent prep |
| CD42a Monoclonal Antibody | Thermo Fisher Scientific | 48-0428-42 | Flow cytometry |
| Chilled microcentrifuge | ThermoFisher Scientific | 75002441 | Quenching |
| D-Glucose | Sigma | G7021 | Reagent prep |
| FITC Anti-Fibrinogen antibody | Abcam | 4217 | Flow cytometry |
| Flow cytometer | Beckman Coulter | 82922828 | Flow cytometry |
| Gauze | VWR | 76049-110 | Phlebotomy |
| Glycerol | Sigma Aldrich | G5516 | Reagent prep |
| HEPES | Sigma Aldrich | H4034 | Reagent prep |
| Human alpha-thrombin | Prolytix | HCT-0020 | Flow cytometry |
| KCl | Sigma Aldrich | P9333 | Reagent prep |
| KH2PO4 | Sigma Aldrich | P5655 | Reagent prep |
| MgCl2 | Sigma | M8266 | Reagent prep |
| Microcentrifuge tubes | VWR | 87003-292 | General |
| Na2HPO4 | Sigma | S3264 | Reagent prep |
| NaCl | Sigma Aldrich | S7653 | Reagent prep |
| NaHCO3 | Sigma Aldrich | S5761 | Reagent prep |
| Narrow bore transfer pipette | VWR | 16001-176 | Platelet washing |
| Paraformaldehyde solution, 4% in PBS | Santa Cruz Biotechnology | sc-281692 | Flow cytometry |
| PECy5 Mouse Anti-Human CD62P | BD Pharmingen | 551142 | Flow cytometry |
| Plate cover | Thermo Fisher Scientific | AB0626 | Flow cytometry |
| Polypropylene 15 mL conical tubes | VWR | 89039-658 | Reagent prep |
| Polypropylene 50 mL conical tubes | VWR | 352070 | Platelet washing |
| Prostaglandin I2 (sodium salt) | Cayman Chemical | 18220 | Reagent prep |
| SKC Inc. C-Chip Disposable Hemocytometers | Fisher Scientific | 22-600-100 | Cell counting |
| Syringe | BD Pharmingen | 14-823-41 | Reagent prep |
| Tourniquet | VWR | 76235-371 | Phlebotomy |
| Vacutainer needle holder | BD | 364815 | Phlebotomy |
| Vortexer | VWR | 102091-234 | Reagent prep |
| Water bath | Thermo Fisher Scientific | TSGP02 | Platelet washing |
| Wide bore transfer pipette | VWR | 76285-362 | Platelet washing |
References
- Versteeg, H. H., Heemskerk, J. W., Levi, M., Reitsma, P. H. New fundamentals in hemostasis. Physiol Rev. 93 (1), 327-358 (2013).
- Webera, M., et al. Enhanced platelet aggregation with trap-6 and collagen in platelet aggregometry in patients with venous thromboembolism. Thromb Res. 107, 325-328 (2002).
- Herbert, J. M., Bernat, A., Maffrand, J. P. Importance of platelets in experimental venous thrombosis in the rat. Blood. 80 (9), 2281-2286 (1992).
- Puurunen, M. K., Hwang, S. J., O'donnell, C. J., Tofler, G., Johnson, A. D. Platelet function as a risk factor for venous thromboembolism in the framingham heart study. Thromb Res. 151, 57-62 (2017).
- Montoro-Garcia, S., Schindewolf, M., Stanford, S., Larsen, O. H., Thiele, T. The role of platelets in venous thromboembolism. Semin Thromb Hemost. 42 (3), 242-251 (2016).
- Koupenova, M., Kehrel, B. E., Corkrey, H. A., Freedman, J. E. Thrombosis and platelets: An update. Eur Heart J. 38 (11), 785-791 (2017).
- Yeung, J., Li, W., Holinstat, M. Platelet signaling and disease: Targeted therapy for thrombosis and other related diseases. Pharmacol Rev. 70 (3), 526-548 (2018).
- Ferreiro, J. L., Gomez-Hospital, J. A., Angiolillo, D. J. Platelet abnormalities in diabetes mellitus. Diab Vasc Dis Res. 7 (4), 251-259 (2010).
- Buergy, D., Wenz, F., Groden, C., Brockmann, M. A. Tumor-platelet interaction in solid tumors. Int J Cancer. 130 (12), 2747-2760 (2012).
- Gkaliagkousi, E., Passacquale, G., Douma, S., Zamboulis, C., Ferro, A. Platelet activation in essential hypertension: Implications for antiplatelet treatment. Am J Hypertens. 23 (3), 229-236 (2010).
- Fidler, T. P., et al. Deletion of GLUT1 and GLUT3 reveals multiple roles for glucose metabolism in platelet and megakaryocyte function. Cell Rep. 20 (4), 881-894 (2017).
- Fidler, T. P., et al. Glucose metabolism is required for platelet hyperactivation in a murine model of type 1 diabetes. Diabetes. 68 (5), 932-938 (2019).
- Kulkarni, P. P., et al. Aerobic glycolysis fuels platelet activation: Small-molecule modulators of platelet metabolism as anti-thrombotic agents. Haematologica. 104 (4), 806-818 (2019).
- Ghatge, M., Flora, G. D., Nayak, M. K., Chauhan, A. K. Platelet metabolic profiling reveals glycolytic and 1-carbon metabolites are essential for gp vi-stimulated human platelets-brief report. Arterioscler Thromb Vasc Biol. 44 (2), 409-416 (2024).
- Ravera, S., Signorello, M. G., Panfoli, I. Platelet metabolic flexibility: A matter of substrate and location. Cells. 12 (13), (2023).
- Hechler, B., Dupuis, A., Mangin, P. H., Gachet, C. Platelet preparation for function testing in the laboratory and clinic: Historical and practical aspects. Res Pract Thromb Haemost. 3 (4), 615-625 (2019).
- Mustard, J. F., Perry, D. W., Ardille, N. G., Packham, M. A. Preparation of suspensions of washed platelets from humans. British Journal of Haematology. 22, 193-204 (1972).
- Cazenave, J. P., et al. Preparation of washed platelet suspensions from human and rodent blood. Methods Mol Biol. 272, 13-28 (2004).
- Fine, K., Ashbrook, P., Brigden, L., Maldonado, J., Didishelm, P. Gel-filtered human platelets. Ultrastructure, function, and role of proteins in inhibition of aggregation by aspirin. Am J Pathol. 84 (1), (1976).
- Weiss, L., et al. An optimized protocol to isolate quiescent washed platelets from human whole blood and generate platelet releasate under clinical conditions. STAR Protoc. 4 (2), 102150 (2023).
- Burzynski, L. C., Pugh, N., Clarke, M. C. H. Platelet isolation and activation assays. Bio Protoc. 9 (20), e3405 (2019).
- Aurbach, K., Spindler, M., Haining, E. J., Bender, M., Pleines, I. Blood collection, platelet isolation and measurement of platelet count and size in mice-a practical guide. Platelets. 30 (6), 698-707 (2018).
- Narciso, M. G., Nasimuzzaman, M. Purification of platelets from mouse blood. J Vis Exp. (147), (2019).
- Aibibula, M., Naseem, K. M., Sturmey, R. G. Glucose metabolism and metabolic flexibility in blood platelets. J Thromb Haemost. 16 (11), 2300-2314 (2018).
- Ravi, S., et al. Metabolic plasticity in resting and thrombin-activated platelets. PLoS One. 10 (4), e0123597 (2015).
- Nayak, M. K., et al. an inhibitor of pyruvate dehydrogenase kinases, inhibits platelet aggregation and arterial thrombosis. Blood Advances. 2, (2018).
- Hadley, J. B., et al. Hormones, age, and sex affect platelet responsiveness in vitro. Transfusion. 62 (9), 1882-1893 (2022).
- Paglia, G., et al. Comprehensive metabolomic study of platelets reveals the expression of discrete metabolic phenotypes during storage. Transfusion. 54 (11), 2911-2923 (2014).
- Sake, C. L., et al. Isotopically nonstationary (13)c metabolic flux analysis in resting and activated human platelets. Metab Eng. 69, 313-322 (2022).
- Antoniewicz, M. R. A guide to metabolic flux analysis in metabolic engineering: Methods, tools and applications. Metab Eng. 63, 2-12 (2021).
- Larsen, M. T., Kuhlmann, M., Hvam, M. L., Howard, K. A. Albumin-based drug delivery: Harnessing nature to cure disease. Mol Cell Ther. 4 (3), (2016).
- Balduini, C. L., Noris, P. P. latelet count and aging. Haematologica. 9 (6), 953-955 (2014).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. Using a hemacytometer to count cells. , (2023).
- Spurgeon, B. E. J., Naseem, K. M. Platelet flow cytometry: Instrument setup, controls, and panel performance. Cytometry B Clin Cytom. 98 (1), 19-27 (2020).
- Van Velzen, J. F., Laros-Van Gorkom, B. A., Pop, G. A., Van Heerde, W. L. Multicolor flow cytometry for evaluation of platelet surface antigens and activation markers. Thromb Res. 130 (1), 92-98 (2012).
- Sake, C. L., Newman, D. M., Boyle, N. R. Evaluation of quenching methods for metabolite recovery in photoautotrophic synechococcus sp. Pcc 7002. Biotechnol Prog. 36 (5), e3015 (2020).
- Sapcariu, S. C., et al. Simultaneous extraction of proteins and metabolites from cells in culture. MethodsX. 1, 74-80 (2014).
- Rana, A., Westein, E., Niego, B., Hagemeyer, C. E. Shear-dependent platelet aggregation: Mechanisms and therapeutic opportunities. Front Cardiovasc Med. 6, 141 (2019).
- Ding, J., et al. Quantification of shear-induced platelet activation: High shear stresses for short exposure time. Artif Organs. 39 (7), 576-583 (2015).
- Ardlie, N., Perry, D., Packham, M., Mustard, J. Influence of apyrase on stability of suspensions of washed rabbit platelets. Proc Soc Exp Biol Med. 136 (4), (1971).
- Rao, G. H. R., Reddy, K. R., Hagert, K., White, J. G. Influence of ph on the prostacyclin (pg12) mediated inhibition of platelet function. Prostaglandins Medicine. 4, 263-273 (1980).
- Navred, K., et al. A simplified flow cytometric method for detection of inherited platelet disorders-a comparison to the gold standard light transmission aggregometry. PLoS One. 14 (1), e0211130 (2019).
- Aldrighi, J. M., et al. Platelet activation status decreases after menopause. Gynecol Endocrinol. 20 (5), 249-257 (2005).
- Bausset, O., et al. Formulation and storage of platelet-rich plasma homemade product. Biores Open Access. 1 (3), 115-123 (2012).
- Nayak, M. K., et al. The metabolic enzyme pyruvate kinase m2 regulates platelet function and arterial thrombosis. Blood. 137 (12), 1658-1668 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved