Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kantitatif metabolik akı çalışmaları için yıkanmış insan trombositlerinin hazırlanması
Bu Makalede
Özet
Trombosit metabolizması, özellikle kanama ve trombotik bozukluklarda trombosit hiper ve hipoaktivitesinin rolü ile ilgili olduğu için ilgi çekicidir. Bazı metabolik tahliller için trombositlerin plazmadan izole edilmesi gereklidir; Burada sunulan, yıkanmış trombositlerden hücre içi metabolitlerin izole edilmesi için bir yöntemdir.
Özet
Trombositler, hemostaz ve doğuştan gelen bağışıklık tepkisinde ayrılmaz bir rol oynayan kan hücreleridir. Trombosit hiper ve hipoaktivitesi metabolik bozukluklarda rol oynamakta ve hem tromboz hem de kanama riskini artırmaktadır. Trombosit aktivasyonu ve metabolizması, birincisini ölçmek için çok sayıda yöntemle, ancak ikincisi için nispeten az sayıda yöntemle sıkı bir şekilde bağlantılıdır. Diğer kan hücrelerinin ve plazma bileşenlerinin müdahalesi olmadan trombosit metabolizmasını incelemek için, trombositlerin kesilme hassasiyeti ve geri dönüşümsüz olarak aktive olma yeteneği nedeniyle önemsiz olmayan bir süreç olan trombositlerin izole edilmesi gerekir. Burada, trombosit agonistleri tarafından stimülasyona duyarlı hareketsiz trombositler üreten trombosit izolasyonu (yıkama) için bir protokol sunulmaktadır. Ardışık santrifüjleme adımları, trombositleri tam kandan izole etmek ve kontrollü, izozmotik bir tamponda yeniden süspanse etmek için trombosit inhibitörlerinin eklenmesiyle kullanılır. Bu yöntem, granül sekresyonu ve integrin aktivitesi belirteçleri ile ölçüldüğü gibi, düşük aktivasyon ile tam kandan trombositlerin %30-40 oranında geri kazanımını tekrarlanabilir bir şekilde üretir. Trombosit sayısı ve yakıt konsantrasyonu, kullanıcının çeşitli metabolik durumları araştırmasına izin vermek için hassas bir şekilde kontrol edilebilir.
Giriş
Trombositler küçüktür (2-4 μm çapında), hemostazda önemli bir rol oynayan anükleat hücreleri, sıkı bir şekilde düzenlenmiş pıhtı oluşumu süreci1. Vasküler bütünlük için hayati önem taşırken, trombositler de olumsuz sağlık olaylarında rol oynar. Trombositler, kan damarlarını tıkayan ve lokal olarak kan akışının azalmasına neden olan pıhtılar olan derin ven trombozu (DVT) ve arteriyel trombozda (AT) rol oynar veya pıhtı parçaları koparsa (embolize), akciğerlere, kalbe veya beyne kan akışını engelleyebilirler 2,3,4,5,6,7 . Trombosit hiperreaktivitesi, hipertansiyon, diyabet ve kanserin bir komorbiditesidir ve DVT ve AT insidansının artmasına neden olur 8,9,10. Trombosit aktivasyonu ve metabolizması sıkı bir şekilde bağlantılıdır11,12, bu da trombosit metabolizmasını terapötik bir strateji olarak hedeflemeye olan ilginin artmasınayol açar 13,14. Aktivasyon sırasında meydana gelen tam metabolik yeniden kablolama hakkında tartışmalar vardır ve bu aktif bir çalışma alanıdır15. Hastalıkta trombosit disfonksiyonuna ve bunun metabolizma ile olan bağlarına olan bu artan ilgi, trombositleri izole etmek ve metabolizmalarını incelemek için tekrarlanabilir bir yönteme olan ihtiyacın altını çizmektedir.
İnsan trombositleri tipik olarak damar delinmesi ile elde edilir ve daha sonra tam kandan izole edilir. Yıkanan trombositler, ardışık yıkama ve santrifüj adımları16 ile tam kandan ayrılır. Bu başlangıçta Mustard'ın17. grubu tarafından yapıldı ve Cazenave'nin18. grubu tarafından biraz değiştirildi. Diğer bir alternatif, paketlenmiş bir agaroz jel boncuksütunu 19 kullanılarak boyut dışlama kromatografisi ile trombositten zengin plazmadan (PRP) elde edilebilen jel filtreli trombositlerdir. Hem insan hem de kemirgen kanı için birçok yıkama protokolü mevcuttur ve çeşitli tahliller için optimize edilmiştir 20,21,22,23, ancak trombosit metabolizmasını ölçmek için optimize edilmemiştir.
Trombosit metabolizmasını incelemek için teknikler arasında Seahorse XF analizörü 11,24,25,26,27, hücre dışı akı ölçümleri 11,13,24, metabolomik14,28 ve izotop destekli metabolik akı analizi (13C-MFA) aracılığıyla biyoenerjetik ölçümler yer alır29. Metabolomik çalışmalarda amaç tipik olarak iki farklı durum arasındaki değişmiş yolları belirlemektir (örneğin, dinlenme ve aktive edilmiş trombositler14). Metabolomik çalışmalar, sıvı kromatografisi-kütle spektrometresi (LC-MS) kullanımını içerir. Bu çalışmalar hücre içi veya hücre dışı metabolitler için yapılabilir ve sıklıkla yol analizi veya temel bileşen analizi (PCA) ile birleştirilir14,28. İzotop destekli metabolik akı analizi (13C-MFA), hücrelere izleyici olarak bilinen etiketli bir substratın beslenmesini ve bu izleyicinin LC-MS ile bir reaksiyon ağı boyunca nasıl yayıldığının ölçülmesini içerir. Bu teknik, reaksiyon seviyesi çözünürlüğü29,30 olan metabolik yollardan akıların hesaplanmasına izin verir. Tam kan ve trombositten zengin plazmada (PRP), yakıt konsantrasyonu (glikoz, glutamin, asetat vb.) donörden donöre değişkenliğe tabidir ve plazmada bulunan albümin ve seks hormonu bağlayıcı globulin, hormonların, ilaçların ve diğer biyolojik olarak ilgili moleküllerin aktif konsantrasyonunu değiştirebilir31. Yıkanmış trombositler, 13C-MFA32 ile uyumlu, bilinen yakıt konsantrasyonları da dahil olmak üzere kullanıcı tanımlı bir ortamda trombositleri askıya almak için bir yöntem sunar.
Burada açıklanan, metabolik tahlillerde kullanılabilecek trombositler üretmek için trombosit yıkama yöntemidir. Protokol, düşük kırmızı kan hücresi ve beyaz kan hücresi kontaminasyonu ile hareketsiz trombositler üretir. Trombosit aktivasyon durumu, trombosit aktivasyon belirteçlerinin akış sitometrisi ile izlendi. Bu protokol, tam kandaki trombosit sayısına göre tekrarlanabilir şekilde en az %30-40 trombosit geri kazanımı sağlar. Bu teknikle elde edilen yıkanmış trombositler metabolik analiz tekniklerine uygundur ve hücre içi metabolit ekstraksiyon yöntemi kullanıcının seçtiği analize göre uyarlanabilir (LC-MS, GC-MS, fotometrik test, vb.).
Protokol
Çalışma, Colorado Üniversitesi Anschutz Tıp Kampüsü'nden Kurumsal İnceleme Kurulu onayı aldı. Tüm çalışma katılımcılarından yazılı onay alındı. Katılımcılar, önceki 48 saat boyunca alkol veya önceki on gün boyunca steroid olmayan antienflamatuar ilaçlar (NSAID'ler) tüketmediklerini bildirdiler. Bu proje, Ulusal Sağlık Enstitüleri Ulusal Kalp, Akciğer ve Kan Enstitüsü tarafından R61HL141794 numaralı ödülle desteklenmektedir.
1. Kan alma
- Kan alımı için ayarlayın. Kan alımının eğitimli bir flebotomist tarafından yapılması önerilir.
- 19 G'lik bir iğne kullanarak iç kolda damar delme işlemi yapın.
- İlk ~2 mL'yi katkısız bir vakutainer'a toplayın ve atın. Bu, trombositleri aktive edebilecek hasarlı endotel hücrelerinden kimyasal sinyal moleküllerini çıkarmak içindir. İlk 2 mL toplandıktan sonra, trombositler üzerindeki kayma stresini azaltmak için turnikeyi çıkarın.
- Kanın geri kalanını 14:3 oranında (kan: ACD-A) antiokoagülan sitrat dekstroz (ACD-A) vakutainerlerine toplayın. Kan ve antikoagülanı karıştırmak için kan alımından sonra her bir vakutaineri nazikçe ters çevirin.
2. Trombosit Yıkama
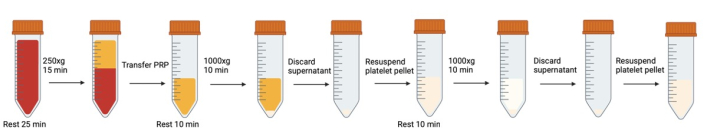
Şekil 1: Trombosit yıkamada yer alan ardışık santrifüjleme ve yeniden süspansiyon adımları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
NOT: Hava kabarcığı oluşumunu önleyin. Özellikle santrifüjlemeden önce, kabarcıklar oluştuğunda çıkarmak için transfer pipetleri kullanın. Kan / trombosit tüpleri her açıldığında / kapatıldığında, CO2 seviyesini artırmak için kapağı kapatmadan önce tüpün içine nefes verilmesi önerilir.
- Sıcaklık etkilerini azaltmak için santrifüjü 37 °C'ye önceden ısıtın. Protokoldeki her santrifüj adımı arasında, santrifüjü 37 °C'de tutun.
- Su banyosunu 37 °C'ye ısıtın. Modifiye edilmiş Tyrode'un glikozlu tamponunu su banyosuna yerleştirin.
NOT: değiştirilmiş Tyrode'un tampon tarifi Ek Dosya 1'de bulunabilir. - Tüm vakutainerlerden toplanan tam kanı 50 mL polipropilen konik tüplerde birleştirin. 45° açıyla kesilmiş eğimli kesimli bir pipet ucu kullanarak, hücre sayımı yapmak için uygun numune hacmini alın (bkz.
- Dar delikli bir transfer pipeti ile dikkatlice aspire edilerek oluşan kabarcıkları çıkarın.
- Kanı 37 °C'de 25 dakika su banyosunda dinlendirin Bu, geri dönüşümlü olarak aktive edilmiş bir durumdaki trombositlerin (vücuttan çıkarılması, tüpten tüpe aktarılması vb.) dinlenme durumuna geri dönmesini sağlar.
- Santrifüjleme sırasında aktivasyonu önlemek için, tam kana 500 nM prostaglandin I2 (PGI2) ve 0.02 U / mL apiraz ekleyin ve bir kez ters çevirerek hafifçe karıştırın. Dar delikli bir transfer pipeti kullanılarak oluşan kabarcıkları çıkarın.
NOT: Uygun PGI2 ve apyraz tarifi için talimatlar Ek Dosya 1'de bulunabilir. - Trombositten zengin plazma (PRP) (42 mL tam kan için 250 x g'da 15 dakika) elde etmek için tam kanı frensiz (37 °C) santrifüjleyin.
- PRP'yi (buffy coat ve kırmızı kan tabakasının üzerindeki üst sarı tabaka) geniş delikli bir transfer pipeti kullanarak 50 mL'lik yeni bir konik tüpe nazikçe toplayın.
- Aktarırken temiz bir konik tüpü eğin ve PRP'yi tüpün yanından nazikçe geçirin. Hava kabarcıklarından kaçının.
- Buffy coat (PRP ile kırmızı kan arasındaki beyaz kan hücresi tabakası) rahatsız etmemek için yaklaşık 3 mm PRP'yi geride bırakın. Rahatsız edilirse, bu, transfer pipetinde ani bir beyaz girdap gibi görünecektir.
- Bir sonraki yıkama adımı için yeniden süspansiyon hacmini belirlemek için hücre sayımı yapın (Bkz. Trombosit Sayma).
- 37 °C'de 10 dakika dinlendirin.
- Eğimli kesimli bir pipet ucu kullanarak akış sitometrisi için numune alın (bkz.
- PRP'ye 500 nM PGI2 ve 0.02 U/mL apyraz ekleyin ve bir kez hafifçe ters çevirerek karıştırın.
- 37 °C'de 1000 x g'da 10 dakika santrifüjleyin (hızlanma:0, fren: 0). Fren kullanmayın. Pelet kompakt değildir ve ani fren yeniden karıştırmaya neden olabilir.
- Santrifüjleme sırasında, yeniden süspansiyon hacmini belirleyin. %75 iyileşme olduğunu varsayalım. Hücre yoğunluğunu yaklaşık 3x105 hücre/μL yapın.
- Yığın hacmi için plastik geniş delikli bir transfer pipeti ve peletin yakınındaki sıvının geri kalanı için 1 mL'lik bir pipet (kesilmemiş uç) kullanarak süpernatanı aspire edin. Tüpün altındaki pelete dokunmaktan kaçının.
- Modifiye Tyrode'un tamponuna 500 nM PGI2 ve 0.02 U/mL apiraz ekleyin. Konik borunun yan tarafından damlatarak 16. adımdan itibaren hesaplanan tampon miktarını yavaşça ekleyin.
- Eğimli kesim ucu ve 1 mL pipet ucu kullanarak, birkaç kez hafifçe yukarı ve aşağı pipetleyerek peleti nazikçe yeniden süspanse edin.
- Hacmi 300 μL'ye ayarlayın, sıvı hattının üzerindeyken pistonu sonuna kadar bastırın, ardından pipeti sıvının altına yerleştirin ve ilk durana kadar gelin. Bu, bilim adamının yanlışlıkla trombositleri aktive edebilecek hava kabarcıkları oluşturmadan peleti yeniden askıya almasına izin verecektir.
- Bazen, peletin dibinde görünür kırmızı kan hücrelerinden oluşan bir halka vardır. Bunu yeniden askıya almaktan kaçının.
- Pelet yeniden süspanse edildikten sonra, yeniden süspanse edilmiş peleti yeni bir konik tüpe aktarmak için geniş delikli bir transfer pipeti kullanın ve geride herhangi bir kırmızı hücre veya gözle görülür şekilde kümelenmiş hücreler bırakın.
- 11-20 arasındaki adımları tekrarlayın. Modifiye Tyrode'un tamponuna yeni bir alikottan 500 nM PGI2 ve 0.02 U/mL eklediğinizden emin olun (18. adımdan itibaren modifiye edilmiş Tyrode'un tamponunu tekrar kullanmayın, PGI2 çok kararsızdır).
- Hücre sayımı için bir örnek alın. Modifiye edilmiş Tyrode tamponu ile trombosit konsantrasyonunu gerektiği gibi ayarlayın.
- Akış sitometrisi için bir örnek almak için eğimli kesimli bir pipet ucu kullanın.
- İnhibitörlerin yıpranması için zaman tanımak ve geri dönüşümlü olarak aktive edilmiş trombositlerin dinlenme durumuna dönmesine izin vermek için trombositlerin 37 ° C'de 1 saat dinlenmesine izin verin.
- Geniş delikli bir pipetle yavaşça karıştırın. Akış sitometrisi için örnekler alın.
- Yıkanmış, dinlendirilmiş trombositler artık metabolik analiz için kullanılmaya hazırdır.
3. Trombositlerin sayımı
- Trombositler, otomatik bir kan hücresi sayacı (üreticinin talimatlarına uyun) veya bir hemositometre33 kullanılarak sayılabilir.
4. Akış Sitometrisi
- Hazırlık
- Antikor karışımlarının ayarlanması ve trombosit aktivasyonunu ölçmek için akış sitometresinin hazırlanması için ayrıntılı protokoller ve en iyi uygulamaların gözden geçirilmesi başka bir yerde bulunabilir34,35.
- Örnekleme
- Akış sitometrisi için bir numune alırken, eğimli kesilmiş bir pipet ucu kullanarak trombosit süspansiyonunu toplayın. Bunu yavaşça antikorlu mikrosantrifüj tüpüne ekleyin, ardından karıştırmak için hafifçe vurun. 30 saniye inkübe edilmesine izin verin.
- Eğimli kesilmiş pipet ucunu kullanarak, trombosit süspansiyonu / antikor karışımını 96 oyuklu plaka üzerindeki uygun kuyuya aktarın.
- Hücreleri sabitlemek için hemen kuyuya sabitleyici ekleyin.
- Fiksasyondan sonraki 8 saat içinde akış sitometresi üzerinde çalıştırın.
- Agonist duyarlılık testleri
- Yıkadıktan sonra, biri dinlenme kontrolü ve diğeri trombin aktive edici kontrol için olmak üzere 2 adet 15 mL'lik konik tüpü bir kenara koyun.
- Eğimli kesimli bir pipet ucu kullanarak her bir konik tüpe 100 μL trombosit süspansiyonunu nazikçe pipetleyin. 37 °C'de 1 saat dinlendirin.
- Bir saatlik dinlenmeden sonra, bir tüpe 0.1 U / mL trombin ekleyin (trombin hazırlama talimatları Ek Dosya 1'de bulunabilir) ve diğerine araç. 37 °C'de 15 dakika inkübe edin.
- Agoniste trombosit duyarlılığını belirlemek için her tüpün bir akış sitometrisi örneğini alın.
5. Kantitatif Metabolik Akı Analizi için Numune Alma
- Söndürme
NOT: Metabolizmayı söndürmek, doğru metabolik akışları ölçmek için gerekli bir adımdır. Hücrelerin hızla soğutulması ve sıcaklıklarının 4 ° C'de veya altında tutulması, metabolizmayı, örneklenen hücrelerin toplu hücrelerin metabolizmasını doğru bir şekilde yansıtması için esasen durdurulduğu varsayılabilecek kadar yavaşlatır. Kullanılabilecek çeşitli yöntemler vardır, ancak hızlı soğutma ihtiyacını dengelemek ve sızıntıyı en aza indirmek için soğuk (-4 °C) normal tuzlu su36 kullanın. Tuz sonraki analize müdahale edecekse, başka bir sıvı kullanılabilir (metanol/su, etanol vb.)37.- Normal tuzlu su alikotlarını hazırlayın ve dondurun. Her bir salin alikotunu istenen numunenin hacminin 6 katı kadar yapın.
NOT: normal tuzlu su tarifi Ek Dosya 1'de bulunabilir. - Mikrosantrifüjü 0 °C'ye kadar önceden soğutun.
- Trombosit süspansiyonunu kısmen donmuş normal salin içinde (< -4 ° C) 1: 6 oranında toplayın (örneğin, mikrosantrifüj tüplerinde 750 μL salin içine 150 μL trombosit süspansiyonu toplayın).
NOT: Trombosit / salin solüsyonunu 15 dakikadan fazla buz üzerinde bırakmayın. - 16.000 x g'da, 0 °C'de 10 dakika santrifüjleyin.
- Süpernatanı harici metabolit analizi için ve peleti hücre içi metabolit ekstraksiyonu ve ölçümü için saklayın. Her ikisini de analize hazır olana kadar -20 °C'de saklayın.
- Bu işlemi istenen zaman aralığında ve numune zaman noktası sayısında tekrarlayın.
- Normal tuzlu su alikotlarını hazırlayın ve dondurun. Her bir salin alikotunu istenen numunenin hacminin 6 katı kadar yapın.
- Hücre İçi Metabolit Ekstraksiyonu
- Söndürülmüş pelete -20 °C'de 0,5 mL önceden soğutulmuş 7:3 metanol su ekleyin. 1 dakika boyunca kuvvetlice girdap.
- Sıvı nitrojen içinde dondurun, 0 °C'de çözdürün, ardından 2 döngü daha tekrarlayın.
- Süspansiyonları 16.000 x g'da -4 °C'de 10 dakika santrifüjleyin.
- Süpernatanı yeni bir mikrosantrifüj tüpünde toplayın.
- 3. adımdaki peleti kullanın ve ekstraksiyon protokolünü (1-3. adımlar) 50:50 metanol:su ile tekrarlayın. Toplanan ikinci özü birinciye ekleyin. Gece boyunca kurutun.
- Kurutulmuş ekstraktı 150 μL LC-MS dereceli suda (veya amaçlanan analiz için uygun başka bir çözücüde) tekrar süspanse edin. 4 °C'de 15 dakika karıştırın. Hücre kalıntılarını gidermek için kısaca girdap yapın ve 0.22 μm mikrosantrifüj tüplerine aktarın. 16.000 x g ve 4 °C'de 5 dakika santrifüjleyin.
- Santrifüjden çıkarın, filtreye 50 μL daha optimum su pipetleyin ve filtreyi durulamak için tekrar santrifüjleyin (5 dakika, 16.000 x g ve 4 °C). Analiz için toplayın.
Sonuçlar
Şekil 2'deki temsili sonuçlar, 3 erkek ve 3 kadın olmak üzere 6 farklı kan bağışçısını temsil etmektedir. Tam kana göre trombosit verimi Şekil 2A'da gösterilmiştir. Son trombosit iyileşmesi ortalama %52 ± %3 idi (standart sapma, n=6). Beyaz kan hücresi kontaminasyonuna kıyasla son trombosit sayısı, otomatik bir hematoloji analizörü kullanılarak ölçüldü. Beyaz kan hücresi sayıları toplam hücreleri...
Tartışmalar
Trombositler, kayma gerilimi ve agonistlerin varlığı dahil olmak üzere çevrelerine karşı çok hassastır38,39. Bu, trombositlerin işlenmesini ve izole edilmesini zorlaştırır, inhibitörlerin ve geniş delikli pipetlerin kullanımını çok önemli hale getirir40. PGI2'nin uygun şekilde saklanması ve hazırlanması hayati önem taşır, çünkü PGI2'nin temel PBS'de hazı...
Açıklamalar
Yazarların bildirecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, Dr. Pierre Mangin'in laboratuvarından Dr. Emily Janus-Bell ve Clarisse Mouriaux'ya ve Dr. Jorge DiPaola'nın laboratuvarından Katrina Bark'a rehberlikleri ve tavsiyeleri için teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 µM filter Spin-X tubes | Millapore-Sigma | CLS8160 | Reagent prep |
| 19 G x 3/4" needle | McKesson Corporation | 448406 | Phlebotomy |
| 21 G 1.5 inch needle with luer lock | Amazon | B0C39PJD23 | Reagent prep |
| 96 well plate, half area | Greiner Bio-One | 675101 | Flow cytometry |
| ACD-A vaccutainers | Fisher Scientific | 364606 | Phlebotomy |
| Adapter | McKesson Corporation | 609 | Phlebotomy |
| Alcohol swab | VWR | 15648-916 | Phlebotomy |
| Apyrase from potatoes | Sigma | A6410-100UN | Reagent prep |
| CD42a Monoclonal Antibody | Thermo Fisher Scientific | 48-0428-42 | Flow cytometry |
| Chilled microcentrifuge | ThermoFisher Scientific | 75002441 | Quenching |
| D-Glucose | Sigma | G7021 | Reagent prep |
| FITC Anti-Fibrinogen antibody | Abcam | 4217 | Flow cytometry |
| Flow cytometer | Beckman Coulter | 82922828 | Flow cytometry |
| Gauze | VWR | 76049-110 | Phlebotomy |
| Glycerol | Sigma Aldrich | G5516 | Reagent prep |
| HEPES | Sigma Aldrich | H4034 | Reagent prep |
| Human alpha-thrombin | Prolytix | HCT-0020 | Flow cytometry |
| KCl | Sigma Aldrich | P9333 | Reagent prep |
| KH2PO4 | Sigma Aldrich | P5655 | Reagent prep |
| MgCl2 | Sigma | M8266 | Reagent prep |
| Microcentrifuge tubes | VWR | 87003-292 | General |
| Na2HPO4 | Sigma | S3264 | Reagent prep |
| NaCl | Sigma Aldrich | S7653 | Reagent prep |
| NaHCO3 | Sigma Aldrich | S5761 | Reagent prep |
| Narrow bore transfer pipette | VWR | 16001-176 | Platelet washing |
| Paraformaldehyde solution, 4% in PBS | Santa Cruz Biotechnology | sc-281692 | Flow cytometry |
| PECy5 Mouse Anti-Human CD62P | BD Pharmingen | 551142 | Flow cytometry |
| Plate cover | Thermo Fisher Scientific | AB0626 | Flow cytometry |
| Polypropylene 15 mL conical tubes | VWR | 89039-658 | Reagent prep |
| Polypropylene 50 mL conical tubes | VWR | 352070 | Platelet washing |
| Prostaglandin I2 (sodium salt) | Cayman Chemical | 18220 | Reagent prep |
| SKC Inc. C-Chip Disposable Hemocytometers | Fisher Scientific | 22-600-100 | Cell counting |
| Syringe | BD Pharmingen | 14-823-41 | Reagent prep |
| Tourniquet | VWR | 76235-371 | Phlebotomy |
| Vacutainer needle holder | BD | 364815 | Phlebotomy |
| Vortexer | VWR | 102091-234 | Reagent prep |
| Water bath | Thermo Fisher Scientific | TSGP02 | Platelet washing |
| Wide bore transfer pipette | VWR | 76285-362 | Platelet washing |
Referanslar
- Versteeg, H. H., Heemskerk, J. W., Levi, M., Reitsma, P. H. New fundamentals in hemostasis. Physiol Rev. 93 (1), 327-358 (2013).
- Webera, M., et al. Enhanced platelet aggregation with trap-6 and collagen in platelet aggregometry in patients with venous thromboembolism. Thromb Res. 107, 325-328 (2002).
- Herbert, J. M., Bernat, A., Maffrand, J. P. Importance of platelets in experimental venous thrombosis in the rat. Blood. 80 (9), 2281-2286 (1992).
- Puurunen, M. K., Hwang, S. J., O'donnell, C. J., Tofler, G., Johnson, A. D. Platelet function as a risk factor for venous thromboembolism in the framingham heart study. Thromb Res. 151, 57-62 (2017).
- Montoro-Garcia, S., Schindewolf, M., Stanford, S., Larsen, O. H., Thiele, T. The role of platelets in venous thromboembolism. Semin Thromb Hemost. 42 (3), 242-251 (2016).
- Koupenova, M., Kehrel, B. E., Corkrey, H. A., Freedman, J. E. Thrombosis and platelets: An update. Eur Heart J. 38 (11), 785-791 (2017).
- Yeung, J., Li, W., Holinstat, M. Platelet signaling and disease: Targeted therapy for thrombosis and other related diseases. Pharmacol Rev. 70 (3), 526-548 (2018).
- Ferreiro, J. L., Gomez-Hospital, J. A., Angiolillo, D. J. Platelet abnormalities in diabetes mellitus. Diab Vasc Dis Res. 7 (4), 251-259 (2010).
- Buergy, D., Wenz, F., Groden, C., Brockmann, M. A. Tumor-platelet interaction in solid tumors. Int J Cancer. 130 (12), 2747-2760 (2012).
- Gkaliagkousi, E., Passacquale, G., Douma, S., Zamboulis, C., Ferro, A. Platelet activation in essential hypertension: Implications for antiplatelet treatment. Am J Hypertens. 23 (3), 229-236 (2010).
- Fidler, T. P., et al. Deletion of GLUT1 and GLUT3 reveals multiple roles for glucose metabolism in platelet and megakaryocyte function. Cell Rep. 20 (4), 881-894 (2017).
- Fidler, T. P., et al. Glucose metabolism is required for platelet hyperactivation in a murine model of type 1 diabetes. Diabetes. 68 (5), 932-938 (2019).
- Kulkarni, P. P., et al. Aerobic glycolysis fuels platelet activation: Small-molecule modulators of platelet metabolism as anti-thrombotic agents. Haematologica. 104 (4), 806-818 (2019).
- Ghatge, M., Flora, G. D., Nayak, M. K., Chauhan, A. K. Platelet metabolic profiling reveals glycolytic and 1-carbon metabolites are essential for gp vi-stimulated human platelets-brief report. Arterioscler Thromb Vasc Biol. 44 (2), 409-416 (2024).
- Ravera, S., Signorello, M. G., Panfoli, I. Platelet metabolic flexibility: A matter of substrate and location. Cells. 12 (13), (2023).
- Hechler, B., Dupuis, A., Mangin, P. H., Gachet, C. Platelet preparation for function testing in the laboratory and clinic: Historical and practical aspects. Res Pract Thromb Haemost. 3 (4), 615-625 (2019).
- Mustard, J. F., Perry, D. W., Ardille, N. G., Packham, M. A. Preparation of suspensions of washed platelets from humans. British Journal of Haematology. 22, 193-204 (1972).
- Cazenave, J. P., et al. Preparation of washed platelet suspensions from human and rodent blood. Methods Mol Biol. 272, 13-28 (2004).
- Fine, K., Ashbrook, P., Brigden, L., Maldonado, J., Didishelm, P. Gel-filtered human platelets. Ultrastructure, function, and role of proteins in inhibition of aggregation by aspirin. Am J Pathol. 84 (1), (1976).
- Weiss, L., et al. An optimized protocol to isolate quiescent washed platelets from human whole blood and generate platelet releasate under clinical conditions. STAR Protoc. 4 (2), 102150 (2023).
- Burzynski, L. C., Pugh, N., Clarke, M. C. H. Platelet isolation and activation assays. Bio Protoc. 9 (20), e3405 (2019).
- Aurbach, K., Spindler, M., Haining, E. J., Bender, M., Pleines, I. Blood collection, platelet isolation and measurement of platelet count and size in mice-a practical guide. Platelets. 30 (6), 698-707 (2018).
- Narciso, M. G., Nasimuzzaman, M. Purification of platelets from mouse blood. J Vis Exp. (147), (2019).
- Aibibula, M., Naseem, K. M., Sturmey, R. G. Glucose metabolism and metabolic flexibility in blood platelets. J Thromb Haemost. 16 (11), 2300-2314 (2018).
- Ravi, S., et al. Metabolic plasticity in resting and thrombin-activated platelets. PLoS One. 10 (4), e0123597 (2015).
- Nayak, M. K., et al. an inhibitor of pyruvate dehydrogenase kinases, inhibits platelet aggregation and arterial thrombosis. Blood Advances. 2, (2018).
- Hadley, J. B., et al. Hormones, age, and sex affect platelet responsiveness in vitro. Transfusion. 62 (9), 1882-1893 (2022).
- Paglia, G., et al. Comprehensive metabolomic study of platelets reveals the expression of discrete metabolic phenotypes during storage. Transfusion. 54 (11), 2911-2923 (2014).
- Sake, C. L., et al. Isotopically nonstationary (13)c metabolic flux analysis in resting and activated human platelets. Metab Eng. 69, 313-322 (2022).
- Antoniewicz, M. R. A guide to metabolic flux analysis in metabolic engineering: Methods, tools and applications. Metab Eng. 63, 2-12 (2021).
- Larsen, M. T., Kuhlmann, M., Hvam, M. L., Howard, K. A. Albumin-based drug delivery: Harnessing nature to cure disease. Mol Cell Ther. 4 (3), (2016).
- Balduini, C. L., Noris, P. P. latelet count and aging. Haematologica. 9 (6), 953-955 (2014).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. Using a hemacytometer to count cells. , (2023).
- Spurgeon, B. E. J., Naseem, K. M. Platelet flow cytometry: Instrument setup, controls, and panel performance. Cytometry B Clin Cytom. 98 (1), 19-27 (2020).
- Van Velzen, J. F., Laros-Van Gorkom, B. A., Pop, G. A., Van Heerde, W. L. Multicolor flow cytometry for evaluation of platelet surface antigens and activation markers. Thromb Res. 130 (1), 92-98 (2012).
- Sake, C. L., Newman, D. M., Boyle, N. R. Evaluation of quenching methods for metabolite recovery in photoautotrophic synechococcus sp. Pcc 7002. Biotechnol Prog. 36 (5), e3015 (2020).
- Sapcariu, S. C., et al. Simultaneous extraction of proteins and metabolites from cells in culture. MethodsX. 1, 74-80 (2014).
- Rana, A., Westein, E., Niego, B., Hagemeyer, C. E. Shear-dependent platelet aggregation: Mechanisms and therapeutic opportunities. Front Cardiovasc Med. 6, 141 (2019).
- Ding, J., et al. Quantification of shear-induced platelet activation: High shear stresses for short exposure time. Artif Organs. 39 (7), 576-583 (2015).
- Ardlie, N., Perry, D., Packham, M., Mustard, J. Influence of apyrase on stability of suspensions of washed rabbit platelets. Proc Soc Exp Biol Med. 136 (4), (1971).
- Rao, G. H. R., Reddy, K. R., Hagert, K., White, J. G. Influence of ph on the prostacyclin (pg12) mediated inhibition of platelet function. Prostaglandins Medicine. 4, 263-273 (1980).
- Navred, K., et al. A simplified flow cytometric method for detection of inherited platelet disorders-a comparison to the gold standard light transmission aggregometry. PLoS One. 14 (1), e0211130 (2019).
- Aldrighi, J. M., et al. Platelet activation status decreases after menopause. Gynecol Endocrinol. 20 (5), 249-257 (2005).
- Bausset, O., et al. Formulation and storage of platelet-rich plasma homemade product. Biores Open Access. 1 (3), 115-123 (2012).
- Nayak, M. K., et al. The metabolic enzyme pyruvate kinase m2 regulates platelet function and arterial thrombosis. Blood. 137 (12), 1658-1668 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır