É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preparação de plaquetas humanas lavadas para estudos quantitativos de fluxo metabólico
Neste Artigo
Resumo
O metabolismo plaquetário é de interesse, particularmente no que se refere ao papel da hiper e hipoatividade plaquetária no sangramento e distúrbios trombóticos. O isolamento de plaquetas do plasma é necessário para alguns ensaios metabólicos; Apresentamos aqui um método para isolamento de metabólitos intracelulares de plaquetas lavadas.
Resumo
As plaquetas são células sanguíneas que desempenham um papel fundamental na hemostasia e na resposta imune inata. A hiper e hipoatividade plaquetária têm sido implicadas em distúrbios metabólicos, aumentando o risco de trombose e sangramento. A ativação plaquetária e o metabolismo estão intimamente ligados, com os numerosos métodos para medir o primeiro, mas relativamente poucos para o segundo. Para estudar o metabolismo plaquetário sem a interferência de outras células sanguíneas e componentes plasmáticos, as plaquetas devem ser isoladas, um processo que não é trivial devido à sensibilidade ao cisalhamento das plaquetas e à capacidade de ativação irreversível. Apresenta-se aqui um protocolo de isolamento plaquetário (lavagem) que produz plaquetas quiescentes sensíveis à estimulação por agonistas plaquetários. Etapas sucessivas de centrifugação são usadas com a adição de inibidores plaquetários para isolar as plaquetas do sangue total e ressuspendê-las em um tampão issomótico controlado. Este método produz reprodutivelmente 30% a 40% de recuperação de plaquetas do sangue total com baixa ativação, medida por marcadores de secreção de grânulos e atividade de integrina. A contagem de plaquetas e a concentração de combustível podem ser controladas com precisão para permitir que o usuário investigue uma variedade de situações metabólicas.
Introdução
As plaquetas são células pequenas (2–4 μm de diâmetro) e anucleadas que desempenham um papel importante na hemostasia, o processo rigidamente regulado de formação de coágulos1. Embora vitais para a integridade vascular, as plaquetas também estão implicadas em eventos adversos à saúde. As plaquetas estão envolvidas na trombose venosa profunda (TVP) e na trombose arterial (TA), que são coágulos que obstruem os vasos sanguíneos, levando à diminuição do suprimento sanguíneo localmente, ou, se pedaços do coágulo se romperem (embolizarem), podem bloquear o suprimento de sangue para os pulmões, coração ou cérebro 2,3,4,5,6,7 . A hiper-reatividade plaquetária é uma comorbidade de hipertensão, diabetes e câncer, levando ao aumento da incidência de TVP e TA 8,9,10. A ativação plaquetária e o metabolismo estão intimamente ligados11,12, levando a um maior interesse em direcionar o metabolismo plaquetário como estratégia terapêutica13,14. Há um debate sobre a religação metabólica exata que ocorre após a ativação, e este é um campo ativo de estudo15. Esse aumento do interesse na disfunção plaquetária na doença e seus laços com o metabolismo ressalta a necessidade de um método repetível para isolar as plaquetas e estudar seu metabolismo.
As plaquetas humanas são normalmente obtidas por punção venosa e depois isoladas do sangue total. As plaquetas lavadas são separadas do sangue total por meio de sucessivas etapas de lavagem e centrifugação16. Isso foi originalmente feito pelo grupo17 de Mustard e ligeiramente modificado pelo grupo18 de Cazenave. Outra alternativa são as plaquetas filtradas em gel, que podem ser obtidas a partir do plasma rico em plaquetas (PRP) por cromatografia de exclusão de tamanho usando uma coluna compactada de grânulos de gel de agarose19. Existem muitos protocolos de lavagem para sangue humano e de roedores e são otimizados para vários ensaios 20,21,22,23, mas não para medir o metabolismo plaquetário.
As técnicas para estudar o metabolismo plaquetário incluem medições bioenergéticas via analisador Seahorse XF 11,24,25,26,27, medições de fluxo extracelular 11,13,24, metabolômica 14,28 e análise de fluxo metabólico assistido por isótopos (13C-MFA)29. Em estudos metabolômicos, o objetivo é tipicamente determinar vias alteradas entre duas condições diferentes (por exemplo, plaquetas em repouso versus ativadas14). Os estudos metabolômicos envolvem o uso de cromatografia líquida-espectrometria de massa (LC-MS). Esses estudos podem ser feitos para metabólitos intra ou extracelulares e são frequentemente associados à análise de vias ou análise de componentes principais (PCA)14,28. A análise do fluxo metabólico assistido por isótopos (13C-MFA) envolve alimentar as células com um substrato marcado conhecido como marcador e medir como esse marcador se propaga através de uma rede de reação com LC-MS. Essa técnica permite o cálculo de fluxos por vias metabólicas com resolução de nível de reação 29,30. No sangue total e no plasma rico em plaquetas (PRP), a concentração de combustível (glicose, glutamina, acetato, etc.) está sujeita à variabilidade de doador para doador, e a albumina e a globulina ligadora de hormônios sexuais presentes no plasma podem alterar a concentração ativa de hormônios, drogas e outras moléculas biologicamente relevantes31. As plaquetas lavadas oferecem um método para suspender as plaquetas em um meio definido pelo usuário, incluindo concentrações de combustível conhecidas, que é compatível com 13C-MFA32.
Aqui está descrito um método de lavagem de plaquetas para produzir plaquetas que pode ser usado em ensaios metabólicos. O protocolo produz plaquetas quiescentes com baixa contaminação de glóbulos vermelhos e glóbulos brancos. O status de ativação plaquetária foi monitorado por citometria de fluxo de marcadores de ativação plaquetária. Este protocolo atinge de forma reprodutível pelo menos 30% a 40% de recuperação plaquetária em relação à contagem de plaquetas no sangue total. As plaquetas lavadas obtidas com esta técnica são adequadas para as técnicas de análise metabólica, e o método de extração de metabólitos intracelulares pode ser adaptado à análise de escolha do usuário (LC-MS, GC-MS, ensaio fotométrico, etc).
Protocolo
O estudo recebeu a aprovação do Conselho de Revisão Institucional do Campus Médico Anschutz da Universidade do Colorado. O consentimento por escrito foi obtido de todos os participantes do estudo. Os participantes relataram que não consumiram álcool nas últimas 48 horas ou anti-inflamatórios não esteróides (AINEs) nos últimos dez dias. Este projeto é apoiado pelo Instituto Nacional do Coração, Pulmão e Sangue dos Institutos Nacionais de Saúde sob o número de concessão R61HL141794.
1. Coleta de sangue
- Configurado para coleta de sangue. Recomenda-se que a coleta de sangue seja realizada por um flebotomista treinado.
- Realize a punção venosa na parte interna do braço usando uma agulha de 19 G.
- Colete os primeiros ~ 2 mL em um vacutainer sem aditivos e descarte. Isso é para remover moléculas de sinalização química de células endoteliais danificadas que podem ativar as plaquetas. Após a coleta inicial de 2 mL, remova o torniquete para reduzir a tensão de cisalhamento nas plaquetas.
- Colete o resto do sangue em vacutainers antiocoagulantes citrato dextrose (ACD-A) na proporção de 14:3 (sangue: ACD-A). Inverta suavemente cada vacutainer após a coleta de sangue para misturar sangue e anticoagulante.
2. Lavagem de plaquetas
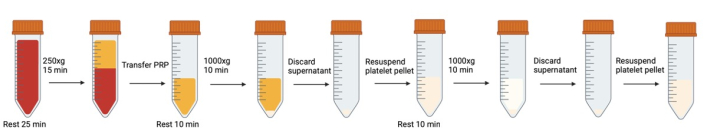
Figura 1: Etapas sucessivas de centrifugação e ressuspensão envolvidas na lavagem de plaquetas. Clique aqui para ver uma versão maior desta figura.
NOTA: Evite a geração de bolhas de ar. Use pipetas de transferência para remover as bolhas quando elas forem formadas, especialmente antes da centrifugação. Cada vez que os tubos de sangue/plaquetas são abertos/fechados, é recomendado respirar no tubo antes de fechar a tampa para aumentar o nível de CO2 .
- Pré-aqueça a centrífuga a 37 °C para reduzir os efeitos da temperatura. Entre cada etapa de centrifugação do protocolo, manter a centrífuga a 37 °C.
- Pré-aqueça o banho-maria a 37 °C. Coloque o tampão de Tyrode modificado com glicose no banho-maria.
NOTA: a receita de buffer de Tyrode modificada pode ser encontrada no Arquivo Suplementar 1. - Combine o sangue total coletado de todos os vacutainers em tubos cônicos de polipropileno de 50 mL. Usando uma ponta de pipeta de corte chanfrado cortada em um ângulo de 45°, pegue o volume de amostra apropriado para realizar uma contagem de células (consulte Contagem de células).
- Remova quaisquer bolhas geradas por aspiração cuidadosa com uma pipeta de transferência de furo estreito.
- Deixe o sangue repousar em banho-maria durante 25 minutos a 37 °C Isto permite que as plaquetas num estado reversivelmente ativado (de serem removidas do corpo, transferidas de tubo para tubo, etc.) regressem ao estado de repouso.
- Para evitar a ativação durante a centrifugação, adicione 500 nM de prostaglandina I2 (PGI2) e 0,02 U/mL de apirase ao sangue total e misture suavemente invertendo uma vez. Remova quaisquer bolhas geradas usando uma pipeta de transferência de furo estreito.
NOTA: As instruções para a receita adequada de PGI2 e apirase podem ser encontradas no Arquivo Suplementar 1. - Centrifugue sangue total para obter plasma rico em plaquetas (PRP) (15 minutos a 250 x g para 42 mL de sangue total) sem freio (37 ° C).
- Colete suavemente o PRP (camada amarela superior acima do revestimento leucocitário e da camada de sangue vermelho) em um novo tubo cônico de 50 mL usando uma pipeta de transferência de furo largo.
- Ao transferir, incline um tubo cônico limpo e passe suavemente o PRP pela lateral do tubo. Evite bolhas de ar.
- Deixe aproximadamente 3 mm de PRP para trás para evitar perturbar o revestimento leucocitário (a camada de glóbulos brancos entre o PRP e o sangue vermelho). Se perturbado, isso parecerá um redemoinho repentino de branco na pipeta de transferência.
- Faça a contagem de células (consulte Contagem de plaquetas) para determinar o volume de ressuspensão para a próxima etapa de lavagem.
- Deixar repousar durante 10 minutos a 37 °C.
- Usando uma ponta de pipeta de corte chanfrado, colete uma amostra para citometria de fluxo (consulte Citometria de fluxo).
- Adicione 500 nM PGI2 e 0,02 U/mL de apirase ao PRP e misture invertendo suavemente uma vez.
- Centrifugue durante 10 minutos a 1000 x g a 37 °C (aceleração: 0 travão: 0). Não utilize o travão. O pellet não é compacto e o freio repentino pode causar remixagem.
- Durante a centrifugação, determine o volume de ressuspensão. Suponha 75% de recuperação. Faça a densidade celular de aproximadamente 3x105 células/μL.
- Aspire o sobrenadante usando uma pipeta de transferência de plástico de diâmetro largo para o volume a granel e uma pipeta de 1 mL (ponta não cortada) para o restante do líquido próximo ao pellet. Evite tocar no pellet no fundo do tubo.
- Adicionar 500 nM PGI2 e 0,02 U/mL de apirase ao tampão de Tyrode modificado. Adicione lentamente a quantidade calculada de tampão da etapa 16, escorrendo pela lateral do tubo cônico.
- Usando uma ponta de corte chanfrado e uma ponta de pipeta de 1 mL, ressuspenda suavemente o pellet pipetando suavemente para cima e para baixo várias vezes.
- Defina o volume para 300 μL, pressione o êmbolo totalmente acima da linha de líquido, coloque a pipeta abaixo do líquido e suba até a primeira parada. Isso permitirá que o cientista ressuspenda o pellet sem criar acidentalmente bolhas de ar que possam ativar as plaquetas.
- Ocasionalmente, há um anel de glóbulos vermelhos visíveis na parte inferior do pellet. Evite ressuspender isso.
- Assim que o pellet for ressuspenso, use uma pipeta de transferência de furo largo para transferir o pellet ressuspenso para um novo tubo cônico, deixando para trás quaisquer glóbulos vermelhos ou células visivelmente aglomeradas.
- Repita as etapas 11 a 20. Certifique-se de adicionar 500 nM PGI2 e 0.02 U/mL de uma alíquota nova ao tampão de Tyrode modificado (não reutilize o tampão de Tyrode modificado da etapa 18, PGI2 é muito instável).
- Pegue uma amostra para uma contagem de células. Ajuste a concentração de plaquetas conforme necessário com o tampão de Tyrode modificado.
- Use uma ponta de pipeta de corte chanfrado para coletar uma amostra para citometria de fluxo.
- Deixe as plaquetas descansarem por 1 h a 37 ° C para dar tempo para que os inibidores desapareçam e permitir que qualquer plaqueta ativada reversivelmente retorne ao estado de repouso.
- Misture delicadamente com uma pipeta de furo largo. Colher amostras para citometria de fluxo.
- As plaquetas lavadas e em repouso estão agora prontas para serem usadas para análise metabólica.
3. Contagem de plaquetas
- As plaquetas podem ser contadas usando um contador de células sanguíneas automatizado (siga as instruções do fabricante) ou um hemocitômetro33.
4. Citometria de fluxo
- Preparação
- Protocolos detalhados e revisões das melhores práticas para a configuração de misturas de anticorpos e preparação do citômetro de fluxo para medir a ativação plaquetária podem ser encontrados em outros lugares34,35.
- Amostragem
- Ao coletar uma amostra para citometria de fluxo, colete a suspensão de plaquetas usando uma ponta de pipeta de corte chanfrado. Adicione lentamente ao tubo de microcentrífuga com anticorpos e, em seguida, agite suavemente para misturar. Deixe incubar por 30 s.
- Usando a ponta da pipeta de corte chanfrado, transfira a mistura de suspensão de plaquetas/anticorpos para o poço apropriado na placa de 96 poços.
- Adicione imediatamente o fixador ao poço para fixar as células.
- Execute o citômetro de fluxo dentro de 8 h após a fixação.
- Testes de sensibilidade ao agonista
- Após a lavagem, reserve 2 tubos cônicos de 15 mL, um para controle de repouso e outro como controle ativado por trombina.
- Pipete suavemente 100 μL de suspensão de plaquetas em cada tubo cônico usando uma ponta de pipeta de corte chanfrado. Deixar repousar a 37 °C durante 1 h.
- Após a hora de descanso, adicione 0,1 U/mL de trombina a um tubo (as instruções para a preparação da trombina podem ser encontradas no Arquivo Suplementar 1) e o veículo ao outro. Incubar a 37 °C durante 15 min.
- Pegue uma amostra de citometria de fluxo de cada tubo para determinar a sensibilidade plaquetária ao agonista.
5. Amostragem para análise quantitativa do fluxo metabólico
- Têmpera
NOTA: A extinção do metabolismo é uma etapa necessária para medir fluxos metabólicos precisos. O resfriamento rápido das células e a manutenção de sua temperatura igual ou inferior a 4 °C retardam o metabolismo o suficiente para que se possa presumir que ele está essencialmente interrompido, de modo que as células amostradas reflitam com precisão o metabolismo das células do volume. Há uma variedade de métodos que podem ser usados, mas para equilibrar a necessidade de resfriamento rápido e minimizar o vazamento, use solução salina normal fria (-4 ° C)36. Se o sal interferir na análise subsequente, outro fluido pode ser usado (metanol/água, etanol, etc.)37.- Prepare e congele alíquotas de solução salina normal. Faça cada alíquota salina a 6x o volume da amostra desejada.
NOTA: a receita salina normal pode ser encontrada no Arquivo Suplementar 1. - Microcentrífuga pré-resfriada a 0 °C.
- Colete a suspensão plaquetária em solução salina normal parcialmente congelada (< -4 ° C) na proporção de 1: 6 (por exemplo, colete 150 μL de suspensão plaquetária em 750 μL de solução salina em tubos de microcentrífuga).
NOTA: Não deixe a solução de plaquetas/solução salina no gelo por mais de 15 min. - Centrifugue a 16.000 x g, 0 °C por 10 min.
- Guarde o sobrenadante para análise de metabólitos externos e o pellet para extração e medição de metabólitos intracelulares. Conservar ambos a -20 °C até estarem prontos para análise.
- Repita esse processo no intervalo de tempo desejado e no número de pontos de tempo da amostra.
- Prepare e congele alíquotas de solução salina normal. Faça cada alíquota salina a 6x o volume da amostra desejada.
- Extração de metabólitos intracelulares
- Adicione 0,5 mL de metanol-água 7:3 pré-resfriado a -20 °C ao pellet temperado. Vórtice vigorosamente por 1 min.
- Congele em nitrogênio líquido, descongele a 0 °C e repita por mais 2 ciclos.
- Centrifugar as suspensões a 16.000 x g durante 10 minutos a -4 °C.
- Recolha o sobrenadante num novo tubo de microcentrífuga.
- Use o pellet da etapa 3 e repita o protocolo de extração (etapas 1-3) com 50:50 metanol:água. Adicione o segundo extrato coletado ao primeiro. Seque durante a noite.
- Ressuspender o extracto seco em 150 μL de água de qualidade LC-MS (ou outro dissolvente adequado para a análise pretendida). Misturar durante 15 minutos a 4 °C. Brevemente vórtice e transferência para tubos de microcentrífuga de 0,22 μm para remover os detritos celulares. Centrifugue por 5 minutos a 16.000 x g e 4 °C.
- Retire da centrifugação, pipete mais 50 μL de água ideal para o filtro e centrifugue novamente (5 min, 16.000 x g e 4 °C) para enxaguar o filtro. Colete para análise.
Resultados
Os resultados representativos na Figura 2 representam 6 doadores de sangue diferentes, incluindo 3 homens e 3 mulheres. O rendimento plaquetário em relação ao sangue total é mostrado na Figura 2A. A recuperação plaquetária final foi em média de 52% ± 3% (desvio-padrão, n=6). A contagem final de plaquetas em comparação com a contaminação dos glóbulos brancos foi medida usando um analisador hematológico automatizad...
Discussão
As plaquetas são muito sensíveis ao seu ambiente, incluindo estresse de cisalhamento e presença de agonistas38,39. Isso torna as plaquetas difíceis de manusear e isolar, tornando crucial o uso de inibidores e pipetas de calibre largo40. O armazenamento e a preparação adequados da IGP2 são vitais, uma vez que a não preparação da IGP2 no PBS básico resultará numa rápida deg...
Divulgações
Os autores não têm conflito de interesse a relatar.
Agradecimentos
Os autores gostariam de agradecer à Dra. Emily Janus-Bell e Clarisse Mouriaux do laboratório do Dr. Pierre Mangin e Katrina Bark do laboratório do Dr. Jorge DiPaola por sua orientação e conselho.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 µM filter Spin-X tubes | Millapore-Sigma | CLS8160 | Reagent prep |
| 19 G x 3/4" needle | McKesson Corporation | 448406 | Phlebotomy |
| 21 G 1.5 inch needle with luer lock | Amazon | B0C39PJD23 | Reagent prep |
| 96 well plate, half area | Greiner Bio-One | 675101 | Flow cytometry |
| ACD-A vaccutainers | Fisher Scientific | 364606 | Phlebotomy |
| Adapter | McKesson Corporation | 609 | Phlebotomy |
| Alcohol swab | VWR | 15648-916 | Phlebotomy |
| Apyrase from potatoes | Sigma | A6410-100UN | Reagent prep |
| CD42a Monoclonal Antibody | Thermo Fisher Scientific | 48-0428-42 | Flow cytometry |
| Chilled microcentrifuge | ThermoFisher Scientific | 75002441 | Quenching |
| D-Glucose | Sigma | G7021 | Reagent prep |
| FITC Anti-Fibrinogen antibody | Abcam | 4217 | Flow cytometry |
| Flow cytometer | Beckman Coulter | 82922828 | Flow cytometry |
| Gauze | VWR | 76049-110 | Phlebotomy |
| Glycerol | Sigma Aldrich | G5516 | Reagent prep |
| HEPES | Sigma Aldrich | H4034 | Reagent prep |
| Human alpha-thrombin | Prolytix | HCT-0020 | Flow cytometry |
| KCl | Sigma Aldrich | P9333 | Reagent prep |
| KH2PO4 | Sigma Aldrich | P5655 | Reagent prep |
| MgCl2 | Sigma | M8266 | Reagent prep |
| Microcentrifuge tubes | VWR | 87003-292 | General |
| Na2HPO4 | Sigma | S3264 | Reagent prep |
| NaCl | Sigma Aldrich | S7653 | Reagent prep |
| NaHCO3 | Sigma Aldrich | S5761 | Reagent prep |
| Narrow bore transfer pipette | VWR | 16001-176 | Platelet washing |
| Paraformaldehyde solution, 4% in PBS | Santa Cruz Biotechnology | sc-281692 | Flow cytometry |
| PECy5 Mouse Anti-Human CD62P | BD Pharmingen | 551142 | Flow cytometry |
| Plate cover | Thermo Fisher Scientific | AB0626 | Flow cytometry |
| Polypropylene 15 mL conical tubes | VWR | 89039-658 | Reagent prep |
| Polypropylene 50 mL conical tubes | VWR | 352070 | Platelet washing |
| Prostaglandin I2 (sodium salt) | Cayman Chemical | 18220 | Reagent prep |
| SKC Inc. C-Chip Disposable Hemocytometers | Fisher Scientific | 22-600-100 | Cell counting |
| Syringe | BD Pharmingen | 14-823-41 | Reagent prep |
| Tourniquet | VWR | 76235-371 | Phlebotomy |
| Vacutainer needle holder | BD | 364815 | Phlebotomy |
| Vortexer | VWR | 102091-234 | Reagent prep |
| Water bath | Thermo Fisher Scientific | TSGP02 | Platelet washing |
| Wide bore transfer pipette | VWR | 76285-362 | Platelet washing |
Referências
- Versteeg, H. H., Heemskerk, J. W., Levi, M., Reitsma, P. H. New fundamentals in hemostasis. Physiol Rev. 93 (1), 327-358 (2013).
- Webera, M., et al. Enhanced platelet aggregation with trap-6 and collagen in platelet aggregometry in patients with venous thromboembolism. Thromb Res. 107, 325-328 (2002).
- Herbert, J. M., Bernat, A., Maffrand, J. P. Importance of platelets in experimental venous thrombosis in the rat. Blood. 80 (9), 2281-2286 (1992).
- Puurunen, M. K., Hwang, S. J., O'donnell, C. J., Tofler, G., Johnson, A. D. Platelet function as a risk factor for venous thromboembolism in the framingham heart study. Thromb Res. 151, 57-62 (2017).
- Montoro-Garcia, S., Schindewolf, M., Stanford, S., Larsen, O. H., Thiele, T. The role of platelets in venous thromboembolism. Semin Thromb Hemost. 42 (3), 242-251 (2016).
- Koupenova, M., Kehrel, B. E., Corkrey, H. A., Freedman, J. E. Thrombosis and platelets: An update. Eur Heart J. 38 (11), 785-791 (2017).
- Yeung, J., Li, W., Holinstat, M. Platelet signaling and disease: Targeted therapy for thrombosis and other related diseases. Pharmacol Rev. 70 (3), 526-548 (2018).
- Ferreiro, J. L., Gomez-Hospital, J. A., Angiolillo, D. J. Platelet abnormalities in diabetes mellitus. Diab Vasc Dis Res. 7 (4), 251-259 (2010).
- Buergy, D., Wenz, F., Groden, C., Brockmann, M. A. Tumor-platelet interaction in solid tumors. Int J Cancer. 130 (12), 2747-2760 (2012).
- Gkaliagkousi, E., Passacquale, G., Douma, S., Zamboulis, C., Ferro, A. Platelet activation in essential hypertension: Implications for antiplatelet treatment. Am J Hypertens. 23 (3), 229-236 (2010).
- Fidler, T. P., et al. Deletion of GLUT1 and GLUT3 reveals multiple roles for glucose metabolism in platelet and megakaryocyte function. Cell Rep. 20 (4), 881-894 (2017).
- Fidler, T. P., et al. Glucose metabolism is required for platelet hyperactivation in a murine model of type 1 diabetes. Diabetes. 68 (5), 932-938 (2019).
- Kulkarni, P. P., et al. Aerobic glycolysis fuels platelet activation: Small-molecule modulators of platelet metabolism as anti-thrombotic agents. Haematologica. 104 (4), 806-818 (2019).
- Ghatge, M., Flora, G. D., Nayak, M. K., Chauhan, A. K. Platelet metabolic profiling reveals glycolytic and 1-carbon metabolites are essential for gp vi-stimulated human platelets-brief report. Arterioscler Thromb Vasc Biol. 44 (2), 409-416 (2024).
- Ravera, S., Signorello, M. G., Panfoli, I. Platelet metabolic flexibility: A matter of substrate and location. Cells. 12 (13), (2023).
- Hechler, B., Dupuis, A., Mangin, P. H., Gachet, C. Platelet preparation for function testing in the laboratory and clinic: Historical and practical aspects. Res Pract Thromb Haemost. 3 (4), 615-625 (2019).
- Mustard, J. F., Perry, D. W., Ardille, N. G., Packham, M. A. Preparation of suspensions of washed platelets from humans. British Journal of Haematology. 22, 193-204 (1972).
- Cazenave, J. P., et al. Preparation of washed platelet suspensions from human and rodent blood. Methods Mol Biol. 272, 13-28 (2004).
- Fine, K., Ashbrook, P., Brigden, L., Maldonado, J., Didishelm, P. Gel-filtered human platelets. Ultrastructure, function, and role of proteins in inhibition of aggregation by aspirin. Am J Pathol. 84 (1), (1976).
- Weiss, L., et al. An optimized protocol to isolate quiescent washed platelets from human whole blood and generate platelet releasate under clinical conditions. STAR Protoc. 4 (2), 102150 (2023).
- Burzynski, L. C., Pugh, N., Clarke, M. C. H. Platelet isolation and activation assays. Bio Protoc. 9 (20), e3405 (2019).
- Aurbach, K., Spindler, M., Haining, E. J., Bender, M., Pleines, I. Blood collection, platelet isolation and measurement of platelet count and size in mice-a practical guide. Platelets. 30 (6), 698-707 (2018).
- Narciso, M. G., Nasimuzzaman, M. Purification of platelets from mouse blood. J Vis Exp. (147), (2019).
- Aibibula, M., Naseem, K. M., Sturmey, R. G. Glucose metabolism and metabolic flexibility in blood platelets. J Thromb Haemost. 16 (11), 2300-2314 (2018).
- Ravi, S., et al. Metabolic plasticity in resting and thrombin-activated platelets. PLoS One. 10 (4), e0123597 (2015).
- Nayak, M. K., et al. an inhibitor of pyruvate dehydrogenase kinases, inhibits platelet aggregation and arterial thrombosis. Blood Advances. 2, (2018).
- Hadley, J. B., et al. Hormones, age, and sex affect platelet responsiveness in vitro. Transfusion. 62 (9), 1882-1893 (2022).
- Paglia, G., et al. Comprehensive metabolomic study of platelets reveals the expression of discrete metabolic phenotypes during storage. Transfusion. 54 (11), 2911-2923 (2014).
- Sake, C. L., et al. Isotopically nonstationary (13)c metabolic flux analysis in resting and activated human platelets. Metab Eng. 69, 313-322 (2022).
- Antoniewicz, M. R. A guide to metabolic flux analysis in metabolic engineering: Methods, tools and applications. Metab Eng. 63, 2-12 (2021).
- Larsen, M. T., Kuhlmann, M., Hvam, M. L., Howard, K. A. Albumin-based drug delivery: Harnessing nature to cure disease. Mol Cell Ther. 4 (3), (2016).
- Balduini, C. L., Noris, P. P. latelet count and aging. Haematologica. 9 (6), 953-955 (2014).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. Using a hemacytometer to count cells. , (2023).
- Spurgeon, B. E. J., Naseem, K. M. Platelet flow cytometry: Instrument setup, controls, and panel performance. Cytometry B Clin Cytom. 98 (1), 19-27 (2020).
- Van Velzen, J. F., Laros-Van Gorkom, B. A., Pop, G. A., Van Heerde, W. L. Multicolor flow cytometry for evaluation of platelet surface antigens and activation markers. Thromb Res. 130 (1), 92-98 (2012).
- Sake, C. L., Newman, D. M., Boyle, N. R. Evaluation of quenching methods for metabolite recovery in photoautotrophic synechococcus sp. Pcc 7002. Biotechnol Prog. 36 (5), e3015 (2020).
- Sapcariu, S. C., et al. Simultaneous extraction of proteins and metabolites from cells in culture. MethodsX. 1, 74-80 (2014).
- Rana, A., Westein, E., Niego, B., Hagemeyer, C. E. Shear-dependent platelet aggregation: Mechanisms and therapeutic opportunities. Front Cardiovasc Med. 6, 141 (2019).
- Ding, J., et al. Quantification of shear-induced platelet activation: High shear stresses for short exposure time. Artif Organs. 39 (7), 576-583 (2015).
- Ardlie, N., Perry, D., Packham, M., Mustard, J. Influence of apyrase on stability of suspensions of washed rabbit platelets. Proc Soc Exp Biol Med. 136 (4), (1971).
- Rao, G. H. R., Reddy, K. R., Hagert, K., White, J. G. Influence of ph on the prostacyclin (pg12) mediated inhibition of platelet function. Prostaglandins Medicine. 4, 263-273 (1980).
- Navred, K., et al. A simplified flow cytometric method for detection of inherited platelet disorders-a comparison to the gold standard light transmission aggregometry. PLoS One. 14 (1), e0211130 (2019).
- Aldrighi, J. M., et al. Platelet activation status decreases after menopause. Gynecol Endocrinol. 20 (5), 249-257 (2005).
- Bausset, O., et al. Formulation and storage of platelet-rich plasma homemade product. Biores Open Access. 1 (3), 115-123 (2012).
- Nayak, M. K., et al. The metabolic enzyme pyruvate kinase m2 regulates platelet function and arterial thrombosis. Blood. 137 (12), 1658-1668 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados