A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
بوابات القلب بأثر رجعي مع نموذج أولي للتصوير المقطعي المحوسب بالأشعة السينية للحيوانات الصغيرة
In This Article
Summary
نحن نقدم وصفا شاملا لطريقة بوابات القلب بأثر رجعي الجوهرية ل CrumpCAT ، وهو نموذج أولي للتصوير المقطعي المحوسب بالأشعة السينية للحيوانات الصغيرة (CT) تم تصميمه وإنشاؤه في مؤسستنا البحثية.
Abstract
CrumpCAT هو نموذج أولي للتصوير المقطعي المحوسب بالأشعة السينية للحيوانات الصغيرة (CT) تم تطويره في مؤسستنا البحثية. يستخدم كاشف CMOS بمعدل إطارات أقصى يبلغ 29 هرتز ومصادر الأشعة السينية التنغستن المماثلة ذات الطاقات التي تتراوح من 50 كيلو فولت إلى 80 كيلو فولت على نطاق واسع عبر أدوات التصوير المقطعي المحوسب قبل السريرية المتاحة تجاريا. هذا يجعل العمل الموصوف وثيق الصلة بالمؤسسات الأخرى ، على الرغم من الحكمة المتصورة عموما بأن هذه الكاشفات ليست مناسبة لبوابات معدلات ضربات القلب العالية للفئران (~ 600 نبضة / دقيقة). يتميز الماسح الضوئي بتصوير متوسط (200 ميكرومتر) وعالي الدقة (125 ميكرومتر) ، والتنظير الفلوري ، وبوابات التنفس بأثر رجعي ، وبوابات القلب بأثر رجعي ، مع إعادة بناء صورة الإسقاط المتكررة أو المرشحة. من بين هذه الميزات ، تعد بوابة القلب الميزة الأكثر فائدة لدراسة وظائف القلب في الجسم الحي ، لأنها تقضي بشكل فعال على ضبابية الصورة الناتجة عن حركة الجهاز التنفسي والقلب.
هنا ، نصف طريقتنا للتصوير المقطعي المحوسب بأثر رجعي بأثر رجعي قبل السريري ، والتي تهدف إلى تطوير البحث حول وظيفة القلب في الجسم الحي وتحليل الهيكل. تكتسب طريقة بوابات القلب عددا كبيرا من الإسقاطات في أقصر وقت تعرض عملي (~ 20 مللي ثانية) ثم تستخرج بأثر رجعي إشارات الجهاز التنفسي والقلب من التغيرات الزمنية في تسلسل الإسقاط الخام. تستخدم هذه الإشارات لرفض الإسقاطات التي تنتمي إلى مرحلة إلهام معدل الحركة العالي للدورة التنفسية ولتقسيم الإسقاطات المتبقية إلى 12 مجموعة ، كل منها يتوافق مع مرحلة واحدة من الدورة القلبية. يتم إعادة بناء كل مجموعة بشكل مستقل باستخدام طريقة تكرارية لإنتاج صورة حجمية لكل مرحلة قلبية ، مما ينتج عنه مجموعة بيانات رباعية الأبعاد (4D).
يمكن تحليل صور المرحلة هذه إما بشكل جماعي أو فردي ، مما يسمح بتقييم مفصل لوظائف القلب. لقد أظهرنا فعالية كلا النهجين لميزة بوابات القلب في الماسح الضوئي النموذجي من خلال نتائج التصوير التمثيلية في الجسم الحي .
Introduction
غالبا ما تستخدم أبحاث الصغيرة مزيجا من طرق التصوير غير الغازية ، مع كون التصوير المقطعي المحوسب بالأشعة السينية (CT) خيارا بارزا نظرا لنضجه وفعاليته من حيث التكلفة وسرعته1،2 وقدرته على توفير معلومات تكميلية جنبا إلى جنب مع طرائق أخرى مثل التصوير المقطعي بالإصدار البوزيتروني (PET) 2،3 والتصوير المقطعي المحوسب بإصدار فوتون واحد (SPECT)2،4. ومع ذلك ، مثل تقنيات التصوير الأخرى ، فإن التصوير المقطعي المحوسب عرضة للقطع الأثرية للحركة الفسيولوجية التي يسببها القلب النابض أو التنفس ، مما يؤدي إلى عدم وضوح وتحد من دقة البحث.
لمعالجة هذا القيد ، يمكن التخفيف من عدم وضوح حركة الجهاز التنفسي والقلب من خلال تقنية تعرف باسم البوابات5،6،7،8 ، حيث تتم مزامنة الحصول على البيانات مع مراحل محددة من الدورة القلبية أو التنفسية (أو البوابات). تتضمن إحدى الطرق لتحقيق ذلك ، والمعروفة باسم البوابات المحتملة3،6 ، توصيل أجهزة استشعار بالحيوان لتوفير إشارات بوابة في الوقت الفعلي لماسح ضوئي متوافق. على الرغم من فعاليتها ، إلا أن هذه الطريقة تتطلب عمالة كثيفة وتستغرق وقتا طويلا ، خاصة عند توصيل أجهزة الاستشعار بصدر وأقدام الصغيرة مثل الفئران ، مما يحد من حجم الدراسات. بدلا من ذلك ، تتضمن البوابات الجوهرية بأثر رجعي7،9،10،11 الحصول على بيانات السلاسل الزمنية دون استخدام أجهزة الاستشعار ولكن من خلال تحديد الميزات في البيانات التي تسمح بالفرز بأثر رجعي للنتائج بناء على مرحلتها في الدورة القلبية أو التنفسية. يقدم هذا النهج نتائج مماثلة للبوابات المحتملة ولكن دون الحاجة إلى أجهزة إضافية أو الجهد المبذول في توصيل مستشعر النبض ، وبالتالي يبسط البروتوكولات التجريبية إلى حد كبير.
في طريقتنا للتصوير المقطعي المحوسب للقلب قبل السريري ، نستخدم البوابات الجوهرية بأثر رجعي لاستخراج دورات الجهاز التنفسي والقلب من اختلافات السعة في المناطق في إسقاطات الأشعة السينية التي تظهر أهم التغييرات بين الإطارات المتتالية. لتسهيل هذه العملية ، يتم تسجيل قالب صدر الفأر بشكل مشترك في الإسقاط الخلفي الأمامي الأول باستخدام المعلومات المتبادلة12. بمجرد وضع القالب في مكانه ، يتم تلخيص شدة البكسل في نافذة بالقرب من الحجاب الحاجز لتوليد إشارة تنفسية بديلة ، بينما يتم تلخيص تلك القريبة من عضلة القلب لاشتقاق إشارة القلب البديلة. ثم يتم تصفية هذه الإشارات بتمرير النطاق في المجال الزمني ، ويتم تعيين رقم طور كسري لكل إطار في مجموعة البيانات (بين 0 و 1) بناء على مرحلته التنفسية والقلبية. هذا يسمح باختيار أو رفض الإسقاطات وفقا لقيم الطور الخاصة بها. عادة ، يتم الاحتفاظ بالإطارات المقابلة لمرحلة انتهاء الصلاحية النهائية للدورة التنفسية (0.15 ≤ المرحلة < 0.85) ، بينما يتم التخلص من الإطارات من مرحلة الإلهام ، حيث تكون الحركة أكثر وضوحا. يتم تجميع الإطارات المتبقية في 12 مرحلة قلبية ، يمثل كل منها 1/12 (0.083) من الدورة القلبية ويتم إعادة بنائها في صور ثلاثية الأبعاد باستخدام طريقة تكرارية (تعظيم توقعات المجموعة الفرعية المرتبة [OSEM])13،14. يتم تلخيص العملية برمتها في الشكل 1.
Protocol
تمت مراجعة البروتوكولات التجريبية للحيوانات والموافقة عليها من قبل اللجنة المؤسسية لرعاية واستخدامه بجامعة كاليفورنيا ، لوس أنجلوس (UCLA). تم استخدام الفئران C57BL / 6J (8 أسابيع ، ذكور ، 24-26 جم) في هذا البروتوكول. الماسح الضوئي المقطعي المحوسب المستخدم في هذه الدراسة هو CrumpCAT (الشكل 2) ، وهو نموذج أولي تم تطويره في مؤسستنا البحثية للأبحاث قبل السريرية ، مما يوفر لنا التحكم والمرونة اللازمة لتحسين بروتوكولات الاستحواذ وإعادة البناء. تفترض الطريقة أن معدل ضربات القلب للفئران المخدرة لن يزيد معدل ضربات القلب عن 600 نبضة / دقيقة ومعدل تنفس يتراوح بين 20 و 180 نفسا /دقيقة 15.
1. إعدادات المعدات
- قم بتشغيل مصدر الأشعة السينية بجهد ذروة يبلغ 50 كيلو فولت بتيار مستمر يبلغ 200 ميكرو أمبير.
- اضبط تجميع بكسل كاميرا الأشعة السينية على 2 ووقت التعريض الضوئي إلى أقصر قيمة عملية (20 مللي ثانية من وقت التعرض بالإضافة إلى 14 مللي ثانية وقت قراءة لإجمالي وقت أخذ العينات 34 مللي ثانية).
ملاحظة: يحتوي خيار no-binning (binning 1) على معدل إطارات أبطأ، وبالتالي لا يمكن استخدامه لعمليات الاستحواذ ذات البوابات. يبلغ الحد الأقصى لمعدل الإطارات حوالي 30 إطارا / ثانية.
2. تحضير
- تخدير الفئران بمزيج من الأكسجين وغاز الأيزوفلوران بتركيز 2.0٪.
- احتفظ بالحيوانات تحت التخدير لمدة 10 دقائق قبل التصوير المقطعي المحوسب، للتأكد من استقرار العلامات الحيوية واسترخاء لتجنب أي حركة للجسم أثناء الفحص. احكم على عمق تخدير الفأر من خلال عدم وجود منعكس قرصة إصبع القدم عند الضغط بإحكام على الحزام بين أصابع القدم بأظافر.
- لكي يتمكن التصوير القلبي من تصور غرف القلب ، قم بحقن 100 ميكرولتر من عامل تباين التصوير المقطعي المحوسب عن طريق الوريد عبر وريد الذيل مباشرة قبل التصوير المقطعي المحوسب (الشكل 3 أ).
- ضع الفأر المخدر داخل غرفة التصوير المقطعي المحوسب (الشكل 3 ب).
3. الحصول على البيانات
- قم بتشغيل برنامج CrumpCAT.
- التصوير المقطعي المحوسب غير المسور بدقة عالية (125 ميكرومتر، التجميع 1) (الشكل 4 أ)
- أدخل معرف الدراسة على واجهة المستخدم.
- حدد Mouse Hi-Res في القائمة المنسدلة البروتوكول .
- انقر فوق الزر Scan على واجهة المستخدم للحصول على 720 إسقاطا مع وقت تعرض يبلغ 80 مللي ثانية / إسقاط.
- التصوير المقطعي المحوسب غير المسور بدقة متوسطة (200 ميكرومتر، التجميع 2) (الشكل 4 ب)
- أدخل معرف الدراسة على واجهة المستخدم.
- حدد Mouse Standard في القائمة المنسدلة البروتوكول .
- انقر فوق الزر Scan على واجهة المستخدم للحصول على 720 إسقاطا مع وقت تعرض يبلغ 100 مللي ثانية / إسقاط.
- التصوير المقطعي المحوسب المسور (200 ميكرومتر ، binning 2) (الشكل 4C)
- أدخل معرف الدراسة على واجهة المستخدم.
- حدد بوابات القلب في القائمة المنسدلة البروتوكول .
- انقر فوق الزر Scan على واجهة المستخدم ، واحصل على 21,600 إسقاط مع وقت تعرض يبلغ 20 مللي ثانية / إسقاط.
4. المعالجة المسبقة للبيانات
ملاحظة: خطوات المعالجة المسبقة مطلوبة فقط لعمليات الاستحواذ ذات البوابات. يتم تنفيذ كل هذه الخطوات تلقائيا بواسطة برنامج إعادة الإعمار ولا يلزم تدخل المشغل.
- استخراج الإشارة
- للتسجيل المشترك لقالب الصدر ، دع صورة صغيرة (قالب) تمثل بشكل خشن صدر الفأر مع الأضلاع والقلب والرئتين والكبد يتم تسجيلها تلقائيا في أول إسقاط للأشعة السينية ، عن طريق تعظيم المعلومات المتبادلة12 بين الإسقاط والقالب (الشكل 5).
ملاحظة: يتم تنفيذ عمليات الترجمة فقط على القالب ويتم استخدام القالب المسجل بشكل مشترك لتحديد مناطق الاهتمام (ROIs) على جميع التوقعات. - لاستخراج إشارة الجهاز التنفسي ، اسمح بتعيين عائد استثمار مستطيل (ROI-1) في القالب لتمثيل الحجاب الحاجز والإشارة التنفسية التي سيتم إنشاؤها عن طريق جمع شدة البكسل داخل ROI-1 لكل إسقاط (الشكل 5).
- لاستخراج إشارة القلب ، دع عائد استثمار مستطيل ثان (ROI-2) يتم تعيينه في القالب بالقرب من القلب ، والإشارة القلبية التي تم إنشاؤها عن طريق جمع شدة البكسل في ROI-2 لكل إسقاط (الشكل 5).
ملاحظة: يتم تسجيل قالب الصدر بشكل مشترك فقط في الإسقاط الأول لتحديد صفوف الصور والأعمدة (النافذة) التي يجب استخدامها لاستخراج الإشارة. هذه النافذة واسعة بما يكفي لتشمل جميع الإسقاطات طالما أن متمركز بشكل معقول ، كما هو الحال عند استخدام سرير16.
- للتسجيل المشترك لقالب الصدر ، دع صورة صغيرة (قالب) تمثل بشكل خشن صدر الفأر مع الأضلاع والقلب والرئتين والكبد يتم تسجيلها تلقائيا في أول إسقاط للأشعة السينية ، عن طريق تعظيم المعلومات المتبادلة12 بين الإسقاط والقالب (الشكل 5).
- مرشح تمرير النطاق
- السماح بإنشاء مرشاح تمرير النطاق من خلال الجمع بين وظيفتين من Sinc مع ترددات قطع مختلفة في المجال الزمني17، والتي تتوافق مع مرشحات التمرير المنخفض في مجال التردد كما هو موضح أدناه.
- دع البرنامج يطبق مرشح تمرير النطاق على إشارة القلب باستخدام نطاق تردد [300 ، 600] دقيقة -1 (الشكل 6 أ).
ملاحظة: لا تزال الإشارة القلبية غير المفلترة (الشكل 6 ب) تحتوي على مساهمة كبيرة من حركة الجهاز التنفسي. - وبالمثل ، دع إشارة الجهاز التنفسي يتم تصفيتها باستخدام نطاق تردد [20 ، 300] دقيقة -1. يتم الحفاظ على التوافقيات الأعلى لإنتاج إشارة ليست مجرد جيبية وتحدد بشكل أكثر وضوحا المرحلتين الرئيسيتين: الإلهام والزفير.
ملاحظة: في هذه المرحلة ، يمكن بسهولة استيفاء كل من إشارات الجهاز التنفسي والقلب واعتبارها وظائف مستمرة للوقت لغرض حساب رقم الطور الكسري.
- تعيين المرحلة
- دع البرنامج يحدد بداية كل دورة (الجهاز التنفسي أو القلبي) من خلال إيجاد المعابر الصفرية للمشتق الأول للإشارة. يتوافق كل تقاطع صفري مع الحد الأقصى في الإشارة ويمثل بداية دورة جديدة ونهاية الدورة السابقة. على سبيل المثال ، انظر إشارة الجهاز التنفسي في الشكل 7.
- السماح بتعيين قيمة طور كسري (بين 0 و 1) لكل إسقاط لكل من الإشارتين (الجهاز التنفسي أو القلب).
ملاحظة: بحكم التعريف ، تحتوي نقطة البداية على قيمة طور كسري تساوي صفرا (للدورة الحالية) أو واحدة (للدورة السابقة).
- أقنعة الاختيار
- دع يتم إنشاء 12 قناعا ثنائيا (واحد لكل مرحلة قلبية) لتحديد الإسقاطات التي تنتمي إلى كل مرحلة. يحتوي كل قناع على 21,600 إدخال (واحد لكل إسقاط) إما 0 أو 1 ، مما يعني رفض هذا الإسقاط أو الاحتفاظ به ، على التوالي.
- لكل قناع (مرحلة) ، لاحظ أن البرنامج يشير إلى ما إذا كان يتم الاحتفاظ بالإسقاط (1) أو التخلص منه (0) وفقا لرقم الطور الكسري. بالنسبة للمرحلة 0 ، يتم الاحتفاظ بالإسقاطات ذات قيمة الطور القلبي في الفاصل الزمني [0 ، 1/12]. بالنسبة للمرحلة 1 ، يتم الاحتفاظ بقيم المرحلة القلبية في الفاصل الزمني [1/12 ، 2/12] ، وهكذا.
- لكل قناع (مرحلة) ، لاحظ أن أي إسقاطات ذات مرحلة تنفسية أقل من 0.15 أو أكبر من 0.85 يتم رفضها (0 في القناع) لأنها تنتمي إلى مرحلة الإلهام ، التي لها أكبر حركة (الشكل 8 أ). يوضح الشكل 8 ب تعيين المرحلة القلبية للتوقعات لأول 2 ثانية.
ملاحظة: لم يتم إدخال أي تحيز كبير في عملية الاختيار هذه لأن عدد الإسقاطات لكل مرحلة كان ثابتا نسبيا عند 1,800 ± 194.
5. إعادة بناء الصورة
- بالنسبة لعمليات التصوير المقطعي المحوسب غير المسورة ، أعد بناء الصور بدقة متوسطة (200 ميكرومتر) أو عالية (125 ميكرومتر) باستخدام خوارزمية الإسقاط الخلفي المصفى (Feldkamp18) باستخدام مرشح Shepp-Logan.
- بالنسبة لفحوصات التصوير المقطعي المحوسب ببوابات القلب ، أعد بناء كل صورة من صور المرحلة القلبية باستخدام خوارزمية OSEMالتكرارية 13 ، مع 12 مجموعة فرعية و 8 تكرارات ، مع مراعاة الإسقاطات المختارة التي تساهم في مرحلة معينة فقط (كما هو موضح في قناع ثنائي لاختيار الطور).
- لتقليل الضوضاء ، قم بتطبيق مرشح متوسط ما بعد إعادة البناء في البعد الزمني (أي عبر الصور) ومرشح 3D-Gaussian خفيف في البعد المكاني (σ = 38 ميكرومتر).
ملاحظة: لإعادة بناء الصورة ذات بوابات الجهاز التنفسي ، استخدم جميع مراحل القلب بشكل غير واضح. يتم تطبيق تصحيح تصلب الشعاع (تصحيح الماء) على كل عملية إعادة بناء.
6. تقييم الصورة وقياس حجم البطين الأيسر (LV)
- افتح صورة التصوير المقطعي المحوسب في عارض DICOM مثل Amide19 (الشكل 9 أ).
- قم بتحسين تباين الصورة المرئية عن طريق تعيين نطاق قيمة التصوير المقطعي المحوسب (المقاسة بوحدة Hounsfield [HU]) على أنه [-500، 500] (الشكل 9 أ).
- تقييم جودة الصورة
- ارسم عائد استثمار للمنطقة المتكلسة ، والتي يتم تعريفها على أنها المنطقة حول الحد الأقصى بقيمة CT أكبر أو تساوي 85٪ من الحد الأقصى لقيمة HU (الشكل 9 ب).
- استخدم نسبة التباين إلى الضوضاء (CNR)20,21 كمقياس لتقييم جودة الصورة وقدرتها على تحديد الهياكل الصغيرة، مثل التكلسات الصغيرة:
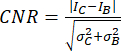 ,
,
حيث يمثل I و σ متوسط الشدة والانحراف المعياري للمنطقة: التكلس (المنخفض C) أو الخلفية (الكتابة السفلية B).
- قياس حجم البطين الأيسر
- ارسم عائد استثمار ثلاثي الأبعاد مجانا لتحديد الجهد المنخفض في كل مرحلة (الشكل 10 أ).
- قم بتحديد حجم الجهد المنخفض عن طريق حساب فوكسل بقيمة CT عتبة تبلغ 730 HU (الشكل 10 ب). تظهر مخططة لأحجام الجهد المنخفض في الشكل 10 ج.
ملاحظة: عتبة قيمة CT ليست مطلقة. يعتمد ذلك على عامل التباين المستخدم ، وحجم ، والإجهاد ، والحالة الصحية ، والوقت بين الحقن والتصوير المقطعي المحوسب. Amide هو برنامج موزع بحرية تم تطويره في معهدنا ، ولكن تتوفر برامج عرض صور أخرى أكثر تطورا (على سبيل المثال ، ORS Dragonfly22).
النتائج
قمنا أولا بمقارنة صور التصوير المقطعي المحوسب غير المسورة والمسورة لتصور تكلس القلب في الفئران (ذكور ، 30-32 جم). تم إنشاء نموذج الفئران لتكلس القلب عن طريق إحداث إصابة قلبية عن طريق التجميد السريع والذوبان في أنسجة القلب (إصابة التبريد) ، كما هو موضح سابقا23. با...
Discussion
تطبيق الأجهزة المحدد الموضح هنا هو نظام التصوير المقطعي المحوسب بالأشعة السينية المصنوع خصيصا ومعهدنا ، ولكن الكاشف المحدد يستخدم على نطاق واسع عبر أدوات التصوير المقطعي المحوسب قبل السريرية المتاحة تجاريا ، مما يجعل العمل الموصوف وثيق الصلة بالمؤسسات الأخرى. هذا الن?...
Disclosures
الدكتور ريتشارد تاشيرو هو مستشار في Sofie Biosciences و Xodus Imaging. الدكتور آريون ف. شاتزيوانو هو مؤسس Sofie Biosciences.
Acknowledgements
نشكر جميع أعضاء مركز تكنولوجيا التصوير قبل السريري بجامعة كاليفورنيا في لوس أنجلوس كرامب على مساعدتهم ودعمهم. على وجه الخصوص ، نشكر ميكايلا تامبولين وإيزابيل داي على إعداد للتصوير المقطعي المحوسب للقلب ونشكر صوفي شوميلوف على توليد بعض عائد الاستثمار للبطين الأيسر أثناء الدراسة. نشكر أيضا الدكتورين أرجون ديب وييجي وانغ (جامعة كاليفورنيا في لوس أنجلوس) على تقديم نماذج الفئران لإصابات القلب الإقفارية الحادة للتصوير المصغر بالتصوير المضغوط لتكلس القلب. يتم دعم هذا العمل من قبل منحة دعم مركز المعاهد الوطنية للصحة للسرطان (2 P30 CA016042-44).
Materials
| Name | Company | Catalog Number | Comments |
| C57BL/6J mice | Jackson Laboratory | 664 | Male, 8 weeks old, 24-26 g |
| Dexela camera | Varex | 1512 | Detector, 20 ms exposure, 74.8/149.6 µm pixel |
| VivoVist | Nanoprobes | 1301-5X0.25ML | CT Contrast agent |
| X-ray source | Moxtek | TUB00082 | 50 kV peak, 200 µA, 1.0 mm-thick Al filter |
References
- Schambach, S. J., Bag, S., Schilling, L., Groden, C., Brockmann, M. A. Application of micro-CT in small animal imaging. Methods. 50 (1), 2-13 (2010).
- Koba, W., Jelicks, L. A., Fine, E. J. MicroPET/SPECT/CT imaging of small animal models of disease. Am J Pathol. 182 (2), 319-324 (2013).
- Hutchins, G. D., Miller, M. A., Soon, V. C., Receveur, T. Small animal PET imaging. ILAR J. 49 (1), 54-65 (2008).
- Franc, B. L., Acton, P. D., Mari, C., Hasegawa, B. H. Small-animal SPECT and SPECT/CT: important tools for preclinical investigation. J Nucl Med. 49 (10), 1651-1663 (2008).
- Badea, C. T. H. L., Hedlund, L. W., Johnson, G. A. Micro-CT with respiratory and cardiac gating: Micro-CT with respiratory and cardiac gating. Med Phys. 31 (12), 3324-3329 (2004).
- Guo, X., Johnston, S. M., Qi, Y., Johnson, G. A., Badea, C. T. 4D micro-CT using fast prospective gating. Phys Med Biol. 57 (1), 257 (2011).
- Drangova, M., Ford, N. L., Detombe, S. A., Wheatley, A. R., Holdsworth, D. W. Fast retrospectively gated quantitative four-dimensional (4D) cardiac micro computed tomography imaging of free-breathing mice. Invest Radiol. 42 (2), 85-94 (2007).
- Blocker, S. J., Holbrook, M. D., Mowery, Y. M., Sullivan, D. C., Badea, C. T. The impact of respiratory gating on improving volume measurement of murine lung tumors in micro-CT imaging. PLoS One. 15 (2), e0225019 (2020).
- Bartling, S. H., et al. Retrospective motion gating in small animal CT of mice and rats. Invest Radiol. 42 (10), 704-714 (2007).
- Kuntz, J., et al. Fully automated intrinsic respiratory and cardiac gating for small animal CT. Phys Med Biol. 55 (7), 2069 (2010).
- Hahn, A., Sauppe, S., Lell, M., Kachelrieß, M. Automatic intrinsic cardiac and respiratory gating from cone-beam CT scans of the thorax region. SPIE Proc. Med Imaging. 9783, 200-205 (2016).
- Maes, F., Vandermeulen, D., Suetens, P. Medical image registration using mutual information. Proc IEEE. 91 (10), 1699-1722 (2003).
- Sheng, J., Chen, B., Ma, Y., Shi, Y. A novel reconstruction approach combining OSEM and split Bregman method for low dose CT. Biomedical Signal Processing and Control. 62, 102095 (2020).
- Romdhane, H., Cherni, M. A., Sallem, D. B. On the efficiency of OSEM algorithm for tomographic lung CT images reconstruction. 2016 Second International Image Processing, Applications and Systems (IPAS). , (2016).
- Ewald, A. J., Werb, Z., Egeblad, M. Monitoring of vital signs for long-term survival of mice under anesthesia. Cold Spring Harb Protoc. 2, 5563 (2011).
- Suckow, C., et al. Multimodality rodent imaging chambers for use under barrier conditions with gas anesthesia. Mol Imaging Biol. 11 (2), 100-106 (2009).
- Owen, M. . Practical signal processing. , 81 (2007).
- Feldkamp, L. A., Davis, L. C., Kress, J. W. Practical cone-beam algorithm. J Opt Soc Am. A-optics Image Sci Vision. 1 (6), 612-619 (1984).
- Loening, A. M., Gambhir, S. S. AMIDE: A free software tool for multimodality medical image analysis. Mol Imaging. 2 (3), 131-137 (2003).
- Rodriguez-Molares, A., et al. The generalized contrast-to-noise ratio: A formal definition for lesion detectability. IEEE Trans Ultrason Ferroelectr Freq Control. 67 (4), 745-759 (2020).
- Patterson, M. S., Foster, F. S. The improvement and quantitative assessment of B-mode images produced by an annular array/cone hybrid. Ultrason Imaging. 5 (3), 195-213 (1983).
- . Dragonfly 2022.2 Available from: https://www.theobjects.com/dragonfly (2022)
- Pillai, I. C. L., et al. Cardiac fibroblasts adopt osteogenic fates and can be targeted to attenuate pathological heart calcification. Cell Stem Cell. 20 (2), 218-232 (2017).
- Li, S., et al. A humanized monoclonal antibody targeting an ectonucleotidase rescues cardiac metabolism and heart function after myocardial infarction. Cell Rep Med. 5 (11), 101795 (2024).
- Nadkarni, R., Clark, D. P., Allphin, A. J., Badea, C. T. Investigating deep learning strategies for fast denoising of 5D cardiac photon-counting micro-CT images. Phys Med Biol. 69 (20), 205010 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved