A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שער לב רטרוספקטיבי עם אב טיפוס של טומוגרפיה ממוחשבת לצילום רנטגן של בעלי חיים קטנים
In This Article
Summary
אנו מספקים תיאור מקיף של שיטת שער הלב הרטרוספקטיבית הפנימית של CrumpCAT, אב טיפוס של סורק טומוגרפיה ממוחשבת (CT) של בעלי חיים קטנים שתוכנן ונבנה במוסד המחקר שלנו.
Abstract
ה-CrumpCAT הוא אב טיפוס של סורק טומוגרפיה ממוחשבת (CT) של בעלי חיים קטנים שפותח במוסד המחקר שלנו. גלאי CMOS עם קצב פריימים מרבי של 29 הרץ ומקורות רנטגן טונגסטן דומים עם אנרגיות הנעות בין 50 kVp ל-80 kVp נמצאים בשימוש נרחב במכשירי CT רנטגן פרה-קליניים הזמינים מסחרית. זה הופך את העבודה המתוארת לרלוונטית מאוד למוסדות אחרים, למרות הדעה הרווחת שגלאים אלה אינם מתאימים לשער קצב הלב הגבוה של עכברים (~600 פעימות לדקה). הסורק כולל הדמיה ברזולוציה בינונית (200 מיקרומטר) וגבוהה (125 מיקרומטר), פלואורוסקופיה, שער נשימה רטרוספקטיבי ושער לב רטרוספקטיבי, עם שחזור תמונת הקרנה איטרטיבית או מסוננת. בין התכונות הללו, שער לב הוא התכונה השימושית ביותר לחקר תפקודי לב in vivo, מכיוון שהוא מבטל ביעילות טשטוש תמונה הנגרם על ידי תנועת נשימה ולב.
כאן, אנו מתארים את השיטה שלנו להדמיית CT רטרוספקטיבית פנימית פרה-קלינית, שמטרתה לקדם את המחקר על תפקוד הלב וניתוח המבנה in vivo . שיטת שער הלב רוכשת מספר רב של הקרנות בזמן החשיפה המעשי הקצר ביותר (~20 אלפיות השנייה) ולאחר מכן מחלצת רטרוספקטיבית אותות נשימה ולב משינויים זמניים ברצפי הקרנה גולמיים. אותות אלה משמשים לדחיית הקרנות השייכות לשלב ההשראה של קצב התנועה הגבוה של מחזור הנשימה ולחלוקת ההקרנות הנותרות ל-12 קבוצות, שכל אחת מהן מתאימה לשלב אחד של מחזור הלב. כל קבוצה משוחזרת באופן עצמאי בשיטה איטרטיבית להפקת תמונה נפחית עבור כל שלב לבבי, וכתוצאה מכך מערך נתונים ארבע-ממדי (4D).
ניתן לנתח תמונות פאזה אלה באופן קולקטיבי או אינדיבידואלי, מה שמאפשר הערכה מפורטת של תפקוד הלב. הדגמנו את היעילות של שתי הגישות של תכונת שער הלב של סורק האב-טיפוס באמצעות תוצאות הדמיה מייצגות in vivo .
Introduction
מחקר בבעלי חיים קטנים משתמש לעתים קרובות בשילוב של שיטות הדמיה לא פולשניות, כאשר טומוגרפיה ממוחשבת של קרני רנטגן (CT), היא בחירה בולטת בשל הבשלות, העלות-תועלת, המהירות 1,2 והיכולת לספק מידע משלים לצד שיטות אחרות כגון טומוגרפיה של פליטת פוזיטרונים (PET)2,3 וטומוגרפיה ממוחשבת של פליטת פוטון יחיד (SPECT)2,4. עם זאת, כמו טכניקות הדמיה אחרות, CT רגיש לחפצי תנועה פיזיולוגיים הנגרמים על ידי הלב הפועם או הנשימה, אשר מכניסים טשטוש ומגבילים את דיוק המחקר.
כדי לטפל במגבלה זו, ניתן להפחית את טשטוש תנועת הנשימה והלב באמצעות טכניקה המכונה שער 5,6,7,8, שבה רכישת הנתונים מסונכרנת עם שלבים ספציפיים של מחזור הלב או הנשימה (או שערים). גישה אחת להשגת זה, המכונה שער פרוספקטיבי 3,6, כוללת הצמדת חיישנים לבעל החיים כדי לספק אותות שער בזמן אמת לסורק תואם. למרות יעילותה, שיטה זו עתירת עבודה וגוזלת זמן, במיוחד כאשר מחברים חיישנים לחזה ולכפות של בעלי חיים קטנים כמו עכברים, ובכך מגבילה את היקף המחקרים. לחלופין, שער רטרוספקטיביפנימי 7,9,10,11 כרוך ברכישת נתוני סדרות זמן ללא שימוש בחיישנים אלא על ידי זיהוי מאפיינים בנתונים המאפשרים מיון רטרוספקטיבי של התוצאות על סמך השלב שלהן במחזור הלב או הנשימה. גישה זו מציעה תוצאות דומות לשער פוטנציאלי אך ללא צורך בחומרה נוספת או במאמץ הכרוך בחיבור חיישן דופק, ולכן מפשטת מאוד את הפרוטוקולים הניסיוניים.
בשיטה שלנו להדמיית CT לב פרה-קלינית, אנו משתמשים בשער רטרוספקטיבי פנימי כדי לחלץ מחזורי נשימה ולב משינויים במשרעת באזורים בהקרנות רנטגן המציגים את השינויים המשמעותיים ביותר בין מסגרות עוקבות. כדי להקל על תהליך זה, תבנית בית חזה של עכבר נרשמת בהקרנה האחורית הראשונה באמצעות מידע הדדי12. ברגע שהתבנית נמצאת במקומה, עוצמות הפיקסלים בחלון ליד הסרעפת מסוכמות כדי ליצור אות נשימתי חלופי, בעוד אלה הסמוכים לשריר הלב מסוכמים כדי להפיק את האות הלבבי החלופי. לאחר מכן, אותות אלה מסוננים בתחום הזמן, ולכל מסגרת במערך הנתונים מוקצה מספר פאזה חלקי (בין 0 ל-1) בהתבסס על שלב הנשימה והלב שלה. זה מאפשר בחירה או דחייה של תחזיות בהתאם לערכי הפאזה שלהן. בדרך כלל, מסגרות המתאימות לשלב התפוגה הסופי של מחזור הנשימה (0.15 ≤ שלב < 0.85) נשמרות, ואילו אלה משלב ההשראה, בהן התנועה בולטת ביותר, מושלכות. המסגרות הנותרות מקובצות ל-12 שלבי לב, כל אחד מייצג 1/12 (0.083) ממחזור הלב ומשוחזרות לתמונות תלת מימד בשיטה איטרטיבית (Ordered Subset Expectation Maximization [OSEM])13,14. התהליך כולו מסוכם באיור 1.
Access restricted. Please log in or start a trial to view this content.
Protocol
פרוטוקולים של ניסויים בבעלי חיים נבדקו ואושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת קליפורניה, לוס אנג'לס (UCLA). עכברי C57BL/6J (בני 8 שבועות, זכר, 24-26 גרם) שימשו בפרוטוקול זה. סורק ה-CT ששימש במחקר זה הוא CrumpCAT (איור 2), אב טיפוס שפותח במוסד המחקר שלנו למחקר פרה-קליני, ומספק לנו את השליטה והגמישות הדרושות כדי לייעל את פרוטוקולי הרכישה והשחזור. השיטה מניחה שלעכברים מורדמים יהיה דופק שלא יעלה על 600 פעימות לדקה וקצב נשימה בין 20 ל-180 נשימות לדקה15.
1. הגדרות ציוד
- הפעל את מקור קרני הרנטגן במתח שיא של 50 קילוואט עם זרם רציף של 200 μA.
- הגדר את שילוב הפיקסלים של מצלמת הרנטגן ל-2 ואת זמן החשיפה לערך המעשי הקצר ביותר שלו (זמן חשיפה של 20 אלפיות השנייה בתוספת זמן קריאה של 14 אלפיות השנייה לזמן דגימה כולל של 34 אלפיות השנייה).
הערה: לאפשרות ללא שילוב (binning 1) יש קצב פריימים איטי יותר ולכן לא ניתן להשתמש בה לרכישות מגודרות. קצב הפריימים המרבי הוא בסביבות 30 פריימים לשנייה.
2. הכנת בעלי חיים
- להרדים עכברים בתערובת של חמצן וגז איזופלורן בריכוז של 2.0%.
- שמור את בעלי החיים תחת הרדמה למשך 10 דקות לפני הדמיית CT, כדי להבטיח שהסימנים החיוניים יציבים ושבעלי החיים רגועים כדי למנוע כל תנועת גוף במהלך הסריקה. שפטו את עומק ההרדמה של עכבר לפי היעדר רפלקס צביטת הבוהן כאשר צובטים בחוזקה את הרצועה בין אצבעות הרגליים בעזרת ציפורן.
- כדי שההדמיה עם שער הלב תדמה את חדרי הלב, יש להזריק תוך ורידי 100 מיקרוליטר של חומר ניגוד CT דרך וריד הזנב מיד לפני הדמיית CT (איור 3A).
- מקמו את העכבר המורדם בתוך תא ההדמיה של ה-CT (איור 3B).
3. רכישת נתונים
- הפעל את תוכנת CrumpCAT.
- הדמיית CT לא-מגודרת ברזולוציה גבוהה (125 מיקרומטר, binning 1) (איור 4A)
- הזינו מזהה מחקר בממשק המשתמש.
- בחר Hi-Res של עכבר בתפריט הנפתח פרוטוקול .
- לחץ על כפתור הסריקה בממשק המשתמש כדי להשיג 720 הקרנות עם זמן חשיפה של 80 אלפיות השנייה להקרנה.
- הדמיית CT לא-מגודרת ברזולוציה בינונית (200 מיקרומטר, binning 2) (איור 4B)
- הזינו מזהה מחקר בממשק המשתמש.
- בחר תקן עכבר בתפריט הנפתח פרוטוקול .
- לחץ על כפתור הסריקה בממשק המשתמש כדי להשיג 720 הקרנות עם זמן חשיפה של 100 אלפיות השנייה להקרנה.
- הדמיית CT מגודרת (200 מיקרומטר, binning 2) (איור 4C)
- הזינו מזהה מחקר בממשק המשתמש.
- בחר שער לב בתפריט הנפתח פרוטוקול .
- לחץ על כפתור הסריקה בממשק המשתמש, וקבל 21,600 הקרנות עם זמן חשיפה של 20 אלפיות השנייה להקרנה.
4. עיבוד מקדים של נתונים
הערה: שלבי עיבוד מקדים נדרשים רק עבור רכישות מגודרות. כל השלבים הללו מבוצעים באופן אוטומטי על ידי תוכנת השחזור ואין צורך בהתערבות המפעיל.
- חילוץ אותות
- עבור רישום משותף של תבנית בית החזה, תנו לתמונה קטנה (תבנית) המייצגת באופן גס בית חזה של עכבר עם הצלעות, הלב, הריאות והכבד להירשם אוטומטית בהקרנת הרנטגן הראשונה, על ידי מקסום המידע ההדדי12 בין ההקרנה לתבנית (איור 5).
הערה: רק פעולות תרגום מבוצעות בתבנית והתבנית הרשומה במשותף משמשת לזיהוי אזורי עניין (ROI) בכל התחזיות. - עבור חילוץ אותות נשימה, אפשר לייעד ROI מלבני (ROI-1) בתבנית כדי לייצג את הסרעפת ואת אות הנשימה שייווצר על ידי סיכום עוצמות הפיקסלים בתוך ROI-1 עבור כל הקרנה (איור 5).
- עבור מיצוי אותות לבביים, יש לייעד ROI מלבן שני (ROI-2) בתבנית ליד הלב, ואת האות הלבבי שנוצר על ידי סיכום עוצמות הפיקסלים ב-ROI-2 עבור כל הקרנה (איור 5).
הערה: תבנית בית החזה נרשמת רק בהקרנה הראשונה כדי לזהות באילו שורות ועמודות תמונה (חלון) יש להשתמש לחילוץ אותות. חלון זה רחב מספיק כדי להקיף את כל ההקרנות כל עוד החיה מרוכזת באופן סביר, כפי שקורה בעת שימוש במיטת החיות שלנו16.
- עבור רישום משותף של תבנית בית החזה, תנו לתמונה קטנה (תבנית) המייצגת באופן גס בית חזה של עכבר עם הצלעות, הלב, הריאות והכבד להירשם אוטומטית בהקרנת הרנטגן הראשונה, על ידי מקסום המידע ההדדי12 בין ההקרנה לתבנית (איור 5).
- מסנן פס פס
- אפשר ליצור מסנן מעביר-פס על ידי שילוב של שתי פונקציות Sinc עם תדרי ניתוק שונים בתחום הטמפורלי17, התואמים למסנני מעביר-פס נמוכים בתחום התדרים כמתואר להלן.
- תן לתוכנה להחיל את מסנן מעבר הפס על אות הלב באמצעות פס תדרים של [300, 600] דקות-1 (איור 6A).
הערה: אות הלב הלא מסונן (איור 6B) עדיין מכיל תרומה משמעותית מתנועת הנשימה. - באופן דומה, תן לסנן את אות הנשימה באמצעות פס תדרים של [20, 300] דקות-1. ההרמוניות הגבוהות יותר נשמרות כדי לייצר אות שאינו רק סינוסואידלי ומזהה בצורה ברורה יותר את שני השלבים העיקריים: השראה ותפוגה.
הערה: בשלב זה, ניתן בקלות לבצע אינטרפולציה של אותות נשימה ולב ולהיחשב כפונקציות רציפות של זמן לצורך חישוב מספר הפאזה השברית.
- הקצאת שלבים
- תן לתוכנה לזהות את תחילתו של כל מחזור (נשימתי או לבבי) על ידי מציאת הצלבות האפס של הנגזרת הראשונה של האות. כל חציית אפס תואמת מקסימום באות ומסמנת את תחילתו של מחזור חדש ואת סופו של הקודם. לדוגמה, ראו את אות הנשימה באיור 7.
- אפשר להקצות ערך פאזה חלקי (בין 0 ל-1) לכל הקרנה עבור כל אחד משני האותות (נשימתי או לבבי).
הערה: בהגדרה, לנקודת ההתחלה יש ערך פאזה חלקי של אפס (עבור המחזור הנוכחי) או אחד (עבור המחזור הקודם).
- מסיכות בחירה
- תן ליצור 12 מסכות בינאריות (אחת לכל שלב לבבי) כדי לבחור הקרנות השייכות לכל שלב. כל מסכה מכילה 21,600 ערכים (אחד לכל הקרנה) שהם 0 או 1, כלומר לדחות או לשמור על ההקרנה הזו, בהתאמה.
- עבור כל מסכה (שלב), שימו לב שהתוכנה מציינת אם הקרנה נשמרת (1) או מושלכת (0) בהתאם למספר הפאזה השברי שלה. עבור שלב 0, הקרנות עם ערך פאזה לבבי במרווח [0, 1/12] נשמרות. עבור שלב 1, ערכי שלב הלב במרווח [1/12, 2/12] נשמרים, וכן הלאה.
- עבור כל מסכה (שלב), שימו לב שכל הקרנות עם שלב נשימתי קטן מ-0.15 או גדול מ-0.85 נדחות (0 במסכה) מכיוון שהן שייכות לשלב ההשראה, שיש לו את התנועה הגדולה ביותר (איור 8A). איור 8B מציג את הקצאת שלב הלב לתחזיות עבור 2 השניות הראשונות.
הערה: לא הוצגה הטיה משמעותית בתהליך בחירה זה מכיוון שמספר ההקרנות לשלב היה קבוע יחסית ב-1,800 ±-194.
5. שחזור תמונה
- עבור סריקות CT שאינן מגודרות, שחזר תמונות ברזולוציה בינונית (200 מיקרומטר) או גבוהה (125 מיקרומטר) באמצעות אלגוריתם הקרנה אחורית מסוננת (Feldkamp18) עם מסנן שפ-לוגן.
- עבור סריקות CT עם שער לב, שחזר כל תמונת שלב לב באמצעות אלגוריתם OSEM איטרטיבי13, עם 12 תת-קבוצות ו-8 איטרציות, רק תוך התחשבות בתחזיות נבחרות התורמות לשלב נתון (כפי שמצוין במסכה בינארית לבחירת פאזה).
- כדי להפחית רעש, החל מסנן חציוני לאחר שחזור בממד הזמן (כלומר, על פני תמונות) ומסנן תלת מימד-גאוס קל בממד המרחבי (σ = 38 מיקרומטר).
הערה: לשחזור תמונה עם שער נשימה, השתמש בכל שלבי הלב בצורה לא ברורה. תיקון התקשות קרן (תיקון מים) מוחל על כל שחזור.
6. הערכת תמונה וכימות נפח החדר השמאלי (LV).
- פתח את תמונת ה-CT במציג DICOM כגון Amide19 (איור 9A).
- שפר את ניגודיות התמונה הנראית לעין על ידי הגדרת טווח ערך ה-CT (נמדד ביחידת Hounsfield [HU]) כ-[-500, 500] (איור 9A).
- הערכת איכות תמונה
- צייר החזר ROI עבור האזור המסוייד, המוגדר כאזור סביב המקסימום עם ערך CT גדול או שווה ל-85% מערך ה-HU המקסימלי (איור 9B).
- השתמש ביחס ניגודיות לרעש (CNR)20,21 כמדד להערכת איכות התמונה ויכולתה לזהות מבנים קטנים, כגון הסתיידויות קטנות:
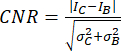 ,
,
כאשר I ו-σ מייצגים את העוצמה הממוצעת וסטיית התקן של אזור: הסתיידות (כתב תחתון C) או רקע (כתב תחתון B).
- כימות נפח החדר השמאלי
- צייר החזר ROI תלת-ממדי ביד חופשית כדי לזהות את ה-LV בכל שלב (איור 10A).
- כמת את נפח ה-LV על ידי חישוב ווקסלים עם ערך CT סף של 730 HU (איור 10B). תרשים של נפחי LV מוצג באיור 10C.
הערה: סף ערך ה-CT אינו מוחלט; זה תלוי בחומר הניגוד בו נעשה שימוש, בגודל החיה, בזן, במצב הבריאותי ובזמן שבין ההזרקה להדמיית CT. Amide היא תוכנה המופצת באופן חופשי שפותחה במכון שלנו, אך ניתן להשיג צופי תמונות מתוחכמים יותר (למשל, ORS Dragonfly22).
Access restricted. Please log in or start a trial to view this content.
תוצאות
תחילה השווינו תמונות CT לא מגודרות ומגודרות להדמיית הסתיידות לב בעכברים (זכר, 30-32 גרם). מודל העכברים של הסתיידות הלב נוצר על ידי גרימת פגיעה לבבית על ידי הקפאה-הפשרה מהירה של רקמת הלב (קריו-פגיעה), כפי שתואר קודם לכן23. עם פרוטוקולי הדמיית CT לא מגודרים, הסתיידויו?...
Access restricted. Please log in or start a trial to view this content.
Discussion
יישום החומרה הספציפי המתואר כאן הוא מערכת CT רנטגן בהתאמה אישית הייחודית למכון שלנו, אך הגלאי הספציפי נמצא בשימוש נרחב במכשירי CT רנטגן פרה-קליניים הזמינים מסחרית, מה שהופך את העבודה המתוארת לרלוונטית למוסדות אחרים. מערכת זו היא מבחינה פונקציונלית אב טיפוס לשתי תת-מערכות ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ד"ר ריצ'רד טשרו הוא יועץ ל-Sofie Biosciences ו-Xodus Imaging. ד"ר אריון פ. צ'ציואנו הוא מייסד Sofie Biosciences.
Acknowledgements
אנו מודים לכל חברי המרכז לטכנולוגיית הדמיה פרה-קלינית של UCLA Crump על עזרתם ותמיכתם. במיוחד אנו מודים למיקיילה טמבולין ואיזבל דיי על הכנת החיות להדמיית CT לב, ומודים לסופי שומילוב על יצירת חלק מהחזר ה-ROI של החדר השמאלי במהלך המחקר. אנו מודים גם לד"ר ארג'ון דב ולד"ר ייג'י וואנג (UCLA) על שסיפקו את המודלים העכבריים של פגיעה לבבית איסכמית חריפה להדמיית מיקרו-CT של הסתיידות לב. עבודה זו נתמכת על ידי מענק תמיכה במרכז הסרטן של NIH (2 P30 CA016042-44).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| C57BL/6J mice | Jackson Laboratory | 664 | Male, 8 weeks old, 24-26 g |
| Dexela camera | Varex | 1512 | Detector, 20 ms exposure, 74.8/149.6 µm pixel |
| VivoVist | Nanoprobes | 1301-5X0.25ML | CT Contrast agent |
| X-ray source | Moxtek | TUB00082 | 50 kV peak, 200 µA, 1.0 mm-thick Al filter |
References
- Schambach, S. J., Bag, S., Schilling, L., Groden, C., Brockmann, M. A. Application of micro-CT in small animal imaging. Methods. 50 (1), 2-13 (2010).
- Koba, W., Jelicks, L. A., Fine, E. J. MicroPET/SPECT/CT imaging of small animal models of disease. Am J Pathol. 182 (2), 319-324 (2013).
- Hutchins, G. D., Miller, M. A., Soon, V. C., Receveur, T. Small animal PET imaging. ILAR J. 49 (1), 54-65 (2008).
- Franc, B. L., Acton, P. D., Mari, C., Hasegawa, B. H. Small-animal SPECT and SPECT/CT: important tools for preclinical investigation. J Nucl Med. 49 (10), 1651-1663 (2008).
- Badea, C. T. H. L., Hedlund, L. W., Johnson, G. A. Micro-CT with respiratory and cardiac gating: Micro-CT with respiratory and cardiac gating. Med Phys. 31 (12), 3324-3329 (2004).
- Guo, X., Johnston, S. M., Qi, Y., Johnson, G. A., Badea, C. T. 4D micro-CT using fast prospective gating. Phys Med Biol. 57 (1), 257(2011).
- Drangova, M., Ford, N. L., Detombe, S. A., Wheatley, A. R., Holdsworth, D. W. Fast retrospectively gated quantitative four-dimensional (4D) cardiac micro computed tomography imaging of free-breathing mice. Invest Radiol. 42 (2), 85-94 (2007).
- Blocker, S. J., Holbrook, M. D., Mowery, Y. M., Sullivan, D. C., Badea, C. T. The impact of respiratory gating on improving volume measurement of murine lung tumors in micro-CT imaging. PLoS One. 15 (2), e0225019(2020).
- Bartling, S. H., et al. Retrospective motion gating in small animal CT of mice and rats. Invest Radiol. 42 (10), 704-714 (2007).
- Kuntz, J., et al. Fully automated intrinsic respiratory and cardiac gating for small animal CT. Phys Med Biol. 55 (7), 2069(2010).
- Hahn, A., Sauppe, S., Lell, M., Kachelrieß, M. Automatic intrinsic cardiac and respiratory gating from cone-beam CT scans of the thorax region. SPIE Proc. Med Imaging. 9783, 200-205 (2016).
- Maes, F., Vandermeulen, D., Suetens, P. Medical image registration using mutual information. Proc IEEE. 91 (10), 1699-1722 (2003).
- Sheng, J., Chen, B., Ma, Y., Shi, Y. A novel reconstruction approach combining OSEM and split Bregman method for low dose CT. Biomedical Signal Processing and Control. 62, 102095(2020).
- Romdhane, H., Cherni, M. A., Sallem, D. B. On the efficiency of OSEM algorithm for tomographic lung CT images reconstruction. 2016 Second International Image Processing, Applications and Systems (IPAS). , (2016).
- Ewald, A. J., Werb, Z., Egeblad, M. Monitoring of vital signs for long-term survival of mice under anesthesia. Cold Spring Harb Protoc. 2, 5563(2011).
- Suckow, C., et al. Multimodality rodent imaging chambers for use under barrier conditions with gas anesthesia. Mol Imaging Biol. 11 (2), 100-106 (2009).
- Owen, M. Practical signal processing. , Cambridge University Press. 81(2007).
- Feldkamp, L. A., Davis, L. C., Kress, J. W. Practical cone-beam algorithm. J Opt Soc Am. A-optics Image Sci Vision. 1 (6), 612-619 (1984).
- Loening, A. M., Gambhir, S. S. AMIDE: A free software tool for multimodality medical image analysis. Mol Imaging. 2 (3), 131-137 (2003).
- Rodriguez-Molares, A., et al. The generalized contrast-to-noise ratio: A formal definition for lesion detectability. IEEE Trans Ultrason Ferroelectr Freq Control. 67 (4), 745-759 (2020).
- Patterson, M. S., Foster, F. S. The improvement and quantitative assessment of B-mode images produced by an annular array/cone hybrid. Ultrason Imaging. 5 (3), 195-213 (1983).
- Dragonfly 2022.2. , Comet Technologies Canada Inc. https://www.theobjects.com/dragonfly (2022).
- Pillai, I. C. L., et al. Cardiac fibroblasts adopt osteogenic fates and can be targeted to attenuate pathological heart calcification. Cell Stem Cell. 20 (2), 218-232 (2017).
- Li, S., et al. A humanized monoclonal antibody targeting an ectonucleotidase rescues cardiac metabolism and heart function after myocardial infarction. Cell Rep Med. 5 (11), 101795(2024).
- Nadkarni, R., Clark, D. P., Allphin, A. J., Badea, C. T. Investigating deep learning strategies for fast denoising of 5D cardiac photon-counting micro-CT images. Phys Med Biol. 69 (20), 205010(2024).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved