Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Prototip Küçük Hayvan X-ışını Bilgisayarlı Tomografi ile Retrospektif Kardiyak Kapı
Bu Makalede
Özet
Araştırma kurumumuzda tasarlanan ve inşa edilen bir prototip küçük hayvan X-ışını bilgisayarlı tomografi (BT) tarayıcısı olan CrumpCAT'in içsel retrospektif kardiyak geçit yönteminin kapsamlı bir tanımını sunuyoruz.
Özet
CrumpCAT, araştırma kurumumuzda geliştirilen bir prototip küçük hayvan X-ışını bilgisayarlı tomografi (BT) tarayıcısıdır. Maksimum 29 Hz kare hızına sahip CMOS dedektörü ve 50 kVp ile 80 kVp arasında değişen enerjilere sahip benzer Tungsten X-ışını kaynakları, ticari olarak temin edilebilen klinik öncesi X-ışını BT cihazlarında yaygın olarak kullanılmaktadır. Bu, bu dedektörlerin farelerin yüksek kalp atış hızlarını (~ 600 atım / dak) ölçmek için uygun olmadığına dair genel olarak algılanan bilgeliğe rağmen, açıklanan çalışmayı diğer kurumlarla oldukça alakalı hale getirir. Tarayıcı, orta (200 μm) ve yüksek (125 μm) çözünürlüklü görüntüleme, floroskopi, retrospektif solunum kapısı ve yinelemeli veya filtreli geri projeksiyon görüntü rekonstrüksiyonu ile retrospektif kardiyak kapak özelliklerine sahiptir. Bu özellikler arasında, kardiyak geçit, solunum ve kardiyak hareketin neden olduğu görüntü bulanıklığını etkili bir şekilde ortadan kaldırdığı için kardiyak fonksiyonları in vivo olarak incelemek için en kullanışlı özelliktir.
Burada, in vivo kardiyak fonksiyon ve yapı analizi ile ilgili araştırmaları ilerletmeyi amaçlayan klinik öncesi intrinsik retrospektif kardiyak kapılı BT görüntüleme yöntemimizi açıklıyoruz. Kardiyak geçit yöntemi, en kısa pratik maruz kalma süresinde (~ 20 ms) çok sayıda projeksiyon elde eder ve daha sonra ham projeksiyon dizilerindeki zamansal değişikliklerden solunum ve kardiyak sinyalleri retrospektif olarak çıkarır. Bu sinyaller, solunum döngüsünün yüksek hareket hızlı inspirasyon aşamasına ait projeksiyonları reddetmek ve kalan projeksiyonları, her biri kardiyak döngünün bir fazına karşılık gelen 12 gruba ayırmak için kullanılır. Her grup, her bir kardiyak faz için hacimsel bir görüntü üretmek için yinelemeli bir yöntem kullanılarak bağımsız olarak yeniden yapılandırılır ve dört boyutlu (4D) bir veri seti elde edilir.
Bu faz görüntüleri, kardiyak fonksiyonun ayrıntılı bir şekilde değerlendirilmesine olanak tanıyarak toplu veya bireysel olarak analiz edilebilir. Prototip tarayıcının kardiyak geçit özelliğinin her iki yaklaşımının da etkinliğini, temsili in vivo görüntüleme sonuçları ile gösterdik.
Giriş
Küçük hayvan araştırmaları genellikle X-ışını bilgisayarlı tomografi (BT) ile invaziv olmayan görüntüleme modalitelerinin bir kombinasyonunu kullanır ve olgunluğu, maliyet etkinliği, hızı 1,2 ve pozitron emisyon tomografisi (PET)2,3 ve tek foton emisyonlu bilgisayarlı tomografi (SPECT)2,4 gibi diğer modalitelerle birlikte tamamlayıcı bilgi sağlama yeteneği nedeniyle öne çıkan bir seçimdir . Bununla birlikte, diğer görüntüleme teknikleri gibi, BT de atan kalp veya solunumun neden olduğu, bulanıklığa neden olan ve araştırmanın doğruluğunu sınırlayan fizyolojik hareket artefaktlarına karşı hassastır.
Bu sınırlamayı ele almak için, solunum ve kardiyak hareket bulanıklığı, veri toplamanın kardiyak veya solunum döngüsünün (veya kapılarının) belirli aşamaları ile senkronize edildiği, geçit 5,6,7,8 olarak bilinen bir teknikle azaltılabilir. Bunu başarmak için ileriye dönük geçit 3,6 olarak bilinen bir yaklaşım, uyumlu bir tarayıcıya gerçek zamanlı geçit sinyalleri sağlamak için hayvana sensörler takmayı içerir. Etkili olsa da, bu yöntem, özellikle fareler gibi küçük hayvanların göğsüne ve pençelerine sensörler takarken, emek yoğun ve zaman alıcıdır, böylece çalışmaların ölçeğini sınırlar. Alternatif olarak, içsel retrospektif geçit 7,9,10,11, sensörler kullanılmadan zaman serisi verilerinin elde edilmesini, ancak sonuçların kardiyak veya solunum döngüsündeki fazlarına göre geriye dönük olarak sıralanmasına izin veren verilerdeki özellikleri tanımlayarak içerir. Bu yaklaşım, olası geçit ile karşılaştırılabilir, ancak ek donanıma veya nabız sensörünün takılması için gereken çabaya ihtiyaç duymadan sonuçlar sunar ve bu nedenle deneysel protokolleri büyük ölçüde basitleştirir.
Klinik öncesi kardiyak BT görüntüleme yöntemimizde, ardışık çerçeveler arasındaki en önemli değişiklikleri sergileyen X-ışını projeksiyonlarındaki bölgelerdeki genlik değişimlerinden solunum ve kardiyak döngüleri çıkarmak için içsel retrospektif geçit kullanıyoruz. Bu işlemi kolaylaştırmak için, bir fare göğüs kafesi şablonu, Karşılıklı Bilgi12 kullanılarak ilk posteroanterior projeksiyona birlikte kaydedilir. Şablon yerleştirildikten sonra, diyaframın yakınındaki bir penceredeki piksel yoğunlukları, vekil bir solunum sinyali oluşturmak için toplanırken, miyokardın yakınındakiler, vekil kardiyak sinyali türetmek için toplanır. Bu sinyaller daha sonra zaman alanında bant geçiren filtrelenir ve veri kümesindeki her kareye solunum ve kalp fazına göre bir kesirli faz numarası (0 ile 1 arasında) atanır. Bu, projeksiyonların faz değerlerine göre seçilmesine veya reddedilmesine izin verir. Tipik olarak, solunum döngüsünün son-sona erme aşamasına (0.15 ≤ faz < 0.85) karşılık gelen çerçeveler korunurken, hareketin en belirgin olduğu inspirasyon aşamasından olanlar atılır. Kalan çerçeveler, her biri kardiyak döngünün 1/12'sini (0.083) temsil eden 12 kardiyak faza gruplandırılır ve yinelemeli bir yöntem (Sıralı Alt Küme Beklenti Maksimizasyonu [OSEM])13,14 kullanılarak 3D görüntülere yeniden yapılandırılır. Tüm süreç Şekil 1'de özetlenmiştir.
Protokol
Hayvan deney protokolleri, Kaliforniya Üniversitesi, Los Angeles (UCLA) Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından gözden geçirildi ve onaylandı. Bu protokolde C57BL/6J fareler (8 haftalık, erkek, 24-26 g) kullanıldı. Bu çalışmada kullanılan CT tarayıcı, klinik öncesi araştırmalar için araştırma kurumumuzda geliştirilen bir prototip olan CrumpCAT'tir (Şekil 2), edinim ve yeniden yapılandırma protokollerini optimize etmek için gereken kontrol ve esnekliği sağlar. Yöntem, anestezi uygulanmış farelerin 600 atım/dk'dan fazla olmayan bir kalp atış hızına ve 20 ila 180 nefes/dk arasında bir solunum hızına sahip olacağını varsayar15.
1. Ekipman ayarları
- X-ışını kaynağını 50 μA sürekli akımla 200 kVp'lik bir tepe voltajında çalıştırın.
- X-ışını kamera piksel gruplamasını 2'ye ve pozlama süresini en kısa pratik değerine ayarlayın (20 ms pozlama süresi artı 14 ms okuma süresi, toplam 34 ms örnekleme süresi için).
NOT: Gruplamasız seçenek (gruplama 1) daha yavaş bir kare hızına sahiptir ve bu nedenle geçitli alımlar için kullanılamaz. Maksimum kare hızı yaklaşık 30 kare/sn'dir.
2. Hayvan hazırlama
- Fareleri% 2.0 konsantrasyonda oksijen ve izofluran gazı karışımı ile uyuşturun.
- Tarama sırasında herhangi bir vücut hareketinden kaçınmak için yaşamsal belirtilerin stabil olduğundan ve hayvanların rahatladığından emin olmak için BT görüntülemeden önce hayvanları 10 dakika anestezi altında tutun. Bir farenin anestezi derinliğini, ayak parmakları arasındaki dokumayı bir tırnağınızla sıkıca sıkıştırırken ayak parmağı kıstırma refleksinin olmamasına göre değerlendirin.
- Kardiyak kapılı görüntülemede kalp odacıklarının görüntülenmesi için, BT görüntülemeden hemen önce kuyruk damarından intravenöz olarak 100 μL BT kontrast maddesi enjekte edilir (Şekil 3A).
- Anestezi uygulanmış fareyi BT görüntüleme odasının içine yerleştirin (Şekil 3B).
3. Veri toplama
- CrumpCAT yazılımını açın.
- Yüksek çözünürlüklü (125 μm, gruplama 1) ile kapısız BT görüntüleme (Şekil 4A)
- Kullanıcı arayüzünde bir Çalışma Kimliği girin.
- Protokol açılır menüsünde Mouse Hi-Res (Fare Yüksek Çözünürlüklü) öğesini seçin.
- 80 ms/projeksiyon pozlama süresiyle 720 projeksiyon elde etmek için kullanıcı arayüzündeki Tara düğmesine tıklayın.
- Orta çözünürlüklü (200 μm, gruplama 2) kapısız BT görüntüleme (Şekil 4B)
- Kullanıcı arayüzünde bir Çalışma Kimliği girin.
- Protokol açılır menüsünde Fare Standardı'nı seçin.
- 100 ms/projeksiyon pozlama süresiyle 720 projeksiyon elde etmek için kullanıcı arayüzündeki Tara düğmesine tıklayın.
- Kapılı BT görüntüleme (200 μm, gruplama 2) (Şekil 4C)
- Kullanıcı arayüzünde bir Çalışma Kimliği girin.
- Protokol açılır menüsünde Kardiyak Geçit'i seçin.
- Kullanıcı arayüzündeki Tara düğmesine tıklayın ve 20 ms/projeksiyon pozlama süresiyle 21.600 projeksiyon elde edin.
4. Veri ön işleme
NOT: Ön işleme adımları yalnızca geçitli alımlar için gereklidir. Tüm bu adımlar rekonstrüksiyon yazılımı tarafından otomatik olarak gerçekleştirilir ve operatör müdahalesi gerekmez.
- Sinyal çıkarma
- Toraks şablonu ortak kaydı için, kaburgalar, kalp, akciğerler ve karaciğer ile bir fare göğsünü kabaca temsil eden küçük bir görüntünün (şablon), projeksiyon ve şablon arasındaki Karşılıklı Bilgi12'yi en üst düzeye çıkararak ilk X-ışını projeksiyonuna otomatik olarak birlikte kaydedilmesine izin verin (Şekil 5).
NOT: Şablon üzerinde yalnızca çeviri işlemleri gerçekleştirilir ve tüm projeksiyonlarda ilgi alanlarını (ROI'ler) tanımlamak için ortak kayıtlı şablon kullanılır. - Solunum sinyali ekstraksiyonu için, her projeksiyon için ROI-1 içindeki piksel yoğunluklarının toplanmasıyla oluşturulacak diyaframı ve solunum sinyalini temsil etmek üzere şablonda dikdörtgen bir ROI'nin (ROI-1) belirlenmesine izin verin (Şekil 5).
- Kardiyak sinyal ekstraksiyonu için, kalbin yanındaki şablonda ikinci bir dikdörtgen ROI (ROI-2) belirlensin ve her projeksiyon için ROI-2'deki piksel yoğunluklarının toplanmasıyla oluşturulan kardiyak sinyale izin verin (Şekil 5).
NOT: Toraks şablonu, sinyal çıkarma için hangi görüntü satırlarının ve sütunlarının (pencere) kullanılması gerektiğini belirlemek için yalnızca ilk projeksiyonda birlikte kaydedilir. Bu pencere, hayvan yatağımızı16 kullanırken olduğu gibi, hayvan makul bir şekilde ortalandığı sürece tüm çıkıntıları kapsayacak kadar geniştir.
- Toraks şablonu ortak kaydı için, kaburgalar, kalp, akciğerler ve karaciğer ile bir fare göğsünü kabaca temsil eden küçük bir görüntünün (şablon), projeksiyon ve şablon arasındaki Karşılıklı Bilgi12'yi en üst düzeye çıkararak ilk X-ışını projeksiyonuna otomatik olarak birlikte kaydedilmesine izin verin (Şekil 5).
- Bant geçiren filtre
- Aşağıda açıklandığı gibi frekans alanındaki düşük geçiren filtrelere karşılık gelen zamansal alan17'de farklı kesme frekanslarına sahip iki Sinc fonksiyonunun birleştirilmesiyle bir bant geçiren filtrenin oluşturulmasına izin verin.
- Yazılımın [300, 600] dk-1'lik bir frekans bandı kullanarak kardiyak sinyale bant geçiren filtreyi uygulamasına izin verin (Şekil 6A).
NOT: Filtrelenmemiş kardiyak sinyal (Şekil 6B) hala solunum hareketinden önemli bir katkı içermektedir. - Benzer şekilde, solunum sinyalinin [20, 300] dk-1'lik bir frekans bandı kullanılarak filtrelenmesine izin verin. Daha yüksek harmonikler, sadece sinüzoidal olmayan ve iki ana fazı daha net bir şekilde tanımlayan bir sinyal üretmek için korunur: ilham ve ekspirasyon.
NOT: Bu noktada, hem solunum hem de kardiyak sinyaller kolayca enterpolasyon yapılabilir ve kesirli faz sayısının hesaplanması amacıyla zamanın sürekli fonksiyonları olarak kabul edilebilir.
- Aşama ataması
- Yazılımın, sinyalin ilk türevinin sıfır geçişlerini bularak her döngünün başlangıcını (solunum veya kardiyak) tanımlamasına izin verin. Her sıfır geçişi, sinyaldeki bir maksimuma karşılık gelir ve yeni bir döngünün başlangıcını ve bir öncekinin sonunu işaretler. Bir örnek için, Şekil 7'deki solunum sinyaline bakın.
- İki sinyalin (solunum veya kardiyak) her biri için her projeksiyona bir kesirli faz değerinin (0 ile 1 arasında) atanmasına izin verin.
NOT: Tanım olarak, başlangıç noktasının kesirli faz değeri sıfır (mevcut döngü için) veya bir (önceki döngü için) olur.
- Seçim maskeleri
- Her faza ait projeksiyonları seçmek için 12 ikili maske (kardiyak faz başına bir tane) oluşturulsun. Her maske, 0 veya 1 olan, yani sırasıyla bu projeksiyonu reddeden veya tutan 21.600 giriş (projeksiyon başına bir tane) içerir.
- Her maske (faz) için, yazılımın kesirli faz numarasına göre bir projeksiyonun tutulup tutulmadığını (1) veya atılıp atılmadığını (0) gösterdiğini gözlemleyin. Faz 0 için, [0, 1/12] aralığında bir kardiyak faz değerine sahip projeksiyonlar tutulur. Faz 1 için, [1/12, 2/12] aralığındaki kardiyak faz değerleri tutulur ve bu şekilde devam eder.
- Her maske (faz) için, solunum fazı 0.15'ten küçük veya 0.85'ten büyük olan herhangi bir projeksiyonun, en büyük harekete sahip olan inspirasyon fazına ait oldukları için reddedildiğine (maskede 0) dikkat edin (Şekil 8A). Şekil 8B , ilk 2 saniye için projeksiyonlara kardiyak faz atamasını göstermektedir.
NOT: Faz başına projeksiyon sayısı 1.800 ± 194'te nispeten sabit olduğundan, bu seçim sürecinde önemli bir sapma ortaya çıkmamıştır.
5. Görüntü rekonstrüksiyonu
- Geçitsiz BT taramaları için, Shepp-Logan filtreli Filtrelenmiş geri projeksiyon (Feldkamp 18) algoritmasını kullanarak orta (200 μm) veya yüksek (125 μm) çözünürlükte görüntüleri yeniden oluşturun.
- Kardiyak kapılı BT taramaları için, her bir kardiyak faz görüntüsünü, yalnızca belirli bir faza katkıda bulunan seçilmiş projeksiyonları dikkate alarak (faz seçimi ikili maskesinde belirtildiği gibi) 12 alt küme ve 8 yineleme ile yinelemeli OSEM algoritması13 kullanarak yeniden oluşturun.
- Gürültüyü azaltmak için, zamansal boyutta (yani görüntüler arasında) bir rekonstrüksiyon sonrası medyan filtre ve uzamsal boyutta (σ = 38 μm) hafif bir 3D-Gauss filtresi uygulayın.
NOT: Solunum kapılı görüntü rekonstrüksiyonu için, tüm kardiyak fazları belirsiz bir şekilde kullanın. Her rekonstrüksiyona kiriş sertleştirme düzeltmesi (su düzeltmesi) uygulanır.
6. Görüntü değerlendirmesi ve sol ventrikül (LV) hacim ölçümü
- CT görüntüsünü Amide19 gibi bir DICOM görüntüleyicide açın (Şekil 9A).
- CT değerini (Hounsfield Unit [HU] cinsinden ölçülür) aralığını [-500, 500] olarak ayarlayarak görünür görüntü kontrastını artırın (Şekil 9A).
- Görüntü kalitesi değerlendirmesi
- Maksimum HU değerinin %85'ine eşit veya daha büyük bir CT değeri ile maksimum etrafındaki bölge olarak tanımlanan kalsifiye bölge için bir ROI çizin (Şekil 9B).
- Görüntü kalitesini ve küçük kireçlenmeler gibi küçük yapıları tanımlama kapasitesini değerlendirmek için bir ölçüm olarak kontrast-gürültü oranını (CNR)20,21 kullanın:
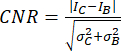 ,
,
burada I ve σ , bir bölgenin ortalama yoğunluğunu ve standart sapmasını temsil eder: kalsifikasyon (alt simge C) veya arka plan (alt simge B).
- Sol ventrikül hacim ölçümü
- Her aşamadaki LV'yi tanımlamak için bir 3D-Freehand ROI çizin (Şekil 10A).
- Eşik CT değeri 730 HU olan vokselleri hesaplayarak LV hacmini ölçün (Şekil 10B). LV hacimlerinin bir grafiği Şekil 10C'de gösterilmiştir.
NOT: CT değeri eşiği mutlak değildir; kullanılan kontrast maddeye, hayvan boyutuna, suşuna, sağlık durumuna ve enjeksiyon ile BT görüntüleme arasındaki süreye bağlıdır. Amid, enstitümüzde geliştirilen ücretsiz olarak dağıtılan bir yazılımdır, ancak diğer daha karmaşık görüntü görüntüleyiciler de mevcuttur (örneğin, ORS Dragonfly22).
Sonuçlar
İlk olarak farelerde (erkek, 30-32 g) kardiyak kalsifikasyonu görselleştirmek için kapısız ve kapılı BT görüntülerini karşılaştırdık. Kardiyak kalsifikasyonun murin modeli, daha önce tarif edildiği gibi, kardiyak dokunun hızlı donma-çözülmesi (kriyo-yaralanma) ile kardiyak hasarın indüklenmesiyle oluşturulmuştur23. Kapısız BT görüntüleme protokolleri ile kardiyak kalsifikasyonlar yüksek çözünürlüklü (125 μm, binning 1) gör?...
Tartışmalar
Burada açıklanan özel donanım uygulaması, enstitümüze özgü özel yapım bir X-ışını BT sistemidir, ancak özel dedektör, ticari olarak temin edilebilen klinik öncesi X-ışını BT cihazlarında yaygın olarak kullanılmaktadır ve bu da açıklanan çalışmayı diğer kurumlarla ilgili hale getirmektedir. Bu sistem, işlevsel olarak, ticari olarak temin edilebilen ve yaygın olarak kullanılan iki in vivo X-ışını mikroCT alt sisteminin prototipidir.
klini...
Açıklamalar
Dr. Richard Taschereau, Sofie Biosciences ve Xodus Imaging'de danışmandır. Dr. Arion F. Chatziioannou, Sofie Biosciences'ın kurucusudur.
Teşekkürler
UCLA Crump Klinik Öncesi Görüntüleme Teknolojisi Merkezi'nin tüm üyelerine yardımları ve destekleri için teşekkür ederiz. Özellikle, hayvanları kardiyak BT görüntülemeye hazırladıkları için Mikayla Tamboline ve Isabel Day'e teşekkür ediyoruz ve çalışma sırasında sol ventrikül ROI'lerinin bir kısmını oluşturduğu için Sophie Shumilov'a teşekkür ediyoruz. Ayrıca Dr. Arjun Deb ve Yijie Wang'a (UCLA) kardiyak kalsifikasyon mikroBT görüntüleme için akut iskemik kardiyak hasarın fare modellerini sağladıkları için teşekkür ederiz. Bu çalışma NIH Kanser Merkezi Destek Hibesi (2 P30 CA016042-44) tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| C57BL/6J mice | Jackson Laboratory | 664 | Male, 8 weeks old, 24-26 g |
| Dexela camera | Varex | 1512 | Detector, 20 ms exposure, 74.8/149.6 µm pixel |
| VivoVist | Nanoprobes | 1301-5X0.25ML | CT Contrast agent |
| X-ray source | Moxtek | TUB00082 | 50 kV peak, 200 µA, 1.0 mm-thick Al filter |
Referanslar
- Schambach, S. J., Bag, S., Schilling, L., Groden, C., Brockmann, M. A. Application of micro-CT in small animal imaging. Methods. 50 (1), 2-13 (2010).
- Koba, W., Jelicks, L. A., Fine, E. J. MicroPET/SPECT/CT imaging of small animal models of disease. Am J Pathol. 182 (2), 319-324 (2013).
- Hutchins, G. D., Miller, M. A., Soon, V. C., Receveur, T. Small animal PET imaging. ILAR J. 49 (1), 54-65 (2008).
- Franc, B. L., Acton, P. D., Mari, C., Hasegawa, B. H. Small-animal SPECT and SPECT/CT: important tools for preclinical investigation. J Nucl Med. 49 (10), 1651-1663 (2008).
- Badea, C. T. H. L., Hedlund, L. W., Johnson, G. A. Micro-CT with respiratory and cardiac gating: Micro-CT with respiratory and cardiac gating. Med Phys. 31 (12), 3324-3329 (2004).
- Guo, X., Johnston, S. M., Qi, Y., Johnson, G. A., Badea, C. T. 4D micro-CT using fast prospective gating. Phys Med Biol. 57 (1), 257 (2011).
- Drangova, M., Ford, N. L., Detombe, S. A., Wheatley, A. R., Holdsworth, D. W. Fast retrospectively gated quantitative four-dimensional (4D) cardiac micro computed tomography imaging of free-breathing mice. Invest Radiol. 42 (2), 85-94 (2007).
- Blocker, S. J., Holbrook, M. D., Mowery, Y. M., Sullivan, D. C., Badea, C. T. The impact of respiratory gating on improving volume measurement of murine lung tumors in micro-CT imaging. PLoS One. 15 (2), e0225019 (2020).
- Bartling, S. H., et al. Retrospective motion gating in small animal CT of mice and rats. Invest Radiol. 42 (10), 704-714 (2007).
- Kuntz, J., et al. Fully automated intrinsic respiratory and cardiac gating for small animal CT. Phys Med Biol. 55 (7), 2069 (2010).
- Hahn, A., Sauppe, S., Lell, M., Kachelrieß, M. Automatic intrinsic cardiac and respiratory gating from cone-beam CT scans of the thorax region. SPIE Proc. Med Imaging. 9783, 200-205 (2016).
- Maes, F., Vandermeulen, D., Suetens, P. Medical image registration using mutual information. Proc IEEE. 91 (10), 1699-1722 (2003).
- Sheng, J., Chen, B., Ma, Y., Shi, Y. A novel reconstruction approach combining OSEM and split Bregman method for low dose CT. Biomedical Signal Processing and Control. 62, 102095 (2020).
- Romdhane, H., Cherni, M. A., Sallem, D. B. On the efficiency of OSEM algorithm for tomographic lung CT images reconstruction. 2016 Second International Image Processing, Applications and Systems (IPAS). , (2016).
- Ewald, A. J., Werb, Z., Egeblad, M. Monitoring of vital signs for long-term survival of mice under anesthesia. Cold Spring Harb Protoc. 2, 5563 (2011).
- Suckow, C., et al. Multimodality rodent imaging chambers for use under barrier conditions with gas anesthesia. Mol Imaging Biol. 11 (2), 100-106 (2009).
- Owen, M. . Practical signal processing. , 81 (2007).
- Feldkamp, L. A., Davis, L. C., Kress, J. W. Practical cone-beam algorithm. J Opt Soc Am. A-optics Image Sci Vision. 1 (6), 612-619 (1984).
- Loening, A. M., Gambhir, S. S. AMIDE: A free software tool for multimodality medical image analysis. Mol Imaging. 2 (3), 131-137 (2003).
- Rodriguez-Molares, A., et al. The generalized contrast-to-noise ratio: A formal definition for lesion detectability. IEEE Trans Ultrason Ferroelectr Freq Control. 67 (4), 745-759 (2020).
- Patterson, M. S., Foster, F. S. The improvement and quantitative assessment of B-mode images produced by an annular array/cone hybrid. Ultrason Imaging. 5 (3), 195-213 (1983).
- . Dragonfly 2022.2 Available from: https://www.theobjects.com/dragonfly (2022)
- Pillai, I. C. L., et al. Cardiac fibroblasts adopt osteogenic fates and can be targeted to attenuate pathological heart calcification. Cell Stem Cell. 20 (2), 218-232 (2017).
- Li, S., et al. A humanized monoclonal antibody targeting an ectonucleotidase rescues cardiac metabolism and heart function after myocardial infarction. Cell Rep Med. 5 (11), 101795 (2024).
- Nadkarni, R., Clark, D. P., Allphin, A. J., Badea, C. T. Investigating deep learning strategies for fast denoising of 5D cardiac photon-counting micro-CT images. Phys Med Biol. 69 (20), 205010 (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır