Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Ретроспективное стробирование сердца с помощью прототипа рентгеновского компьютерного томографа мелких животных
В этой статье
Резюме
Мы предоставляем исчерпывающее описание встроенного метода ретроспективного кардиологического гейтирования CrumpCAT, прототипа рентгеновского компьютерного томографа (КТ) мелких животных, разработанного и изготовленного в нашем научно-исследовательском институте.
Аннотация
CrumpCAT — это прототип рентгеновского компьютерного томографа (КТ) мелких животных, разработанный в нашем научно-исследовательском институте. КМОП-детектор с максимальной частотой кадров 29 Гц и аналогичные вольфрамовые рентгеновские источники с энергией от 50 кВ до 80 кВв широко используются в коммерчески доступных доклинических рентгеновских компьютерных приборах. Это делает описанную работу весьма актуальной для других учреждений, несмотря на общепринятое мнение о том, что эти детекторы не подходят для ограничения высоких частот сердечных сокращений мышей (~600 уд/мин). Сканер поддерживает визуализацию со средним (200 мкм) и высоким (125 мкм) разрешением, рентгеноскопию, ретроспективное респираторное гейтинг и ретроспективное кардиологическое гейтинг с итеративной или отфильтрованной проекцией изображения. Среди этих особенностей стробирование сердца является наиболее полезной функцией для изучения сердечных функций in vivo, поскольку оно эффективно устраняет размытие изображения, вызванное дыханием и движением сердца.
В данной статье мы описываем наш метод доклинической ретроспективной кардиозависированной компьютерной томографии, направленный на продвижение исследований в области анализа функции и структуры сердца in vivo . Кардиозависимый метод позволяет получить большое количество проекций за кратчайшее практическое время экспозиции (~20 мс), а затем ретроспективно извлекает дыхательные и сердечные сигналы из временных изменений в необработанных проекционных последовательностях. Эти сигналы используются для отбрасывания проекций, относящихся к фазе вдоха с высокой частотой движения дыхательного цикла, и для разделения оставшихся проекций на 12 групп, каждая из которых соответствует одной фазе сердечного цикла. Каждая группа реконструируется независимо с использованием итерационного метода для получения объемного изображения для каждой фазы сердца, в результате чего получается четырехмерный (4D) набор данных.
Эти фазовые изображения могут быть проанализированы как в совокупности, так и по отдельности, что позволяет детально оценить сердечную функцию. Мы продемонстрировали эффективность обоих подходов к функции кардиогатации прототипа сканера на основе репрезентативных результатов визуализации in vivo .
Введение
В исследованиях на мелких животных часто используется комбинация неинвазивных методов визуализации, при этом рентгеновская компьютерная томография (КТ) является важным выбором из-за ее зрелости, экономичности, скорости 1,2 и способности предоставлять дополнительную информацию наряду с другими методами, такими как позитронно-эмиссионная томография (ПЭТ)2,3 и однофотонная эмиссионная компьютерная томография (ОФЭКТ)2,4. Однако, как и другие методы визуализации, компьютерная томография подвержена физиологическим артефактам движения, вызванным биением сердца или дыханием, которые вносят размытость и ограничивают точность исследования.
Чтобы устранить это ограничение, размытие дыхания и сердечных движений может быть смягчено с помощью метода, известного как стробирование 5,6,7,8, при котором сбор данных синхронизируется с определенными фазами сердечного или дыхательного цикла (или воротами). Один из подходов к достижению этой цели, известный как перспективный стробирование 3,6, включает в себя прикрепление датчиков к животному для передачи сигналов стробирования в режиме реального времени на совместимый сканер. Несмотря на свою эффективность, этот метод является трудоемким и занимает много времени, особенно при прикреплении датчиков к груди и лапам мелких животных, таких как мыши, что ограничивает масштаб исследований. В качестве альтернативы, встроенное ретроспективное стробирование 7,9,10,11 предполагает получение данных временных рядов без использования датчиков, но путем выявления особенностей в данных, которые позволяют ретроспективно сортировать результаты на основе их фазы в сердечном или дыхательном цикле. Этот подход дает результаты, сравнимые с перспективным стробированием, но без необходимости в дополнительном оборудовании или усилиях, связанных с подключением импульсного датчика, и, следовательно, значительно упрощает экспериментальные протоколы.
В нашем методе доклинической компьютерной томографии сердца мы используем собственное ретроспективное стробирование для извлечения дыхательных и сердечных циклов из вариаций амплитуды в областях рентгеновских проекций, которые демонстрируют наиболее значительные изменения между последовательными кадрами. Чтобы облегчить этот процесс, шаблон грудной клетки мыши совместно регистрируется на первой заднепередней проекции с использованием Mutual Information12. После того, как шаблон установлен, интенсивность пикселей в окне рядом с диафрагмой суммируется для генерации суррогатного дыхательного сигнала, в то время как интенсивность пикселей вблизи миокарда суммируется для получения суррогатного сердечного сигнала. Затем эти сигналы фильтруются полосой пропускания во временной области, и каждому кадру в наборе данных присваивается дробный номер фазы (от 0 до 1) в зависимости от его дыхательной и сердечной фазы. Это позволяет выбирать или отклонять проекции в соответствии с их фазовыми значениями. Как правило, кадры, соответствующие фазе конца и выдоха дыхательного цикла (0,15 ≤ фазе < 0,85), сохраняются, в то время как кадры из фазы вдоха, где движение наиболее выражено, отбрасываются. Остальные кадры сгруппированы в 12 сердечных фаз, каждая из которых представляет 1/12 (0,083) сердечного цикла, и реконструируются в 3D-изображения с использованием итерационного метода (Ordered Subset Expectation Maximization [OSEM])13,14. Весь процесс обобщен на рисунке 1.
протокол
Протоколы экспериментов на животных были рассмотрены и одобрены Институциональным комитетом по уходу за животными и их использованию Калифорнийского университета в Лос-Анджелесе (UCLA). В этом протоколе использовались мыши C57BL/6J (8 недель, самец, 24-26 г). В этом исследовании использовался компьютерный томограф CrumpCAT (рис. 2), прототип, разработанный в нашем научно-исследовательском институте для доклинических исследований, который обеспечивает нам контроль и гибкость, необходимые для оптимизации протоколов сбора и реконструкции. Метод предполагает, что мыши, находящиеся под наркозом, будут иметь частоту сердечных сокращений не более 600 уд/мин и частоту дыхания от 20 до 180 вдохов/мин15.
1. Настройки оборудования
- Работа источника рентгеновского излучения при пиковом напряжении 50 кВ и постоянном токе 200 мкА.
- Установите объединение пикселей рентгеновской камеры на 2, а время экспозиции на наименьшее практическое значение (время экспозиции 20 мс плюс время чтения 14 мс для общего времени дискретизации 34 мс).
ПРИМЕЧАНИЕ: Опция без биннинга (группирование 1) имеет меньшую частоту кадров и, следовательно, не может использоваться для закрытой съемки. Максимальная частота кадров составляет около 30 кадров/с.
2. Подготовка животных
- Обезболивайте мышей смесью кислорода и газообразного изофлурана в концентрации 2,0%.
- Держите животных под наркозом в течение 10 минут перед компьютерной томографией, чтобы убедиться, что жизненно важные показатели стабильны и животные расслаблены, чтобы избежать любых движений тела во время сканирования. Судите о глубине анестезии мыши по отсутствию рефлекса защемления пальцев ног при сильном защемлении перепонки между пальцами ногтей.
- Для кардиозавистивной визуализации камер сердца необходимо внутривенно ввести 100 мкл контрастного вещества для КТ через хвостовую вену непосредственно перед компьютерной томографией (рис. 3A).
- Поместите мышь под наркозом в камеру компьютерной томографии (рисунок 3B).
3. Сбор данных
- Включите программу CrumpCAT.
- Незатворная компьютерная томография с высоким разрешением (125 мкм, биннинг 1) (Рисунок 4A)
- Введите идентификатор исследования в пользовательском интерфейсе.
- Выберите «Мышь Hi-Res» в раскрывающемся меню « Протокол ».
- Нажмите кнопку «Сканировать» в пользовательском интерфейсе, чтобы получить 720 проекций со временем экспозиции 80 мс/проекция.
- Незатворная компьютерная томография со средним разрешением (200 мкм, биннинг 2) (Рисунок 4B)
- Введите идентификатор исследования в пользовательском интерфейсе.
- Выберите «Стандартная мышь» в раскрывающемся меню « Протокол ».
- Нажмите кнопку «Сканирование » в пользовательском интерфейсе, чтобы получить 720 проекций с временем экспозиции 100 мс/проекция.
- Закрытая компьютерная томография (200 мкм, биннинг 2) (Рисунок 4C)
- Введите идентификатор исследования в пользовательском интерфейсе.
- Выберите «Кардиологическое стробирование » в раскрывающемся меню « Протокол ».
- Нажмите кнопку «Сканировать » в пользовательском интерфейсе и получите 21 600 проекций со временем экспозиции 20 мс/проекция.
4. Предварительная обработка данных
ПРИМЕЧАНИЕ: Шаги предварительной обработки требуются только для закрытых сборов. Все эти шаги выполняются автоматически программным обеспечением для реконструкции и не требуют вмешательства оператора.
- Извлечение сигнала
- Для совместной регистрации шаблона грудной клетки пусть небольшое изображение (шаблон), грубо представляющее грудную клетку мыши с ребрами, сердцем, легкими и печенью, будет автоматически зарегистрировано на первой рентгеновской проекции, максимизируя взаимную информацию12 между проекцией и шаблоном (рисунок 5).
ПРИМЕЧАНИЕ: В шаблоне выполняются только операции перевода, а совместно зарегистрированный шаблон используется для определения областей интереса (ROI) во всех проекциях. - Для извлечения дыхательного сигнала позвольте указать в шаблоне прямоугольный ROI (ROI-1), представляющий диафрагму и дыхательный сигнал, который должен быть сгенерирован путем суммирования интенсивностей пикселей внутри ROI-1 для каждой проекции (рис. 5).
- Для извлечения сердечного сигнала пусть в шаблоне рядом с сердцем будет обозначен второй прямоугольник ROI (ROI-2), а сердечный сигнал будет сгенерирован путем суммирования интенсивностей пикселей в ROI-2 для каждой проекции (рис. 5).
ПРИМЕЧАНИЕ: Шаблон грудной клетки регистрируется только на первой проекции, чтобы определить, какие строки и столбцы изображения (окна) должны использоваться для извлечения сигнала. Это окно достаточно широкое, чтобы охватить все проекции при условии, что животное находится в центре разумно, как в случае использования нашей кровати для животных16.
- Для совместной регистрации шаблона грудной клетки пусть небольшое изображение (шаблон), грубо представляющее грудную клетку мыши с ребрами, сердцем, легкими и печенью, будет автоматически зарегистрировано на первой рентгеновской проекции, максимизируя взаимную информацию12 между проекцией и шаблоном (рисунок 5).
- Полосовой фильтр
- Возможность создания полосового фильтра путем объединения двух функций Sinc с различными частотами среза во временной области17, которые соответствуют фильтрам нижних частот в частотной области, как описано ниже.
- Пусть программное обеспечение применит полосовой фильтр к сердечному сигналу, используя полосу частот [300, 600] мин-1 (рис. 6A).
ПРИМЕЧАНИЕ: Неотфильтрованный сердечный сигнал (Рисунок 6B) по-прежнему содержит значительный вклад дыхательных движений. - Аналогичным образом, пусть дыхательный сигнал фильтруется с использованием полосы частот [20, 300] мин-1. Высшие гармоники сохраняются для того, чтобы производить сигнал, который не является просто синусоидальным, а более четко идентифицирует две основные фазы: вдох и выдох.
Примечание: На этом этапе как дыхательные, так и сердечные сигналы могут быть легко интерполированы и рассматриваться как непрерывные функции времени с целью вычисления дробного числа фаз.
- Назначение фаз
- Программное обеспечение позволяет определить начало каждого цикла (дыхательного или сердечного), находя пересечения нуля первой производной сигнала. Каждое пересечение нуля соответствует максимуму в сигнале и знаменует начало нового цикла и окончание предыдущего. В качестве примера см. дыхательный сигнал на рисунке 7.
- Позвольте назначить дробное значение фазы (от 0 до 1) каждой проекции для каждого из двух сигналов (дыхательного или сердечного).
ПРИМЕЧАНИЕ: По определению, начальная точка имеет дробное значение фазы, равное нулю (для текущего цикла) или единице (для предыдущего цикла).
- Маски выделения
- Пусть будет создано 12 бинарных масок (по одной на фазу сердца) для выбора проекций, принадлежащих каждой фазе. Каждая маска содержит 21 600 записей (по одной на проекцию), которые имеют значение 0 или 1, что означает отклонение или сохранение этой проекции соответственно.
- Обратите внимание, что для каждой маски (фазы) программное обеспечение указывает, сохраняется ли проекция (1) или отбрасывается (0) в соответствии с ее дробным номером фазы. Для фазы 0 сохраняются проекции со значением сердечной фазы в интервале [0, 1/12]. Для фазы 1 сохраняются значения сердечной фазы в интервале [1/12, 2/12] и так далее.
- Обратите внимание, что для каждой маски (фазы) любые проекции с фазой дыхания меньше 0,15 или больше 0,85 отклоняются (0 в маске), поскольку они относятся к фазе вдоха, которая имеет наибольшее движение (рис. 8A). На рисунке 8B показано распределение сердечной фазы по проекциям в течение первых 2 с.
ПРИМЕЧАНИЕ: В этом процессе отбора не было внесено существенной систематической ошибки, поскольку количество прогнозов на фазу было относительно постоянным и составляло 1800 ± 194.
5. Реконструкция изображения
- Для нестробированной компьютерной томографии реконструируйте изображения со средним (200 мкм) или высоким (125 мкм) разрешением с использованием алгоритма обратной проекции с фильтром Feldkamp18 с фильтром Шеппа-Логана.
- Для кардиозависимых компьютерных томографов реконструируйте изображение каждой фазы сердца с использованием итерационного алгоритма OSEM13 с 12 подмножествами и 8 итерациями, принимая во внимание только выбранные проекции, участвующие в данной фазе (как указано в бинарной маске выбора фазы).
- Чтобы уменьшить шум, примените медианный фильтр после реконструкции во временном измерении (т. е. по изображениям) и световой 3D-гауссов фильтр в пространственном измерении (σ = 38 мкм).
ПРИМЕЧАНИЕ: Для реконструкции респираторно-зависимого изображения используйте все фазы сердца нечетко. Коррекция лучевого закаливания (водная коррекция) применяется к каждой конструкции.
6. Оценка изображения и количественная оценка объема левого желудочка (ЛЖ)
- Откройте изображение компьютерной томографии в программе просмотра DICOM, например Amide19 (Рисунок 9A).
- Увеличьте контрастность видимого изображения, установив значение CT (измеренное в единицах Хаунсфилда [HU]) на [-500, 500] (рис. 9A).
- Оценка качества изображения
- Нарисуйте ROI для кальцинированной области, которая определяется как область вокруг максимума со значением CT, большим или равным 85% от максимального значения HU (рис. 9B).
- Используйте отношение контраст/шум (CNR)20,21 в качестве метрики для оценки качества изображения и его способности идентифицировать небольшие структуры, такие как небольшие кальцинаты:
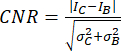 ,
,
где I и σ представляют среднюю интенсивность и стандартное отклонение области: кальцификация (индекс C) или фон (индекс B).
- Количественная оценка объема левого желудочка
- Нарисуйте 3D-Freehand ROI, чтобы определить LV в каждой фазе (рис. 10A).
- Количественно оцените объем ЛЖ путем вычисления вокселей с пороговым значением CT 730 HU (рис. 10B). График объемов LV показан на рисунке 10C.
ПРИМЕЧАНИЕ: Пороговое значение CT не является абсолютным; Это зависит от используемого контрастного вещества, размера животного, штамма, состояния здоровья и времени между инъекцией и компьютерной томографией. Amide — это свободно распространяемое программное обеспечение, разработанное в нашем институте, но доступны и другие, более сложные программы просмотра изображений (например, ORS Dragonfly22).
Результаты
Сначала мы сравнили незатворные и стробированные КТ-изображения для визуализации кальциноза сердца у мышей (самцы, 30-32 г). Мышиная модель кальцификации сердца была создана путем индуцирования сердечного повреждения путем быстрого замораживания-оттаивания сердечной...
Обсуждение
Конкретная аппаратная реализация, описанная здесь, представляет собой специально разработанную систему рентгеновской компьютерной томографии, уникальную для нашего института, но конкретный детектор широко используется в коммерчески доступных доклинических рентг...
Раскрытие информации
Доктор Ричард Ташеро является консультантом Sofie Biosciences и Xodus Imaging. Доктор Арион Ф. Хатзииоанну является основателем компании Sofie Biosciences.
Благодарности
Мы благодарим всех сотрудников Технологического центра доклинической визуализации Крампа Калифорнийского университета в Лос-Анджелесе за их помощь и поддержку. В частности, мы благодарим Микайлу Тамболин и Изабель Дэй за подготовку животных к компьютерной томографии сердца и благодарим Софию Шумилову за получение некоторых ROI левого желудочка во время исследования. Мы также благодарим докторов Арджуна Деба и Ицзе Вана (Калифорнийский университет в Лос-Анджелесе) за предоставление мышиных моделей острого ишемического повреждения сердца для микрокомпьютерной томографии кальцификации сердца. Эта работа поддержана грантом поддержки Онкологического центра NIH (2 P30 CA016042-44).
Материалы
| Name | Company | Catalog Number | Comments |
| C57BL/6J mice | Jackson Laboratory | 664 | Male, 8 weeks old, 24-26 g |
| Dexela camera | Varex | 1512 | Detector, 20 ms exposure, 74.8/149.6 µm pixel |
| VivoVist | Nanoprobes | 1301-5X0.25ML | CT Contrast agent |
| X-ray source | Moxtek | TUB00082 | 50 kV peak, 200 µA, 1.0 mm-thick Al filter |
Ссылки
- Schambach, S. J., Bag, S., Schilling, L., Groden, C., Brockmann, M. A. Application of micro-CT in small animal imaging. Methods. 50 (1), 2-13 (2010).
- Koba, W., Jelicks, L. A., Fine, E. J. MicroPET/SPECT/CT imaging of small animal models of disease. Am J Pathol. 182 (2), 319-324 (2013).
- Hutchins, G. D., Miller, M. A., Soon, V. C., Receveur, T. Small animal PET imaging. ILAR J. 49 (1), 54-65 (2008).
- Franc, B. L., Acton, P. D., Mari, C., Hasegawa, B. H. Small-animal SPECT and SPECT/CT: important tools for preclinical investigation. J Nucl Med. 49 (10), 1651-1663 (2008).
- Badea, C. T. H. L., Hedlund, L. W., Johnson, G. A. Micro-CT with respiratory and cardiac gating: Micro-CT with respiratory and cardiac gating. Med Phys. 31 (12), 3324-3329 (2004).
- Guo, X., Johnston, S. M., Qi, Y., Johnson, G. A., Badea, C. T. 4D micro-CT using fast prospective gating. Phys Med Biol. 57 (1), 257 (2011).
- Drangova, M., Ford, N. L., Detombe, S. A., Wheatley, A. R., Holdsworth, D. W. Fast retrospectively gated quantitative four-dimensional (4D) cardiac micro computed tomography imaging of free-breathing mice. Invest Radiol. 42 (2), 85-94 (2007).
- Blocker, S. J., Holbrook, M. D., Mowery, Y. M., Sullivan, D. C., Badea, C. T. The impact of respiratory gating on improving volume measurement of murine lung tumors in micro-CT imaging. PLoS One. 15 (2), e0225019 (2020).
- Bartling, S. H., et al. Retrospective motion gating in small animal CT of mice and rats. Invest Radiol. 42 (10), 704-714 (2007).
- Kuntz, J., et al. Fully automated intrinsic respiratory and cardiac gating for small animal CT. Phys Med Biol. 55 (7), 2069 (2010).
- Hahn, A., Sauppe, S., Lell, M., Kachelrieß, M. Automatic intrinsic cardiac and respiratory gating from cone-beam CT scans of the thorax region. SPIE Proc. Med Imaging. 9783, 200-205 (2016).
- Maes, F., Vandermeulen, D., Suetens, P. Medical image registration using mutual information. Proc IEEE. 91 (10), 1699-1722 (2003).
- Sheng, J., Chen, B., Ma, Y., Shi, Y. A novel reconstruction approach combining OSEM and split Bregman method for low dose CT. Biomedical Signal Processing and Control. 62, 102095 (2020).
- Romdhane, H., Cherni, M. A., Sallem, D. B. On the efficiency of OSEM algorithm for tomographic lung CT images reconstruction. 2016 Second International Image Processing, Applications and Systems (IPAS). , (2016).
- Ewald, A. J., Werb, Z., Egeblad, M. Monitoring of vital signs for long-term survival of mice under anesthesia. Cold Spring Harb Protoc. 2, 5563 (2011).
- Suckow, C., et al. Multimodality rodent imaging chambers for use under barrier conditions with gas anesthesia. Mol Imaging Biol. 11 (2), 100-106 (2009).
- Owen, M. . Practical signal processing. , 81 (2007).
- Feldkamp, L. A., Davis, L. C., Kress, J. W. Practical cone-beam algorithm. J Opt Soc Am. A-optics Image Sci Vision. 1 (6), 612-619 (1984).
- Loening, A. M., Gambhir, S. S. AMIDE: A free software tool for multimodality medical image analysis. Mol Imaging. 2 (3), 131-137 (2003).
- Rodriguez-Molares, A., et al. The generalized contrast-to-noise ratio: A formal definition for lesion detectability. IEEE Trans Ultrason Ferroelectr Freq Control. 67 (4), 745-759 (2020).
- Patterson, M. S., Foster, F. S. The improvement and quantitative assessment of B-mode images produced by an annular array/cone hybrid. Ultrason Imaging. 5 (3), 195-213 (1983).
- . Dragonfly 2022.2 Available from: https://www.theobjects.com/dragonfly (2022)
- Pillai, I. C. L., et al. Cardiac fibroblasts adopt osteogenic fates and can be targeted to attenuate pathological heart calcification. Cell Stem Cell. 20 (2), 218-232 (2017).
- Li, S., et al. A humanized monoclonal antibody targeting an ectonucleotidase rescues cardiac metabolism and heart function after myocardial infarction. Cell Rep Med. 5 (11), 101795 (2024).
- Nadkarni, R., Clark, D. P., Allphin, A. J., Badea, C. T. Investigating deep learning strategies for fast denoising of 5D cardiac photon-counting micro-CT images. Phys Med Biol. 69 (20), 205010 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены