JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
프로토타입 소형 동물 X-ray 컴퓨터 단층 촬영기를 사용한 후향적 심장 게이팅
요약
당사는 당사 연구 기관에서 설계 및 제작한 소형 동물 X선 컴퓨터 단층 촬영(CT) 스캐너 프로토타입인 CrumpCAT의 고유한 후향적 심장 게이팅 방법에 대한 포괄적인 설명을 제공합니다.
초록
CrumpCAT은 당사 연구 기관에서 개발한 소형 동물 X선 컴퓨터 단층 촬영(CT) 스캐너의 프로토타입입니다. 최대 프레임 속도가 29Hz인 CMOS 검출기와 50kVp에서 80kVp 범위의 에너지를 가진 유사한 텅스텐 X선 소스는 상업적으로 이용 가능한 전임상 X선 CT 기기에 널리 사용됩니다. 이것은 이러한 감지기가 마우스의 높은 심박수(~600회/분)를 게이팅하는 데 적합하지 않다는 일반적으로 인식되는 지혜에도 불구하고 설명된 작업을 다른 기관과 매우 관련성이 높게 만듭니다. 이 스캐너는 중(200μm) 및 고해상도(125μm) 이미징, 형광투시법, 후향적 호흡 게이팅 및 후향적 심장 게이팅 기능을 갖추고 있으며, 반복 또는 필터링된 프로젝션 이미지 재구성을 제공합니다. 이러한 기능 중 심장 게이팅은 호흡 및 심장 운동으로 인한 이미지 흐림을 효과적으로 제거하기 때문에 생체 내에서 심장 기능을 연구하는 데 가장 유용한 기능입니다.
여기에서는 생체 내 심장 기능 및 구조 분석에 대한 연구를 발전시키는 것을 목표로 하는 전임상 내적 후향적 심장 개폐식 CT 이미징 방법에 대해 설명합니다. Cardiac-Gating 방법은 가장 짧은 실제 노출 시간(~20ms)에서 많은 수의 투영을 획득한 다음 원시 투영 시퀀스의 시간적 변화에서 호흡 및 심장 신호를 소급하여 추출합니다. 이러한 신호는 호흡 주기의 높은 움직임 속도 흡기 단계에 속하는 돌기를 거부하고 나머지 돌기를 각각 심장 주기의 한 단계에 해당하는 12개의 그룹으로 나누는 데 사용됩니다. 각 그룹은 각 심장 단계에 대한 체적 이미지를 생성하기 위해 반복적인 방법을 사용하여 독립적으로 재구성되어 4차원(4D) 데이터 세트가 생성됩니다.
이러한 위상 이미지는 집합적으로 또는 개별적으로 분석할 수 있으므로 심장 기능을 자세히 평가할 수 있습니다. 우리는 대표적인 생체 내 이미징 결과를 통해 프로토타입 스캐너의 심장 게이팅 기능에 대한 두 가지 접근 방식의 효과를 입증했습니다.
서문
소동물 연구는 종종 X선 컴퓨터 단층 촬영(CT)과 함께 비침습적 이미징 양식의 조합을 사용하는데, 이는 성숙도, 비용 효율성, 속도 1,2 및 양전자 방출 단층 촬영(PET)2,3 및 단일 광자 방출 컴퓨터 단층 촬영(SPECT)2,4과 같은 다른 양식과 함께 보완 정보를 제공할 수 있는 능력으로 인해 탁월한 선택입니다. 그러나 다른 영상 기술과 마찬가지로 CT는 박동하는 심장이나 호흡으로 인한 생리적 운동 인공물에 취약하여 흐릿함을 유발하고 연구의 정확성을 제한합니다.
이러한 제한을 해결하기 위해 데이터 수집이 심장 또는 호흡 주기(또는 게이트)의 특정 단계와 동기화되는 게이팅 5,6,7,8로 알려진 기술을 통해 호흡기 및 심장 모션 블러링을 완화할 수 있습니다. 이를 달성하기 위한 한 가지 방법은 전향적 게이팅 3,6으로 알려져 있으며, 동물에 센서를 부착하여 호환 가능한 스캐너에 실시간 게이팅 신호를 제공하는 것입니다. 이 방법은 효과적이기는 하지만 노동 집약적이고 시간이 많이 소요되며, 특히 생쥐와 같은 작은 동물의 가슴과 발에 센서를 부착할 때 연구 규모가 제한됩니다. 대안적으로, 내재적 후향적 게이팅 7,9,10,11은 센서를 사용하지 않고 시계열 데이터를 획득하는 것을 포함하지만, 심장 또는 호흡 주기의 위상에 따라 결과를 소급적으로 정렬할 수 있는 데이터의 특징을 식별함으로써 수집한다. 이 접근 방식은 장래의 게이팅과 유사한 결과를 제공하지만 추가 하드웨어나 펄스 센서 부착에 수반되는 노력이 필요하지 않으므로 실험 프로토콜을 크게 단순화합니다.
전임상 심장 CT 이미징 방법에서는 내재적 후향적 게이팅을 사용하여 연속적인 프레임 사이에서 가장 중요한 변화를 보이는 X선 투영 영역의 진폭 변화로부터 호흡 및 심장 주기를 추출합니다. 이 과정을 용이하게 하기 위해, 마우스 흉부 템플릿은 Mutual Information12를 사용하여 첫 번째 후방 전방 돌기에 공동 등록됩니다. 템플릿이 배치되면 횡격막 근처의 창에 있는 픽셀 강도를 합산하여 대리 호흡 신호를 생성하고, 심근 근처의 픽셀 강도를 합산하여 대리 심장 신호를 유도합니다. 그런 다음 이러한 신호는 시간 도메인에서 대역 통과 필터링되고 데이터 세트의 각 프레임에는 호흡 및 심장 단계에 따라 분수 위상 번호(0과 1 사이)가 할당됩니다. 이를 통해 위상 값에 따라 투영을 선택하거나 거부할 수 있습니다. 일반적으로 호흡 주기의 말기-호기 단계(0.15 ≤ < 0.85)에 해당하는 프레임은 유지되고 움직임이 가장 두드러지는 흡기 단계의 프레임은 폐기됩니다. 나머지 프레임은 12개의 심장 단계로 그룹화되며, 각 위상은 심장 주기의 1/12(0.083)을 나타내며 반복 방법(OSEM[Ordered Subset Expectation Maximization])을 사용하여 3D 이미지로 재구성됩니다13,14. 전체 프로세스는 그림 1에 요약되어 있습니다.
프로토콜
동물 실험 프로토콜은 UCLA(University of California, Los Angeles)의 기관 동물 관리 및 사용 위원회(Institutional Animal Care and Use Committee)에서 검토 및 승인했습니다. C57BL/6J 마우스(생후 8주령, 수컷, 24-26g)가 이 프로토콜에 사용되었습니다. 이 연구에 사용된 CT 스캐너는 전임상 연구를 위해 당사 연구 기관에서 개발한 프로토타입인 CrumpCAT(그림 2)으로, 수집 및 재구성 프로토콜을 최적화하는 데 필요한 제어 및 유연성을 제공합니다. 이 방법은 마취된 마우스의 심박수가 600회/분 이하이고 호흡수가 20에서 180회/분15회 사이라고 가정합니다.
1. 장비 설정
- 200μA 연속 전류로 50kVp의 피크 전압에서 X선 소스를 작동합니다.
- X-ray 카메라 픽셀 비닝을 2로 설정하고 노출 시간을 가장 짧은 실제 값(20ms 노출 시간 더하기 14ms 읽기 시간 동안 총 샘플링 시간 34ms)으로 설정합니다.
참고: 비닝 없음 옵션(비닝 1)은 프레임 속도가 느리므로 게이트 획득에 사용할 수 없습니다. 최대 프레임 속도는 약 30프레임/초입니다.
2. 동물 준비
- 산소와 이소플루란 가스의 혼합물로 2.0% 농도의 마우스를 마취합니다.
- CT 영상 촬영 전에 10분 동안 동물을 마취 상태로 유지하여 활력 징후가 안정적인지 확인하고 동물이 스캔 중 신체 움직임을 피할 수 있도록 긴장을 풀도록 합니다. 손톱으로 발가락 사이의 웨빙을 단단히 꼬집을 때 발가락 핀치 반사가 부족하여 마우스의 마취 깊이를 판단합니다.
- 심장 개폐 영상에서 심실을 시각화하려면 CT 영상 촬영 직전에 꼬리 정맥을 통해 100μL의 CT 조영제를 정맥 주사합니다(그림 3A).
- 마취된 마우스를 CT 이미징 챔버 내부에 놓습니다(그림 3B).
3. 데이터 수집
- CrumpCAT 소프트웨어를 켭니다.
- 고해상도(125μm, 비닝 1)의 비게이트 CT 이미징(그림 4A)
- 사용자 인터페이스에서 스터디 ID를 입력합니다.
- Protocol 드롭다운 메뉴에서 Mouse Hi-Res 를 선택합니다.
- 사용자 인터페이스에서 Scan 버튼을 클릭하면 노출 시간이 80ms/프로젝션인 720개의 프로젝션을 획득할 수 있습니다.
- 중간 해상도(200μm, 비닝 2)의 비게이트 CT 이미징(그림 4B)
- 사용자 인터페이스에서 스터디 ID를 입력합니다.
- 프로토콜 드롭다운 메뉴에서 마우스 표준을 선택합니다.
- 사용자 인터페이스에서 Scan 버튼을 클릭하여 노출 시간이 100ms/프로젝션인 720개의 프로젝션을 획득합니다.
- 게이트 CT 이미징(200μm, 비닝 2)(그림 4C)
- 사용자 인터페이스에서 스터디 ID를 입력합니다.
- 프로토콜 드롭다운 메뉴에서 Cardiac Gating을 선택합니다.
- 사용자 인터페이스에서 스캔 버튼을 클릭하고 20ms/프로젝션의 노출 시간으로 21,600개의 프로젝션을 획득합니다.
4. 데이터 전처리
참고: 전처리 단계는 게이트 획득에만 필요합니다. 이러한 모든 단계는 재구성 소프트웨어에 의해 자동으로 수행되며 작업자의 개입이 필요하지 않습니다.
- 신호 추출
- 흉부 템플릿 공동 정합을 위해, 갈비뼈, 심장, 폐 및 간이 있는 쥐의 흉부를 거칠게 나타내는 작은 이미지(템플릿)가 프로젝션과 템플릿 사이의 상호 정보12 를 최대화하여 첫 번째 X-ray 프로젝션에 자동으로 공동 등록되도록 합니다(그림 5).
참고: 템플릿에서는 번역 작업만 수행되며 공동 등록된 템플릿은 모든 투영에서 관심 영역(ROI)을 식별하는 데 사용됩니다. - 호흡 신호 추출을 위해 템플릿에 직사각형 ROI(ROI-1)를 지정하여 횡격막을 나타내고 각 투영에 대해 ROI-1 내부의 픽셀 강도를 합산하여 호흡 신호를 생성할 수 있습니다(그림 5).
- 심장 신호 추출을 위해 심장 근처의 템플릿에 두 번째 직사각형 ROI(ROI-2)를 지정하고 각 투영에 대해 ROI-2의 픽셀 강도를 합산하여 생성된 심장 신호를 확인합니다(그림 5).
참고: 흉부 템플릿은 신호 추출에 사용해야 하는 이미지 행과 열(창)을 식별하기 위해 첫 번째 프로젝션에만 함께 등록됩니다. 그 창은 동물의 침대(16)를 사용할 때와 같이 동물이 합리적으로 중앙에 있는 한 모든 투영을 포함할 수 있을 만큼 충분히 넓습니다.
- 흉부 템플릿 공동 정합을 위해, 갈비뼈, 심장, 폐 및 간이 있는 쥐의 흉부를 거칠게 나타내는 작은 이미지(템플릿)가 프로젝션과 템플릿 사이의 상호 정보12 를 최대화하여 첫 번째 X-ray 프로젝션에 자동으로 공동 등록되도록 합니다(그림 5).
- 대역 통과 필터
- 대역 통과 필터가 시간 영역(17)에서 서로 다른 차단 주파수를 갖는 두 개의 Sinc 함수를 결합함으로써 생성될 수 있도록 하며, 이는 후술하는 바와 같이 주파수 영역에서의 저역 통과 필터에 대응한다.
- 소프트웨어가 [300, 600] min-1 의 주파수 대역을 사용하여 심장 신호에 대역 통과 필터를 적용하도록 합니다(그림 6A).
참고: 필터링되지 않은 심장 신호(그림 6B)에는 여전히 호흡 운동의 상당한 기여가 포함되어 있습니다. - 마찬가지로, [20, 300] min-1의 주파수 대역을 사용하여 호흡 신호를 필터링합니다. 더 높은 고조파는 단순히 사인파가 아닌 신호를 생성하기 위해 보존되며 두 가지 주요 단계, 즉 흡기 및 호기를 보다 명확하게 식별합니다.
참고: 이 시점에서 호흡 신호와 심장 신호는 모두 쉽게 보간될 수 있으며 분수 위상수를 계산하기 위해 연속적인 시간 함수로 간주될 수 있습니다.
- 단계 할당
- 소프트웨어가 신호의 1차 도함수의 제로 크로싱을 찾아 각 주기(호흡기 또는 심장)의 시작을 식별하도록 합니다. 각 제로 크로싱은 신호의 최대값에 해당하며 새 주기의 시작과 이전 주기의 끝을 표시합니다. 예를 들어 그림 7의 호흡 신호를 참조하십시오.
- 두 신호(호흡기 또는 심장) 각각에 대한 각 투영에 분수 위상 값(0과 1 사이)을 할당할 수 있습니다.
참고: 정의에 따라 시작점은 0(현재 주기의 경우) 또는 1(이전 주기의 경우)의 분수 위상 값을 갖습니다.
- 선택 마스크
- 12개의 이진 마스크(심장 단계당 하나)를 만들어 각 단계에 속하는 돌기를 선택하도록 합니다. 각 마스크에는 21,600개의 항목(프로젝션당 하나씩)이 포함되어 있으며, 이는 각각 해당 프로젝션을 거부하거나 유지하는 0 또는 1입니다.
- 각 마스크(위상)에 대해 소프트웨어가 분수 위상 번호에 따라 투영이 유지되는지(1) 또는 폐기되는지(0) 여부를 나타내는 것을 관찰합니다. 위상 0의 경우, [0, 1/12] 구간 내의 심장 위상 값이 있는 투영이 유지됩니다. 1단계의 경우 [1/12, 2/12] 간격의 심장 위상 값이 유지됩니다.
- 각 마스크(위상)에 대해 호흡 단계가 0.15 미만 또는 0.85보다 큰 투영은 가장 큰 움직임이 있는 흡기 단계에 속하기 때문에 거부됩니다(마스크에서 0). 그림 8B 는 처음 2초 동안의 투영에 대한 심장 위상 할당을 보여줍니다.
참고: 이 선택 과정에서는 위상당 투영 수가 1,800± 194로 비교적 일정했기 때문에 큰 편향이 도입되지 않았습니다.
5. 이미지 재구성
- 비게이트 CT 스캔의 경우, Shepp-Logan 필터와 함께 필터링된 역투영(Feldkamp18) 알고리즘을 사용하여 중간(200μm) 또는 고해상도(125μm)로 이미지를 재구성합니다.
- 심장 게이트 CT 스캔의 경우, 12개의 하위 세트와 8개의 반복이 있는 반복 OSEM 알고리즘13을 사용하여 각 심장 위상 이미지를 재구성하고, 주어진 위상에 기여하는 선택된 투영만 고려합니다(위상 선택 이진 마스크에 표시된 대로).
- 노이즈를 줄이려면 시간 차원(즉, 이미지 전체)에 재구성 후 중앙값 필터를 적용하고 공간 차원(σ = 38μm)에 가벼운 3D-가우스 필터를 적용합니다.
참고: 호흡기 게이트 이미지 재구성의 경우 모든 심장 단계를 불분명하게 사용하십시오. 빔 경화 보정(물 보정)은 모든 재건에 적용됩니다.
6. 이미지 평가 및 좌심실(LV) 부피 정량화
- DICOM 뷰어(예: Amide19 )에서 CT 이미지를 엽니다(그림 9A).
- CT 값(Hounsfield Unit [HU]로 측정) 범위를 [-500, 500]으로 설정하여 가시 이미지 대비를 향상시킵니다(그림 9A).
- 이미지 품질 평가
- CT 값이 최대 HU 값의 85% 이상인 최대 주변 영역으로 정의되는 석회화된 영역에 대한 ROI를 그립니다(그림 9B).
- CNR(contrast-to-noise ratio)20,21을 메트릭으로 사용하여 이미지 품질과 작은 석회화와 같은 작은 구조를 식별할 수 있는 능력을 평가합니다.
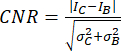 ,
,
여기서 I 와 σ 는 영역의 평균 강도와 표준 편차를 나타냅니다: 석회화(아래 첨자 C) 또는 배경(아래 첨자 B).
- 좌심실 부피 정량화
- 3D-Freehand ROI를 그려 각 단계에서 LV를 식별합니다(그림 10A).
- 임계값 CT 값이 730HU인 복셀을 계산하여 LV 부피를 정량화합니다(그림 10B). LV 부피의 플롯은 그림 10C에 나와 있습니다.
참고: CT 값 임계값은 절대적이지 않습니다. 사용된 조영제, 동물의 크기, 균주, 건강 상태, 주사와 CT 영상 사이의 시간에 따라 다릅니다. Amide는 본 연구소에서 개발한 무료 배포 소프트웨어이지만 다른 더 정교한 이미지 뷰어(예: ORS Dragonfly22)를 사용할 수 있습니다.
결과
먼저 생쥐(수컷, 30-32g)의 심장 석회화를 시각화하기 위해 비게이트 CT 이미지와 게이트 CT 이미지를 비교했습니다. 심장 석회화의 쥐 모델은 앞서 설명한 바와 같이 심장 조직의 급속한 동결-해동(cryo-injury)에 의해 심장 손상을 유도함으로써 만들어졌다23. 비게이트 CT 이미징 프로토콜을 통해 고해상도(125μm, binning 1) 이미지에서 심장 석회화를 보다 명확하...
토론
여기에 설명된 특정 하드웨어 구현은 우리 연구소 고유의 맞춤형 X-ray CT 시스템이지만, 특정 검출기는 상업적으로 이용 가능한 전임상 X-ray CT 기기에 널리 사용되므로 설명된 작업을 다른 기관과 관련이 있습니다. 이 시스템은 기능적으로 상업적으로 이용 가능하고 널리 사용되는 두 가지 생체 내 X선 microCT 서브 시스템이 내장되어 있는 프로토타입입니다
전임상...
공개
Richard Taschereau 박사는 Sofie Biosciences 및 Xodus Imaging의 컨설턴트입니다. Arion F. Chatziioannou 박사는 Sofie Biosciences의 설립자입니다.
감사의 말
UCLA Crump Preclinical Imaging Technology Center의 모든 구성원의 도움과 지원에 감사드립니다. 특히, 심장 CT 촬영을 위해 동물을 준비시킨 Mikayla Tamboline과 Isabel Day에게 감사를 표하고, 연구 기간 동안 좌심실 ROI를 일부 달성한 Sophie Shumilov에게 감사드립니다. 또한 심장 석회화 microCT 영상을 위한 급성 허혈성 심장 손상의 쥐 모델을 제공한 Arjun Deb 박사와 Yijie Wang 박사(UCLA)에게 감사드립니다. 이 연구는 NIH Cancer Center Support Grant(2 P30 CA016042-44)의 지원을 받습니다.
자료
| Name | Company | Catalog Number | Comments |
| C57BL/6J mice | Jackson Laboratory | 664 | Male, 8 weeks old, 24-26 g |
| Dexela camera | Varex | 1512 | Detector, 20 ms exposure, 74.8/149.6 µm pixel |
| VivoVist | Nanoprobes | 1301-5X0.25ML | CT Contrast agent |
| X-ray source | Moxtek | TUB00082 | 50 kV peak, 200 µA, 1.0 mm-thick Al filter |
참고문헌
- Schambach, S. J., Bag, S., Schilling, L., Groden, C., Brockmann, M. A. Application of micro-CT in small animal imaging. Methods. 50 (1), 2-13 (2010).
- Koba, W., Jelicks, L. A., Fine, E. J. MicroPET/SPECT/CT imaging of small animal models of disease. Am J Pathol. 182 (2), 319-324 (2013).
- Hutchins, G. D., Miller, M. A., Soon, V. C., Receveur, T. Small animal PET imaging. ILAR J. 49 (1), 54-65 (2008).
- Franc, B. L., Acton, P. D., Mari, C., Hasegawa, B. H. Small-animal SPECT and SPECT/CT: important tools for preclinical investigation. J Nucl Med. 49 (10), 1651-1663 (2008).
- Badea, C. T. H. L., Hedlund, L. W., Johnson, G. A. Micro-CT with respiratory and cardiac gating: Micro-CT with respiratory and cardiac gating. Med Phys. 31 (12), 3324-3329 (2004).
- Guo, X., Johnston, S. M., Qi, Y., Johnson, G. A., Badea, C. T. 4D micro-CT using fast prospective gating. Phys Med Biol. 57 (1), 257 (2011).
- Drangova, M., Ford, N. L., Detombe, S. A., Wheatley, A. R., Holdsworth, D. W. Fast retrospectively gated quantitative four-dimensional (4D) cardiac micro computed tomography imaging of free-breathing mice. Invest Radiol. 42 (2), 85-94 (2007).
- Blocker, S. J., Holbrook, M. D., Mowery, Y. M., Sullivan, D. C., Badea, C. T. The impact of respiratory gating on improving volume measurement of murine lung tumors in micro-CT imaging. PLoS One. 15 (2), e0225019 (2020).
- Bartling, S. H., et al. Retrospective motion gating in small animal CT of mice and rats. Invest Radiol. 42 (10), 704-714 (2007).
- Kuntz, J., et al. Fully automated intrinsic respiratory and cardiac gating for small animal CT. Phys Med Biol. 55 (7), 2069 (2010).
- Hahn, A., Sauppe, S., Lell, M., Kachelrieß, M. Automatic intrinsic cardiac and respiratory gating from cone-beam CT scans of the thorax region. SPIE Proc. Med Imaging. 9783, 200-205 (2016).
- Maes, F., Vandermeulen, D., Suetens, P. Medical image registration using mutual information. Proc IEEE. 91 (10), 1699-1722 (2003).
- Sheng, J., Chen, B., Ma, Y., Shi, Y. A novel reconstruction approach combining OSEM and split Bregman method for low dose CT. Biomedical Signal Processing and Control. 62, 102095 (2020).
- Romdhane, H., Cherni, M. A., Sallem, D. B. On the efficiency of OSEM algorithm for tomographic lung CT images reconstruction. 2016 Second International Image Processing, Applications and Systems (IPAS). , (2016).
- Ewald, A. J., Werb, Z., Egeblad, M. Monitoring of vital signs for long-term survival of mice under anesthesia. Cold Spring Harb Protoc. 2, 5563 (2011).
- Suckow, C., et al. Multimodality rodent imaging chambers for use under barrier conditions with gas anesthesia. Mol Imaging Biol. 11 (2), 100-106 (2009).
- Owen, M. . Practical signal processing. , 81 (2007).
- Feldkamp, L. A., Davis, L. C., Kress, J. W. Practical cone-beam algorithm. J Opt Soc Am. A-optics Image Sci Vision. 1 (6), 612-619 (1984).
- Loening, A. M., Gambhir, S. S. AMIDE: A free software tool for multimodality medical image analysis. Mol Imaging. 2 (3), 131-137 (2003).
- Rodriguez-Molares, A., et al. The generalized contrast-to-noise ratio: A formal definition for lesion detectability. IEEE Trans Ultrason Ferroelectr Freq Control. 67 (4), 745-759 (2020).
- Patterson, M. S., Foster, F. S. The improvement and quantitative assessment of B-mode images produced by an annular array/cone hybrid. Ultrason Imaging. 5 (3), 195-213 (1983).
- . Dragonfly 2022.2 Available from: https://www.theobjects.com/dragonfly (2022)
- Pillai, I. C. L., et al. Cardiac fibroblasts adopt osteogenic fates and can be targeted to attenuate pathological heart calcification. Cell Stem Cell. 20 (2), 218-232 (2017).
- Li, S., et al. A humanized monoclonal antibody targeting an ectonucleotidase rescues cardiac metabolism and heart function after myocardial infarction. Cell Rep Med. 5 (11), 101795 (2024).
- Nadkarni, R., Clark, D. P., Allphin, A. J., Badea, C. T. Investigating deep learning strategies for fast denoising of 5D cardiac photon-counting micro-CT images. Phys Med Biol. 69 (20), 205010 (2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유