需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用原型小动物 X 射线计算机断层扫描进行回顾性心脏门控
摘要
我们全面描述了 CrumpCAT 的内在回顾性心脏门控方法,CrumpCAT 是我们研究机构设计和制造的原型小动物 X 射线计算机断层扫描 (CT) 扫描仪。
摘要
CrumpCAT 是我们研究机构开发的小型动物 X 射线计算机断层扫描 (CT) 扫描仪原型。最大帧速率为 29 Hz 的 CMOS 探测器和能量范围为 50 kVp 至 80 kVp 的类似钨 X 射线源广泛用于市售的临床前 X 射线 CT 仪器。这使得所描述的工作与其他机构高度相关,尽管人们普遍认为这些探测器不适合控制小鼠的高心率(~600 次/分钟)。该扫描仪具有中等 (200 μm) 和高 (125 μm) 分辨率成像、透视、回顾性呼吸门控和回顾性心脏门控功能,具有迭代或滤波回投影图像重建功能。在这些特征中,心脏门控是研究 体内心脏功能最有用的特征,因为它有效地消除了由呼吸和心脏运动引起的图像模糊。
在这里,我们描述了我们的临床前回顾性心脏门控 CT 成像方法,旨在推进 体内 心脏功能和结构分析的研究。心脏门控方法在最短的实际曝光时间 (~20 ms) 获取大量投影,然后从原始投影序列的时间变化中回顾性地提取呼吸和心脏信号。这些信号用于拒绝属于呼吸周期高运动速率吸气阶段的投射,并将剩余的投射分为 12 组,每组对应于心动周期的一个阶段。使用迭代方法独立重建每组,以生成每个心脏相位的体积图像,从而产生四维 (4D) 数据集。
这些相位图像可以集体或单独分析,从而可以详细评估心脏功能。我们通过代表性的 体内 成像结果证明了原型扫描仪心脏门控功能的两种方法的有效性。
引言
小动物研究通常采用非侵入性成像方式的组合,其中 X 射线计算机断层扫描 (CT) 是一个突出的选择,因为它成熟、成本效益、速度 1,2,并且能够与其他方式(如正电子发射断层扫描 (PET)2,3 和单光子发射计算机断层扫描 (SPECT)2,4 一起提供互补信息.然而,与其他成像技术一样,CT 容易受到由跳动心脏或呼吸引起的生理运动伪影的影响,这会导致模糊并限制研究的准确性。
为了解决这一限制,可以通过一种称为门控 5,6,7,8 的技术来缓解呼吸和心脏运动模糊,其中数据采集与心脏或呼吸周期(或门)的特定阶段同步。实现这一目标的一种方法称为预期门控 3,6,涉及将传感器连接到动物身上,以向兼容的扫描仪提供实时门控信号。这种方法虽然有效,但费力且耗时,尤其是在将传感器连接到小鼠等小动物的胸部和爪子时,从而限制了研究规模。或者,内在回顾性门控 7,9,10,11 涉及在不使用传感器的情况下获取时间序列数据,而是通过识别数据中的特征,允许根据结果在心脏或呼吸周期中的阶段对结果进行回顾性排序。这种方法提供的结果与预期的门控相当,但不需要额外的硬件或脉冲传感器连接所涉及的工作,因此大大简化了实验方案。
在我们的临床前心脏 CT 成像方法中,我们利用内在回顾性门控从 X 射线投影中表现出最显着变化的区域的振幅变化中提取呼吸和心脏周期,这些区域在连续帧之间表现出最显着的变化。为了促进这一过程,使用互信息12 将小鼠胸部模板共同配准到第一个后前投影上。模板就位后,将隔膜附近窗口中的像素强度相加以产生替代呼吸信号,而将心肌附近的像素强度相加以得出替代心脏信号。然后,这些信号在时域中进行带通滤波,并根据其呼吸和心脏相位为数据集中的每个帧分配一个分数相位编号(介于 0 和 1 之间)。这允许根据相位值选择或拒绝投影。通常,与呼吸周期的呼气末期 (0.15 ≤ 期 < 0.85) 相对应的帧被保留,而来自运动最明显的吸气期的帧被丢弃。其余帧分为 12 个心相,每个心相代表心动周期的 1/12 (0.083),并使用迭代方法(有序子集期望最大化 [OSEM])13,14 重建为 3D 图像。整个过程总结如图 1 所示。
Access restricted. Please log in or start a trial to view this content.
研究方案
动物实验方案由加州大学洛杉矶分校 (UCLA) 机构动物护理和使用委员会审查和批准。该方案使用 C57BL/6J 小鼠 (8 周龄,雄性,24-26 g)。本研究中使用的 CT 扫描仪是 CrumpCAT(图 2),这是我们研究机构为临床前研究开发的原型,为我们提供了优化采集和重建方案所需的控制和灵活性。该方法假设麻醉小鼠的心率不超过 600 次/分钟,呼吸频率在 20 到 180 次呼吸/分钟之间15。
1. 设备设置
- 在 50 kVp 的峰值电压和 200 μA 的连续电流下运行 X 射线源。
- 将 X 射线相机像素合并设置为 2,并将曝光时间设置为其最短的实际值(20 毫秒曝光时间加上 14 毫秒读取时间,总采样时间为 34 毫秒)。
注意:无像素合并选项(像素合并 1)的帧速率较慢,因此不能用于门限采集。 最大帧速率 约为 30 帧/秒。
2. 动物准备
- 用 2.0% 浓度的氧气和异氟醚气体的混合物麻醉小鼠。
- 在 CT 成像前将动物麻醉 10 分钟,以确保生命体征稳定,并确保动物放松以避免在扫描过程中发生任何身体运动。通过用指甲用力捏住脚趾之间的蹼时是否缺乏脚趾捏反射来判断小鼠的麻醉深度。
- 为了使心脏门控成像可视化心腔,请在 CT 成像前立即通过尾静脉静脉注射 100 μL CT 造影剂(图 3A)。
- 将麻醉的鼠标放入 CT 成像室内(图 3B)。
3. 数据采集
- 打开 CrumpCAT 软件。
- 高分辨率的非门控 CT 成像(125 μm,分档 1)(图 4A)
- 在用户界面上输入 Study ID。
- 在 Protocol 下拉菜单中选择 Mouse Hi-Res。
- 单击用户界面上的 Scan 按钮可获取 720 个投影,曝光时间为 80 ms/投影。
- 中等分辨率的非门控 CT 成像(200 μm,分档 2)(图 4B)
- 在用户界面上输入 Study ID。
- 在 Protocol 下拉菜单中选择 Mouse Standard。
- 单击用户界面上的 Scan 按钮以 100 ms/投影的曝光时间获取 720 个投影。
- 门控 CT 成像(200 μm,分档 2)(图 4C)
- 在用户界面上输入 Study ID。
- 在 Protocol 下拉菜单中选择 Cardiac Gating。
- 单击用户界面上的 Scan (扫描) 按钮,以 20 ms/投影的曝光时间为 20 ms 获取 21,600 个投影。
4. 数据预处理
注意:只有门控采集才需要预处理步骤。所有这些步骤都由重建软件自动执行,无需作员干预。
- 信号提取
- 对于胸部模板共配准,通过最大化投影和模板之间的互信息12 ,让粗略表示小鼠胸部与肋骨、心脏、肺和肝脏的小图像(模板)自动共配准到第一个 X 射线投影上(图 5)。
注意:仅对模板执行转换作,并且共同注册的模板用于识别所有投影上的感兴趣区域 (ROI)。 - 对于呼吸信号提取,允许在模板中指定一个矩形 ROI (ROI-1) 来表示隔膜和呼吸信号,通过对每个投影的 ROI-1 内的像素强度求和来生成(图 5)。
- 对于心脏信号提取,让在靠近心脏的模板中指定第二个矩形 ROI (ROI-2),并通过将每个投影的 ROI-2 中的像素强度相加来生成心脏信号(图 5)。
注意:胸部模板仅在第一次投影上共同注册,以确定哪些图像行和列(窗口)应用于信号提取。只要动物合理居中,该窗口就足够宽,可以包含所有投影,就像使用我们的动物床16 时的情况一样。
- 对于胸部模板共配准,通过最大化投影和模板之间的互信息12 ,让粗略表示小鼠胸部与肋骨、心脏、肺和肝脏的小图像(模板)自动共配准到第一个 X 射线投影上(图 5)。
- 带通滤波器
- 允许通过在时间域17 中组合两个具有不同截止频率的 Sinc 函数来生成带通滤波器,这对应于频域中的低通滤波器,如下所述。
- 让软件使用 [300, 600] min-1 的频带对心脏信号应用带通滤波器(图 6A)。
注意:未过滤的心脏信号(图 6B)仍然包含来自呼吸运动的显着贡献。 - 同样,让呼吸信号使用 [20, 300] min-1 的频带进行过滤。保留较高的谐波以产生一个信号,该信号不仅仅是正弦信号,而是更清楚地识别两个主要阶段:吸气和呼气。
注意:此时,呼吸信号和心脏信号都可以很容易地插值,并考虑时间的连续函数,以计算分数相位数。
- 阶段分配
- 让软件通过查找信号一阶导数的零交叉点来识别每个周期(呼吸或心脏)的开始。每个过零点对应于信号中的最大值,并标志着新周期的开始和前一个周期的结束。有关示例,请参见 图 7 中的呼吸信号。
- 允许为两个信号(呼吸或心脏)中的每个信号的每个投影分配一个分数相位值(介于 0 和 1 之间)。
注:根据定义,起点的分数相位值为 0 (对于当前周期) 或 1 (对于前一个周期)。
- 选区蒙版
- 让我们创建 12 个二进制掩码(每个心脏相位一个)来选择属于每个阶段的投影。每个掩码包含 21,600 个条目(每个投影一个),这些条目要么是 0 要么是 1,分别表示拒绝或保留该投影。
- 对于每个掩模(相位),请注意软件是否根据其小数相位编号指示投影是保留 (1) 还是丢弃 (0)。对于阶段 0,将保留心脏相位值在区间 [0, 1/12] 内的投影。对于阶段 1,将保留区间 [1/12, 2/12] 内的心脏相位值,依此类推。
- 对于每个掩码(阶段),请注意,任何呼吸阶段小于 0.15 或大于 0.85 的投影都被拒绝(掩码中为 0),因为它们属于吸气阶段,该阶段具有最大的运动(图 8A)。 图 8B 显示了前 2 秒投影的心脏相位分配。
注意:此选择过程没有引入明显的偏差,因为每个阶段的投影数量相对恒定,为 1,800 ± 194。
5. 图像重建
- 对于非门控 CT 扫描,使用带有 Shepp-Logan 滤波器的过滤反向投影 (Feldkamp18) 算法以中等 (200 μm) 或高 (125 μm) 分辨率重建图像。
- 对于心脏门控 CT 扫描,使用迭代 OSEM 算法13 重建每个心脏相位图像,具有 12 个子集和 8 次迭代,仅考虑有助于给定相位的选定投影(如相位选择二进制掩码所示)。
- 为了减少噪声,在时间维度(即跨图像)应用重建后中值滤波器,在空间维度 (σ = 38 μm) 应用轻型 3D 高斯滤波器。
注意:对于呼吸门控图像重建,请模糊地使用所有心脏相位。梁硬化校正(水校正)应用于每次重建。
6. 图像评估和左心室 (LV) 体积量化
- 在 DICOM 查看器中打开 CT 图像,例如 Amide19 (图 9A)。
- 通过将 CT 值(以 Hounsfield 单位 [胡] 测量)范围设置为 [-500, 500] 来增强可见图像对比度(图 9A)。
- 图像质量评估
- 为钙化区域绘制 ROI,其定义为 CT 值大于或等于最大 胡 值的 85% 的最大值周围的区域(图 9B)。
- 使用对比度噪声比 (CNR)20,21 作为指标来评估图像质量及其识别小结构(如小钙化)的能力:
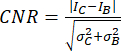 ,
,
其中 I 和 σ 表示区域的平均强度和标准差:钙化(下标 C)或背景(下标 B)。
- 左心室体积量化
- 绘制 3D 手绘 ROI 以识别每个阶段的 LV(图 10A)。
- 通过计算阈值 CT 值为 730 胡 的体素来量化 LV 体积(图 10B)。LV 体积图如图 10C 所示。
注意:CT 值阈值不是绝对的;这取决于所使用的造影剂、动物的大小、品系、健康状况以及注射和 CT 成像之间的时间。Amide 是我们研究所开发的免费分发软件,但也可以使用其他更复杂的图像查看器(例如,ORS Dragonfly22)。
Access restricted. Please log in or start a trial to view this content.
结果
我们首先比较了非门控和门控 CT 图像对小鼠 (雄性,30-32 g) 心脏钙化的可视化。如前所述,心脏钙化的小鼠模型是通过快速冻融心脏组织(冷冻损伤)诱导心脏损伤而创建的23。使用非门控 CT 成像方案,在高分辨率 (125 μm,分档 1) 图像上更清楚地识别心脏钙化(图 11A)。在中等分辨率 (200 μm,像素合并 2) 和高分辨率 (12...
Access restricted. Please log in or start a trial to view this content.
讨论
此处描述的特定硬件实现是我们研究所独有的定制 X 射线 CT 系统,但特定探测器广泛用于市售的临床前 X 射线 CT 仪器,使所描述的工作与其他机构相关。该系统在功能上是两个市售且广泛使用的 体内 X 射线 microCT 子系统的原型 嵌入
在临床前 PET/CT 扫描仪中。这些 microCT 扫描仪共享探测器架构和性能(像素大小、灵敏度、DQE、帧速率等)。其他几家体内 临床...
Access restricted. Please log in or start a trial to view this content.
披露声明
Richard Taschereau 博士是 Sofie Biosciences 和 Xodus Imaging 的顾问。Arion F. Chatziioannou 博士是 Sofie Biosciences 的创始人之一。
致谢
我们感谢 UCLA Crump 临床前成像技术中心的所有成员的帮助和支持。特别是,我们感谢 Mikayla Tamboline 和 Isabel Day 为动物准备心脏 CT 成像,并感谢 Sophie Shumilov 在研究期间产生一些左心室 ROI。我们还感谢 Arjun Deb 和 Yijie Wang 博士 (UCLA) 为心脏钙化 microCT 成像提供急性缺血性心脏损伤的小鼠模型。这项工作得到了 NIH 癌症中心支持补助金 (2 P30 CA016042-44) 的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| C57BL/6J mice | Jackson Laboratory | 664 | Male, 8 weeks old, 24-26 g |
| Dexela camera | Varex | 1512 | Detector, 20 ms exposure, 74.8/149.6 µm pixel |
| VivoVist | Nanoprobes | 1301-5X0.25ML | CT Contrast agent |
| X-ray source | Moxtek | TUB00082 | 50 kV peak, 200 µA, 1.0 mm-thick Al filter |
参考文献
- Schambach, S. J., Bag, S., Schilling, L., Groden, C., Brockmann, M. A. Application of micro-CT in small animal imaging. Methods. 50 (1), 2-13 (2010).
- Koba, W., Jelicks, L. A., Fine, E. J. MicroPET/SPECT/CT imaging of small animal models of disease. Am J Pathol. 182 (2), 319-324 (2013).
- Hutchins, G. D., Miller, M. A., Soon, V. C., Receveur, T. Small animal PET imaging. ILAR J. 49 (1), 54-65 (2008).
- Franc, B. L., Acton, P. D., Mari, C., Hasegawa, B. H. Small-animal SPECT and SPECT/CT: important tools for preclinical investigation. J Nucl Med. 49 (10), 1651-1663 (2008).
- Badea, C. T. H. L., Hedlund, L. W., Johnson, G. A. Micro-CT with respiratory and cardiac gating: Micro-CT with respiratory and cardiac gating. Med Phys. 31 (12), 3324-3329 (2004).
- Guo, X., Johnston, S. M., Qi, Y., Johnson, G. A., Badea, C. T. 4D micro-CT using fast prospective gating. Phys Med Biol. 57 (1), 257(2011).
- Drangova, M., Ford, N. L., Detombe, S. A., Wheatley, A. R., Holdsworth, D. W. Fast retrospectively gated quantitative four-dimensional (4D) cardiac micro computed tomography imaging of free-breathing mice. Invest Radiol. 42 (2), 85-94 (2007).
- Blocker, S. J., Holbrook, M. D., Mowery, Y. M., Sullivan, D. C., Badea, C. T. The impact of respiratory gating on improving volume measurement of murine lung tumors in micro-CT imaging. PLoS One. 15 (2), e0225019(2020).
- Bartling, S. H., et al. Retrospective motion gating in small animal CT of mice and rats. Invest Radiol. 42 (10), 704-714 (2007).
- Kuntz, J., et al. Fully automated intrinsic respiratory and cardiac gating for small animal CT. Phys Med Biol. 55 (7), 2069(2010).
- Hahn, A., Sauppe, S., Lell, M., Kachelrieß, M. Automatic intrinsic cardiac and respiratory gating from cone-beam CT scans of the thorax region. SPIE Proc. Med Imaging. 9783, 200-205 (2016).
- Maes, F., Vandermeulen, D., Suetens, P. Medical image registration using mutual information. Proc IEEE. 91 (10), 1699-1722 (2003).
- Sheng, J., Chen, B., Ma, Y., Shi, Y. A novel reconstruction approach combining OSEM and split Bregman method for low dose CT. Biomedical Signal Processing and Control. 62, 102095(2020).
- Romdhane, H., Cherni, M. A., Sallem, D. B. On the efficiency of OSEM algorithm for tomographic lung CT images reconstruction. 2016 Second International Image Processing, Applications and Systems (IPAS). , (2016).
- Ewald, A. J., Werb, Z., Egeblad, M. Monitoring of vital signs for long-term survival of mice under anesthesia. Cold Spring Harb Protoc. 2, 5563(2011).
- Suckow, C., et al. Multimodality rodent imaging chambers for use under barrier conditions with gas anesthesia. Mol Imaging Biol. 11 (2), 100-106 (2009).
- Owen, M. Practical signal processing. , Cambridge University Press. 81(2007).
- Feldkamp, L. A., Davis, L. C., Kress, J. W. Practical cone-beam algorithm. J Opt Soc Am. A-optics Image Sci Vision. 1 (6), 612-619 (1984).
- Loening, A. M., Gambhir, S. S. AMIDE: A free software tool for multimodality medical image analysis. Mol Imaging. 2 (3), 131-137 (2003).
- Rodriguez-Molares, A., et al. The generalized contrast-to-noise ratio: A formal definition for lesion detectability. IEEE Trans Ultrason Ferroelectr Freq Control. 67 (4), 745-759 (2020).
- Patterson, M. S., Foster, F. S. The improvement and quantitative assessment of B-mode images produced by an annular array/cone hybrid. Ultrason Imaging. 5 (3), 195-213 (1983).
- Dragonfly 2022.2. , Comet Technologies Canada Inc. https://www.theobjects.com/dragonfly (2022).
- Pillai, I. C. L., et al. Cardiac fibroblasts adopt osteogenic fates and can be targeted to attenuate pathological heart calcification. Cell Stem Cell. 20 (2), 218-232 (2017).
- Li, S., et al. A humanized monoclonal antibody targeting an ectonucleotidase rescues cardiac metabolism and heart function after myocardial infarction. Cell Rep Med. 5 (11), 101795(2024).
- Nadkarni, R., Clark, D. P., Allphin, A. J., Badea, C. T. Investigating deep learning strategies for fast denoising of 5D cardiac photon-counting micro-CT images. Phys Med Biol. 69 (20), 205010(2024).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。