このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
プロトタイプ小動物X線CTOによるレトロスペクティブ心臓ゲーティング
要約
私たちは、私たちの研究機関で設計および構築されたプロトタイプの小動物X線X線コンピューター断層撮影(CT)スキャナーであるCrumpCATの内因性レトロスペクティブ心臓ゲーティング法の包括的な説明を提供します。
要約
CrumpCATは、当研究所で開発された小動物用X線CTスキャナーの試作機です。最大フレームレートが29HzのCMOS検出器や、50kVpから80kVpの範囲のエネルギーを持つ同様のタングステンX線源は、市販の前臨床X線CT装置で広く使用されています。これにより、これらの検出器はマウスの高い心拍数(~600拍/分)のゲーティングには適していないという一般的に認識されている知恵にもかかわらず、説明された研究は他の機関に非常に関連性があります。このスキャナーは、中分解能(200μm)および高分解能(125μm)のイメージング、透視法、レトロスペクティブ呼吸ゲーティング、レトロスペクティブ心臓ゲーティングを特徴としており、反復またはフィルタリングされた投影画像再構成が可能です。これらの特徴の中で、心筋ゲーティングは、呼吸や心臓の動きによって引き起こされる画像のぼやけを効果的に排除するため、 in vivoでの心機能の研究に最も有用な特徴です。
ここでは、 in vivo 心機能および構造解析の研究を進めることを目的とした、前臨床の内因性レトロスペクティブ心筋同期CTイメージングの方法について説明します。心拍ゲーティング法は、最短の実用露光時間(~20 ms)で多数の投影を取得し、生の投影シーケンスの時間的変化から呼吸信号と心臓信号を遡及的に抽出します。これらの信号は、呼吸周期の高運動速度吸気フェーズに属する投影を拒否し、残りの投影を12のグループに分割し、それぞれが心周期の1つのフェーズに対応するために使用されます。各グループは、反復的な方法を使用して独立して再構築され、各心相の体積画像が生成され、4次元(4D)データセットが得られます。
これらの位相画像は、まとめてまたは個別に分析できるため、心機能の詳細な評価が可能になります。プロトタイプスキャナーの心臓ゲーティング機能の両方のアプローチの有効性を、代表的な in vivo イメージング結果を通じて実証しました。
概要
小動物研究では、非侵襲的なイメージングモダリティの組み合わせが採用されることが多く、X線コンピュータ断層撮影法(CT)は、その成熟度、費用対効果、速度1,2、および陽電子放出断層撮影法(PET)2,3や単一光子放出型コンピュータ断層撮影法(SPECT)2,4などの他のモダリティと並んで補完的な情報を提供する能力により、有力な選択肢となっています.しかし、他のイメージング技術と同様に、CTは心臓の鼓動や呼吸によって引き起こされる生理的な運動アーチファクトの影響を受けやすく、ぼやけを引き起こし、研究の精度を制限します。
この制限に対処するために、ゲーティング5、6、7、8と呼ばれる手法を使用して、データ取得を心筋または呼吸周期(またはゲート)の特定のフェーズと同期させることで、呼吸および心臓の動きのぼやけを軽減できます。これを達成するための1つのアプローチは、プロスペクティブゲーティング3,6として知られており、動物にセンサーを取り付けて、互換性のあるスキャナーにリアルタイムのゲーティング信号を提供することを含みます。この方法は効果的ですが、特にマウスなどの小動物の胸部や足にセンサーを取り付ける場合、労働集約的で時間がかかるため、研究の規模が制限されます。あるいは、内因性レトロスペクティブゲーティング7,9,10,11は、センサを使用せずに時系列データを取得することを含むが、心周期または呼吸周期における位相に基づいて結果を遡及的にソートすることを可能にするデータの特徴を特定することによって行われる。このアプローチでは、プロスペクティブゲーティングに匹敵する結果が得られますが、追加のハードウェアやパルスセンサーの取り付けに伴う労力は必要なく、したがって実験プロトコルが大幅に簡素化されます。
前臨床心臓CTイメージングの方法では、内因性レトロスペクティブゲーティングを利用して、連続するフレーム間で最も顕著な変化を示すX線投影領域の振幅変動から呼吸および心臓周期を抽出します。このプロセスを容易にするために、マウスの胸部テンプレートは、相互情報量12を用いて第1の後前方投影に共登録される。テンプレートが配置されると、横隔膜の近くのウィンドウのピクセル強度を合計して代理呼吸信号を生成し、心筋近くのピクセル強度を合計して代理心筋信号を導き出します。次に、これらの信号は時間領域でバンドパスフィルタリングされ、データセット内の各フレームには、呼吸期と心筋の位相に基づいて小数部の位相番号(0 から 1)が割り当てられます。これにより、位相値に従って投影を選択または拒否できます。通常、呼吸周期の終了-呼気期(0.15≤期<0.85)に対応するフレームは保持されますが、動きが最も顕著な吸気期のフレームは破棄されます。残りのフレームは、12の心相にグループ化され、各々は心周期の1/12(0.083)を表し、反復法(Ordered Subset Expectation Maximization[OSEM])13,14を用いて3D画像に再構成される。全体のプロセスを図 1 にまとめます。
プロトコル
動物実験プロトコルは、カリフォルニア大学ロサンゼルス校(UCLA)の施設動物管理および使用委員会によって審査され、承認されました。このプロトコルでは、C57BL/6Jマウス(8週齢、雄、24-26g)を使用しました。この研究で使用したCTスキャナーは、前臨床研究のために私たちの研究機関で開発されたプロトタイプであるCrumpCAT(図2)であり、取得および再構成プロトコルを最適化するために必要な制御と柔軟性を提供します。この方法は、麻酔をかけたマウスの心拍数が600拍/分以下で、呼吸数が20〜180呼吸/分であると仮定しています15。
1. 機器の設定
- X線源を50kVpのピーク電圧で200μAの連続電流で運転します。
- X 線カメラのピクセル ビニングを 2 に設定し、露光時間を実用最短の値 (露光時間 20 ミリ秒と読み取り時間 14 ミリ秒で、合計サンプリング時間 34 ミリ秒) に設定します。
注: ビニングなしオプション (ビニング 1) はフレーム レートが遅いため、ゲート集録には使用できません。 最大フレームレート は約 30フレーム/秒です。
2.動物の調理
- 酸素とイソフルランガスの混合物を2.0%濃度でマウスに麻酔します。
- CTイメージングの前に動物を10分間麻酔下に置いて、バイタルサインが安定していること、およびスキャン中の体の動きを避けるために動物がリラックスしていることを確認します。マウスの麻酔の深さは、指の爪で足の指の間のウェビングをしっかりとつまむときのつま先つまみ反射の欠如によって判断します。
- 心腔を視覚化するための心電図イメージングでは、CTイメージングの直前に尾静脈から100μLのCT造影剤を静脈内注射します(図3A)。
- 麻酔をかけたマウスをCTイメージングチャンバー内に置きます(図3B)。
3. データ取得
- CrumpCATソフトウェアの電源を入れます。
- 高分解能(125 μm、ビニング1)のノンゲートCTイメージング(図4A)
- ユーザーインターフェースにスタディIDを入力します。
- [プロトコル]ドロップダウンメニューで[マウス高解像度]を選択します。
- ユーザーインターフェースの「スキャン」ボタンをクリックすると、露光時間が80ms/プロジェクションで720個のプロジェクションを取得できます。
- 中分解能(200 μm、ビニング2)のノンゲートCTイメージング(図4B)
- ユーザーインターフェースにスタディIDを入力します。
- [プロトコル]ドロップダウンメニューで[マウス標準]を選択します。
- ユーザーインターフェースの「スキャン」ボタンをクリックすると、露光時間が100ms/プロジェクションで720のプロジェクションを取得できます。
- ゲートCTイメージング(200 μm、ビニング2)(図4C)
- ユーザーインターフェースにスタディIDを入力します。
- 「プロトコル」ドロップダウンメニューで「Cardiac Gating」を選択します。
- ユーザーインターフェースの「スキャン」ボタンをクリックし、露光時間20ms/プロジェクションで21,600個のプロジェクションを取得します。
4. データの前処理
注:前処理手順は、ゲート式集録の場合にのみ必要です。これらの手順はすべて、再構築ソフトウェアによって自動的に実行され、オペレーターの介入は必要ありません。
- 信号抽出
- 胸部テンプレートの共レジストレーションでは、肋骨、心臓、肺、肝臓を有するマウスの胸部を粗く表現した小さな画像(テンプレート)を、投影とテンプレートとの間の相互情報量12 を最大化して、最初のX線投影に自動的に共登録させる(図5)。
注: テンプレートに対しては平行移動操作のみが実行され、同時登録されたテンプレートは、すべての投影法で関心領域 (ROI) を特定するために使用されます。 - 呼吸信号の抽出では、各投影のROI-1内のピクセル強度を合計することにより、横膜と生成される呼吸信号を表す長方形のROI(ROI-1)をテンプレートで指定できます(図5)。
- 心電線の抽出では、心臓の近くのテンプレートで 2 つ目の四角形 ROI(ROI-2)を指定し、各投影法の ROI-2 のピクセル強度を合計して心電図を生成します(図 5)。
注: 胸部テンプレートは、信号抽出に使用する画像の行と列 (ウィンドウ) を識別するために、最初の投影でのみ共登録されます。その窓は、動物が適度に中央に配置されている限り、すべての投影を包含するのに十分な幅があり、それは私たちの動物用ベッド16を使用する場合の場合である。
- 胸部テンプレートの共レジストレーションでは、肋骨、心臓、肺、肝臓を有するマウスの胸部を粗く表現した小さな画像(テンプレート)を、投影とテンプレートとの間の相互情報量12 を最大化して、最初のX線投影に自動的に共登録させる(図5)。
- バンドパスフィルター
- 時間領域17 でカットオフ周波数が異なる 2 つの Sinc 関数 (以下で説明するように、周波数領域のローパス フィルターに対応する) を組み合わせてバンドパス フィルターを生成できるようにします。
- ソフトウェアで、[300, 600] min-1 の周波数帯域を使用して、心信号にバンドパスフィルタを適用します(図6A)。
注:フィルタリングされていない心臓信号(図6B)には、呼吸運動による大きな寄与がまだ含まれています。 - 同様に、呼吸信号を [20, 300] min-1 の周波数帯域を使用してフィルタリングします。高次高調波は、単に正弦波ではなく、吸気と呼気という2つの主要なフェーズをより明確に識別する信号を生成するために保持されます。
注:この時点で、呼吸信号と心臓信号の両方を容易に補間し、分数位相数を計算する目的で時間の連続関数と見なすことができます。
- フェーズの割り当て
- ソフトウェアに、信号の最初の導関数のゼロクロッシングを見つけることにより、各サイクル(呼吸器または心臓)の開始を識別させます。各ゼロクロッシングは信号の最大値に対応し、新しいサイクルの開始と前のサイクルの終了を示します。例については、 図 7 の呼吸信号を参照してください。
- 小数位相値 (0 から 1 の間) を 2 つの信号 (呼吸器または心臓) のそれぞれの各投影に割り当てることができます。
注: 定義上、開始点の小数位相値は 0 (現在のサイクルの場合) または 1 (前のサイクルの場合) です。
- 選択マスク
- 12 個のバイナリ マスク (心臓フェーズごとに 1 つ) を作成して、各フェーズに属する投影を選択します。各マスクには、0 または 1 の 21,600 エントリ (投影ごとに 1 つ) が含まれており、それぞれその投影を拒否または保持します。
- マスク (位相) ごとに、プロジェクションが保持 (1) されるか破棄 (0) されるかをソフトウェアが小数フェーズ番号に従って示していることを確認します。フェーズ 0 の場合、区間 [0, 1/12] に心筋フェーズ値を持つ投影が保持されます。フェーズ 1 では、間隔 [1/12、2/12] の心相値が保持されます。
- 各マスク(フェーズ)について、呼吸フェーズが0.15未満または0.85より大きい投影は、最大の動きを持つ吸気フェーズに属しているため、拒否されることに注意してください(マスクの0)(図8A)。 図8B は、最初の2秒間の予測への心臓相の割り当てを示しています。
注:この選択プロセスでは、フェーズごとの投影数が1,800±194と比較的一定であったため、有意なバイアスは導入されませんでした。
5. 画像の再構成
- ノンゲートCTスキャンの場合、Shepp-LoganフィルターとFilteredバックプロジェクション(Feldkamp18)アルゴリズムを使用して、中分解能(200 μm)または高分解能(125 μm)で画像を再構成します。
- 心同期CTスキャンの場合、反復OSEMアルゴリズム13を使用して、12のサブセットと8回の反復を使用して、特定のフェーズに寄与する選択された投影のみを考慮に入れて、各心臓フェーズ画像を再構築します(フェーズ選択バイナリマスクで示されているように)。
- ノイズを減らすには、時間次元 (つまり、画像全体) に再構成後メディアン フィルターを適用し、空間次元 (σ = 38 μm) に軽い 3D ガウス フィルターを適用します。
注:呼吸器同期画像再構成の場合は、すべての心相を不明瞭に使用してください。梁硬化補正(水質補正)は、すべての再構成に適用されます。
6. 画像評価と左心室(LV)容積定量化
- Amide19 などのDICOMビューアでCT画像を開きます(図9A)。
- CT値(ハウンズフィールドユニット[HU]で測定)の範囲を[-500、500]に設定して、可視画像のコントラストを強化します(図9A)。
- 画質評価
- 石灰化領域の ROI を描画します (これは、CT 値が最大 HU 値の 85% 以上の最大値の周囲の領域として定義されます (図 9B)。
- コントラスト対ノイズ比(CNR)20,21を指標として使用して、画像品質と、小さな石灰化などの小さな構造を識別する能力を評価します。
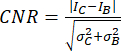 ,
,
ここで、 I と σ は、領域の平均強度と標準偏差を表します: 石灰化 (下付き文字 C) または背景 (下付き文字 B)。
- 左心室容積の定量化
- 3DフリーハンドROIを描画して、各フェーズのLVを特定します(図10A)。
- しきい値CT値が730HUのボクセルを計算することにより、LVボリュームを定量化します(図10B)。LV ボリュームのプロットを 図 10C に示します。
注: CT 値のしきい値は絶対値ではありません。使用する造影剤、動物の大きさ、菌株、健康状態、注射からCT撮影までの時間によって異なります。Amideは当研究所で開発されたフリー配布ソフトウェアですが、それ以外にもより高度な画像ビューア(ORS Dragonfly22など)が用意されています。
結果
まず、マウス(雄、30-32g)の心石灰化を視覚化するために、非ゲートCT画像とゲートCT画像を比較しました。心臓石灰化のマウスモデルは、前述のように、心臓組織の急速な凍結融解(凍結損傷)によって心臓損傷を誘発することによって作成された23。ノンゲートCTイメージングプロトコルでは、高解像度(125μm、ビニング1)画像(図11A
ディスカッション
ここで説明する特定のハードウェア実装は、当研究所独自のカスタムメイドのX線CTシステムですが、特定の検出器は市販の前臨床X線CT装置全体で広く使用されているため、説明されている作業は他の機関に関連しています。このシステムは、機能的には、市販され広く使用されている2つの in vivo X線マイクロCTサブシステムのプロトタイプです
前臨床PET / CT?...
開示事項
Richard Taschereau博士は、Sofie BiosciencesとXodus Imagingのコンサルタントです。アリオン・F・チャツィオアノウ博士は、ソフィー・バイオサイエンスの創設者です。
謝辞
UCLA Crump Preclinical Imaging Technology Centerのすべてのメンバーのご協力とご支援に感謝いたします。特に、心臓CTイメージングのための動物を準備してくれたMikayla Tamboline氏とIsabel Day氏、そして研究中に左心室のROIの一部を生成してくれたSophie Shumilov氏に感謝します。また、心臓石灰化マイクロCTイメージングのための急性虚血性心損傷のマウスモデルを提供してくださったArjun Deb博士とYijie Wang博士(UCLA)にも感謝します。この研究は、NIHがんセンター支援助成金(2 P30 CA016042-44)によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| C57BL/6J mice | Jackson Laboratory | 664 | Male, 8 weeks old, 24-26 g |
| Dexela camera | Varex | 1512 | Detector, 20 ms exposure, 74.8/149.6 µm pixel |
| VivoVist | Nanoprobes | 1301-5X0.25ML | CT Contrast agent |
| X-ray source | Moxtek | TUB00082 | 50 kV peak, 200 µA, 1.0 mm-thick Al filter |
参考文献
- Schambach, S. J., Bag, S., Schilling, L., Groden, C., Brockmann, M. A. Application of micro-CT in small animal imaging. Methods. 50 (1), 2-13 (2010).
- Koba, W., Jelicks, L. A., Fine, E. J. MicroPET/SPECT/CT imaging of small animal models of disease. Am J Pathol. 182 (2), 319-324 (2013).
- Hutchins, G. D., Miller, M. A., Soon, V. C., Receveur, T. Small animal PET imaging. ILAR J. 49 (1), 54-65 (2008).
- Franc, B. L., Acton, P. D., Mari, C., Hasegawa, B. H. Small-animal SPECT and SPECT/CT: important tools for preclinical investigation. J Nucl Med. 49 (10), 1651-1663 (2008).
- Badea, C. T. H. L., Hedlund, L. W., Johnson, G. A. Micro-CT with respiratory and cardiac gating: Micro-CT with respiratory and cardiac gating. Med Phys. 31 (12), 3324-3329 (2004).
- Guo, X., Johnston, S. M., Qi, Y., Johnson, G. A., Badea, C. T. 4D micro-CT using fast prospective gating. Phys Med Biol. 57 (1), 257 (2011).
- Drangova, M., Ford, N. L., Detombe, S. A., Wheatley, A. R., Holdsworth, D. W. Fast retrospectively gated quantitative four-dimensional (4D) cardiac micro computed tomography imaging of free-breathing mice. Invest Radiol. 42 (2), 85-94 (2007).
- Blocker, S. J., Holbrook, M. D., Mowery, Y. M., Sullivan, D. C., Badea, C. T. The impact of respiratory gating on improving volume measurement of murine lung tumors in micro-CT imaging. PLoS One. 15 (2), e0225019 (2020).
- Bartling, S. H., et al. Retrospective motion gating in small animal CT of mice and rats. Invest Radiol. 42 (10), 704-714 (2007).
- Kuntz, J., et al. Fully automated intrinsic respiratory and cardiac gating for small animal CT. Phys Med Biol. 55 (7), 2069 (2010).
- Hahn, A., Sauppe, S., Lell, M., Kachelrieß, M. Automatic intrinsic cardiac and respiratory gating from cone-beam CT scans of the thorax region. SPIE Proc. Med Imaging. 9783, 200-205 (2016).
- Maes, F., Vandermeulen, D., Suetens, P. Medical image registration using mutual information. Proc IEEE. 91 (10), 1699-1722 (2003).
- Sheng, J., Chen, B., Ma, Y., Shi, Y. A novel reconstruction approach combining OSEM and split Bregman method for low dose CT. Biomedical Signal Processing and Control. 62, 102095 (2020).
- Romdhane, H., Cherni, M. A., Sallem, D. B. On the efficiency of OSEM algorithm for tomographic lung CT images reconstruction. 2016 Second International Image Processing, Applications and Systems (IPAS). , (2016).
- Ewald, A. J., Werb, Z., Egeblad, M. Monitoring of vital signs for long-term survival of mice under anesthesia. Cold Spring Harb Protoc. 2, 5563 (2011).
- Suckow, C., et al. Multimodality rodent imaging chambers for use under barrier conditions with gas anesthesia. Mol Imaging Biol. 11 (2), 100-106 (2009).
- Owen, M. . Practical signal processing. , 81 (2007).
- Feldkamp, L. A., Davis, L. C., Kress, J. W. Practical cone-beam algorithm. J Opt Soc Am. A-optics Image Sci Vision. 1 (6), 612-619 (1984).
- Loening, A. M., Gambhir, S. S. AMIDE: A free software tool for multimodality medical image analysis. Mol Imaging. 2 (3), 131-137 (2003).
- Rodriguez-Molares, A., et al. The generalized contrast-to-noise ratio: A formal definition for lesion detectability. IEEE Trans Ultrason Ferroelectr Freq Control. 67 (4), 745-759 (2020).
- Patterson, M. S., Foster, F. S. The improvement and quantitative assessment of B-mode images produced by an annular array/cone hybrid. Ultrason Imaging. 5 (3), 195-213 (1983).
- . Dragonfly 2022.2 Available from: https://www.theobjects.com/dragonfly (2022)
- Pillai, I. C. L., et al. Cardiac fibroblasts adopt osteogenic fates and can be targeted to attenuate pathological heart calcification. Cell Stem Cell. 20 (2), 218-232 (2017).
- Li, S., et al. A humanized monoclonal antibody targeting an ectonucleotidase rescues cardiac metabolism and heart function after myocardial infarction. Cell Rep Med. 5 (11), 101795 (2024).
- Nadkarni, R., Clark, D. P., Allphin, A. J., Badea, C. T. Investigating deep learning strategies for fast denoising of 5D cardiac photon-counting micro-CT images. Phys Med Biol. 69 (20), 205010 (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved