A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
علاج السرطان الحراري البلازموني: أشباح تحاكي أنسجة الورم المضمنة في الجسيمات النانوية لتصور توزيع درجة الحرارة الحرارية الضوئية
In This Article
Summary
تقدم هذه المقالة بروتوكول إعداد أشباح أنسجة الورم التي تكرر الخصائص البصرية للعلاج الحراري الضوئي البلازموني. يفصل التحضير الوهمي ، والتقييمات الحرارية الضوئية ، والتحقق من صحة النموذج العددي المطور بناء على قياسات درجة الحرارة الحرارية الضوئية لتقييم المعلمات العلاجية ، مما يوفر بديلا أخلاقيا وفعالا من حيث التكلفة للدراسات في الجسم الحي للاختبار الأولي
Abstract
يتضمن العلاج الحراري البلازموني (PPTT) ، وهو علاج ناشئ للسرطان ، توصيل الجسيمات النانوية (NPs) إلى الورم ، متبوعا بالإشعاع بالأشعة تحت الحمراء القريبة (NIR) لتوليد حرارة موضعية تدمر الخلايا السرطانية. قبل إعطاء PPTT ، يجب تقدير المعلمات العلاجية - تركيز NP ، وشدة التشعيع ، والمدة -. لهذا ، يتم إجراء المحاكاة العددية. ومع ذلك ، لضمان حساب قوي ، يجب التحقق من صحة هذه المحاكاة من خلال التجارب الحرارية الضوئية على الأشباح التي تحاكي أنسجة الورم والتي تكرر الخصائص البصرية لأنسجة الورم. بالنسبة ل PPTT ، تخضع المعلمات العلاجية لتشتت وامتصاص الإشعاع الساقط بواسطة الأنسجة و NPs. لذلك ، يمكن إجراء تجارب التحقق من الصحة على الأشباح التي تحاكي معامل التشتت المنخفض (μثانية) ومعامل الامتصاص (μأ) للورم / الأنسجة المستهدفة.
على وجه التحديد ، يوفر هذا البروتوكول تعليمات لإعداد الأشباح التي تحاكي μ و μمن ورم الثدي المحقون بقضبان نانوية ذهبية ، محاطة بأنسجة الثدي الطبيعية. يوضح البروتوكول أيضا تفاصيل تشعيع الأشعة تحت الحمراء ، ومراقبة درجة الحرارة ، والتحقق من صحة النتائج العددية من خلال مقارنة درجات الحرارة الزمانية المكانية مع تلك المقاسة باستخدام المزدوجات الحرارية. سهلت البروتوكولات المقدمة في هذه الدراسة تحضير أشباح أنسجة ورم الثدي الأسطوانية القائمة على الهيدروجيل بأبعاد (φ40 × 12 مم) ومنطقة الورم المركزية (φ20 × 6 مم) ، والتي تتكون من 1٪ agarose كمصفوفة أساسية وداخل الدهون كمكون تشتت ومنطقة الورم المضمنة في قضبان نانوية ذهبية بتركيز 25 ميكروغرام / مل. توضح النتائج التمثيلية من دراسة حالة تطبيق الأشباح المصنعة للتحقق من صحة المحاكاة العددية ل PPTT. وخلصت الدراسة إلى أن البروتوكولات المثبتة ذات قيمة لإجراء تجارب حرارية ضوئية تهدف إلى تحسين وتخطيط المعلمات العلاجية قبل التجارب في الجسم الحي والتحقق من صحة المحاكاة العددية ل PPTT.
Introduction
العلاج الحراري البلازموني (PPTT) هو طريقة علاج موضعية ناشئة للسرطان تتضمن توصيل الجسيمات النانوية (NPs) إلى موقع الورم ، متبوعا بالإشعاع بالأشعة تحت الحمراء القريبة (NIR). عادة ما يتم إعطاء NPs عبر الطرق داخل الورم (IT) أو الوريد (IV)1. عند تشعيع الأشعة تحت الحمراء ، يؤدي التفاعل البلازموني للإشعاع الساقط و NPs إلى توليد حرارة موضعية على سطح NPs ، والتي تتبدد بعد ذلك في أنسجة الورم المحيطة2،3. يرفع هذا التسخين الموضعي درجة الحرارة في منطقة الورم ، مما يؤدي إلى موت الخلايا السرطانية من خلال الاستئصال الحراري4،5. يمكن تحقيق علاج فعال للسرطان من خلال الحفاظ على درجات حرارة محددة ، مثل 46 درجة مئوية لمدة 1 ساعة6 ، أو 50-52 درجة مئوية لمدة 4-6 دقائق7 ، أو 60 درجة مئوية للضرر الفوري8 عبر العمليات البيولوجية المختلفة.
تم استكشاف العديد من العوامل الحرارية الضوئية والإبلاغ عنها لتطبيق العلاج الحراري الضوئي ، وتم تقييم فعاليتها العلاجية من خلال الدراسات في المختبر أو في الجسم الحي . تشمل هذه العوامل المواد العضوية9 مثل الأصباغ القريبة من الأشعة تحت الحمراء (على سبيل المثال ، Indocyanine Green و IR780 و IR820) ، والعوامل الحرارية الضوئية القائمة على البوليمر (على سبيل المثال ، البولي دوبامين) ، والمواد غير العضوية10 ، بما في ذلك NPs القائمة على المعادن النبيلة أو NPs البلازمونية (على سبيل المثال ، NPs الذهبية) 11 ، الكبريت / الأكاسيد المعدنية الانتقالية12 ، و MXenes13. من بين هذه ، توفر NPs البلازمونية ، وتحديدا NPs الذهبية ، العديد من المزايا مقارنة بالعوامل الحرارية الضوئية التقليدية (على سبيل المثال ، الأصباغ) ، مثل استقرار حراري ضوئي أفضل ، وكفاءة تحويل حرارية ضوئية أعلى ، واستجابة بلازمونية قابلة للضبط من خلال اختلافات الشكل والحجم10. هذه السمات تجعل NPs الذهبية مرشحا مثاليا للعلاج الحراري الضوئي ، حيث يخضع بعضها حاليا للتجارب السريرية14.
لتحسين الفعالية العلاجية وضمان الضرر الحراري الكافي للورم أثناء PPTT ، من الضروري تقدير معلمات العلاج مثل جرعة NP (من حيث التركيز) ومعلمات إشعاع NIR (بما في ذلك شدة التشعيع ومدته) قبل التطبيق قبل السريري / السريري ل PPTT. عادة ما تستخدم المحاكاة العددية لإنشاء هذه المعلمات. تم تطوير طرق عددية مختلفة لتقييم الضرر الحراري داخل أنسجة الورم ، مع كون طريقة بولتزمان الشبكية أحد هذه الأساليب15،16. ومع ذلك ، لكي تكون هذه المحاكاة موثوقة ، يجب التحقق من صحتها باستخدام نظائر الأنسجة المعروفة باسم الأشباح التي تحاكي الأنسجة. يمكن تحضير هذه الأشباح لتكرار الخصائص البصرية أو الحرارية أو البيولوجية أو الميكانيكية للأنسجة الحقيقية ، وتكون بمثابة بدائل لإجراء الاختبارات الأولية وتقييم العلاج والتحقق من صحة الأجهزة أو المواد أو الأساليب المطورة حديثا المخصصة للتطبيقات البيولوجية17،18. يمكن أن يقلل هذا من المعاناة غير الضرورية للحيوانات أو البشر ويعالج المخاوف الأخلاقية المرتبطة بمثل هذهالتجارب 19،20.
يعتمد تصميم وتصنيع الشبح على التطبيق المقصود21. على سبيل المثال ، أثناء العلاجات الضوئية مثل PPTT ، تتأثر جرعة الإشعاع الساقط بكمية الضوء التي تمتصها أو تناثرها NPs والأنسجة22،23. لذلك ، يتم استخدام الأشباح البصرية التي تحاكي الخصائص البصرية ، وتحديدا معامل التشتت المنخفض (μثانية) ومعامل الامتصاص (μأ) للأنسجة البيولوجية ، لتقييمات PPTT والتحقق اللاحق من المحاكاة العددية24،25. تتكون الأشباح البصرية عادة من ثلاثة مكونات رئيسية: مصفوفة أساسية ، وعوامل تشتت ، وعوامل امتصاص17،26. تحتفظ المصفوفة الأساسية بمكونات التشتت والامتصاص بتركيزات مناسبة لتكرار الخصائص البصرية المطلوبة. يمكن تصنيف هذه الأشباح إلى أشباح صلبة وسائلة وشبه صلبة (هيدروجيل) ، اعتمادا على نوع المصفوفة الأساسية. بالنسبة للدراسات العلاجية الحرارية مثل PPTT ، يفضل استخدام أشباح الهيدروجيل ، وخاصة الأشباح القائمة على الاغاروز ، بسبب توافقها الحيوي ، والتشتت والامتصاص المتأصلين الضئيلين ، وعملية التصنيع البسيطة ، والمرونة التي يجب صبها في الأشكال والأحجام المرغوبة المقابلة لهندسةالورم 19،22. الأهم من ذلك ، يمكن استخدام الأشباح المحضرة القائمة على الاغاروز حتى ~ 70-80 درجة مئوية في درجات حرارة السائبة ، حيث أن درجة حرارة انصهار الأشباح من نوع الاغاروز هي ~ 80 درجة مئوية19. بالنسبة ل PPTT ، نظرا لأن نطاق درجة الحرارة ~ 50-80 درجة مئوية كاف ، يمكن استخدام هذه الأشباح القائمة على الاغاروز للتقييمات الحرارية الضوئية القائمة على PPTT.
تم تطوير العديد من الأشباح التي تحاكي الأنسجة القائمة على الهيدروجيل والإبلاغ عنها لتطبيقات مختلفة. طور Mustari et al. أشباح تحاكي الأنسجة القائمة على الاغاروز وأظهروا فائدتها في التحقق من صحة نظام بصري مصممحديثا 18. في دراسة أخرى ، تم إعداد الأشباح الحرارية التي تحاكي الأنسجة لقياس مدى الضرر الحراري أثناء العلاج بالموجات فوق الصوتية المركزة عالية الكثافة (HIFU)27. كما تم إعداد أشباح تحاكي الأنسجة القائمة على بولي أكريلاميد لتحليل تأثير التجويف أثناء علاج السرطان القائم على HIFU28. الهدف من هذه الدراسة هو إظهار طريقة خطوة بخطوة لتصنيع الأشباح التي تحاكي أنسجة الورم جنبا إلى جنب مع بروتوكول التجارب الحرارية الضوئية القائمة على الوهمية لتقييمات PPTT. يهدف هذا البروتوكول التفصيلي المقترح إلى تعزيز اعتماد وقابلية استنساخ التحضير الوهمي وطرق التجارب الحرارية الضوئية اللاحقة القائمة على الوهمية لاختبار الأداء الحراري الضوئي للهياكل النانوية المطورة حديثا ، وبالتالي التحقق من صحة عمليات المحاكاة العددية والمساعدة في التخطيط المسبق للمعالجة أو تحسين المعلمات العلاجية ل PPTT. تصف هذه المقالة بروتوكول تحضير وهمي مصمم خصيصا لأورام الثدي تحت السطح. ومع ذلك ، يمكن تكييف نفس الخطوات لتصنيع أنواع مختلفة من الأنسجة السرطانية (بأشكال وأحجام مختلفة) عن طريق تغيير تكوين عوامل الامتصاص والتشتت البصرية. على سبيل المثال ، تم استخدام التقييمات الحرارية الضوئية المستندة إلى الأنسجة الوهمية التي تحاكي الأنسجة في الدراسات التي تم الإبلاغ عنها سابقا للتحقق من صحة محاكاة PPTT لورم الساعد تحت السطح24 ، IDC تحت السطح25 ، وأورام الجلد29.
تصف هذه الورقة خطوات تحضير شبح بصري يحاكي μ ورم الثدي تحت السطح أو تحت الجلد ، وتحديدا سرطان الأقنية الغازية (IDC) ، الموجود على بعد 3 مم تحت سطح الجلد وتحيط به أنسجة الثدي الطبيعية. الشبح عبارة عن هندسة أسطوانية محضرة باستخدام الاغاروز كمصفوفة أساسية وداخل الدهون (IL) كعامل تشتت مضاف بتركيزات مناسبة لتقليد μ من أنسجة الثدي الطبيعية والسرطانية. Agarose ، هيدروجيل شفاف مع تشتت وامتصاص ضئيل ، هو مصفوفة أساسية مثالية للأشباح البصرية18،30. علاوة على ذلك ، يستخدم IL ، وهو مستحلب دهني بنسبة 20٪ يحاكي بنية الطبقة الثنائية لأغشية الخلايا ، على نطاق واسع كعامل تشتت31،32 وتم اختياره لهذه الدراسة لتكرار μ أنسجة الثدي الطبيعية والسرطانية. تم تصميم الشبح لتقليد ورم الثدي (IDC) المحقون بقضبان نانوية ذهبية (AuNRs) كNPs البلازمونية ، محاطة بأنسجة الثدي الطبيعية بدون AuNRs. من بين مختلف NPs الذهبية المستخدمة في PPTT ، تم اختيار AuNRs لهذه الدراسة نظرا لاستجابتها البلازمونية القوية في منطقة NIR واستخدامها على نطاق واسع في دراسات PPTT قبل السريرية ، بما في ذلك تلك التي تشمل مرضى والقطط14. يوضح البروتوكول تحضير نوعين من الأشباح: أحدهما يحتوي على ورم يتميز بتوزيع AuNR كما يظهر مع الحقن الوريدي والآخر مع ورم يعكس توزيع AuNR الذي تم تحقيقه عن طريق حقن تكنولوجيا المعلومات. باتباع بروتوكول التحضير الوهمي ، يتم وصف الإعداد التجريبي لتشعيع الأشعة تحت الحمراء وخطوات إجراء التقييمات الحرارية الضوئية على الأشباح. أخيرا ، يتم توفير دليل خطوة بخطوة لتفسير نتائج توزيع درجة الحرارة التي تم الحصول عليها من هذه التقييمات ومقارنة البيانات التجريبية بنتائج المحاكاة العددية. تساعد هذه المقارنة في التحقق من صحة طريقة عددية مطورة ، مما يتيح ضبط معلمات العلاج المثلى المصممة خصيصا للورم.
Protocol
ملاحظة: تم تحضير الأشباح باستخدام الاغاروز والدهون الداخلية بناء على التراكيب المبلغ عنها في الأدبيات لتحقيق الخصائص البصرية المطلوبة. لم يتم استخدام أي أنسجة بيولوجية حقيقية من المرضى أو الجثث. لذلك ، فإن إعداد هذه الأشباح خال من القيود الأخلاقية ولا يتطلب موافقة مستنيرة.
1. اختيار أو تصنيع قالب مناسب
- . اختيار قالب مناسب
- اختر قالبا يتناسب مع الشكل والأبعاد المطلوبة للأشباح. بالنسبة للأشباح الأسطوانية ذات منطقة الورم الموزعة بشكل موحد مع NPs ومحاطة بأنسجة طبيعية ، استخدم طبق بتري زجاجي ودورق صغير مثل القالب8 (الشكل 1 أ).
ملاحظة: هذه الخطوات مخصصة لإعداد الأشباح التي تحاكي أنسجة الورم في الهندسة الأسطوانية. بالنسبة للأشكال أو الأحجام الأخرى ، حدد قالبا مناسبا. إذا لم يتوفر قالب مناسب، فقم بتصنيع قالب باستخدام الطباعة ثلاثية الأبعاد (3D)، كما هو مفصل في الخطوة 1.2.
- اختر قالبا يتناسب مع الشكل والأبعاد المطلوبة للأشباح. بالنسبة للأشباح الأسطوانية ذات منطقة الورم الموزعة بشكل موحد مع NPs ومحاطة بأنسجة طبيعية ، استخدم طبق بتري زجاجي ودورق صغير مثل القالب8 (الشكل 1 أ).
- تصنيع القالب عن طريق الطباعة ثلاثية الأبعاد
- صمم نموذجا ثلاثي الأبعاد باستخدام برنامج التصميم بمساعدة الكمبيوتر (CAD) (على سبيل المثال ، SolidWorks أو Autodesk Inventor أو CATIA) وفقا للشكل والحجم المطلوبين. لاتباع هذا البروتوكول ، صمم أسطوانة مجوفة واحدة (القطر الداخلي 40 مم ، السماكة 2 مم ، والارتفاع 12 مم ؛ انظر الملف التكميلي 1) وقالبين أسطواني صلبين (الأبعاد φ20 × 6 مم و φ14 × 3 مم) ، كما هو موضح في الشكل 1 ب.
- لتصميم / صياغة الأسطوانة المجوفة ، في برنامج CAD ، قم بإنشاء دائرتين بأقطار 40 مم و 44 مم. ثم قم بثق الهندسة لمدة 12 مم.
- بالنسبة لقوالب الإخفاء الأسطوانية الصلبة ، قم بإنشاء دوائر بأقطار 20 مم و 14 مم ، ثم بثقها بطول 6 مم و 3 مم ، على التوالي (انظر الملف التكميلي 2 والملف التكميلي 3). ارسم مستطيلا (الجانبين 44 مم و 5 مم) على جانب واحد من الأسطوانة وقم ببثقه بمقدار 2 مم.
- قم بتحويل النماذج ثلاثية الأبعاد إلى تنسيق Gcode باستخدام برنامج متوافق مع طابعة ثلاثية الأبعاد (على سبيل المثال ، Cura) للطباعة.
- استخدم Gcode هذا لطباعة القوالب (على سبيل المثال ، هنا ، باستخدام حمض polylactic [PLA] φ1.75 مم ، 1 كجم من eSun) باستخدام طابعة ثلاثية الأبعاد.
ملاحظة: يتم رسم المستطيل لتعليق قوالب التقنيع. يمكن تصميم قوالب مختلفة وتصنيعها لإعداد الأشباح بالأشكال الأخرى المرغوبة.
- صمم نموذجا ثلاثي الأبعاد باستخدام برنامج التصميم بمساعدة الكمبيوتر (CAD) (على سبيل المثال ، SolidWorks أو Autodesk Inventor أو CATIA) وفقا للشكل والحجم المطلوبين. لاتباع هذا البروتوكول ، صمم أسطوانة مجوفة واحدة (القطر الداخلي 40 مم ، السماكة 2 مم ، والارتفاع 12 مم ؛ انظر الملف التكميلي 1) وقالبين أسطواني صلبين (الأبعاد φ20 × 6 مم و φ14 × 3 مم) ، كما هو موضح في الشكل 1 ب.
2. تحضير المحاليل الوهمية التي تحاكي أنسجة الورم25
ملاحظة: في هذه الدراسة ، يتم تحضير الأشباح البصرية القائمة على الاغاروز ذات الهندسة الأسطوانية التي تحاكي أنسجة الورم لتشبه ورم الثدي تحت السطح الذي يتم حقنه باستخدام AuNRs ، عن طريق تكنولوجيا المعلومات أو الحقن الوريدي ، كما هو موضح في الشكل 2. يحتوي شبح تكنولوجيا المعلومات على منطقتين: منطقة الورم المركزية مع AuNRs ومنطقة الأنسجة الطبيعية المحيطة. يحتوي الشبح الوريدي على ثلاث مناطق: منطقة ورم بها AuNRs في محيط الورم ، ومنطقة ورم مركزية عارية بدون AuNRs ، ومنطقة الأنسجة الطبيعية المحيطة. نظرا لأن الخصائص البصرية (μa و μ s') تختلف بالنسبة للورم والأنسجة الطبيعية ، يتم تحضير حلول وهمية منفصلة لكل منطقة لها تركيبات مختلفة وسيتم مناقشتها بشكل منفصل.
- تحضير محلول وهمي يحاكي أنسجة الثدي الطبيعية (الحل 1)
ملاحظة: سيتم استخدام هذا الحل لكل من أشباح تكنولوجيا المعلومات والوريد. يتم عرض خطوات التحضير للحل 1 في الشكل 3 أ.- احسب الحجم النظري للمحلول بناء على أبعاد القالب.
ملاحظة: هنا ، بالنسبة للقالب الأسطواني φ40 × 12 مم ، يكون الحجم المحسوب 15 سم3 أو 15 مل لكل شبح. نظرا لأنه يجب تحضير اثنين من هذه الأشباح ، فإن الحجم الإجمالي هو 15 مل × 2 ، أي 30 مل. لذلك ، قم بإعداد 35 مل من المحلول لحساب التبخر أو الانسكاب أثناء خطوة التحضير الوهمية. - احسب الكمية (الوزن / التركيز / الحجم) لجميع المكونات الوهمية - الاغاروز (كمادة أساسية) و IL (كمكون مبعثر) - لإضافتها إلى محلول 35 مل.
- أضف 0.35 جم من الاغاروز لتحضير 35 مل من المحلول المقابل لتركيز 1٪ وزن / حجم.
- تقدير تركيز IL المقابل ل μs المطلوبة من أنسجة الثدي الطبيعية (أي 10.1 سم -1 33) بناء على تركيز IL مقابل بيانات μ s المتوفرة في الأدبيات. بعد ذلك ، احسب حجم IL (مخزون مستحلب 20٪) لإضافته إلى المحلول الوهمي باستخدام المعادلة (1):
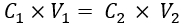 (1)
(1)
حيث C1 و V1 هما تركيز مخزون الكاشف (هنا 20٪ مخزون IL) وحجم محلول مخزون الكاشف المراد إضافته (هنا يتم حسابه) ، على التوالي. C2 هو التركيز المطلوب للكاشف (الذي يتم الحصول عليه من الأدبيات) في محلول العمل النهائي ، و V2 هو الحجم الكلي لمحلول العمل النهائي (هنا ، 35 مل).
ملاحظة: هنا ، بالنسبة ل μثانية من 10.1 سم -1 ، فإن تركيز IL المقدر من الأدبيات المبلغ عنها هو 1.04٪ 34،35. باستخدام الخطوات المذكورة أعلاه ، يبلغ حجم IL (20٪ مخزون IL) المراد إضافته 1.82 مل.
- يزن 0.35 غرام من agarose ويضاف إلى 33.18 مل من الماء منزوع الأيونات (DI) في دورق غطي الدورق بورق الألمنيوم لتجنب فقدان الماء.
- سخني الدورق الذي يحتوي على المحلول على طبق ساخن على حرارة 120 درجة مئوية مع التقليب حتى يصبح المحلول شفافا.
- اخفض درجة حرارة اللوح الساخن إلى 60 درجة مئوية. بعد 15 دقيقة ، أضف 1.82 مل من IL مع التحريك. احتفظ بالمحلول الناتج ، الحل 1 ، تحت التحريك عند 60 درجة مئوية حتى الاستخدام (جاهز للصب).
ملاحظة: يجب حفظ المحلول الوهمي عند 60 درجة مئوية في ظروف التحريك. خلاف ذلك ، فإنه يؤدي إلى تصلب المحلول.
- احسب الحجم النظري للمحلول بناء على أبعاد القالب.
- تحضير محلول شبح الورم المضمن في AuNR (الحل 2)
ملاحظة: سيتم استخدام هذا الحل لكل من أشباح تكنولوجيا المعلومات والوريد. يتم عرض خطوات تحضير الحل 2 في الشكل 3 ب.- احسب حجم منطقة الورم المراد ملؤها (φ20 × 6 مم).
ملاحظة: الحجم التقريبي لاثنين من أشباح الورم هو 3.8 مل. لذلك ، سيكون حجم المحلول المراد تحضيره 4.5 مل. - احسب كمية المكونات الوهمية للورم المراد إضافتها - agarose و IL و AuNRs - باستخدام خطوات مماثلة كما هو مذكور في القسم 2.1.
- أضف 45 مجم لتحضير 4.5 مل من المحلول المقابل لتركيز وزن / حجم 1٪.
- IL: μثانية من ورم الثدي هو 4.6 سم -1 33 ولتقليد نفس الشيء ، فإن تركيز IL المقابل المطلوب هو 0.472٪ 34،35. لذلك ، أضف 106.2 ميكرولتر من IL من 20٪ مخزون IL إلى 4.5 مل من محلول شبح الورم.
- التركيز المطلوب ل AuNRs في الشبح هو 25 ميكروغرام / مل. لتحقيق نفس الشيء ، أضف 3.21 مل من محلول AuNRs (تركيز المخزون: 35 ميكروغرام / مل) إلى محلول شبح الورم.
- أضف 45 ملغ من الاغاروز إلى 1.18 مل من ماء DI في دورق وقم بتغطيته بورق الألمنيوم.
- ضع الدورق على طبق ساخن وحركه على حرارة 120 درجة مئوية حتى يصبح المحلول شفافا.
- اخفض درجة حرارة اللوح الساخن إلى 60 درجة مئوية واترك المحلول لمدة 15 دقيقة.
- أضف 106.2 ميكرولتر من IL و 3.21 مل من تعليق AuNR (35 ميكروغرام / مل) في ظروف التحريك. احتفظ بالمحلول الناتج ، المحلول 2 ، تحت التحريك عند 60 درجة مئوية حتى الصب.
- احسب حجم منطقة الورم المراد ملؤها (φ20 × 6 مم).
- تحضير محلول وهمي للورم العاري (بدون AuNRs) (الحل 3)
ملاحظة: سيتم استخدام هذا الحل للشبح الوريدي فقط. يتم عرض خطوات تحضير الحل 2 في الشكل 3 ج.- احسب الحجم النظري للتعليق المراد إضافته لإنشاء منطقة ورم عارية (~ φ20 × 6 مم).
ملاحظة: الحجم التقريبي لأشباح الورم هو 1.9 مل. لذلك ، سيكون حجم المحلول المراد تحضيره 2.5 مل. - احسب كمية المكونات الوهمية للورم المراد إضافتها - agarose و IL باستخدام خطوات مماثلة كما هو مذكور في القسم 2.1.
- أضف 25 ملغ من الاغاروز لتحضير 2.5 مل من المحلول لتحقيق تركيز 1٪ وزن / حجم.
- IL: μثانية من ورم الثدي هو 4.6 سم -1 33 ولتقليد نفس الشيء ، فإن تركيز IL المقابل المطلوب هو 0.472٪ 34،35. أضف 59 ميكرولتر من مخزون IL 20٪.
- أضف 25 ملغ من الاغاروز إلى 2.44 مل من ماء DI في دورق وقم بتغطيته بورق الألمنيوم.
- ضعي الدورق على طبق ساخن وقلبي على حرارة 120 درجة مئوية حتى يصبح المحلول شفافا.
- اخفض درجة حرارة اللوح الساخن إلى 60 درجة مئوية واترك المحلول لمدة 15 دقيقة.
- أضف 59 ميكرولتر من IL إلى المحلول تحت ظروف التحريك. احتفظ بالمحلول الناتج ، الحل 3 ، تحت ظروف التحريك عند 60 درجة مئوية حتى الصب.
- احسب الحجم النظري للتعليق المراد إضافته لإنشاء منطقة ورم عارية (~ φ20 × 6 مم).
3. تحضير شبح الأنسجة الورمية24،25،36
- تحضير القوالب لخطوة الصب. لهذا الغرض ، أغلق الجزء السفلي من القوالب الأسطوانية بالبارافيلم وضع قالب التقنيع (φ20 × 6 مم) في المنتصف.
- صب المحلول 1 في القوالب الأسطوانية حتى العلامة العلوية لقالب الإخفاء واتركه يتجمد (الشكل 4 أ).
- بعد التصلب ، قم بإزالة قالب الإخفاء لإنشاء تجويف لمنطقة الورم (الشكل 4 ب).
ملاحظة: سيكون البروتوكول هو نفسه لكل من أشباح تكنولوجيا المعلومات والوريد حتى الخطوة 3.3. ستتم مناقشة العملية بشكل منفصل لتكنولوجيا المعلومات والأشباح الوريدية بعد الخطوة 3.3. - شبحتكنولوجيا المعلومات 24,25,36
- املأ التجويف بالمحلول 2 واتركه يتجمد (الشكل 4 ج).
- أضف الحل 1 إلى الجزء العلوي من الشبح واتركه يتجمد تماما (الشكل 4 د).
- IV الوهمي24،25
- أدخل قالب إخفاء أصغر (φ14 × 3 مم) واملأ التجويف المحيط به بالمحلول 2 (الشكل 4E).
- بعد التصلب ، قم بإزالة القالب الأصغر واملأ التجويف المتبقي بالمحلول 3 (الشكل 4F).
- أضف الحل 1 إلى الأعلى واسمح بالتصلب الكامل (الشكل 4G).
4. إدخال المزدوجات الحرارية داخل الشبح24،25،36
ملاحظة: لمراقبة توزيع درجة الحرارة المكانية ، يتم إدخال المزدوجات الحرارية من النوع K داخل الشبح في مواقع شعاعية (r) ومحورية (z) مختلفة ، كما هو موضح في الشكل 2. لإدخال المزدوجات الحرارية في مواقع دقيقة ، يتم استخدام الشعيرات الدموية الزجاجية كأدلة لضمان الدقة. يشار إلى مواقع المزدوجة الحرارية على أنها (ص ، ض) ، حيث تعمل نقطة المنتصف على السطح العلوي للورم على عمق z = 3 مم كنقطة مرجعية لكل من أشباح تكنولوجيا المعلومات والوريد ويتم تعيينها على أنها (0 ، 3) ، كما هو موضح في الشكل 2 أ ، ب. عند اختيار المواقع الشعاعية والمحورية لتحديد الضرر الحراري في منطقة الورم ، فإن المواقع الموجودة في محيط الورم (الشعاعي والمحوري) أمر بالغ الأهمية. يضمن تحقيق درجات الحرارة المطلوبة في هذه النقاط الطرفية أثناء تشعيع الرنين النيجيري استئصال الورم بالكامل. وبالتالي ، يتم وضع المزدوجات الحرارية في نقاط قصوى شعاعية (من الورم) عند z = 3 و 9 مم ، أي (10 ، 3) و (10 ، 9) ، ويتم وضع مزدوج حراري واحد في واجهة الأنسجة السرطانية الورمية عند z = 9 مم (الموقع المحوري المحيطي) ، أي (0 ، 9) كما هو موضح في الشكل 2 أ ، ب. بالإضافة إلى ذلك ، لتقييم توزيع درجة الحرارة المحورية ، يتم إدخال مزدوج حراري بين المواقع (0 ، 3) و (0 ، 9) ، تم تعيينه على أنه (0 ، 6). أخيرا ، لتقييم ارتفاع درجة الحرارة في منطقة الأنسجة السليمة المحيطة ، يتم إدخال مزدوج حراري واحد عند (15 ، 3).
- قم بقص الشعيرات الدموية الزجاجية إلى أطوال مناسبة بحيث تصل إلى المواقع الشعاعية والمحورية المرغوبة داخل الشبح.
- أدخل المزدوجات الحرارية داخل هذه الشعيرات الدموية الزجاجية وقم بثقبها في مواقع شبح شعاعية ومحورية محددة واحدة تلو الأخرى.
- بمجرد وضع جميع المزدوجات الحرارية في مكانها ، ضع الشبح بعناية في طبق بتري زجاجي لإشعاع NIR اللاحق ، كما هو موضح في الشكل 5 أ.
5. التعرض للإشعاع NIR وقياس درجات الحرارة الحرارية الضوئية الناتجة36
- ضع طبق بتري الزجاجي الذي يحتوي على الشبح (يتم إدخاله باستخدام مزدوجات حرارية) بحيث تكون المنطقة المركزية من السطح العلوي للشبح متعامدة مع طرف الألياف الضوئية لمصدر ضوء NIR ، كما هو موضح في الشكل 5 أ.
ملاحظة: يمكن ضبط قطر الشعاع على السطح الوهمي عن طريق تغيير المسافة بين السطح وطرف الألياف الضوئية. هنا ، يتم الاحتفاظ بمسافة 9 مم لتحقيق قطر شعاع 20 مم ، يغطي منطقة الورم المركزية. - قم بتوصيل نظام الحصول على البيانات (DAQ) بالكمبيوتر وافتح برنامج LabVIEW.
- قم بتشغيل مصدر ضوء NIR (الشكل 5 ب) وزر التشغيل في البرنامج في وقت واحد لتسجيل بيانات درجة الحرارة في بداية التشعيع.
- قم بإشعاع الشبح لمدة 20 دقيقة ، ثم قم بإيقاف تشغيل مصدر ضوء NIR وأوقف التسجيل.
- ارسم بيانات درجة الحرارة المسجلة مقابل الوقت.
6. مقارنة درجة الحرارة مع نتائج المحاكاة24،25
ملاحظة: تتكرر التجارب بشكل عام ، ويتم تسجيل درجات الحرارة على فترات زمنية محددة في جميع مواقع المزدوجات الحرارية. للتحقق من الصحة، يتم تنفيذ الخطوات التالية:
- احسب المتوسط والانحراف المعياري لدرجات الحرارة التجريبية في جميع مواقع المزدوجات الحرارية (r ، z).
- احسب درجات الحرارة في مواقع المزدوجات الحرارية المدروسة عدديا.
- ارسم متوسط درجة الحرارة التي تم الحصول عليها من التجارب ودرجة الحرارة التي تم الحصول عليها عن طريق المحاكاة في جميع مواقع المزدوجات الحرارية فيما يتعلق بالوقت ، كما هو موضح في الشكل 6.
- احسب جذر متوسط الخطأ التربيعي (RMSE) ومتوسط الخطأ المطلق (MAE) لجميع مواقع المزدوجات الحرارية لتحديد الفرق في درجة الحرارة لتقييم التحقق ، كما هو موضح في الجدول 1.
ملاحظة: يتم حساب MAE و RMSE باستخدام المعادلتين 2 و 3 ، على التوالي.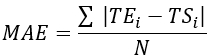 (2)
(2)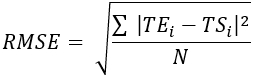 (3)
(3)
حيث TE، TS، و N هي درجة الحرارة التي تم الحصول عليها تجريبيا، ودرجة الحرارة المحسوبة عدديا، وعدد نقاط البيانات (هنا، يتم تسجيل درجات الحرارة كل ثانية لمدة 20 دقيقة؛ وبالتالي = 1,200)، على التوالي. أنا يمثل اللحظات الزمنية.
النتائج
يوضح الشكل 6 متوسط درجات الحرارة الزمنية التي تم الحصول عليها أثناء التجارب باستخدام شبح الأنسجة السرطانية المضمن في AuNR في جميع مواقع المزدوجات الحرارية ، كما هو موضح في الشكل 2 ، مقارنة بدرجات الحرارة التي تم الحصول علي...
Discussion
تقدم هذه الورقة بروتوكول تحضير الأنسجة السرطانية القائمة على الاغاروز التي تحاكي الأشباح البصرية. تم تصميم الأشباح بطريقة تحاكي الخصائص البصرية للورم والأنسجة الطبيعية لاستخدامها في دراسات PPTT. في هذه الدراسة ، يتم تسليط الضوء على تطبيق هذه الأشباح للتحقق من صحة الطرق ?...
Disclosures
ليس لدى المؤلفين مصالح متنافسة للإفصاح عنها.
Acknowledgements
أجريت هذه الدراسة دون أي دعم مالي من أي هيئات تمويل عامة أو تجارية أو غير ربحية. يقر المؤلفون بمنظمة CSIR-Central Scientific Instruments Organization ، شانديغار ، الهند ، للبنية التحتية والدعم.
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | 9012-36-6 | Base matrix for phantoms |
| Deionized (DI) water (18.2 MΩ) | NA | NA | Solvent for the preparation of phantom solutions |
| Gold nanorods (AuNRs) | Nanopartz | A12-10-808 | Plasmonic nanoparticles |
| Intralipid (20% emulsion stock) | Sigma-Aldrich | 68890-65-3 | Scattering agent of phantoms |
| Parafilm | Parafilm M | 380020 | To seal the bottom of cylindrical mold |
| Polylactic acid filament | eSun | NA | Material for molds (1.75 mm dia wire) |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| 3D Printer | Creality | Ender-3 | For printing molds |
| Data acquisition (DAQ) system | National Instruments | cDAQ-9171 | For recording temperatures |
| DI water unit | Merck Millipore | Direct-Q3 | For DI water |
| Hot plate with magnetic stirrer | IKA | C-MAG HS 4 | For phantom solutions preparation |
| NIR light source | NA (In-house developed) | NA | For NIR irradiation of phantoms, (800/50 nm; Center wavelength: 800 nm, Bandwidth: 50 nm) |
| Optical Fiber (1/2" × 12") | Edmund Optics | 38-659 | For NIR irradiation of phantoms |
| Type K thermocouples | RS Components | RS Pro 397-1589 | For temperature monitoring at various phantom locations during NIR irradiation |
| Weighing Balance | Wensar | PGB 200 | For weighing agarose |
| Name of Software | Company | Catalog Number | Comments/Description |
| Autodesk Inventor 2021 | Autodesk | NA | For mechanical designing of molds |
| Cura 5.7 | Ultimaker | NA | For converting mechanical design to Gcode for 3D printing |
| Matlab R2024b | MathWorks | NA | For numerical simulations and temperature data plots |
| Name of Labwares used | Company | Catalog Number | Comments/Description |
| Beakers (50 mL) | Borosil | 1000D12 | For phantom solution preparations |
| Beakers (10 mL) | Borosil | 1000006 | For phantom solution preparations |
| Pipette (100-1000 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 063 | For adding constituents into the phantom solution |
| Pipette (10-100 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 047 | For adding constituents into the phantom solution |
| Spatula | Borosil | LASC8888M06 | For weighing agarose and demolding the phantoms from the molds |
| Tips (100-1000 µL) | Tarsons | 521016 | For adding constituents into the phantom solution |
| Tips (10-100 µL) | Tarsons | 521010Y | For adding constituents into the phantom solution |
References
- Riley, R. S., Day, E. S. Gold nanoparticle-mediated photothermal therapy: applications and opportunities for multimodal cancer treatment. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (4), e1449 (2017).
- Webb, J. A., Bardhan, R. Emerging advances in nanomedicine with engineered gold nanostructures. Nanoscale. 6 (5), 2502-2530 (2014).
- Abadeer, N. S., Murphy, C. J. Recent progress in cancer thermal therapy using gold nanoparticles. J Phys Chem C. 120 (9), 4691-4716 (2016).
- Murphy, C. J., et al. Virus-sized gold nanorods: Plasmonic particles for biology. Acc Chem Res. 52 (8), 2124-2135 (2019).
- Overchuk, M., Weersink, R. A., Wilson, B. C., Zheng, G. Photodynamic and photothermal therapies: Synergy opportunities for nanomedicine. ACS Nano. 17 (9), 7979-8003 (2023).
- Goldberg, S. N., Gazelle, G. S., Mueller, P. R. Thermal ablation therapy for focal malignancy. Am J Roentgenol. 174 (2), 323-331 (2000).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Role of optical coefficients and healthy tissue-sparing characteristics in gold nanorod-assisted thermal therapy. Int J Hyperth. 29 (1), 87-97 (2013).
- Khurana, D., Vikas, A. K., Shaw, S., Soni, Polydopamine coated gold nano blackbodies for tumor-selective spatial thermal damage during plasmonic photothermal cancer therapy. IEEE Trans Nanobiosci. 21 (4), 482-489 (2021).
- Jung, H. S., Verwilst, P., Sharma, A., Shin, J., Sessler, J. L., Kim, J. S. Organic molecule-based photothermal agents: an expanding photothermal therapy universe. Chem Soc Rev. 47 (7), 2280-2297 (2018).
- Ge, R. L., Yan, P. N., Liu, Y., Li, Z. S., Shen, S. Q., Yu, Y. Recent advances and clinical potential of near infrared photothermal conversion materials for photothermal hepatocellular carcinoma therapy. Adv Func Mater. 33 (29), 2301138 (2023).
- Shabani, L., et al. An investigation into green synthesis of Ru template gold nanoparticles and the in vitro photothermal effect on the MCF-7 human breast cancer cell line. Appl Phys A. 129 (8), 564 (2023).
- Mosleh-Shirazi, S., et al. Investigation through the anticancer properties of green synthesized spinel ferrite nanoparticles in present and absent of laser photothermal effect. Ceram Int. 49 (7), 11293-11301 (2023).
- Amani, A. M., et al. Innovation applications of MXenes in biomedicine. Mater Today Commun. 40, 109929 (2024).
- Ali, M. R. K., Wu, Y., El-Sayed, M. A. Gold-nanoparticle-assisted plasmonic photothermal therapy advances toward clinical application. J Phys Chem C. 123 (25), 15375-15393 (2019).
- Lahonian, M., Golneshan, A. A. Numerical study of temperature distribution in a spherical tissue in magnetic fluid hyperthermia using Lattice Boltzmann method. IEEE Trans NanoBiosci. 10 (4), 262-268 (2011).
- Shaw, A. K., Soni, S. Role of periodic irradiation and incident beam radius for plasmonic photothermal therapy of subsurface tumors. J Therm Biol. 121, 103859 (2024).
- Pogue, B. W., Patterson, M. S. Review of tissue simulating phantoms for optical spectroscopy, imaging and dosimetry. J Biomed Opt. 11 (4), 041102 (2006).
- Mustari, A., et al. Agarose-based tissue mimicking optical phantoms for diffuse reflectance spectroscopy. J Vis Exp. (138), e57578 (2018).
- Dabbagh, A., Abdullah, B. J. J., Ramasindarum, C., Abu Kasim, N. H. Tissue-mimicking gel phantoms for thermal therapy studies. Ultrason imaging. 36 (4), 291-316 (2014).
- Khurana, D., et al. Experimental investigation of photothermal conversion and thermal conductivity of broadband absorbing gold nanoblackbodies and graphene oxide nanoparticles for plasmonic photothermal cancer therapy. Int Commun Heat Mass Transf. 156, 107597 (2024).
- Ortega-Palacios, R., Leija, L., Vera, A., Cepeda, M. F. J. Measurement of breast-tumor phantom dielectric properties for microwave breast cancer treatment evaluation. , 216-219 (2010).
- Wagnières, G., et al. An optical phantom with tissue-like properties in the visible for use in PDT and fluorescence spectroscopy. Phys Med Biol. 42 (7), 1415 (1997).
- Didychuk, C. L., Ephrat, P., Chamson-Reig, A., Jacques, S. L., Carson, J. J. L. Depth of photothermal conversion of gold nanorods embedded in a tissue-like phantom. Nanotechnology. 20 (19), 195102 (2009).
- Shaw, A. K., Khurana, D., Soni, S. Thermal damage analysis of sub-surface soft tissue sarcoma for Indocyanine Green mediated photothermal cancer therapy. Therm Sci Eng Prog. 46, 102168 (2023).
- Shaw, A. K., Khurana, D., Soni, S. Assessment of thermal damage for plasmonic photothermal therapy of subsurface tumors. Phys Eng Sci Med. 47 (3), 1107-1121 (2024).
- Khurana, D., Soni, S. Tissue-mimicking phantoms for photothermal performance evaluations. Recent Trends in Cancer Therapeutics: Plasmonic Photothermal-Based Multimodal Cancer Therapy. , 109-136 (2024).
- Eranki, A., et al. Tissue-mimicking thermochromic phantom for characterization of HIFU devices and applications. Int J Hyperth. 36 (1), 517-528 (2019).
- McLaughlan, J. R. Controllable nucleation of cavitation from plasmonic gold nanoparticles for enhancing high intensity focused ultrasound applications. J Vis Exp. (140), e58045 (2018).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Experimental and numerical investigation of heat confinement during nanoparticle-assisted thermal therapy. Int Commun Heat Mass Transf. 69, 11-17 (2015).
- Ntombela, L., Adeleye, B., Chetty, N. Low-cost fabrication of optical tissue phantoms for use in biomedical imaging. Heliyon. 6 (3), e03602 (2020).
- Lai, P., Xu, X., Wang, L. V. Dependence of optical scattering from Intralipid in gelatin-gel based tissue-mimicking phantoms on mixing temperature and time. J Biomed Opt. 19 (3), 035002 (2014).
- Aernouts, B., Van Beers, R., Watté, R., Lammertyn, J., Saeys, W. Dependent scattering in Intralipid®phantoms in the 600-1850 nm range. Opt Express. 22 (5), 6086-6098 (2014).
- Tromberg, B. J., et al. Non-invasive in vivo characterization of breast tumors using photon migration spectroscopy. Neoplasia. 2 (1-2), 26-40 (2000).
- Kanick, S. C., et al. Scattering phase function spectrum makes reflectance spectrum measured from Intralipid phantoms and tissue sensitive to the device detection geometry. Biomed Opt Express. 3 (5), 1086-1100 (2012).
- Yuan, B., Chen, N., Zhu, Q. Emission and absorption properties of indocyanine green in Intralipid solution. J Biomed Opt. 9 (3), 497-503 (2004).
- Khurana, D., et al. Gold nanoblackbodies-based multifunctional nanocomposite for multimodal cancer therapy. Int J Pharm. 642, 123112 (2023).
- Brough, D., Ramos, J., Delpech, B., Jouhara, H. Development and validation of a TRNSYS type to simulate heat pipe heat exchangers in transient applications of waste heat recovery. Int J Thermofluid. 9, 100056 (2021).
- Vardaki, M. Z., Kourkoumelis, N. Tissue phantoms for biomedical applications in Raman spectroscopy: A review. Biomed Eng Computational Biol. 11, 1179597220948100 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved