Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Terapia fototérmica plasmónica contra el cáncer: fantasmas que imitan el tejido tumoral incrustados en nanopartículas para visualizar la distribución de la temperatura fototérmica
* Estos autores han contribuido por igual
En este artículo
Resumen
En este artículo se presenta el protocolo para la preparación de maniquíes de tejido tumoral que replican propiedades ópticas para la terapia fototérmica plasmónica. En él se detalla la preparación de maniquíes, las evaluaciones fototérmicas y la validación del modelo numérico desarrollado basado en mediciones de temperatura fototérmica para evaluar parámetros terapéuticos, ofreciendo una alternativa ética y rentable a los estudios in vivo para las pruebas preliminares.
Resumen
La terapia fototérmica plasmónica (PPTT, por sus siglas en inglés), un tratamiento emergente contra el cáncer, consiste en administrar nanopartículas (NP) a un tumor, seguidas de irradiación de infrarrojo cercano (NIR) para generar calor localizado que destruye las células cancerosas. Antes de administrar PPTT, es necesario estimar los parámetros terapéuticos (concentración de NP, intensidad de irradiación y duración). Para ello, se realizan simulaciones numéricas. Sin embargo, para garantizar una computación robusta, estas simulaciones deben validarse a través de experimentos fototérmicos en maniquíes que imitan el tejido tumoral y replican las propiedades ópticas del tejido tumoral. En el caso de la TTPP, los parámetros terapéuticos se rigen por la dispersión y absorción de la radiación incidente por el tejido y las NP. Por lo tanto, se pueden realizar experimentos de validación en maniquíes que imitan el coeficiente de dispersión reducido (μs') y el coeficiente de absorción (μa) del tumor/tejido objetivo.
Específicamente, este protocolo proporciona instrucciones para preparar maniquíes que imitan μ s y μ de tumor de mama inyectados con nanovarillas de oro, rodeados de tejido mamario normal. El protocolo también detalla la irradiación NIR, el monitoreo de la temperatura y la validación de los resultados numéricos mediante la comparación de las temperaturas espacio-temporales con las medidas usando termopares. Los protocolos presentados en este estudio facilitaron la preparación de fantomas cilíndricos de tejido tumoral de mama basados en hidrogel con dimensiones (φ40 x 12 mm) y una región tumoral central (φ20 x 6 mm), que comprende un 1% de agarosa como matriz base e intralípidos como constituyente de dispersión y región tumoral incrustada con nanovarillas de oro a una concentración de 25 μg/mL. Los resultados representativos de un estudio de caso ilustran la aplicación de maniquíes fabricados para validar simulaciones numéricas para PPTT. El estudio concluye que los protocolos demostrados son valiosos para la realización de experimentos fototérmicos destinados a optimizar y planificar parámetros terapéuticos previos a los experimentos in vivo y validar simulaciones numéricas para PPTT.
Introducción
La terapia fototérmica plasmónica (PPTT, por sus siglas en inglés) es una modalidad emergente de tratamiento localizado del cáncer que implica la administración de nanopartículas (NP) en el sitio del tumor, seguidas de irradiación con radiación de infrarrojo cercano (NIR). Las NP se administran típicamente por vía intratumoral (IT) o intravenosa (IV)1. Tras la irradiación NIR, la interacción plasmónica de la radiación incidente y las NPs conduce a la generación de calor localizado en la superficie de las NPs, que luego se disipa en el tejido tumoral circundante 2,3. Este calentamiento localizado eleva la temperatura en la región tumoral, lo que conduce a la muerte de las células cancerosas a través de la ablación térmica 4,5. El tratamiento eficaz del cáncer puede lograrse manteniendo temperaturas específicas, como 46 ºC durante 1 h6, 50-52 ºC durante 4-6 min7, o 60 ºC para el daño instantáneo8 a través de diversos procesos biológicos.
Se han explorado y reportado varios agentes fototérmicos para su aplicación en terapia fototérmica, y su eficacia terapéutica se ha evaluado mediante estudios in vitro o in vivo . Estos agentes incluyen materiales orgánicos9 como tintes de infrarrojo cercano (por ejemplo, verde de indocianina, IR780, IR820), agentes fototérmicos a base de polímeros (por ejemplo, polidopamina) y materiales inorgánicos10, incluidas las NP a base de metales nobles o NP plasmónicas (por ejemplo, NP de oro)11, azufre/óxidos de metales de transición12 y MXenes13. Entre estos, las NP plasmónicas, específicamente las NP de oro, ofrecen varias ventajas sobre los agentes fototérmicos tradicionales (por ejemplo, colorantes), como una mejor estabilidad fototérmica, una mayor eficiencia de conversión fototérmica y una respuesta plasmónica sintonizable a través de variaciones de forma y tamaño10. Estos atributos hacen que las NP de oro sean candidatas ideales para la terapia fototérmica, y algunas se encuentran actualmente en ensayos clínicos14.
Para optimizar la eficacia terapéutica y garantizar un daño térmico tumoral suficiente durante la PPTT, es esencial estimar los parámetros del tratamiento, como la dosis de NP (en términos de concentración) y los parámetros de radiación NIR (incluida la intensidad y la duración de la irradiación) antes de la aplicación preclínica/clínica de la PPTT. Las simulaciones numéricas se emplean normalmente para establecer estos parámetros. Se han desarrollado varios métodos numéricos para evaluar el daño térmico dentro del tejido tumoral, siendo el método de Boltzmann reticular uno de estos enfoques15,16. Sin embargo, para que estas simulaciones sean fiables, deben validarse utilizando análogos tisulares conocidos como maniquíes que imitan tejidos. Estos maniquíes pueden prepararse para replicar las propiedades ópticas, térmicas, biológicas o mecánicas de los tejidos reales, sirviendo como sustitutos para realizar pruebas preliminares, evaluación de tratamientos y validación de dispositivos, materiales o métodos recientemente desarrollados destinados a aplicaciones biológicas17,18. Esto puede reducir el sufrimiento innecesario de los animales o de los seres humanos y abordar las preocupaciones éticas asociadas con tales experimentos19,20.
El diseño y la fabricación de un maniquí dependen de la aplicación prevista21. Por ejemplo, durante las fototerapias como la PPTT, la dosis de radiación incidente está influenciada por la cantidad de luz absorbida o dispersada por las NP y los tejidos22,23. Por lo tanto, se utilizan maniquíes ópticos que imitan las propiedades ópticas, específicamente el coeficiente de dispersión reducido (μs') y el coeficiente de absorción (μa) de los tejidos biológicos, para las evaluaciones PPTT y la posterior validación de simulaciones numéricas24,25. Los maniquíes ópticos suelen estar compuestos por tres constituyentes principales: una matriz base, agentes dispersores y agentes de absorción17,26. La matriz base mantiene los componentes de dispersión y absorción en concentraciones adecuadas para replicar las propiedades ópticas deseadas. Estos maniquíes se pueden clasificar en maniquíes sólidos, líquidos y semisólidos (hidrogel), según el tipo de matriz base. Para los estudios terapéuticos térmicos como la PPTT, se prefieren los maniquíes de hidrogel, en particular los maniquíes basados en agarosa, debido a su biocompatibilidad, dispersión y absorción inherentes insignificantes, proceso de fabricación simple y flexibilidad para ser moldeados en las formas y tamaños deseados correspondientes a las geometrías tumorales19,22. Lo más importante es que los maniquíes preparados a base de agarosa se pueden utilizar hasta ~70-80 ºC a temperaturas a granel, ya que la temperatura de fusión de los maniquíes de tipo agarosa es de ~80 ºC19. En el caso de PPTT, dado que un rango de temperatura de ~50-80 ºC es suficiente, estos maniquíes basados en agarosa pueden utilizarse para evaluaciones fototérmicas basadas en PPTT.
Se han desarrollado y reportado varios maniquíes imitadores de tejidos a base de hidrogel para diversas aplicaciones. Mustari et al. desarrollaron maniquíes imitadores de tejidos basados en agarosa y demostraron su utilidad en la validación de un sistema óptico de nuevo diseño18. En otro estudio, se prepararon maniquíes termocrómicos que imitan tejidos para medir el alcance del daño térmico durante la terapia de ultrasonido focalizado de alta intensidad (HIFU)27. También se han preparado maniquíes que imitan tejidos a base de poliacrilamida para analizar el efecto de la cavitación durante la terapia oncológica basada en HIFU28. El objetivo de este estudio es demostrar un método paso a paso para fabricar maniquíes que imitan el tejido tumoral junto con el protocolo para experimentos fototérmicos basados en maniquíes para evaluaciones PPTT. Este protocolo detallado propuesto tiene como objetivo promover la adopción y la reproducibilidad de la preparación de maniquíes y los posteriores métodos de experimentación fototérmica basados en maniquíes para probar el rendimiento fototérmico de las nanoestructuras recientemente desarrolladas, validando así las simulaciones numéricas y ayudando a la planificación del pretratamiento o a la optimización de los parámetros terapéuticos de PPTT. En este artículo se describe un protocolo de preparación de maniquíes diseñado específicamente para tumores de mama subsuperficiales; Sin embargo, los mismos pasos se pueden adaptar para fabricar varios tipos de tejido tumoral (de varias formas y tamaños) alterando la composición de los agentes de absorción y dispersión óptica. A modo de ejemplo, las evaluaciones fototérmicas demostradas basadas en maniquíes que imitan el tejido se han empleado en estudios informados anteriormente para validar simulaciones de PPTT para el tumor subsuperficial del antebrazo24, el IDCsubsuperficial 25 y los tumores de piel29.
En este artículo se describen los pasos de preparación de un maniquí óptico que imita las μde un tumor de mama subsuperficial o subcutáneo, concretamente el carcinoma ductal invasivo (CDI), situado a 3 mm por debajo de la superficie de la piel y rodeado de tejido mamario normal. El maniquí es de geometría cilíndrica preparado utilizando agarosa como matriz base e intralipídico (IL) como agente dispersor añadido en concentraciones adecuadas para imitar μ de tejido mamario normal y canceroso. La agarosa, un hidrogel transparente con una dispersión y absorción insignificantes, es una matriz base ideal para maniquíes ópticos18,30. Además, la IL, una emulsión de grasa al 20% que imita la estructura bicapa de las membranas celulares, es ampliamente utilizada como agente dispersor31,32 y fue elegida para este estudio para replicar las μdel tejido mamario normal y canceroso. El maniquí está diseñado para imitar el tumor de mama (IDC) inyectado con nanovarillas de oro (AuNR) como NP plasmónicas, rodeado de tejido mamario normal sin AuNR. Entre las diversas NP de oro utilizadas en la PPTT, las AuNR fueron seleccionadas para este estudio debido a su fuerte respuesta plasmónica en la región NIR y su uso generalizado en estudios preclínicos de PPTT, incluidos los que involucran a pacientes caninos y felinos14. El protocolo demuestra la preparación de dos tipos de maniquíes: uno con un tumor que presenta una distribución de AuNR como se observa con la inyección intravenosa y el otro con un tumor que refleja la distribución de AuNR lograda mediante la inyección IT. Siguiendo el protocolo de preparación de maniquíes, se describe la configuración experimental para la irradiación NIR y los pasos para realizar evaluaciones fototérmicas en los maniquíes. Finalmente, se proporciona una guía paso a paso para interpretar los resultados de la distribución de temperatura obtenidos de estas evaluaciones y para comparar los datos experimentales con los resultados de la simulación numérica. Esta comparación ayuda a validar un método numérico desarrollado, lo que permite el ajuste de los parámetros de tratamiento óptimos adaptados específicamente a un tumor.
Protocolo
NOTA: Los maniquíes se prepararon utilizando agarosa e intralípidos sobre la base de composiciones reportadas en la literatura para lograr las propiedades ópticas deseadas. No se utilizó tejido biológico real de pacientes o cadáveres. Por lo tanto, la preparación de estos maniquíes está libre de restricciones éticas y no requiere consentimiento informado.
1. Selección o fabricación de un molde adecuado
- . Selección de un molde adecuado
- Elija un molde que coincida con la forma y las dimensiones deseadas para los maniquíes. En el caso de los maniquíes cilíndricos con una región tumoral distribuida uniformemente con NP y rodeada de tejido normal, utilice una placa de Petri de vidrio y un vaso de precipitados pequeño como molde8 (Figura 1A).
NOTA: Estos pasos son para preparar maniquíes que imitan el tejido tumoral en geometría cilíndrica. Para otras formas o tamaños, seleccione un molde apropiado. Si no se dispone de un molde adecuado, fabrique uno mediante impresión tridimensional (3D), como se detalla en el paso 1.2.
- Elija un molde que coincida con la forma y las dimensiones deseadas para los maniquíes. En el caso de los maniquíes cilíndricos con una región tumoral distribuida uniformemente con NP y rodeada de tejido normal, utilice una placa de Petri de vidrio y un vaso de precipitados pequeño como molde8 (Figura 1A).
- Fabricación de molde por impresión 3D
- Diseñe un modelo 3D utilizando software de diseño asistido por computadora (CAD) (por ejemplo, SolidWorks, Autodesk Inventor o CATIA) de acuerdo con la forma y el tamaño deseados. Para seguir este protocolo, diseñe un cilindro hueco (diámetro interior de 40 mm, grosor de 2 mm y altura de 12 mm; consulte el Archivo complementario 1) y dos moldes de enmascaramiento cilíndricos sólidos (dimensiones φ20 x 6 mm y φ14 x 3 mm), como se muestra en la Figura 1B.
- Para el diseño/dibujo de cilindros huecos, en el software CAD, cree dos círculos con diámetros de 40 mm y 44 mm. A continuación, extruya la geometría 12 mm.
- Para moldes de enmascaramiento cilíndricos sólidos, cree círculos con diámetros de 20 mm y 14 mm, luego extruya 6 mm y 3 mm, respectivamente (consulte el Archivo Suplementario 2 y el Archivo Suplementario 3). Dibuje un rectángulo (lados de 44 mm y 5 mm) en un lado del cilindro y extrúyalo 2 mm.
- Convierta los modelos 3D a formato Gcode utilizando un software compatible con la impresora 3D (por ejemplo, Cura) para imprimir.
- Utilice este Gcode para imprimir los moldes (por ejemplo, aquí, utilizando ácido poliláctico [PLA] φ1,75 mm, 1 kg de eSun) utilizando una impresora 3D.
NOTA: El rectángulo se dibuja para suspender los moldes de enmascaramiento. Se pueden diseñar y fabricar diferentes moldes para preparar maniquíes con otras formas deseadas.
- Diseñe un modelo 3D utilizando software de diseño asistido por computadora (CAD) (por ejemplo, SolidWorks, Autodesk Inventor o CATIA) de acuerdo con la forma y el tamaño deseados. Para seguir este protocolo, diseñe un cilindro hueco (diámetro interior de 40 mm, grosor de 2 mm y altura de 12 mm; consulte el Archivo complementario 1) y dos moldes de enmascaramiento cilíndricos sólidos (dimensiones φ20 x 6 mm y φ14 x 3 mm), como se muestra en la Figura 1B.
2. Preparación de soluciones fantasma que imitan el tejido tumoral25
NOTA: En este estudio, los maniquíes ópticos basados en agarosa de geometría cilíndrica que imitan el tejido tumoral se preparan para parecerse a un tumor de mama subsuperficial inyectado con AuNR, mediante inyección IT o IV, como se muestra en la Figura 2. El maniquí IT tiene dos regiones: una región tumoral central con AuNRs y una región de tejido normal circundante. El maniquí IV tiene tres regiones: una región tumoral con AuNR en la periferia del tumor, una región tumoral central desnuda sin AuNR y una región de tejido normal circundante. Dado que las propiedades ópticas (μa y μs') difieren para el tumor y el tejido normal, se preparan soluciones fantasma separadas para cada región que tiene diferentes composiciones y se discutirán por separado.
- Preparación de una solución fantasma que imita el tejido mamario normal (Solución 1)
NOTA: Esta solución se utilizará tanto para maniquíes IT como para maniquíes IV. Los pasos de preparación de la Solución 1 se muestran en la Figura 3A.- Calcule el volumen teórico de la solución en función de las dimensiones del molde.
NOTA: Aquí, para el molde cilíndrico de φ40 x 12 mm, el volumen calculado es de 15 cm3 o 15 mL por maniquí. Como es necesario preparar dos maniquíes de este tipo, el volumen total es de 15 mL x 2, que es de 30 mL. Por lo tanto, prepare 35 ml de la solución para tener en cuenta la evaporación o el derrame durante el paso de preparación del maniquí. - Calcule la cantidad (peso/concentración/volumen) de todos los constituyentes fantasma -agarosa (como material base) e IL (como constituyente de dispersión)- que se añadirán a la solución de 35 mL.
- Añadir 0,35 g de agarosa para preparar 35 mL de solución correspondiente a una concentración de 1% p/v.
- Estimación de la concentración de IL correspondiente a los μ deseados de tejido mamario normal (es decir, 10,1 cm-1 33) con base en los datos de concentración de IL frente a μ s disponibles en la literatura. A continuación, calcule el volumen de IL (20% de stock de emulsión) que se añadirá a la solución fantasma utilizando la ecuación (1):
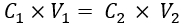 (1)
(1)
Donde C1 y V1 son la concentración del stock de reactivo (en este caso, un 20% de stock de IL) y el volumen de la solución de stock de reactivo que debe añadirse (en este caso se calculará), respectivamente. C2 es la concentración requerida del reactivo (que se obtendrá de la literatura) en la solución de trabajo final, y V2 es el volumen total de la solución de trabajo final (en este caso, 35 mL).
NOTA: Aquí, para μs' de 10,1 cm-1, la concentración de IL estimada a partir de la literatura reportada es de 1,04%34,35. Siguiendo los pasos anteriores, el volumen de IL (20% de stock de IL) que se debe añadir es de 1,82 mL.
- Pesar 0,35 g de agarosa y añadirla a 33,18 ml de agua desionizada (DI) en un vaso de precipitados. Cubra el vaso de precipitados con papel de aluminio para evitar la pérdida de agua.
- Calentar el vaso de precipitados que contiene la solución en una placa calefactora a 120 °C agitando hasta que la solución se vuelva transparente.
- Bajar la temperatura de la placa calefactora a 60 ºC. Después de 15 minutos, agregue 1,82 mL de IL mientras revuelve. Mantener la solución resultante, Solución 1, agitando a 60 ºC hasta su uso (lista para verter).
NOTA: La solución fantasma a 60 ºC debe mantenerse en condiciones de agitación. De lo contrario, conduce a la solidificación de la solución.
- Calcule el volumen teórico de la solución en función de las dimensiones del molde.
- Preparación de una solución tumoral fantasma incluida en AuNR (Solución 2)
NOTA: Esta solución se utilizará tanto para maniquíes IT como para maniquíes IV. Los pasos de preparación de la Solución 2 se muestran en la Figura 3B.- Calcular el volumen de la región tumoral a rellenar (φ20 x 6 mm).
NOTA: El volumen aproximado para dos maniquíes tumorales de este tipo es de 3,8 mL. Por lo tanto, el volumen de la solución a preparar sería de 4,5 mL. - Calcule la cantidad de constituyentes fantasma tumorales que se van a añadir (agarosa, IL y AuNRs) siguiendo pasos similares a los mencionados en la sección 2.1.
- Añadir 45 mg para preparar 4,5 mL de solución correspondiente a una concentración de 1% p/v.
- La IL:μs' del tumor de mama es de 4,6 cm-1 33 y para imitarla, la concentración de IL correspondiente requerida es del 0,472%34,35. Por lo tanto, agregue 106,2 μL de IL de un 20% de caldo de IL a 4,5 mL de solución tumoral fantasma.
- La concentración deseada de AuNRs en el maniquí es de 25 μg/mL. Para lograr lo mismo, agregue 3,21 mL de solución de AuNRs (concentración de stock: 35 μg/mL) a la solución tumoral fantasma.
- Agregue 45 mg de agarosa a 1,18 ml de agua desionizada en un vaso de precipitados y cúbralo con papel de aluminio.
- Coloque el vaso de precipitados en una placa calefactora y remueva a 120 ºC hasta que la solución se vuelva transparente.
- Reducir la temperatura de la placa calefactora a 60 ºC y dejar actuar la solución durante 15 min.
- Añadir 106,2 μL de IL y 3,21 mL de suspensión de AuNR (35 μg/mL) en condiciones de agitación. Mantener la solución resultante, Solución 2, agitando a 60 ºC hasta el vertido.
- Calcular el volumen de la región tumoral a rellenar (φ20 x 6 mm).
- Preparación de una solución fantasma para el tumor desnudo (sin AuNRs) (Solución 3)
NOTA: Esta solución se utilizará solo para maniquí IV. Los pasos de preparación de la Solución 2 se muestran en la Figura 3C.- Calcular el volumen teórico de la suspensión a añadir para crear una región tumoral desnuda (~ φ20 x 6 mm).
NOTA: El volumen aproximado de los maniquíes tumorales es de 1,9 mL. Por lo tanto, el volumen de la solución a preparar sería de 2,5 mL. - Calcule la cantidad de constituyentes tumorales fantasma que se van a añadir, agarosa e IL, siguiendo pasos similares a los mencionados en la sección 2.1.
- Añadir 25 mg de agarosa para preparar 2,5 mL de solución con el fin de alcanzar una concentración del 1% p/v.
- La IL:μs' del tumor de mama es de 4,6 cm-1 33 y para imitarla, la concentración de IL correspondiente requerida es del 0,472%34,35. Añadir 59 μL de caldo IL al 20%.
- Agregue 25 mg de agarosa a 2,44 ml de agua desionizada en un vaso de precipitados y cúbralo con papel de aluminio.
- Coloque el vaso de precipitados en una placa calefactora y remueva a 120 ºC hasta que la solución se vuelva transparente.
- Reducir la temperatura de la placa calefactora a 60 ºC y dejar actuar la solución durante 15 min.
- Añadir 59 μL de IL a la solución en condiciones de agitación. Mantener la solución resultante, Solución 3, en condiciones de agitación a 60 ºC hasta el vertido.
- Calcular el volumen teórico de la suspensión a añadir para crear una región tumoral desnuda (~ φ20 x 6 mm).
3. Preparación de un maniquí que imita el tejido tumoral 24,25,36
- Prepare los moldes para el paso de vertido. Para ello, selle la parte inferior de los moldes cilíndricos con parafilm y coloque el molde de enmascaramiento (φ20 x 6 mm) en el centro.
- Vierta la solución 1 en los moldes cilíndricos hasta la marca superior del molde de enmascaramiento y deje que se solidifique (Figura 4A).
- Después de la solidificación, retire el molde de enmascaramiento para crear una cavidad para la región tumoral (Figura 4B).
NOTA: El protocolo será el mismo para los maniquíes IT e IV hasta el paso 3.3. El proceso se discutirá por separado para los maniquíes IT e IV después del paso 3.3. - Fantasma informático 24,25,36
- Llene la cavidad con la Solución 2 y deje que se solidifique (Figura 4C).
- Agregue la Solución 1 a la parte superior del maniquí y deje que se solidifique completamente (Figura 4D).
- Fantasma IV24,25
- Inserte un molde de enmascarar más pequeño (φ14 x 3 mm) y llene la cavidad a su alrededor con la Solución 2 (Figura 4E).
- Después de solidificar, retire el molde más pequeño y llene la cavidad restante con la Solución 3 (Figura 4F).
- Agregue la Solución 1 a la parte superior y permita una solidificación completa (Figura 4G).
4. Inserción de los termopares dentro del fantoma 24,25,36
NOTA: Para monitorear la distribución espacial de la temperatura, los termopares de tipo K se insertan dentro del maniquí en varias ubicaciones radiales (r) y axiales (z), como se ilustra en la Figura 2. Para la inserción de termopares en ubicaciones precisas, se utilizan capilares de vidrio como guías para garantizar la precisión. Las ubicaciones de los termopares se denotan como (r, z), donde el punto medio en la superficie superior del tumor a una profundidad z = 3 mm sirve como punto de referencia para los manitomas IT e IV y se designa como (0, 3), como se muestra en la Figura 2A, B. Al seleccionar ubicaciones radiales y axiales para cuantificar el daño térmico en la región tumoral, las ubicaciones en la periferia del tumor (tanto radiales como axiales) son críticas. Alcanzar las temperaturas requeridas en estos puntos periféricos durante la irradiación NIR garantiza la ablación completa del tumor. Por lo tanto, los termopares se colocan en los puntos extremos radiales (del tumor) a z = 3 y 9 mm, es decir, (10, 3) y (10, 9), y un termopar se coloca en la interfaz tumor-tejido a z = 9 mm (ubicación axial periférica), es decir, (0, 9) como se muestra en la Figura 2A, B. Además, para evaluar la distribución de la temperatura axial, se inserta un termopar entre las ubicaciones (0, 3) y (0, 9), designado como (0, 6). Por último, para evaluar el aumento de temperatura en la región circundante del tejido sano, se inserta un termopar en (15, 3).
- Corte los capilares de vidrio a longitudes adecuadas para que alcancen las ubicaciones radiales y axiales deseadas dentro del maniquí.
- Inserte termopares dentro de estos capilares de vidrio y perfore en las ubicaciones radiales y axiales especificadas del maniquí uno por uno.
- Una vez que todos los termopares estén en su lugar, coloque cuidadosamente el maniquí en una placa de Petri de vidrio para la posterior irradiación NIR, como se muestra en la Figura 5A.
5. Exposición a la irradiación NIR y medición de las temperaturas fototérmicas resultantes36
- Coloque la placa de Petri de vidrio que contiene el maniquí (insertada con termopares) de modo que la región central de la superficie superior del maniquí sea perpendicular a la punta de la fibra óptica de la fuente de luz NIR, como se muestra en la Figura 5A.
NOTA: El diámetro del haz en la superficie fantasma se puede ajustar cambiando la distancia entre la superficie y la punta de fibra óptica. Aquí, se mantiene una distancia de 9 mm para lograr un diámetro de haz de 20 mm, cubriendo la región central del tumor. - Conecte el sistema de Adquisición de Datos (DAQ) a la computadora y abra el software LabVIEW.
- Encienda la fuente de luz NIR (Figura 5B) y el botón de reproducción en el software simultáneamente para registrar los datos de temperatura al comienzo de la irradiación.
- Irradie el maniquí durante 20 minutos, luego apague la fuente de luz NIR y detenga la grabación.
- Trace los datos de temperatura registrados en función del tiempo.
6. Comparación de temperatura con los resultados de la simulación 24,25
NOTA: Los experimentos generalmente se repiten y las temperaturas se registran a intervalos de tiempo establecidos en todas las ubicaciones de termopares. Para la validación, se realizan los siguientes pasos:
- Calcule la media y la desviación estándar de las temperaturas experimentales en todas las ubicaciones de termopares (r, z).
- Calcule numéricamente las temperaturas en las ubicaciones de termopar consideradas.
- Grafique la temperatura media obtenida de los experimentos y la temperatura obtenida por simulación en todas las ubicaciones de termopares con respecto al tiempo, como se muestra en la Figura 6.
- Calcule el error cuadrático medio (RMSE) y el error absoluto medio (MAE) para todas las ubicaciones de termopares para cuantificar la diferencia de temperatura y evaluar la validación, como se muestra en la Tabla 1.
NOTA: MAE y RMSE se calculan utilizando las ecuaciones 2 y 3, respectivamente.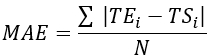 (2)
(2)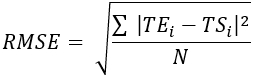 (3)
(3)
Donde TE, TS y N son la temperatura obtenida experimentalmente, la temperatura calculada numéricamente y el número de puntos de datos (aquí, las temperaturas se registran cada segundo durante 20 min; por lo tanto, = 1.200), respectivamente. i representa instantes de tiempo.
Resultados
La Figura 6 muestra las temperaturas medias temporales obtenidas durante los experimentos con un maniquí de tejido tumoral incluido en AuNR en todas las ubicaciones del termopar, como se muestra en la Figura 2, en comparación con las temperaturas obtenidas durante las simulaciones en las ubicaciones de termopar correspondientes. Aquí, los experimentos se realizaron 4 veces para cada distribuci...
Discusión
En este trabajo se presenta el protocolo para la preparación de tejido tumoral basado en agarosa que imita maniquíes ópticos. Los maniquíes están diseñados para imitar las propiedades ópticas de los tejidos tumorales y normales para su uso en estudios de PPTT. En este estudio se destaca la aplicación de estos maniquíes para la validación de métodos numéricos durante PPTT. El paso más crítico de este protocolo es mantener la temperatura de las soluciones fantasma que contien...
Divulgaciones
Los autores no tienen intereses contrapuestos que revelar.
Agradecimientos
Este estudio se llevó a cabo sin ningún apoyo financiero de ningún organismo de financiación público, comercial o sin fines de lucro. Los autores agradecen a CSIR-Central Scientific Instruments Organisation, Chandigarh, India, por su infraestructura y apoyo.
Materiales
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | 9012-36-6 | Base matrix for phantoms |
| Deionized (DI) water (18.2 MΩ) | NA | NA | Solvent for the preparation of phantom solutions |
| Gold nanorods (AuNRs) | Nanopartz | A12-10-808 | Plasmonic nanoparticles |
| Intralipid (20% emulsion stock) | Sigma-Aldrich | 68890-65-3 | Scattering agent of phantoms |
| Parafilm | Parafilm M | 380020 | To seal the bottom of cylindrical mold |
| Polylactic acid filament | eSun | NA | Material for molds (1.75 mm dia wire) |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| 3D Printer | Creality | Ender-3 | For printing molds |
| Data acquisition (DAQ) system | National Instruments | cDAQ-9171 | For recording temperatures |
| DI water unit | Merck Millipore | Direct-Q3 | For DI water |
| Hot plate with magnetic stirrer | IKA | C-MAG HS 4 | For phantom solutions preparation |
| NIR light source | NA (In-house developed) | NA | For NIR irradiation of phantoms, (800/50 nm; Center wavelength: 800 nm, Bandwidth: 50 nm) |
| Optical Fiber (1/2" × 12") | Edmund Optics | 38-659 | For NIR irradiation of phantoms |
| Type K thermocouples | RS Components | RS Pro 397-1589 | For temperature monitoring at various phantom locations during NIR irradiation |
| Weighing Balance | Wensar | PGB 200 | For weighing agarose |
| Name of Software | Company | Catalog Number | Comments/Description |
| Autodesk Inventor 2021 | Autodesk | NA | For mechanical designing of molds |
| Cura 5.7 | Ultimaker | NA | For converting mechanical design to Gcode for 3D printing |
| Matlab R2024b | MathWorks | NA | For numerical simulations and temperature data plots |
| Name of Labwares used | Company | Catalog Number | Comments/Description |
| Beakers (50 mL) | Borosil | 1000D12 | For phantom solution preparations |
| Beakers (10 mL) | Borosil | 1000006 | For phantom solution preparations |
| Pipette (100-1000 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 063 | For adding constituents into the phantom solution |
| Pipette (10-100 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 047 | For adding constituents into the phantom solution |
| Spatula | Borosil | LASC8888M06 | For weighing agarose and demolding the phantoms from the molds |
| Tips (100-1000 µL) | Tarsons | 521016 | For adding constituents into the phantom solution |
| Tips (10-100 µL) | Tarsons | 521010Y | For adding constituents into the phantom solution |
Referencias
- Riley, R. S., Day, E. S. Gold nanoparticle-mediated photothermal therapy: applications and opportunities for multimodal cancer treatment. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (4), e1449 (2017).
- Webb, J. A., Bardhan, R. Emerging advances in nanomedicine with engineered gold nanostructures. Nanoscale. 6 (5), 2502-2530 (2014).
- Abadeer, N. S., Murphy, C. J. Recent progress in cancer thermal therapy using gold nanoparticles. J Phys Chem C. 120 (9), 4691-4716 (2016).
- Murphy, C. J., et al. Virus-sized gold nanorods: Plasmonic particles for biology. Acc Chem Res. 52 (8), 2124-2135 (2019).
- Overchuk, M., Weersink, R. A., Wilson, B. C., Zheng, G. Photodynamic and photothermal therapies: Synergy opportunities for nanomedicine. ACS Nano. 17 (9), 7979-8003 (2023).
- Goldberg, S. N., Gazelle, G. S., Mueller, P. R. Thermal ablation therapy for focal malignancy. Am J Roentgenol. 174 (2), 323-331 (2000).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Role of optical coefficients and healthy tissue-sparing characteristics in gold nanorod-assisted thermal therapy. Int J Hyperth. 29 (1), 87-97 (2013).
- Khurana, D., Vikas, A. K., Shaw, S., Soni, Polydopamine coated gold nano blackbodies for tumor-selective spatial thermal damage during plasmonic photothermal cancer therapy. IEEE Trans Nanobiosci. 21 (4), 482-489 (2021).
- Jung, H. S., Verwilst, P., Sharma, A., Shin, J., Sessler, J. L., Kim, J. S. Organic molecule-based photothermal agents: an expanding photothermal therapy universe. Chem Soc Rev. 47 (7), 2280-2297 (2018).
- Ge, R. L., Yan, P. N., Liu, Y., Li, Z. S., Shen, S. Q., Yu, Y. Recent advances and clinical potential of near infrared photothermal conversion materials for photothermal hepatocellular carcinoma therapy. Adv Func Mater. 33 (29), 2301138 (2023).
- Shabani, L., et al. An investigation into green synthesis of Ru template gold nanoparticles and the in vitro photothermal effect on the MCF-7 human breast cancer cell line. Appl Phys A. 129 (8), 564 (2023).
- Mosleh-Shirazi, S., et al. Investigation through the anticancer properties of green synthesized spinel ferrite nanoparticles in present and absent of laser photothermal effect. Ceram Int. 49 (7), 11293-11301 (2023).
- Amani, A. M., et al. Innovation applications of MXenes in biomedicine. Mater Today Commun. 40, 109929 (2024).
- Ali, M. R. K., Wu, Y., El-Sayed, M. A. Gold-nanoparticle-assisted plasmonic photothermal therapy advances toward clinical application. J Phys Chem C. 123 (25), 15375-15393 (2019).
- Lahonian, M., Golneshan, A. A. Numerical study of temperature distribution in a spherical tissue in magnetic fluid hyperthermia using Lattice Boltzmann method. IEEE Trans NanoBiosci. 10 (4), 262-268 (2011).
- Shaw, A. K., Soni, S. Role of periodic irradiation and incident beam radius for plasmonic photothermal therapy of subsurface tumors. J Therm Biol. 121, 103859 (2024).
- Pogue, B. W., Patterson, M. S. Review of tissue simulating phantoms for optical spectroscopy, imaging and dosimetry. J Biomed Opt. 11 (4), 041102 (2006).
- Mustari, A., et al. Agarose-based tissue mimicking optical phantoms for diffuse reflectance spectroscopy. J Vis Exp. (138), e57578 (2018).
- Dabbagh, A., Abdullah, B. J. J., Ramasindarum, C., Abu Kasim, N. H. Tissue-mimicking gel phantoms for thermal therapy studies. Ultrason imaging. 36 (4), 291-316 (2014).
- Khurana, D., et al. Experimental investigation of photothermal conversion and thermal conductivity of broadband absorbing gold nanoblackbodies and graphene oxide nanoparticles for plasmonic photothermal cancer therapy. Int Commun Heat Mass Transf. 156, 107597 (2024).
- Ortega-Palacios, R., Leija, L., Vera, A., Cepeda, M. F. J. Measurement of breast-tumor phantom dielectric properties for microwave breast cancer treatment evaluation. , 216-219 (2010).
- Wagnières, G., et al. An optical phantom with tissue-like properties in the visible for use in PDT and fluorescence spectroscopy. Phys Med Biol. 42 (7), 1415 (1997).
- Didychuk, C. L., Ephrat, P., Chamson-Reig, A., Jacques, S. L., Carson, J. J. L. Depth of photothermal conversion of gold nanorods embedded in a tissue-like phantom. Nanotechnology. 20 (19), 195102 (2009).
- Shaw, A. K., Khurana, D., Soni, S. Thermal damage analysis of sub-surface soft tissue sarcoma for Indocyanine Green mediated photothermal cancer therapy. Therm Sci Eng Prog. 46, 102168 (2023).
- Shaw, A. K., Khurana, D., Soni, S. Assessment of thermal damage for plasmonic photothermal therapy of subsurface tumors. Phys Eng Sci Med. 47 (3), 1107-1121 (2024).
- Khurana, D., Soni, S. Tissue-mimicking phantoms for photothermal performance evaluations. Recent Trends in Cancer Therapeutics: Plasmonic Photothermal-Based Multimodal Cancer Therapy. , 109-136 (2024).
- Eranki, A., et al. Tissue-mimicking thermochromic phantom for characterization of HIFU devices and applications. Int J Hyperth. 36 (1), 517-528 (2019).
- McLaughlan, J. R. Controllable nucleation of cavitation from plasmonic gold nanoparticles for enhancing high intensity focused ultrasound applications. J Vis Exp. (140), e58045 (2018).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Experimental and numerical investigation of heat confinement during nanoparticle-assisted thermal therapy. Int Commun Heat Mass Transf. 69, 11-17 (2015).
- Ntombela, L., Adeleye, B., Chetty, N. Low-cost fabrication of optical tissue phantoms for use in biomedical imaging. Heliyon. 6 (3), e03602 (2020).
- Lai, P., Xu, X., Wang, L. V. Dependence of optical scattering from Intralipid in gelatin-gel based tissue-mimicking phantoms on mixing temperature and time. J Biomed Opt. 19 (3), 035002 (2014).
- Aernouts, B., Van Beers, R., Watté, R., Lammertyn, J., Saeys, W. Dependent scattering in Intralipid®phantoms in the 600-1850 nm range. Opt Express. 22 (5), 6086-6098 (2014).
- Tromberg, B. J., et al. Non-invasive in vivo characterization of breast tumors using photon migration spectroscopy. Neoplasia. 2 (1-2), 26-40 (2000).
- Kanick, S. C., et al. Scattering phase function spectrum makes reflectance spectrum measured from Intralipid phantoms and tissue sensitive to the device detection geometry. Biomed Opt Express. 3 (5), 1086-1100 (2012).
- Yuan, B., Chen, N., Zhu, Q. Emission and absorption properties of indocyanine green in Intralipid solution. J Biomed Opt. 9 (3), 497-503 (2004).
- Khurana, D., et al. Gold nanoblackbodies-based multifunctional nanocomposite for multimodal cancer therapy. Int J Pharm. 642, 123112 (2023).
- Brough, D., Ramos, J., Delpech, B., Jouhara, H. Development and validation of a TRNSYS type to simulate heat pipe heat exchangers in transient applications of waste heat recovery. Int J Thermofluid. 9, 100056 (2021).
- Vardaki, M. Z., Kourkoumelis, N. Tissue phantoms for biomedical applications in Raman spectroscopy: A review. Biomed Eng Computational Biol. 11, 1179597220948100 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados