É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Terapia Plasmônica Fototérmica do Câncer: Fantasmas que imitam o tecido tumoral embebido em nanopartículas para visualizar a distribuição fototérmica da temperatura
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este artigo apresenta o protocolo de preparação de simuladores tumor-tecido que replicam propriedades ópticas para terapia fototérmica plasmônica. Ele detalha a preparação do simulador, as avaliações fototérmicas e a validação do modelo numérico desenvolvido com base em medições de temperatura fototérmica para avaliar parâmetros terapêuticos, oferecendo uma alternativa ética e econômica aos estudos in vivo para testes preliminares.
Resumo
A terapia fototérmica plasmônica (PPTT), um tratamento emergente contra o câncer, envolve a entrega de nanopartículas (NPs) a um tumor, seguida de irradiação no infravermelho próximo (NIR) para gerar calor localizado que destrói as células cancerígenas. Antes de administrar o TTPP, os parâmetros terapêuticos - concentração de NP, intensidade e duração da irradiação - precisam ser estimados. Para isso, são realizadas simulações numéricas. No entanto, para garantir uma computação robusta, essas simulações devem ser validadas por meio de experimentos fototérmicos em fantasmas que imitam o tecido tumoral, replicando as propriedades ópticas do tecido tumoral. Para o TTPP, os parâmetros terapêuticos são governados pelo espalhamento e absorção da radiação incidente pelo tecido e NPs. Portanto, experimentos de validação podem ser conduzidos em simuladores que imitam o coeficiente de espalhamento reduzido (μs') e o coeficiente de absorção (μa) do tumor/tecido alvo.
Especificamente, este protocolo fornece instruções para a preparação de fantasmas imitando μ s' e μa de tumor de mama injetado com nanobastões de ouro, cercados por tecido mamário normal. O protocolo também detalha a irradiação NIR, o monitoramento da temperatura e a validação de resultados numéricos, comparando as temperaturas espaço-temporais com as medidas usando termopares. Os protocolos apresentados neste estudo facilitaram a preparação de simuladores cilíndricos de tecido tumoral de mama à base de hidrogel com dimensões (φ40 x 12 mm) e uma região tumoral central (φ20 x 6 mm), compreendendo 1% de agarose como matriz de base e intralipídio como constituinte de espalhamento e região tumoral embebida com nanobastões de ouro na concentração de 25 μg/mL. Resultados representativos de um estudo de caso ilustram a aplicação de simuladores fabricados para validar simulações numéricas para PPTT. O estudo conclui que os protocolos demonstrados são valiosos para a realização de experimentos fototérmicos com o objetivo de otimizar e planejar parâmetros terapêuticos antes de experimentos in vivo e validar simulações numéricas para PPTT.
Introdução
A terapia fototérmica plasmônica (PPTT) é uma modalidade emergente de tratamento do câncer localizado que envolve a entrega de nanopartículas (NPs) ao local do tumor, seguida de irradiação com radiação infravermelha próxima (NIR). As NPs são tipicamente administradas por via intratumoral (IT) ou intravenosa (IV)1. Após a irradiação NIR, a interação plasmônica da radiação incidente e NPs leva à geração de calor localizado na superfície dos NPs, que então se dissipa no tecido tumoral circundante 2,3. Esse aquecimento localizado eleva a temperatura na região do tumor, levando à morte das células cancerígenas por ablação térmica 4,5. O tratamento eficaz do câncer pode ser alcançado mantendo temperaturas específicas, como 46 ºC por 1 h6, 50-52 ºC por 4-6 min7 ou 60 ºC por danos instantâneos8 por meio de vários processos biológicos.
Vários agentes fototérmicos têm sido explorados e relatados para aplicação em terapia fototérmica, e sua eficácia terapêutica tem sido avaliada por meio de estudos in vitro ou in vivo . Esses agentes incluem materiais orgânicos9 , como corantes infravermelhos próximos (por exemplo, verde de indocianina , IR780, IR820), agentes fototérmicos à base de polímeros (por exemplo, polidopamina) e materiais inorgânicos10, incluindo NPs à base de metais nobres ou NPs plasmônicos (por exemplo, NPs de ouro) 11, enxofre / óxidos de metais de transição12 e MXenes13. Entre estes, os NPs plasmônicos, especificamente os NPs de ouro, oferecem várias vantagens sobre os agentes fototérmicos tradicionais (por exemplo, corantes), como melhor estabilidade fototérmica, maior eficiência de conversão fototérmica e resposta plasmônica sintonizável por meio de variações de forma e tamanho10. Esses atributos tornam os NPs de ouro candidatos ideais para terapia fototérmica, com alguns atualmente em ensaios clínicos14.
Para otimizar a eficácia terapêutica e garantir danos térmicos tumorais suficientes durante o TTPP, é essencial estimar os parâmetros do tratamento, como dosagem de NP (em termos de concentração) e parâmetros de radiação NIR (incluindo intensidade e duração da irradiação) antes da aplicação pré-clínica/clínica do TTPP. Simulações numéricas são normalmente empregadas para estabelecer esses parâmetros. Vários métodos numéricos foram desenvolvidos para avaliar o dano térmico no tecido tumoral, sendo o método de Boltzmann em rede uma dessas abordagens 15,16. No entanto, para que essas simulações sejam confiáveis, elas devem ser validadas usando análogos de tecido conhecidos como simuladores de tecido. Esses simuladores podem ser preparados para replicar as propriedades ópticas, térmicas, biológicas ou mecânicas de tecidos reais, servindo como substitutos para realizar testes preliminares, avaliação de tratamento e validação de dispositivos, materiais ou métodos recém-desenvolvidos destinados a aplicações biológicas17,18. Isso pode reduzir o sofrimento desnecessário de animais ou seres humanos e abordar as preocupações éticas associadas a tais experimentos19,20.
O projeto e a fabricação de um simulador dependem da aplicação pretendida21. Por exemplo, durante fototerapias como o TTPP, a dose de radiação incidente é influenciada pela quantidade de luz absorvida ou espalhada pelos NPs e tecidos22,23. Portanto, simuladores ópticos que mimetizam as propriedades ópticas, especificamente o coeficiente de espalhamento reduzido (μs') e o coeficiente de absorção (μa) de tecidos biológicos, são usados para avaliações de TTPP e posterior validação de simulações numéricas24,25. Os simuladores ópticos são tipicamente compostos de três constituintes principais: uma matriz de base, agentes de dispersão e agentes de absorção 17,26. A matriz de base contém os componentes de dispersão e absorção em concentrações adequadas para replicar as propriedades ópticas desejadas. Esses simuladores podem ser classificados em simuladores sólidos, líquidos e semissólidos (hidrogel), dependendo do tipo de matriz de base. Para estudos termoterapêuticos como o PPTT, os simuladores de hidrogel, particularmente os simuladores à base de agarose, são preferidos devido à sua biocompatibilidade, espalhamento e absorção inerentes insignificantes, processo de fabricação simples e flexibilidade para serem moldados nas formas e tamanhos desejados correspondentes às geometrias do tumor19,22. Mais importante ainda, os simuladores à base de agarose preparados podem ser usados até ~ 70-80 ºC de temperatura a granel, pois a temperatura de fusão dos simuladores do tipo agarose é de ~ 80 ºC19. Para PPTT, como uma faixa de temperatura de ~ 50-80 ºC é suficiente, esses fantasmas à base de agarose podem ser usados para avaliações fototérmicas baseadas em PPTT.
Vários simuladores de imitação de tecido à base de hidrogel foram desenvolvidos e relatados para várias aplicações. Mustari et al. desenvolveram simuladores que imitam tecidos à base de agarose e demonstraram sua utilidade na validação de um sistema óptico recém-projetado18. Em outro estudo, simuladores termocrômicos que imitam tecidos foram preparados para medir a extensão do dano térmico durante a terapia de ultrassom focalizado de alta intensidade (HIFU)27. Simuladores que imitam tecidos à base de poliacrilamida também foram preparados para analisar o efeito da cavitação durante a terapia do câncer baseada em HIFU28. O objetivo deste estudo é demonstrar um método passo a passo para fabricar simuladores que imitam o tecido tumoral, juntamente com o protocolo para experimentos fototérmicos baseados em simuladores para avaliações de PPTT. Este protocolo detalhado proposto visa promover a adoção e reprodutibilidade da preparação do simulador e subsequentes métodos de experimentação fototérmica baseados em fantasmas para testar o desempenho fototérmico de nanoestruturas recém-desenvolvidas, validando assim as simulações numéricas e auxiliando no planejamento pré-tratamento ou otimização dos parâmetros terapêuticos do PPTT. Este artigo descreve um protocolo de preparação de simulador projetado especificamente para tumores de mama subsuperficiais; no entanto, as mesmas etapas podem ser adaptadas para a fabricação de vários tipos de tecido tumoral (de várias formas e tamanhos), alterando a composição dos agentes de absorção e espalhamento ópticos. Como exemplo, as avaliações fototérmicas baseadas em fantasmas que imitam tecidos demonstradas foram empregadas em estudos relatados anteriormente para validar simulações de PPTT para tumor de antebraço subsuperficial24, IDC subsuperficial25 e tumores de pele29.
Este artigo descreve as etapas de preparação de um simulador óptico que imita os μs' de um tumor de mama subsuperficial ou subcutâneo, especificamente carcinoma ductal invasivo (CDI), localizado 3 mm abaixo da superfície da pele e circundado por tecido mamário normal. O simulador é de geometria cilíndrica preparado usando agarose como matriz de base e intralipídio (IL) como agente de dispersão adicionado em concentrações adequadas para imitar μs 'de tecido mamário normal e canceroso. A agarose, um hidrogel transparente com dispersão e absorção insignificantes, é uma matriz de base ideal para simuladores ópticos18,30. Além disso, a IL, uma emulsão de 20% de gordura que imita a estrutura de bicamada das membranas celulares, é amplamente utilizada como agente dispersante31,32 e foi escolhida para este estudo para replicar os μs' do tecido mamário normal e canceroso. O simulador foi projetado para imitar o tumor de mama (IDC) injetado com nanobastões de ouro (AuNRs) como NPs plasmônicos, cercados por tecido mamário normal sem AuNRs. Dentre as várias NPs de ouro utilizadas no TTPP, as AuNRs foram selecionadas para este estudo devido à sua forte resposta plasmônica na região NIR e seu uso generalizado em estudos pré-clínicos de TTPP, incluindo aqueles envolvendo pacientes caninos e felinos14. O protocolo demonstra a preparação de dois tipos de simuladores: um com um tumor com distribuição de AuNR como visto com injeção IV e outro com um tumor refletindo a distribuição de AuNR obtida por meio de injeção de IT. Seguindo o protocolo de preparação do simulador, a configuração experimental para irradiação NIR e as etapas para a realização de avaliações fototérmicas nos simuladores são descritas. Finalmente, um guia passo a passo é fornecido para interpretar os resultados da distribuição de temperatura obtidos nessas avaliações e para comparar os dados experimentais com os resultados da simulação numérica. Essa comparação ajuda a validar um método numérico desenvolvido, permitindo o ajuste para parâmetros de tratamento ideais adaptados especificamente a um tumor.
Protocolo
NOTA: Os simuladores foram preparados usando agarose e intralipídio com base em composições relatadas na literatura para atingir as propriedades ópticas desejadas. Nenhum tecido biológico real de pacientes ou cadáveres foi usado. Portanto, a preparação desses simuladores é livre de restrições éticas e não requer consentimento informado.
1. Seleção ou fabricação de um molde adequado
- . Seleção de um molde adequado
- Escolha um molde que corresponda à forma e dimensões desejadas para os fantasmas. Para simuladores cilíndricos com uma região tumoral uniformemente distribuída com NPs e circundada por tecido normal, use uma placa de Petri de vidro e um béquer pequeno como molde8 (Figura 1A).
NOTA: Essas etapas são para preparar fantasmas que imitam o tecido tumoral em geometria cilíndrica. Para outras formas ou tamanhos, selecione um molde apropriado. Se um molde adequado não estiver disponível, fabrique um usando impressão tridimensional (3D), conforme detalhado na etapa 1.2.
- Escolha um molde que corresponda à forma e dimensões desejadas para os fantasmas. Para simuladores cilíndricos com uma região tumoral uniformemente distribuída com NPs e circundada por tecido normal, use uma placa de Petri de vidro e um béquer pequeno como molde8 (Figura 1A).
- Fabricação de moldes por impressão 3D
- Projete um modelo 3D usando o software CAD (Computer-aided Design) (por exemplo, SolidWorks, Autodesk Inventor ou CATIA) de acordo com a forma e o tamanho desejados. Para seguir este protocolo, projete um cilindro oco (diâmetro interno de 40 mm, espessura de 2 mm e altura de 12 mm; consulte o Arquivo Suplementar 1) e dois moldes de mascaramento cilíndricos sólidos (dimensões φ20 x 6 mm e φ14 x 3 mm), conforme mostrado na Figura 1B.
- Para projeto/desenho de cilindros ocos, em software CAD, crie dois círculos com diâmetros de 40 mm e 44 mm. Em seguida, extrude a geometria por 12 mm.
- Para moldes de mascaramento cilíndricos sólidos, crie círculos com diâmetros de 20 mm e 14 mm e, em seguida, extrude para 6 mm e 3 mm, respectivamente (consulte o Arquivo Suplementar 2 e o Arquivo Suplementar 3). Desenhe um retângulo (lados 44 mm e 5 mm) em um lado do cilindro e extrude por 2 mm.
- Converta os modelos 3D para o formato Gcode usando software compatível com impressora 3D (por exemplo, Cura) para impressão.
- Use este Gcode para imprimir os moldes (por exemplo, aqui, usando ácido polilático [PLA] φ1,75 mm, 1 kg de eSun) usando uma impressora 3D.
NOTA: O retângulo é desenhado para suspender os moldes de mascaramento. Diferentes moldes podem ser projetados e fabricados para preparar fantasmas com outras formas desejadas.
- Projete um modelo 3D usando o software CAD (Computer-aided Design) (por exemplo, SolidWorks, Autodesk Inventor ou CATIA) de acordo com a forma e o tamanho desejados. Para seguir este protocolo, projete um cilindro oco (diâmetro interno de 40 mm, espessura de 2 mm e altura de 12 mm; consulte o Arquivo Suplementar 1) e dois moldes de mascaramento cilíndricos sólidos (dimensões φ20 x 6 mm e φ14 x 3 mm), conforme mostrado na Figura 1B.
2. Preparação de soluções fantasmas que imitam o tecido tumoral25
NOTA: Neste estudo, simuladores ópticos à base de agarose de geometria cilíndrica que imitam o tecido tumoral são preparados para se assemelhar a um tumor de mama subsuperficial injetado com AuNRs, via injeção IT ou IV, conforme mostrado na Figura 2. O simulador de TI tem duas regiões: uma região tumoral central com AuNRs e uma região de tecido normal circundante. O simulador IV tem três regiões: uma região tumoral com AuNRs na periferia do tumor, uma região central do tumor nu sem AuNRs e uma região de tecido normal circundante. Como as propriedades ópticas (μa e μs') diferem para tumor e tecido normal, soluções fantasmas separadas são preparadas para cada região com composições diferentes e serão discutidas separadamente.
- Preparação de solução fantasma imitando tecido mamário normal (Solução 1)
NOTA: Esta solução será usada para simuladores de TI e IV. As etapas de preparação da Solução 1 são mostradas na Figura 3A.- Calcule o volume teórico da solução com base nas dimensões do molde.
NOTA: Aqui, para o molde cilíndrico de φ40 x 12 mm, o volume calculado é de 15 cm3 ou 15 mL por simulador. Como dois desses simuladores precisam ser preparados, o volume total é de 15 mL x 2, que é de 30 mL. Portanto, prepare 35 mL da solução para contabilizar a evaporação ou derramamento durante a etapa de preparação do fantasma. - Calcular a quantidade (peso/concentração/volume) de todos os constituintes fantasmas - agarose (como material de base) e IL (como constituinte de dispersão) - a adicionar à solução de 35 ml.
- Adicionar 0,35 g de agarose para preparar 35 ml de solução correspondente a uma concentração de 1% p/v.
- Estime a concentração de IL correspondente aos μ s' desejados do tecido mamário normal (ou seja, 10,1 cm-1 33) com base na concentração de IL versus os dados de μs 'disponíveis na literatura. Em seguida, calcule o volume de IL (20% de estoque de emulsão) a ser adicionado à solução fantasma usando a equação (1):
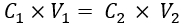 (1)
(1)
Em que C1 e V1 são a concentração da reserva de reagente (neste caso, 20% de reserva de IL) e o volume da solução reserva de reagente a adicionar (aqui deve ser calculado), respectivamente. C2 é a concentração necessária do reagente (a ser obtida da literatura) na solução de trabalho final, e V2 é o volume total da solução de trabalho final (aqui, 35 mL).
NOTA: Aqui, para μs' de 10,1 cm-1, a concentração de IL estimada a partir da literatura relatada é de 1,04%34,35. Usando as etapas acima, o volume de IL (20% de estoque de IL) a ser adicionado é de 1,82 mL.
- Pesar 0,35 g de agarose e adicioná-lo a 33,18 mL de água deionizada (DI) em um béquer. Cubra o copo com papel alumínio para evitar perda de água.
- Aquecer o copo que contém a solução numa placa quente a 120 °C, agitando até que a solução fique transparente.
- Abaixe a temperatura da placa de aquecimento para 60 ºC. Após 15 min, adicione 1,82 mL de IL enquanto mexe. Manter a solução resultante, Solução 1, em agitação a 60 ° C até à utilização (pronta a verter).
NOTA: A solução fantasma a 60 ºC deve ser mantida em condições de agitação. Caso contrário, leva à solidificação da solução.
- Calcule o volume teórico da solução com base nas dimensões do molde.
- Preparação de solução fantasma tumoral embebida em AuNR (Solução 2)
NOTA: Esta solução será usada para simuladores de TI e IV. As etapas de preparação da Solução 2 são mostradas na Figura 3B.- Calcule o volume da região tumoral a ser preenchida (φ20 x 6 mm).
NOTA: O volume aproximado para dois desses fantasmas tumorais é de 3,8 mL. Assim, o volume da solução a ser preparada seria de 4,5 mL. - Calcule a quantidade de constituintes fantasmas tumorais a serem adicionados - agarose, IL e AuNRs - usando etapas semelhantes às mencionadas na Seção 2.1.
- Adicionar 45 mg para preparar 4,5 ml de solução correspondente a uma concentração de 1% p/v.
- IL:μs' de tumor de mama é de 4,6 cm-1 33 e para mimetizar o mesmo, a concentração de IL correspondente necessária é de 0,472%34,35. Portanto, adicione 106,2 μL de IL de estoque de IL a 20% de IL a 4,5 mL de solução fantasma tumoral.
- A concentração desejada de AuNRs no simulador é de 25 μg/mL. Para conseguir o mesmo, adicione 3,21 mL de solução de AuNRs (concentração estoque: 35 μg/mL) à solução fantasma do tumor.
- Adicione 45 mg de agarose a 1,18 mL de água DI em um béquer e cubra-o com uma folha de alumínio.
- Colocar o copo numa placa quente e agitar a 120 ° C até a solução ficar transparente.
- Reduzir a temperatura da placa de aquecimento para 60 ºC e deixar a solução repousar durante 15 min.
- Adicione 106,2 μL de IL e 3,21 mL de suspensão AuNR (35 μg / mL) sob condições de agitação. Manter a solução resultante, Solução 2, sob agitação a 60 ºC até verter.
- Calcule o volume da região tumoral a ser preenchida (φ20 x 6 mm).
- Preparação de solução fantasma de tumor nu (sem AuNRs) (Solução 3)
NOTA: Esta solução será usada apenas para o simulador IV. As etapas de preparação da Solução 2 são mostradas na Figura 3C.- Calcule o volume teórico da suspensão a ser adicionada para criar uma região tumoral nua (~ φ20 x 6 mm).
NOTA: O volume aproximado para simuladores tumorais é de 1,9 mL. Assim, o volume da solução a ser preparada seria de 2,5 mL. - Calcule a quantidade de constituintes fantasmas tumorais a serem adicionados - agarose e IL - usando etapas semelhantes às mencionadas na Seção 2.1.
- Adicione 25 mg de agarose para preparar 2,5 ml de solução de modo a atingir uma concentração de 1% p/v.
- IL:μs' de tumor de mama é de 4,6 cm-1 33 e para mimetizar o mesmo, a concentração de IL correspondente necessária é de 0,472%34,35. Adicione 59 μL de estoque de 20% de IL.
- Adicione 25 mg de agarose a 2,44 mL de água DI em um béquer e cubra-o com uma folha de alumínio.
- Colocar o copo numa placa quente e agitar a 120 ° C até que a solução fique transparente.
- Reduzir a temperatura da placa de aquecimento para 60 ºC e deixar a solução repousar durante 15 min.
- Adicionar 59 μL de IL à solução em condições de agitação. Conservar a solução resultante, Solução 3, em agitar a 60 ° C até verter.
- Calcule o volume teórico da suspensão a ser adicionada para criar uma região tumoral nua (~ φ20 x 6 mm).
3. Preparação de simulador que imita tecido tumoral 24,25,36
- Prepare os moldes para a etapa de vazamento. Para isso, sele o fundo dos moldes cilíndricos com parafilme e coloque o molde de mascaramento (φ20 x 6 mm) no centro.
- Despeje a solução 1 nos moldes cilíndricos até a marca superior do molde de mascaramento e deixe-o solidificar (Figura 4A).
- Após a solidificação, remova o molde de mascaramento para criar uma cavidade para a região do tumor (Figura 4B).
NOTA: O protocolo será o mesmo para os simuladores IT e IV até a etapa 3.3. O processo será discutido separadamente para simuladores IT e IV após a etapa 3.3. - Fantasma de TI 24,25,36
- Encha a cavidade com a solução 2 e deixe-a solidificar ( Figura 4C ).
- Adicione a Solução 1 ao topo do simulador e deixe-o solidificar completamente (Figura 4D).
- IV fantasma 24,25
- Insira um molde de mascaramento menor (φ14 x 3 mm) e preencha a cavidade ao redor com a Solução 2 (Figura 4E).
- Após a solidificação, remova o molde menor e preencha a cavidade restante com a Solução 3 (Figura 4F).
- Adicione a Solução 1 ao topo e permita a solidificação completa (Figura 4G).
4. Inserção dos termopares dentro do simulador 24,25,36
NOTA: Para monitorar a distribuição espacial da temperatura, termopares tipo K são inseridos dentro do simulador em vários locais radiais (r) e axiais (z), conforme ilustrado na Figura 2. Para inserção de termopares em locais precisos, capilares de vidro são usados como guias para garantir a precisão. Os locais do termopar são denotados como (r, z), onde o ponto médio na superfície superior do tumor na profundidade z = 3 mm serve como ponto de referência para os simuladores IT e IV e é designado como (0, 3), conforme mostrado na Figura 2A, B. Ao selecionar os locais radiais e axiais para quantificar o dano térmico na região do tumor, os locais na periferia do tumor (radial e axial) são críticos. Atingir as temperaturas necessárias nesses pontos periféricos durante a irradiação NIR garante a ablação completa do tumor. Assim, os termopares são colocados em pontos extremos radiais (do tumor) em z = 3 e 9 mm, ou seja, (10, 3) e (10, 9), e um termopar é colocado na interface tumor-tecido em z = 9 mm (localização axial periférica), ou seja, (0, 9) conforme ilustrado na Figura 2A, B. Além disso, para avaliar a distribuição axial da temperatura, um termopar é inserido entre os locais (0, 3) e (0, 9), designados como (0, 6). Por fim, para avaliar o aumento da temperatura na região do tecido saudável circundante, um termopar é inserido em (15, 3).
- Corte os capilares de vidro em comprimentos adequados para que atinjam os locais radiais e axiais desejados dentro do simulador.
- Insira termopares dentro desses capilares de vidro e perfure em locais de simulação radiais e axiais especificados, um por um.
- Uma vez que todos os termopares estejam no lugar, coloque cuidadosamente o simulador em uma placa de Petri de vidro para irradiação NIR subsequente, conforme mostrado na Figura 5A.
5. Exposição à irradiação NIR e medição das temperaturas fototérmicas resultantes36
- Coloque a placa de Petri de vidro contendo o simulador (inserida com termopares) de modo que a região central da superfície superior do simulador fique perpendicular à ponta da fibra óptica da fonte de luz NIR, conforme ilustrado na Figura 5A.
NOTA: O diâmetro do feixe na superfície do fantasma pode ser ajustado alterando a distância entre a superfície e a ponta da fibra óptica. Aqui, uma distância de 9 mm é mantida para atingir um diâmetro de feixe de 20 mm, cobrindo a região central do tumor. - Conecte o sistema Data Acquisition (DAQ) ao computador e abra o software LabVIEW.
- Ligue a fonte de luz NIR (Figura 5B) e o botão play no software simultaneamente para registrar os dados de temperatura no início da irradiação.
- Irradie o fantasma por 20 minutos, depois desligue a fonte de luz NIR e pare a gravação.
- Plote os dados de temperatura versus tempo registrados.
6. Comparação de temperatura com resultados de simulação24,25
NOTA: Os experimentos geralmente são repetidos e as temperaturas são registradas em intervalos de tempo definidos em todos os locais do termopar. Para validação, as seguintes etapas são executadas:
- Calcule a média e o desvio padrão das temperaturas experimentais em todos os locais do termopar (r, z).
- Calcule as temperaturas em locais de termopar considerados numericamente.
- Representar graficamente a temperatura média obtida a partir das experiências e a temperatura obtida por simulação em todos os locais do termopar em relação ao tempo, mostradas na figura 6.
- Calcule a raiz do erro quadrático médio (RMSE) e o erro médio absoluto (MAE) para todos os locais do termopar para quantificar a diferença de temperatura para avaliar a validação, conforme mostrado na Tabela 1.
NOTA: O MAE e o RMSE são calculados usando as Equações 2 e 3, respectivamente.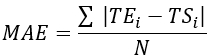 (2)
(2)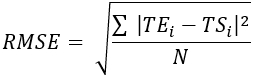 (3)
(3)
Onde TE, TS e N são a temperatura obtida experimentalmente, a temperatura calculada numericamente e o número de pontos de dados (aqui, as temperaturas são registradas a cada segundo por 20 min; portanto, = 1.200), respectivamente. i representa instantes de tempo.
Resultados
A Figura 6 mostra as temperaturas médias temporais obtidas durante experimentos com um simulador de tecido tumoral embebido em AuNR em todos os locais do termopar, conforme mostrado na Figura 2, em comparação com as temperaturas obtidas durante as simulações nos locais do termopar correspondentes. Aqui, os experimentos foram realizados 4x para cada distribuição, ou seja, distribuições IT...
Discussão
Este artigo apresenta o protocolo para a preparação de tecido tumoral à base de agarose mimetizando simuladores ópticos. Os simuladores são projetados de forma a imitar as propriedades ópticas do tumor e dos tecidos normais para seu uso em estudos para PPTT. Neste estudo, destaca-se a aplicação desses simuladores para validação de métodos numéricos durante o TTPP. A etapa mais crítica neste protocolo é manter a temperatura das soluções fantasmas contendo agarose e IL a 60...
Divulgações
Os autores não têm interesses conflitantes a divulgar.
Agradecimentos
Este estudo foi realizado sem qualquer apoio financeiro de quaisquer órgãos de financiamento públicos, comerciais ou sem fins lucrativos. Os autores agradecem à CSIR-Central Scientific Instruments Organisation, Chandigarh, Índia, pela infraestrutura e suporte.
Materiais
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | 9012-36-6 | Base matrix for phantoms |
| Deionized (DI) water (18.2 MΩ) | NA | NA | Solvent for the preparation of phantom solutions |
| Gold nanorods (AuNRs) | Nanopartz | A12-10-808 | Plasmonic nanoparticles |
| Intralipid (20% emulsion stock) | Sigma-Aldrich | 68890-65-3 | Scattering agent of phantoms |
| Parafilm | Parafilm M | 380020 | To seal the bottom of cylindrical mold |
| Polylactic acid filament | eSun | NA | Material for molds (1.75 mm dia wire) |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| 3D Printer | Creality | Ender-3 | For printing molds |
| Data acquisition (DAQ) system | National Instruments | cDAQ-9171 | For recording temperatures |
| DI water unit | Merck Millipore | Direct-Q3 | For DI water |
| Hot plate with magnetic stirrer | IKA | C-MAG HS 4 | For phantom solutions preparation |
| NIR light source | NA (In-house developed) | NA | For NIR irradiation of phantoms, (800/50 nm; Center wavelength: 800 nm, Bandwidth: 50 nm) |
| Optical Fiber (1/2" × 12") | Edmund Optics | 38-659 | For NIR irradiation of phantoms |
| Type K thermocouples | RS Components | RS Pro 397-1589 | For temperature monitoring at various phantom locations during NIR irradiation |
| Weighing Balance | Wensar | PGB 200 | For weighing agarose |
| Name of Software | Company | Catalog Number | Comments/Description |
| Autodesk Inventor 2021 | Autodesk | NA | For mechanical designing of molds |
| Cura 5.7 | Ultimaker | NA | For converting mechanical design to Gcode for 3D printing |
| Matlab R2024b | MathWorks | NA | For numerical simulations and temperature data plots |
| Name of Labwares used | Company | Catalog Number | Comments/Description |
| Beakers (50 mL) | Borosil | 1000D12 | For phantom solution preparations |
| Beakers (10 mL) | Borosil | 1000006 | For phantom solution preparations |
| Pipette (100-1000 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 063 | For adding constituents into the phantom solution |
| Pipette (10-100 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 047 | For adding constituents into the phantom solution |
| Spatula | Borosil | LASC8888M06 | For weighing agarose and demolding the phantoms from the molds |
| Tips (100-1000 µL) | Tarsons | 521016 | For adding constituents into the phantom solution |
| Tips (10-100 µL) | Tarsons | 521010Y | For adding constituents into the phantom solution |
Referências
- Riley, R. S., Day, E. S. Gold nanoparticle-mediated photothermal therapy: applications and opportunities for multimodal cancer treatment. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (4), e1449 (2017).
- Webb, J. A., Bardhan, R. Emerging advances in nanomedicine with engineered gold nanostructures. Nanoscale. 6 (5), 2502-2530 (2014).
- Abadeer, N. S., Murphy, C. J. Recent progress in cancer thermal therapy using gold nanoparticles. J Phys Chem C. 120 (9), 4691-4716 (2016).
- Murphy, C. J., et al. Virus-sized gold nanorods: Plasmonic particles for biology. Acc Chem Res. 52 (8), 2124-2135 (2019).
- Overchuk, M., Weersink, R. A., Wilson, B. C., Zheng, G. Photodynamic and photothermal therapies: Synergy opportunities for nanomedicine. ACS Nano. 17 (9), 7979-8003 (2023).
- Goldberg, S. N., Gazelle, G. S., Mueller, P. R. Thermal ablation therapy for focal malignancy. Am J Roentgenol. 174 (2), 323-331 (2000).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Role of optical coefficients and healthy tissue-sparing characteristics in gold nanorod-assisted thermal therapy. Int J Hyperth. 29 (1), 87-97 (2013).
- Khurana, D., Vikas, A. K., Shaw, S., Soni, Polydopamine coated gold nano blackbodies for tumor-selective spatial thermal damage during plasmonic photothermal cancer therapy. IEEE Trans Nanobiosci. 21 (4), 482-489 (2021).
- Jung, H. S., Verwilst, P., Sharma, A., Shin, J., Sessler, J. L., Kim, J. S. Organic molecule-based photothermal agents: an expanding photothermal therapy universe. Chem Soc Rev. 47 (7), 2280-2297 (2018).
- Ge, R. L., Yan, P. N., Liu, Y., Li, Z. S., Shen, S. Q., Yu, Y. Recent advances and clinical potential of near infrared photothermal conversion materials for photothermal hepatocellular carcinoma therapy. Adv Func Mater. 33 (29), 2301138 (2023).
- Shabani, L., et al. An investigation into green synthesis of Ru template gold nanoparticles and the in vitro photothermal effect on the MCF-7 human breast cancer cell line. Appl Phys A. 129 (8), 564 (2023).
- Mosleh-Shirazi, S., et al. Investigation through the anticancer properties of green synthesized spinel ferrite nanoparticles in present and absent of laser photothermal effect. Ceram Int. 49 (7), 11293-11301 (2023).
- Amani, A. M., et al. Innovation applications of MXenes in biomedicine. Mater Today Commun. 40, 109929 (2024).
- Ali, M. R. K., Wu, Y., El-Sayed, M. A. Gold-nanoparticle-assisted plasmonic photothermal therapy advances toward clinical application. J Phys Chem C. 123 (25), 15375-15393 (2019).
- Lahonian, M., Golneshan, A. A. Numerical study of temperature distribution in a spherical tissue in magnetic fluid hyperthermia using Lattice Boltzmann method. IEEE Trans NanoBiosci. 10 (4), 262-268 (2011).
- Shaw, A. K., Soni, S. Role of periodic irradiation and incident beam radius for plasmonic photothermal therapy of subsurface tumors. J Therm Biol. 121, 103859 (2024).
- Pogue, B. W., Patterson, M. S. Review of tissue simulating phantoms for optical spectroscopy, imaging and dosimetry. J Biomed Opt. 11 (4), 041102 (2006).
- Mustari, A., et al. Agarose-based tissue mimicking optical phantoms for diffuse reflectance spectroscopy. J Vis Exp. (138), e57578 (2018).
- Dabbagh, A., Abdullah, B. J. J., Ramasindarum, C., Abu Kasim, N. H. Tissue-mimicking gel phantoms for thermal therapy studies. Ultrason imaging. 36 (4), 291-316 (2014).
- Khurana, D., et al. Experimental investigation of photothermal conversion and thermal conductivity of broadband absorbing gold nanoblackbodies and graphene oxide nanoparticles for plasmonic photothermal cancer therapy. Int Commun Heat Mass Transf. 156, 107597 (2024).
- Ortega-Palacios, R., Leija, L., Vera, A., Cepeda, M. F. J. Measurement of breast-tumor phantom dielectric properties for microwave breast cancer treatment evaluation. , 216-219 (2010).
- Wagnières, G., et al. An optical phantom with tissue-like properties in the visible for use in PDT and fluorescence spectroscopy. Phys Med Biol. 42 (7), 1415 (1997).
- Didychuk, C. L., Ephrat, P., Chamson-Reig, A., Jacques, S. L., Carson, J. J. L. Depth of photothermal conversion of gold nanorods embedded in a tissue-like phantom. Nanotechnology. 20 (19), 195102 (2009).
- Shaw, A. K., Khurana, D., Soni, S. Thermal damage analysis of sub-surface soft tissue sarcoma for Indocyanine Green mediated photothermal cancer therapy. Therm Sci Eng Prog. 46, 102168 (2023).
- Shaw, A. K., Khurana, D., Soni, S. Assessment of thermal damage for plasmonic photothermal therapy of subsurface tumors. Phys Eng Sci Med. 47 (3), 1107-1121 (2024).
- Khurana, D., Soni, S. Tissue-mimicking phantoms for photothermal performance evaluations. Recent Trends in Cancer Therapeutics: Plasmonic Photothermal-Based Multimodal Cancer Therapy. , 109-136 (2024).
- Eranki, A., et al. Tissue-mimicking thermochromic phantom for characterization of HIFU devices and applications. Int J Hyperth. 36 (1), 517-528 (2019).
- McLaughlan, J. R. Controllable nucleation of cavitation from plasmonic gold nanoparticles for enhancing high intensity focused ultrasound applications. J Vis Exp. (140), e58045 (2018).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Experimental and numerical investigation of heat confinement during nanoparticle-assisted thermal therapy. Int Commun Heat Mass Transf. 69, 11-17 (2015).
- Ntombela, L., Adeleye, B., Chetty, N. Low-cost fabrication of optical tissue phantoms for use in biomedical imaging. Heliyon. 6 (3), e03602 (2020).
- Lai, P., Xu, X., Wang, L. V. Dependence of optical scattering from Intralipid in gelatin-gel based tissue-mimicking phantoms on mixing temperature and time. J Biomed Opt. 19 (3), 035002 (2014).
- Aernouts, B., Van Beers, R., Watté, R., Lammertyn, J., Saeys, W. Dependent scattering in Intralipid®phantoms in the 600-1850 nm range. Opt Express. 22 (5), 6086-6098 (2014).
- Tromberg, B. J., et al. Non-invasive in vivo characterization of breast tumors using photon migration spectroscopy. Neoplasia. 2 (1-2), 26-40 (2000).
- Kanick, S. C., et al. Scattering phase function spectrum makes reflectance spectrum measured from Intralipid phantoms and tissue sensitive to the device detection geometry. Biomed Opt Express. 3 (5), 1086-1100 (2012).
- Yuan, B., Chen, N., Zhu, Q. Emission and absorption properties of indocyanine green in Intralipid solution. J Biomed Opt. 9 (3), 497-503 (2004).
- Khurana, D., et al. Gold nanoblackbodies-based multifunctional nanocomposite for multimodal cancer therapy. Int J Pharm. 642, 123112 (2023).
- Brough, D., Ramos, J., Delpech, B., Jouhara, H. Development and validation of a TRNSYS type to simulate heat pipe heat exchangers in transient applications of waste heat recovery. Int J Thermofluid. 9, 100056 (2021).
- Vardaki, M. Z., Kourkoumelis, N. Tissue phantoms for biomedical applications in Raman spectroscopy: A review. Biomed Eng Computational Biol. 11, 1179597220948100 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados