JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
플라즈모닉 광열 암 치료: 광열 온도 분포 시각화를 위한 나노 입자 내장 종양 조직 모방 팬텀
요약
이 논문은 플라즈몬 광열 요법을 위해 광학적 특성을 복제하는 종양 조직 팬텀을 준비하기 위한 프로토콜을 제시합니다. 이 백서는 팬텀 준비, 광열 평가 및 치료 매개변수를 평가하기 위한 광열 온도 측정을 기반으로 개발된 수치 모델의 검증에 대해 자세히 설명하며, 예비 테스트를 위한 생체 내 연구에 대한 윤리적이고 비용 효율적인 대안을 제공합니다.
초록
새로운 암 치료법인 플라즈몬 광열 요법(PPTT)은 나노 입자(NP)를 종양에 전달한 다음 근적외선(NIR) 조사를 통해 암세포를 파괴하는 국소 열을 생성하는 것입니다. PPTT를 투여하기 전에 NP 농도, 조사 강도 및 지속 시간과 같은 치료 매개변수를 추정해야 합니다. 이를 위해 수치 시뮬레이션이 수행됩니다. 그러나 강력한 계산을 보장하기 위해서는 종양 조직의 광학적 특성을 복제하는 종양 조직 모방 팬텀에 대한 광열 실험을 통해 이러한 시뮬레이션을 검증해야 합니다. PPTT의 경우, 치료 매개변수는 조직과 NP에 의한 입사 방사선의 산란 및 흡수에 의해 제어됩니다. 따라서 표적 종양/조직의 감소된 산란 계수(μs') 및 흡수 계수(μa)를 모방한 팬텀에 대한 검증 실험을 수행할 수 있습니다.
특히, 이 프로토콜은 정상 유방 조직으로 둘러싸인 금 나노막대가 주입된 유방 종양의 μ 및 μ 모방한 팬텀을 준비하기 위한 지침을 제공합니다. 이 프로토콜은 또한 NIR 조사, 온도 모니터링 및 시공간 온도를 열전대를 사용하여 측정한 온도와 비교하여 수치 결과 검증에 대해 자세히 설명합니다. 이 연구에서 제시된 프로토콜은 치수(φ40 x 12mm) 및 중심 종양 영역(φ20 x 6mm)을 가진 하이드로겔 기반 원통형 유방 종양 조직 팬텀의 준비를 촉진했으며, 1% 아가로스를 기본 매트릭스로, 산란 구성 성분으로 지질 내를 포함하며 25μg/mL 농도의 금 나노로드가 내장된 종양 영역을 포함합니다. 사례 연구의 대표적인 결과는 PPTT에 대한 수치 시뮬레이션을 검증하기 위해 제작된 팬텀의 적용을 보여줍니다. 이 연구는 입증된 프로토콜이 생체 내 실험 전에 치료 매개변수를 최적화 및 계획하고 PPTT에 대한 수치 시뮬레이션을 검증하는 것을 목표로 하는 광열 실험을 수행하는 데 유용하다는 결론을 내렸습니다.
서문
플라즈몬 광열 요법(PPTT)은 나노 입자(NP)를 종양 부위에 전달한 다음 근적외선(NIR) 방사선을 조사하는 새로운 국소 암 치료 방식입니다. NP는 일반적으로 종양내(IT) 또는 정맥내(IV) 경로1을 통해 투여됩니다. NIR 조사 시, 입사 방사선과 NP의 플라즈몬 상호 작용은 NP 표면에서 국부적 인 열을 생성 한 다음 주변 종양 조직으로 소멸합니다 2,3. 이러한 국부적인 가열은 종양 부위의 온도를 상승시켜 열 절제를 통해 암세포를 사멸시킵니다 4,5. 효과적인 암 치료는 다양한 생물학적 과정을 통해 46ºC에서 1시간6분, 50-52ºC에서 4-6분7 또는 60ºC에서 즉각적인 손상8과 같은 특정 온도를 유지함으로써 달성할 수 있다.
광열 요법 응용을 위해 다양한 광열제제가 연구되고 보고되었으며, 그 치료 효능은 in vitro 또는 in vivo 연구를 통해 평가되었습니다. 이러한 물질은 근적외선 염료(예: Indocyanine Green, IR780, IR820)와 같은 유기 물질9, 폴리머 기반 광열제(예: 폴리도파민) 및 귀금속 기반 NP 또는 플라즈몬 NP(예: 금 NP)11, 전이 금속 황/산화물(12) 및 MXenes(13)를 포함한 무기 물질10을 포함합니다. 이 중 플라즈몬 NP, 특히 금 NP는 기존 광열제(예: 염료)에 비해 더 나은 광열 안정성, 더 높은 광열 변환 효율, 모양 및 크기 변화를 통한 조정 가능한 플라즈몬 반응과 같은 몇 가지 이점을 제공합니다10. 이러한 특성으로 인해 gold NP는 광열 요법에 이상적인 후보가 되었으며, 그 중 일부는 현재 임상 시험14을 진행 중입니다.
PPTT를 적용하는 동안 치료 효능을 최적화하고 충분한 종양 열 손상을 보장하려면 PPTT의 전임상/임상 적용 전에 NP 투여량(농도 측면) 및 NIR 방사선 매개변수(방사선 조사 강도 및 지속 시간 포함)와 같은 치료 매개변수를 추정하는 것이 중요합니다. 수치 시뮬레이션은 일반적으로 이러한 매개변수를 설정하는 데 사용됩니다. 종양 조직 내의 열적 손상을 평가하기 위해 다양한 수치적 방법이 개발되었으며, 격자 볼츠만(lattice Boltzmann) 방법이 그러한 접근법 중 하나입니다15,16. 그러나 이러한 시뮬레이션의 신뢰성을 위해서는 조직 모방 팬텀(tissue-mimicing phantom)으로 알려진 조직 유사체를 사용하여 검증해야 합니다. 이러한 팬텀은 실제 조직의 광학적, 열적, 생물학적 또는 기계적 특성을 복제할 수 있도록 준비할 수 있으며, 생물학적 응용 분야를 위해 새로 개발된 장치, 재료 또는 방법에 대한 예비 테스트, 치료 평가 및 검증을 수행하기 위한 대체물 역할을 할 수 있습니다17,18. 이를 통해 동물이나 인간 피험자의 불필요한 고통을 줄일 수 있고, 이러한 실험과 관련된 윤리적 문제를 해결할 수 있다19,20.
팬텀의 설계 및 제작은 의도된 응용 프로그램(21)에 따라 다릅니다. 예를 들어, PPTT와 같은 광선 요법 중에 입사 방사선의 선량은 NP와 조직에 의해 흡수되거나 산란되는 빛의 양에 의해 영향을 받습니다22,23. 그러므로, 광학적 특성, 특히 생물학적 조직의 감소된 산란 계수(μs') 및 흡수 계수(μa)를 모방하는 광학 팬텀은 PPTT 평가 및 수치 시뮬레이션의 후속 검증에 사용됩니다24,25. 광학 팬텀은 일반적으로 기본 매트릭스, 산란제 및 흡수제의 세 가지 주요 구성 요소로 구성됩니다17,26. 기본 매트릭스는 산란 및 흡수 성분을 원하는 광학 특성을 복제하기 위해 적절한 농도로 유지합니다. 이러한 팬텀은 기본 매트릭스의 유형에 따라 고체, 액체 및 반고체(하이드로겔) 팬텀으로 분류할 수 있습니다. PPTT와 같은 열 치료 연구의 경우, 하이드로겔 팬텀, 특히 아가로스 기반 팬텀은 생체 적합성, 무시할 수 있는 고유한 산란 및 흡수, 간단한 제조 공정 및 종양 기하학적 구조에 해당하는 원하는 모양과 크기로 주조할 수 있는 유연성으로 인해 선호됩니다19,22. 가장 중요한 것은 아가로스 유형 팬텀의 용융 온도가 ~80ºC19이기 때문에 준비된 아가로스 기반 팬텀은 최대 ~70-80ºC 벌크 온도에서 사용할 수 있다는 것입니다. PPTT의 경우 ~50-80ºC의 온도 범위로 충분하므로 이러한 아가로스 기반 팬텀을 PPTT 기반 광열 평가에 사용할 수 있습니다.
다양한 하이드로겔 기반 조직 모방 팬텀이 다양한 응용 분야를 위해 개발되고 보고되었습니다. Mustari 등은 아가로스 기반 조직 모방 팬텀을 개발했으며 새로 설계된 광학 시스템18을 검증하는 데 유용성을 입증했습니다. 또 다른 연구에서는 고강도 집속 초음파(HIFU) 요법 중 열 손상 정도를 측정하기 위해 조직을 모방한 열변색 팬텀을 준비했습니다27. 폴리아크릴아미드 기반 조직 모방 팬텀은 HIFU 기반 암 치료 중 캐비테이션 효과를 분석하기 위해 준비되었습니다28. 이 연구의 목적은 PPTT 평가를 위한 팬텀 기반 광열 실험 프로토콜과 함께 종양 조직을 모방하는 팬텀을 제작하는 단계별 방법을 시연하는 것입니다. 이 제안된 세부 프로토콜은 새로 개발된 나노 구조체의 광열 성능을 테스트하기 위한 팬텀 제제 및 후속 팬텀 기반 광열 실험 방법의 채택 및 재현성을 촉진하여 수치 시뮬레이션을 검증하고 PPTT의 치료 매개변수의 전처리 계획 또는 최적화를 돕는 것을 목표로 합니다. 이 기사는 표면 아래 유방 종양을 위해 특별히 설계된 팬텀 준비 프로토콜에 대해 설명합니다. 그러나 광학 흡수 및 산란제의 구성을 변경하여 다양한 종양 조직 유형(다양한 모양 및 크기)을 제작하는 데 동일한 단계를 적용할 수 있습니다. 예를 들어, 입증된 조직 모방 팬텀 기반 광열 평가는 이전에 보고된 연구에서 표면 아래 팔뚝 종양24, 표면 아래 IDC25 및 피부 종양29에 대한 PPTT 시뮬레이션을 검증하기 위해 사용되었습니다.
이 논문은 표면 아래 또는 피하 유방 종양, 특히 피부 표면 아래 3mm에 위치하며 정상 유방 조직으로 둘러싸인 침습성 유관 암종(IDC)의 μ s'를 모방한 광학 팬텀의 준비 단계를 설명합니다. 팬텀은 아가로스를 염기 매트릭스로, 산란제인 지질내(IL)를 사용하여 정상 및 암성 유방 조직의 μ s'를 모방하기 위해 적절한 농도로 첨가하여 준비된 원통형 기하학적 구조입니다. 산란 및 흡수가 무시할 수 있는 투명한 하이드로겔인 아가로스(Agarose)는 광학 팬텀18,30에 이상적인 기본 매트릭스입니다. 또한, 세포막의 이중층 구조를 모방한 20% 지방 에멀젼인 IL은 산란제로 널리 사용되며 31,32 정상 및 암성 유방 조직의 μ s'를 복제하기 위해 이 연구를 위해 선택되었습니다. 팬텀은 AuNR이 없는 정상 유방 조직으로 둘러싸인 플라즈몬 NP로 금 나노막대(AuNR)를 주입한 유방 종양(IDC)을 모방하도록 설계되었습니다. PPTT에 사용된 다양한 금 NP 중에서 AuNR은 NIR 영역에서의 강력한 플라즈몬 반응과 개 및 고양이 환자를 포함한 전임상 PPTT 연구에서 널리 사용되기 때문에 본 연구를 위해 선택되었습니다14. 이 프로토콜은 두 가지 유형의 팬텀을 준비하는 방법을 보여줍니다: 하나는 IV 주입에서 볼 수 있는 AuNR 분포를 특징으로 하는 종양이 있는 것이고, 다른 하나는 IT 주입을 통해 달성된 AuNR 분포를 반영하는 종양이 있는 것입니다. 팬텀 준비 프로토콜에 따라 NIR 조사에 대한 실험 설정과 팬텀에 대한 광열 평가를 수행하는 단계에 대해 설명합니다. 마지막으로, 이러한 평가에서 얻은 온도 분포 결과를 해석하고 실험 데이터를 수치 시뮬레이션 결과와 비교하기 위한 단계별 가이드가 제공됩니다. 이 비교는 개발된 수치 방법을 검증하는 데 도움이 되며, 종양에 특별히 맞춤화된 최적의 치료 매개변수를 조정할 수 있습니다.
프로토콜
참고: 팬텀은 원하는 광학적 특성을 달성하기 위해 문헌에 보고된 조성을 기반으로 아가로스 및 지질내를 사용하여 제조되었습니다. 환자나 시체의 실제 생체 조직은 사용하지 않았다. 따라서 이러한 팬텀의 준비는 윤리적 제약에서 자유롭고 정보에 입각한 동의를 필요로 하지 않습니다.
1. 적합한 금형의 선택 또는 제작
- . 적합한 금형 선택
- 팬텀의 원하는 형상 및 치수와 일치하는 금형을 선택합니다. 종양 영역이 NP로 균일하게 분포되어 있고 정상 조직으로 둘러싸인 원통형 팬텀의 경우, 유리 페트리 접시와 작은 비커를 금형8 로 사용합니다(그림 1A).
참고: 이 단계는 원통형 형상에서 종양 조직 모방 팬텀을 준비하기 위한 것입니다. 다른 모양이나 크기의 경우 적절한 금형을 선택합니다. 적합한 금형을 사용할 수 없는 경우 1.2단계에 설명된 대로 3차원(3D) 프린팅을 사용하여 금형을 제작합니다.
- 팬텀의 원하는 형상 및 치수와 일치하는 금형을 선택합니다. 종양 영역이 NP로 균일하게 분포되어 있고 정상 조직으로 둘러싸인 원통형 팬텀의 경우, 유리 페트리 접시와 작은 비커를 금형8 로 사용합니다(그림 1A).
- 3D 프린팅을 통한 금형 제작
- CAD(Computer-Aided Design) 소프트웨어(예: SolidWorks, Autodesk Inventor 또는 CATIA)를 사용하여 원하는 모양과 크기에 따라 3D 모델을 설계합니다. 이 프로토콜을 따르려면 그림 1B와 같이 하나의 중공 실린더(내경 40mm, 두께 2mm, 높이 12mm, 보충 파일 1 참조)와 두 개의 견고한 원통형 마스킹 금형(치수 φ20 x 6mm 및 φ14 x 3mm)을 설계합니다.
- 중공 실린더 설계/드래프팅의 경우 CAD 소프트웨어에서 지름이 40mm와 44mm인 두 개의 원을 작성합니다. 그런 다음 형상을 12mm 돌출시킵니다.
- 솔리드 원통형 마스킹 금형의 경우 직경이 20mm 및 14mm인 원을 만든 다음 각각 6mm 및 3mm로 돌출합니다( 보충 파일 2 및 보충 파일 3 참조). 실린더의 한쪽 면에 직사각형(측면 44mm 및 5mm)을 그리고 2mm 돌출시킵니다.
- 인쇄를 위해 3D 프린터 호환 소프트웨어(예: Cura)를 사용하여 3D 모델을 Gcode 형식으로 변환합니다.
- 이 Gcode를 사용하여 3D 프린터를 사용하여 금형을 인쇄합니다(예: 여기에서는 폴리락트산[PLA] φ1.75mm, eSun 1kg 사용).
참고: 사각형은 마스킹 몰드를 매달기 위해 그려집니다. 다른 원하는 모양의 팬텀을 준비하기 위해 다양한 금형을 설계하고 제작할 수 있습니다.
- CAD(Computer-Aided Design) 소프트웨어(예: SolidWorks, Autodesk Inventor 또는 CATIA)를 사용하여 원하는 모양과 크기에 따라 3D 모델을 설계합니다. 이 프로토콜을 따르려면 그림 1B와 같이 하나의 중공 실린더(내경 40mm, 두께 2mm, 높이 12mm, 보충 파일 1 참조)와 두 개의 견고한 원통형 마스킹 금형(치수 φ20 x 6mm 및 φ14 x 3mm)을 설계합니다.
2. 종양-조직-모방 팬텀 용액의 제조25
참고: 이 연구에서는 종양 조직을 모방한 원통형 기하학의 아가로스 기반 광학 팬텀은 그림 2와 같이 IT 또는 IV 주입을 통해 AuNR을 주입한 표면 아래 유방 종양과 유사하도록 준비됩니다. IT 팬텀에는 AuNR이 있는 중심 종양 영역과 주변 정상 조직 영역의 두 영역이 있습니다. IV 팬텀은 종양 주변에 AuNR이 있는 종양 영역, AuNR이 없는 중앙 벌거벗은 종양 영역, 그리고 이를 둘러싼 정상 조직 영역의 세 가지 영역을 가지고 있습니다. 광학적 특성(μa 및 μs')은 종양과 정상 조직에 따라 다르기 때문에 서로 다른 조성을 갖는 각 영역에 대해 별도의 팬텀 용액을 준비하고 별도로 논의할 것입니다.
- 정상 유방 조직을 모방한 팬텀 용액의 제조(용액 1)
참고: 이 솔루션은 IT 및 IV 팬텀 모두에 사용됩니다. 용액 1 의 준비 단계는 그림 3A에 나와 있습니다.- 금형의 치수를 기준으로 용액의 이론적 부피를 계산합니다.
참고: 여기서 φ40 x 12mm의 원통형 금형의 경우 계산된 부피는 팬텀당 15cm3 또는 15mL입니다. 이러한 팬텀을 2개 준비해야 하므로 총 부피는 15mL x 2, 즉 30mL입니다. 따라서 팬텀 준비 단계 중 증발 또는 유출을 고려하여 용액 35mL를 준비합니다. - 35mL 용액에 첨가할 모든 팬텀 성분(아가로스(기본 물질) 및 IL(산란 성분))의 양(중량/농도/부피)을 계산합니다.
- 0.35g의 아가로스를 첨가하여 1% w/v 농도에 해당하는 35mL의 용액을 준비합니다.
- 문헌에서 사용할 수 있는 μs' 데이터와 비교하여 정상 유방 조직의 원하는 μs'(즉, 10.1 cm-1 33)에 해당하는 IL 농도를 추정합니다. 다음으로, 방정식 (1)을 사용하여 팬텀 용액에 추가할 IL(20% 에멀젼 스톡)의 부피를 계산합니다.
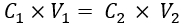 (1)
(1)
여기서, C1 및 V1은 각각 시약 스톡(여기서는 20% IL 스톡)의 농도와 첨가될 시약 스톡 용액의 부피(여기서는 계산됨)이다. C2 는 최종 작업 용액에서 시약 (문헌에서 얻어짐)의 필요한 농도이고 V2 는 최종 작업 용액 (여기서는 35mL)의 총 부피입니다.
참고 : 여기서, 10.1 cm-1의 μs'에 대해보고 된 문헌에서 추정 된 IL 농도는 1.04 % 34,35입니다. 위의 단계를 사용하여 추가할 IL(20% IL 스톡)의 부피는 1.82mL입니다.
- 아가로스 0.35g의 무게를 달아 비커에 담긴 탈이온수(DI) 33.18mL에 넣습니다. 물 손실을 방지하기 위해 비커를 알루미늄 호일로 덮으십시오.
- 용액이 들어 있는 비이커를 120°C의 핫 플레이트에서 용액이 투명해질 때까지 저으면서 가열합니다.
- 열판의 온도를 60ºC로 낮추십시오. 15분 후 저으면서 IL 1.82mL를 첨가합니다. 결과 용액인 용액 1을 사용할 때까지 60ºC에서 교반하는 상태로 유지합니다(붓기 준비).
알림: 60ºC의 팬텀 용액은 교반 조건에서 유지해야 합니다. 그렇지 않으면 용액이 응고됩니다.
- 금형의 치수를 기준으로 용액의 이론적 부피를 계산합니다.
- AuNR 포매 종양 팬텀 용액의 준비(솔루션 2)
참고: 이 솔루션은 IT 및 IV 팬텀 모두에 사용됩니다. 용액 2 의 준비 단계는 그림 3B에 나와 있습니다.- 채울 종양 부위의 부피(φ20 x 6mm)를 계산합니다.
참고: 이러한 종양 팬텀 2개의 대략적인 부피는 3.8mL입니다. 따라서 준비할 용액 부피는 4.5mL입니다. - 섹션 2.1에서 언급한 것과 유사한 단계를 사용하여 추가할 종양 팬텀 구성 성분(아가로스, IL 및 AuNR)의 양을 계산합니다.
- 45mg을 첨가하여 1% w/v 농도에 해당하는 4.5mL의 용액을 준비합니다.
- IL : 유방 종양의 μs'는 4.6 cm-1 33 및 이를 모방하기 위해 필요한 해당 IL 농도는 0.472 % 34,35입니다. 따라서 20% IL 스톡에서 106.2μL의 IL을 4.5mL의 종양 팬텀 용액에 추가합니다.
- 팬텀에서 원하는 AuNR 농도는 25μg/mL입니다. 동일한 결과를 얻으려면 3.21mL의 AuNR 용액(스톡 농도: 35μg/mL)을 종양 팬텀 용액에 추가합니다.
- 비이커에 DI 물 45mL에 아가로스 1.18mg을 넣고 알루미늄 호일로 덮습니다.
- 비커를 핫 플레이트에 놓고 용액이 투명해질 때까지 120ºC에서 저어줍니다.
- 열판의 온도를 60ºC로 낮추고 용액을 15분 동안 그대로 두십시오.
- 교반 조건에서 106.2μL의 IL과 3.21mL의 AuNR 현탁액(35μg/mL)을 추가합니다. 결과 용액 인 용액 2를 부을 때까지 60ºC에서 교반하십시오.
- 채울 종양 부위의 부피(φ20 x 6mm)를 계산합니다.
- 벌거벗은 종양(AuNR 없음) 팬텀 용액의 준비(솔루션 3)
참고: 이 솔루션은 IV 팬텀에만 사용됩니다. 용액 2 의 준비 단계는 그림 3C에 나와 있습니다.- 벌거벗은 종양 영역(~ φ20 x 6mm)을 만들기 위해 추가할 현탁액의 이론적 부피를 계산합니다.
참고: 종양 팬텀의 대략적인 부피는 1.9mL입니다. 따라서 준비할 용액 부피는 2.5mL입니다. - 섹션 2.1에서 언급한 것과 유사한 단계를 사용하여 추가할 종양 팬텀 구성 성분(아가로스 및 IL)의 양을 계산합니다.
- 25%의 w/v 농도를 달성하기 위해 2.5mL의 용액을 준비하기 위해 25mg의 아가로스를 추가합니다.
- IL : 유방 종양의 μs'는 4.6 cm-1 33 및 이를 모방하기 위해 필요한 해당 IL 농도는 0.472 % 34,35입니다. 59μL의 20% IL 스톡을 추가합니다.
- 비이커에 DI 물 2.44mL에 아가로스 25mg을 넣고 알루미늄 호일로 덮습니다.
- 비커를 핫 플레이트에 놓고 용액이 투명해질 때까지 120ºC에서 저어줍니다.
- 열판의 온도를 60ºC로 낮추고 용액을 15분 동안 그대로 두십시오.
- 교반 조건에서 용액에 59μL의 IL을 추가합니다. 결과 용액인 용액 3을 부을 때까지 60ºC의 교반 조건에서 유지하십시오.
- 벌거벗은 종양 영역(~ φ20 x 6mm)을 만들기 위해 추가할 현탁액의 이론적 부피를 계산합니다.
3. 종양 조직 모방 팬텀 24,25,36의 제조
- 주입 단계를 위해 금형을 준비합니다. 이를 위해 원통형 금형의 바닥을 파라필름으로 밀봉하고 마스킹 금형(φ20 x 6mm)을 중앙에 놓습니다.
- 용액 1을 마스킹 금형의 상단 표시까지 원통형 금형에 붓고 응고되도록 합니다(그림 4A).
- 응고 후 마스킹 주형을 제거하여 종양 부위에 대한 공동을 만듭니다(그림 4B).
참고: 프로토콜은 3.3단계까지 IT 및 IV 팬텀 모두에 대해 동일합니다. 이 프로세스는 3.3단계 이후에 IT 및 IV 팬텀에 대해 별도로 논의됩니다. - IT 팬텀 24,25,36
- 캐비티를 용액 2 로 채우고 응고시키십시오(그림 4C).
- 팬텀 상단에 용액 1 을 추가하고 완전히 응고되도록 합니다(그림 4D).
- IV 팬텀24,25
- 더 작은 마스킹 몰드(φ14 x 3mm)를 삽입하고 그 주위의 캐비티를 용액 2 (그림 4E)로 채웁니다.
- 응고 후 더 작은 금형을 제거하고 나머지 캐비티를 용액 3 (그림 4F)으로 채웁니다.
- 용액 1을 맨 위에 추가하고 완전한 응고를 허용합니다(그림 4G).
4. 팬텀 24,25,36 내에 열전대 삽입
참고: 공간 온도 분포를 모니터링하기 위해 K형 열전대는 그림 2와 같이 다양한 방사형(r) 및 축방향(z) 위치에서 팬텀 내에 삽입됩니다. 정확한 위치에 열전대를 삽입하기 위해 유리 모세관이 정밀도를 보장하는 가이드로 사용됩니다. 열전대 위치는 (r, z)로 표시되며, 여기서 깊이 z = 3mm에서 종양 상단 표면의 중간점은 IT 및 IV 팬텀 모두에 대한 기준점 역할을 하며 그림 2A, B와 같이 (0, 3)으로 지정됩니다. 종양 영역의 열 손상을 정량화하기 위해 방사형 및 축 위치를 선택할 때 종양 주변부(방사형 및 축 방향 모두)의 위치가 중요합니다. NIR 방사선 조사 중 이러한 주변 지점에서 필요한 온도에 도달하면 완전한 종양 절제가 보장됩니다. 따라서, 열전대는 z = 3 및 9mm, 즉 (10, 3) 및 (10, 9)의 방사형 극한 지점에 배치되고, 하나의 열전대는 z = 9mm(주변 축 위치), 즉 (0, 9)에서 종양-조직 계면에 배치됩니다. 또한 축 방향 온도 분포를 평가하기 위해 (0, 3)과 (0, 9) 위치에 (0, 6)으로 지정된 열전대가 삽입됩니다. 마지막으로, 주변의 건강한 조직 영역의 온도 상승을 평가하기 위해 (15, 3)에 하나의 열전대를 삽입합니다.
- 유리 모세관을 적절한 길이로 절단하여 팬텀 내에서 원하는 방사형 및 축 방향 위치에 도달하도록 합니다.
- 이 유리 모세관 내에 열전대를 삽입하고 지정된 방사형 및 축 방향 팬텀 위치에 하나씩 구멍을 뚫습니다.
- 모든 열전대가 제자리에 놓이면 그림 5A와 같이 후속 NIR 조사를 위해 팬텀을 유리 페트리 접시에 조심스럽게 놓습니다.
5. NIR 조사에 대한 노출 및 그에 따른 광열 온도 측정36
- 그림 5A와 같이 팬텀 상단 표면의 중앙 영역이 NIR 광원의 광섬유 팁에 수직이 되도록 팬텀(열전대와 함께 삽입됨)이 포함된 유리 페트리 접시를 놓습니다.
알림: 팬텀 표면의 빔 직경은 표면과 광섬유 팁 사이의 거리를 변경하여 조정할 수 있습니다. 여기서, 중앙 종양 영역을 덮는 20mm 빔 직경을 달성하기 위해 9mm 거리를 유지합니다. - 데이터 수집 (DAQ) 시스템을 컴퓨터에 연결하고 LabVIEW 소프트웨어를 엽니다.
- NIR 광원(그림 5B)을 켜고 소프트웨어의 재생 버튼을 동시에 눌러 조사 시작 시 온도 데이터를 기록합니다.
- 팬텀을 20분 동안 조사한 다음 NIR 광원을 끄고 기록을 중지합니다.
- 기록된 온도 대 시간 데이터를 플로팅합니다.
6. 시뮬레이션 결과와의 온도 비교24,25
참고: 실험은 일반적으로 반복되며 온도는 모든 열전대 위치에서 설정된 시간 간격으로 기록됩니다. 유효성 검사를 위해 다음 단계를 수행합니다.
- 모든 열전대 위치 (r, z)에서 실험 온도의 평균과 표준 편차를 계산합니다.
- 고려된 열전대 위치의 온도를 숫자로 계산합니다.
- 실험에서 얻은 평균 온도와 시간에 대한 모든 열전대 위치에서 시뮬레이션으로 얻은 온도를 그림 6에 표시된 대로 표시합니다.
- 표 1과 같이 모든 열전대 위치에 대한 RMSE(Root mean Square Error) 및 MAE(mean absolute error)를 계산하여 온도 차이를 정량화하고 검증을 평가합니다.
참고: MAE 및 RMSE는 각각 방정식 2와 3을 사용하여 계산됩니다.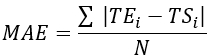 (2)
(2)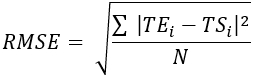 (3)
(3)
여기서 TE, TS 및 N 은 실험적으로 얻은 온도, 수치로 계산된 온도 및 데이터 포인트의 수(여기서 온도는 각각 20분 동안 초당 기록되므로 = 1,200)입니다. i는 시점을 나타냅니다.
결과
그림 6은 그림 2와 같이 모든 열전대 위치에서 AuNR이 포함된 종양 조직 팬텀을 사용하여 실험하는 동안 얻은 시간적 평균 온도를 해당 열전대 위치에서 시뮬레이션 중에 얻은 온도와 비교하여 보여줍니다. 여기서, 실험은 각 분포, 즉 AuNR의 IT 및 IV 분포에 대해 4x 수행되었습니다. 실험 중 실내 온도는 25?...
토론
이 논문은 광학 팬텀을 모방한 아가로스 기반 종양 조직의 준비를 위한 프로토콜을 제시합니다. 팬텀은 PPTT 연구에 사용하기 위해 종양과 정상 조직의 광학적 특성을 모방하는 방식으로 설계되었습니다. 이 연구에서는 PPTT 동안 수치 방법의 검증을 위한 이러한 팬텀의 적용을 강조합니다. 이 프로토콜에서 가장 중요한 단계는 아가로스와 IL을 함유한 팬텀 용액의 온도를 ?...
공개
저자는 공개할 경쟁 이해관계가 없습니다.
감사의 말
이 연구는 공공, 상업 또는 비영리 자금 지원 기관의 재정적 지원 없이 수행되었습니다. 저자는 인도 찬디가르에 소재한 CSIR-Central Scientific Instruments Organization의 인프라와 지원에 감사를 표한다.
자료
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | 9012-36-6 | Base matrix for phantoms |
| Deionized (DI) water (18.2 MΩ) | NA | NA | Solvent for the preparation of phantom solutions |
| Gold nanorods (AuNRs) | Nanopartz | A12-10-808 | Plasmonic nanoparticles |
| Intralipid (20% emulsion stock) | Sigma-Aldrich | 68890-65-3 | Scattering agent of phantoms |
| Parafilm | Parafilm M | 380020 | To seal the bottom of cylindrical mold |
| Polylactic acid filament | eSun | NA | Material for molds (1.75 mm dia wire) |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| 3D Printer | Creality | Ender-3 | For printing molds |
| Data acquisition (DAQ) system | National Instruments | cDAQ-9171 | For recording temperatures |
| DI water unit | Merck Millipore | Direct-Q3 | For DI water |
| Hot plate with magnetic stirrer | IKA | C-MAG HS 4 | For phantom solutions preparation |
| NIR light source | NA (In-house developed) | NA | For NIR irradiation of phantoms, (800/50 nm; Center wavelength: 800 nm, Bandwidth: 50 nm) |
| Optical Fiber (1/2" × 12") | Edmund Optics | 38-659 | For NIR irradiation of phantoms |
| Type K thermocouples | RS Components | RS Pro 397-1589 | For temperature monitoring at various phantom locations during NIR irradiation |
| Weighing Balance | Wensar | PGB 200 | For weighing agarose |
| Name of Software | Company | Catalog Number | Comments/Description |
| Autodesk Inventor 2021 | Autodesk | NA | For mechanical designing of molds |
| Cura 5.7 | Ultimaker | NA | For converting mechanical design to Gcode for 3D printing |
| Matlab R2024b | MathWorks | NA | For numerical simulations and temperature data plots |
| Name of Labwares used | Company | Catalog Number | Comments/Description |
| Beakers (50 mL) | Borosil | 1000D12 | For phantom solution preparations |
| Beakers (10 mL) | Borosil | 1000006 | For phantom solution preparations |
| Pipette (100-1000 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 063 | For adding constituents into the phantom solution |
| Pipette (10-100 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 047 | For adding constituents into the phantom solution |
| Spatula | Borosil | LASC8888M06 | For weighing agarose and demolding the phantoms from the molds |
| Tips (100-1000 µL) | Tarsons | 521016 | For adding constituents into the phantom solution |
| Tips (10-100 µL) | Tarsons | 521010Y | For adding constituents into the phantom solution |
참고문헌
- Riley, R. S., Day, E. S. Gold nanoparticle-mediated photothermal therapy: applications and opportunities for multimodal cancer treatment. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (4), e1449 (2017).
- Webb, J. A., Bardhan, R. Emerging advances in nanomedicine with engineered gold nanostructures. Nanoscale. 6 (5), 2502-2530 (2014).
- Abadeer, N. S., Murphy, C. J. Recent progress in cancer thermal therapy using gold nanoparticles. J Phys Chem C. 120 (9), 4691-4716 (2016).
- Murphy, C. J., et al. Virus-sized gold nanorods: Plasmonic particles for biology. Acc Chem Res. 52 (8), 2124-2135 (2019).
- Overchuk, M., Weersink, R. A., Wilson, B. C., Zheng, G. Photodynamic and photothermal therapies: Synergy opportunities for nanomedicine. ACS Nano. 17 (9), 7979-8003 (2023).
- Goldberg, S. N., Gazelle, G. S., Mueller, P. R. Thermal ablation therapy for focal malignancy. Am J Roentgenol. 174 (2), 323-331 (2000).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Role of optical coefficients and healthy tissue-sparing characteristics in gold nanorod-assisted thermal therapy. Int J Hyperth. 29 (1), 87-97 (2013).
- Khurana, D., Vikas, A. K., Shaw, S., Soni, Polydopamine coated gold nano blackbodies for tumor-selective spatial thermal damage during plasmonic photothermal cancer therapy. IEEE Trans Nanobiosci. 21 (4), 482-489 (2021).
- Jung, H. S., Verwilst, P., Sharma, A., Shin, J., Sessler, J. L., Kim, J. S. Organic molecule-based photothermal agents: an expanding photothermal therapy universe. Chem Soc Rev. 47 (7), 2280-2297 (2018).
- Ge, R. L., Yan, P. N., Liu, Y., Li, Z. S., Shen, S. Q., Yu, Y. Recent advances and clinical potential of near infrared photothermal conversion materials for photothermal hepatocellular carcinoma therapy. Adv Func Mater. 33 (29), 2301138 (2023).
- Shabani, L., et al. An investigation into green synthesis of Ru template gold nanoparticles and the in vitro photothermal effect on the MCF-7 human breast cancer cell line. Appl Phys A. 129 (8), 564 (2023).
- Mosleh-Shirazi, S., et al. Investigation through the anticancer properties of green synthesized spinel ferrite nanoparticles in present and absent of laser photothermal effect. Ceram Int. 49 (7), 11293-11301 (2023).
- Amani, A. M., et al. Innovation applications of MXenes in biomedicine. Mater Today Commun. 40, 109929 (2024).
- Ali, M. R. K., Wu, Y., El-Sayed, M. A. Gold-nanoparticle-assisted plasmonic photothermal therapy advances toward clinical application. J Phys Chem C. 123 (25), 15375-15393 (2019).
- Lahonian, M., Golneshan, A. A. Numerical study of temperature distribution in a spherical tissue in magnetic fluid hyperthermia using Lattice Boltzmann method. IEEE Trans NanoBiosci. 10 (4), 262-268 (2011).
- Shaw, A. K., Soni, S. Role of periodic irradiation and incident beam radius for plasmonic photothermal therapy of subsurface tumors. J Therm Biol. 121, 103859 (2024).
- Pogue, B. W., Patterson, M. S. Review of tissue simulating phantoms for optical spectroscopy, imaging and dosimetry. J Biomed Opt. 11 (4), 041102 (2006).
- Mustari, A., et al. Agarose-based tissue mimicking optical phantoms for diffuse reflectance spectroscopy. J Vis Exp. (138), e57578 (2018).
- Dabbagh, A., Abdullah, B. J. J., Ramasindarum, C., Abu Kasim, N. H. Tissue-mimicking gel phantoms for thermal therapy studies. Ultrason imaging. 36 (4), 291-316 (2014).
- Khurana, D., et al. Experimental investigation of photothermal conversion and thermal conductivity of broadband absorbing gold nanoblackbodies and graphene oxide nanoparticles for plasmonic photothermal cancer therapy. Int Commun Heat Mass Transf. 156, 107597 (2024).
- Ortega-Palacios, R., Leija, L., Vera, A., Cepeda, M. F. J. Measurement of breast-tumor phantom dielectric properties for microwave breast cancer treatment evaluation. , 216-219 (2010).
- Wagnières, G., et al. An optical phantom with tissue-like properties in the visible for use in PDT and fluorescence spectroscopy. Phys Med Biol. 42 (7), 1415 (1997).
- Didychuk, C. L., Ephrat, P., Chamson-Reig, A., Jacques, S. L., Carson, J. J. L. Depth of photothermal conversion of gold nanorods embedded in a tissue-like phantom. Nanotechnology. 20 (19), 195102 (2009).
- Shaw, A. K., Khurana, D., Soni, S. Thermal damage analysis of sub-surface soft tissue sarcoma for Indocyanine Green mediated photothermal cancer therapy. Therm Sci Eng Prog. 46, 102168 (2023).
- Shaw, A. K., Khurana, D., Soni, S. Assessment of thermal damage for plasmonic photothermal therapy of subsurface tumors. Phys Eng Sci Med. 47 (3), 1107-1121 (2024).
- Khurana, D., Soni, S. Tissue-mimicking phantoms for photothermal performance evaluations. Recent Trends in Cancer Therapeutics: Plasmonic Photothermal-Based Multimodal Cancer Therapy. , 109-136 (2024).
- Eranki, A., et al. Tissue-mimicking thermochromic phantom for characterization of HIFU devices and applications. Int J Hyperth. 36 (1), 517-528 (2019).
- McLaughlan, J. R. Controllable nucleation of cavitation from plasmonic gold nanoparticles for enhancing high intensity focused ultrasound applications. J Vis Exp. (140), e58045 (2018).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Experimental and numerical investigation of heat confinement during nanoparticle-assisted thermal therapy. Int Commun Heat Mass Transf. 69, 11-17 (2015).
- Ntombela, L., Adeleye, B., Chetty, N. Low-cost fabrication of optical tissue phantoms for use in biomedical imaging. Heliyon. 6 (3), e03602 (2020).
- Lai, P., Xu, X., Wang, L. V. Dependence of optical scattering from Intralipid in gelatin-gel based tissue-mimicking phantoms on mixing temperature and time. J Biomed Opt. 19 (3), 035002 (2014).
- Aernouts, B., Van Beers, R., Watté, R., Lammertyn, J., Saeys, W. Dependent scattering in Intralipid®phantoms in the 600-1850 nm range. Opt Express. 22 (5), 6086-6098 (2014).
- Tromberg, B. J., et al. Non-invasive in vivo characterization of breast tumors using photon migration spectroscopy. Neoplasia. 2 (1-2), 26-40 (2000).
- Kanick, S. C., et al. Scattering phase function spectrum makes reflectance spectrum measured from Intralipid phantoms and tissue sensitive to the device detection geometry. Biomed Opt Express. 3 (5), 1086-1100 (2012).
- Yuan, B., Chen, N., Zhu, Q. Emission and absorption properties of indocyanine green in Intralipid solution. J Biomed Opt. 9 (3), 497-503 (2004).
- Khurana, D., et al. Gold nanoblackbodies-based multifunctional nanocomposite for multimodal cancer therapy. Int J Pharm. 642, 123112 (2023).
- Brough, D., Ramos, J., Delpech, B., Jouhara, H. Development and validation of a TRNSYS type to simulate heat pipe heat exchangers in transient applications of waste heat recovery. Int J Thermofluid. 9, 100056 (2021).
- Vardaki, M. Z., Kourkoumelis, N. Tissue phantoms for biomedical applications in Raman spectroscopy: A review. Biomed Eng Computational Biol. 11, 1179597220948100 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유