Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Plazmonik Fototermal Kanser Tedavisi: Fototermal Sıcaklık Dağılımını Görselleştirmek için Nanopartikül Gömülü Tümör Dokusu Taklit Eden Fantomlar
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu makale, plazmonik fototermal tedavi için optik özellikleri çoğaltan tümör dokusu fantomlarının hazırlanmasına yönelik protokolü sunmaktadır. Fantom hazırlama, fototermal değerlendirmeler ve terapötik parametreleri değerlendirmek için fototermal sıcaklık ölçümlerine dayalı geliştirilen sayısal modelin doğrulanmasını detaylandırır ve ön test için in vivo çalışmalara etik, uygun maliyetli bir alternatif sunar.
Özet
Gelişmekte olan bir kanser tedavisi olan plazmonik fototermal tedavi (PPTT), bir tümöre nanopartiküllerin (NP'ler) verilmesini ve ardından kanser hücrelerini yok eden lokalize ısı üretmek için yakın kızılötesi (NIR) ışınlamayı içerir. PPTT'yi uygulamadan önce, terapötik parametrelerin - NP konsantrasyonu, ışınlama yoğunluğu ve süresi - tahmin edilmesi gerekir. Bunun için sayısal simülasyonlar yapılır. Bununla birlikte, sağlam hesaplamayı sağlamak için, bu simülasyonlar, tümör dokusunun optik özelliklerini kopyalayan tümör dokusunu taklit eden fantomlar üzerinde fototermal deneyler yoluyla doğrulanmalıdır. PPTT için terapötik parametreler, gelen radyasyonun doku ve NP'ler tarafından saçılması ve emilmesi ile yönetilir. Bu nedenle, hedef tümörün/dokunun azaltılmış saçılma katsayısını (μs') ve absorpsiyon katsayısını (μa) taklit eden fantomlar üzerinde doğrulama deneyleri yapılabilir.
Spesifik olarak, bu protokol, normal meme dokusu ile çevrili, altın nanoçubuklarla enjekte edilen meme tümörünün μs' ve μ a'sını taklit eden fantomların hazırlanması için talimatlar sağlar. Protokol ayrıca, uzay-zamansal sıcaklıkları termokupllar kullanılarak ölçülenlerle karşılaştırarak NIR ışınlamasını, sıcaklık izlemeyi ve sayısal sonuçların doğrulanmasını da detaylandırır. Bu çalışmada sunulan protokoller, boyutları (φ40 x 12 mm) ve merkezi tümör bölgesi (φ20 x 6 mm) olan, baz matriks olarak %1 agaroz ve saçılma bileşeni olarak intralipid ve 25 μg/mL konsantrasyonda altın nanoçubuklarla gömülü tümör bölgesi içeren hidrojel bazlı silindirik meme tümör dokusu fantomlarının hazırlanmasını kolaylaştırmıştır. Bir vaka çalışmasından elde edilen temsili sonuçlar, PPTT için sayısal simülasyonları doğrulamak için fabrikasyon fantomların uygulanmasını göstermektedir. Çalışma, gösterilen protokollerin, in vivo deneylerden önce terapötik parametreleri optimize etmeyi ve planlamayı ve PPTT için sayısal simülasyonları doğrulamayı amaçlayan fototermal deneylerin yürütülmesi için değerli olduğu sonucuna varmıştır.
Giriş
Plazmonik fototermal tedavi (PPTT), tümör bölgesine nanopartiküllerin (NP'ler) verilmesini ve ardından yakın kızılötesi (NIR) radyasyonla ışınlanmayı içeren, gelişmekte olan lokalize bir kanser tedavi yöntemidir. NP'ler tipik olarak intratümöral (IT) veya intravenöz (IV) yollar1 yoluyla uygulanır. NIR ışınlaması üzerine, gelen radyasyonun ve NP'lerin plazmonik etkileşimi, NP'lerin yüzeyinde lokalize ısı oluşumuna yol açar ve bu daha sonra çevredeki tümör dokusunadağılır 2,3. Bu lokalize ısıtma, tümör bölgesindeki sıcaklığı yükseltir ve termal ablasyon yoluyla kanser hücresi ölümüneyol açar 4,5. Etkili kanser tedavisi, çeşitli biyolojik süreçlerle 1 saat6 boyunca 46 ºC, 4-6 dakika7 boyunca 50-52 ºC veya anlık hasar için 60 ºC gibi belirli sıcaklıkların korunmasıylasağlanabilir 8.
Fototermal tedavi uygulaması için çeşitli fototermal ajanlar araştırılmış ve raporlanmıştır ve terapötik etkinlikleri in vitro veya in vivo çalışmalarla değerlendirilmiştir. Bu ajanlar, yakın kızılötesi boyalar (örneğin, İndosiyanin Yeşili, IR780, IR820), polimer bazlı fototermal maddeler (örneğin, polidopamin) gibi organik malzemeleri 9 ve asil metal bazlı NP'ler veya plazmonik NP'ler (örneğin, altın NP'ler) dahil olmak üzere inorganik malzemeleri10 içerir.11, geçiş metali kükürt/oksitler12 ve MXenes13. Bunlar arasında, plazmonik NP'ler, özellikle altın NP'ler, geleneksel fototermal ajanlara (örneğin boyalar) göre daha iyi fototermal stabilite, daha yüksek fototermal dönüşüm verimliliği ve şekil ve boyut varyasyonları yoluyla ayarlanabilir plazmonik tepki gibi çeşitli avantajlar sunar10. Bu özellikler, altın NP'leri fototermal tedavi için ideal adaylar haline getirir ve bazıları şu anda klinik deneylerden geçmektedir14.
PPTT sırasında terapötik etkinliği optimize etmek ve yeterli tümör termal hasarını sağlamak için, PPTT'nin klinik öncesi / klinik uygulamasından önce NP dozu (konsantrasyon açısından) ve NIR radyasyon parametreleri (ışınlama yoğunluğu ve süresi dahil) gibi tedavi parametrelerinin tahmin edilmesi önemlidir. Bu parametreleri oluşturmak için tipik olarak sayısal simülasyonlar kullanılır. Tümör dokusu içindeki termal hasarı değerlendirmek için çeşitli sayısal yöntemler geliştirilmiştir ve kafes Boltzmann yöntemi böyle bir yaklaşımdır15,16. Bununla birlikte, bu simülasyonların güvenilir olması için, doku taklit eden fantomlar olarak bilinen doku analogları kullanılarak doğrulanmaları gerekir. Bu fantomlar, gerçek dokuların optik, termal, biyolojik veya mekanik özelliklerini çoğaltmak için hazırlanabilir ve biyolojik uygulamalara yönelik yeni geliştirilen cihazların, malzemelerin veya yöntemlerin ön testini, tedavi değerlendirmesini ve doğrulanmasını sağlamak için ikame görevi görebilir17,18. Bu, hayvanların veya insan deneklerin gereksiz yere acı çekmesini azaltabilir ve bu tür deneylerle ilişkili etik kaygıları ele alabilir19,20.
Bir fantomun tasarımı ve üretimi, amaçlanan uygulamayabağlıdır 21. Örneğin, PPTT gibi fototerapiler sırasında, gelen radyasyonun dozu, NP'ler ve dokular tarafından emilen veya saçılan ışık miktarından etkilenir22,23. Bu nedenle, optik özellikleri, özellikle biyolojik dokuların azaltılmış saçılma katsayısını (μs') ve absorpsiyon katsayısını (μa) taklit eden optik fantomlar, PPTT değerlendirmeleri ve ardından sayısal simülasyonların doğrulanması için kullanılır24,25. Optik fantomlar tipik olarak üç ana bileşenden oluşur: bir baz matrisi, saçılma maddeleri ve absorpsiyon maddeleri17,26. Baz matris, istenen optik özellikleri çoğaltmak için saçılma ve absorpsiyon bileşenlerini uygun konsantrasyonlarda tutar. Bu fantomlar, baz matrisin tipine bağlı olarak katı, sıvı ve yarı katı (hidrojel) fantomlar olarak sınıflandırılabilir. PPTT gibi termal terapötik çalışmalar için, hidrojel fantomlar, özellikle agaroz bazlı fantomlar, biyouyumlulukları, ihmal edilebilir doğal saçılma ve absorpsiyonları, basit üretim süreçleri ve tümör geometrilerine karşılık gelen istenen şekil ve boyutlarda dökülebilme esneklikleri nedeniyle tercih edilir19,22. En önemlisi, agaroz tipi fantomların erime sıcaklığı ~80 ºC19 olduğundan, hazırlanan agaroz bazlı fantomlar ~70-80 ºC yığın sıcaklıklarına kadar kullanılabilir. PPTT için ~ 50-80 ºC'lik bir sıcaklık aralığı yeterli olduğundan, bu tür agaroz bazlı fantomlar PPTT tabanlı fototermal değerlendirmeler için kullanılabilir.
Çeşitli uygulamalar için çeşitli hidrojel bazlı doku taklit eden fantomlar geliştirilmiş ve rapor edilmiştir. Mustari ve ark. agaroz bazlı doku taklit eden fantomlar geliştirdi ve yeni tasarlanmış bir optik sistemi doğrulamada faydalarını gösterdi18. Başka bir çalışmada, yüksek yoğunluklu odaklanmış ultrason (HIFU) tedavisi sırasında termal hasarın derecesini ölçmek için dokuyu taklit eden termokromik fantomlar hazırlandı27. Poliakrilamid bazlı doku taklit eden fantomlar da HIFU bazlı kanser tedavisi sırasında kavitasyon etkisini analiz etmek için hazırlanmıştır28. Bu çalışmanın amacı, PPTT değerlendirmeleri için fantom tabanlı fototermal deneyler için protokol ile birlikte tümör dokusunu taklit eden fantomları üretmek için adım adım bir yöntem göstermektir. Önerilen bu ayrıntılı protokol, yeni geliştirilen nanoyapıların fototermal performansını test etmek için fantom preparatının ve müteakip fantom tabanlı fototermal deney yöntemlerinin benimsenmesini ve tekrarlanabilirliğini teşvik etmeyi, böylece sayısal simülasyonları doğrulamayı ve PPTT'nin terapötik parametrelerinin ön işlem planlamasına veya optimizasyonuna yardımcı olmayı amaçlamaktadır. Bu makale, yüzey altı meme tümörleri için özel olarak tasarlanmış bir fantom hazırlama protokolünü açıklamaktadır; Bununla birlikte, aynı adımlar, optik absorpsiyon ve saçılma ajanlarının bileşimini değiştirerek çeşitli tümör dokusu tiplerinin (çeşitli şekil ve boyutlarda) üretilmesi için uyarlanabilir. Örnek olarak, gösterilen dokuyu taklit eden fantom tabanlı fototermal değerlendirmeler, alt yüzey önkol tümörü24, alt yüzey IDC25 ve cilt tümörleri29 için PPTT simülasyonlarını doğrulamak için daha önce bildirilen çalışmalarda kullanılmıştır.
Bu yazıda, cilt yüzeyinin 3 mm altında yer alan ve normal meme dokusu ile çevrili, özellikle invaziv duktal karsinom (IDC) olmak üzere bir alt yüzey veya deri altı meme tümörünün μs'lerini taklit eden bir optik fantomun hazırlık aşamaları anlatılmaktadır. Fantom, normal ve kanserli meme dokusunun μs'sini taklit etmek için uygun konsantrasyonlarda eklenen baz matriks olarak agaroz ve saçılma ajanı olarak intralipid (IL) kullanılarak hazırlanan silindirik geometriye sahiptir. İhmal edilebilir saçılma ve absorpsiyona sahip şeffaf bir hidrojel olan agaroz, optik fantomlar18,30 için ideal bir temel matristir. Ayrıca, hücre zarlarının iki katmanlı yapısını taklit eden %20'lik bir yağ emülsiyonu olan IL, bir saçılma ajanı31,32 olarak yaygın olarak kullanılmaktadır ve bu çalışma için normal ve kanserli meme dokusunun μs'sini çoğaltmak için seçilmiştir. Fantom, plazmonik NP'ler olarak altın nanoçubuklar (AuNR'ler) enjekte edilen meme tümörünü (IDC) taklit etmek için tasarlanmıştır ve AuNR'ler olmadan normal meme dokusu ile çevrilidir. PPTT'de kullanılan çeşitli altın NP'ler arasında, NIR bölgesindeki güçlü plazmonik yanıtları ve köpek ve kedi hastalarını içerenler de dahil olmak üzere klinik öncesi PPTT çalışmalarında yaygın kullanımları nedeniyle AuNR'ler bu çalışma için seçilmiştir14. Protokol, iki tip fantomun hazırlanmasını göstermektedir: biri IV enjeksiyonunda görüldüğü gibi AuNR dağılımına sahip bir tümör ve diğeri IT enjeksiyonu ile elde edilen AuNR dağılımını yansıtan bir tümör ile. Fantom hazırlama protokolünü takiben, NIR ışınlaması için deney düzeneği ve fantomlar üzerinde fototermal değerlendirmeler yapma adımları açıklanmaktadır. Son olarak, bu değerlendirmelerden elde edilen sıcaklık dağılımı sonuçlarının yorumlanması ve deneysel verilerin sayısal simülasyon sonuçlarıyla karşılaştırılması için adım adım bir kılavuz sağlanmıştır. Bu karşılaştırma, gelişmiş bir sayısal yöntemin doğrulanmasına yardımcı olur ve bir tümöre özel olarak uyarlanmış optimal tedavi parametrelerinin ayarlanmasını sağlar.
Protokol
NOT: Fantomlar, istenen optik özellikleri elde etmek için literatürde bildirilen bileşimlere dayalı olarak agaroz ve intralipid kullanılarak hazırlandı. Hastalardan veya kadavralardan alınan gerçek bir biyolojik doku kullanılmadı. Bu nedenle, bu fantomların hazırlanması etik kısıtlamalardan muaftır ve bilgilendirilmiş onam gerektirmez.
1. Uygun bir kalıbın seçimi veya imalatı
- . Uygun bir kalıp seçimi
- Fantomlar için istenen şekil ve boyutlara uygun bir kalıp seçin. NP'lerle eşit olarak dağılmış ve normal doku ile çevrili bir tümör bölgesine sahip silindirik fantomlar için, kalıp8 olarak bir cam Petri kabı ve küçük bir beher kullanın (Şekil 1A).
NOT: Bu adımlar, silindirik geometride tümör dokusunu taklit eden fantomları hazırlamak içindir. Diğer şekiller veya boyutlar için uygun bir kalıp seçin. Uygun bir kalıp mevcut değilse, adım 1.2'de ayrıntılı olarak açıklandığı gibi üç boyutlu (3D) baskı kullanarak bir kalıp üretin.
- Fantomlar için istenen şekil ve boyutlara uygun bir kalıp seçin. NP'lerle eşit olarak dağılmış ve normal doku ile çevrili bir tümör bölgesine sahip silindirik fantomlar için, kalıp8 olarak bir cam Petri kabı ve küçük bir beher kullanın (Şekil 1A).
- 3D baskı ile kalıp imalatı
- İstenilen şekil ve boyuta göre Bilgisayar Destekli Tasarım (CAD) yazılımını (ör. SolidWorks, Autodesk Inventor veya CATIA) kullanarak bir 3B model tasarlayın. Bu protokolü takip etmek için, Şekil 1B'de gösterildiği gibi bir içi boş silindir (iç çap 40 mm, kalınlık 2 mm ve yükseklik 12 mm; Ek Dosya 1'e bakın) ve iki katı silindirik maskeleme kalıbı (boyutlar φ20 x 6 mm ve φ14 x 3 mm) tasarlayın.
- İçi boş silindir tasarımı/çizimi için, CAD yazılımında 40 mm ve 44 mm çapında iki daire oluşturun. Ardından, geometriyi 12 mm sıkın.
- Katı silindirik maskeleme kalıpları için, 20 mm ve 14 mm çapında daireler oluşturun, ardından sırasıyla 6 mm ve 3 mm ekstrüzyon yapın (bkz. Ek Dosya 2 ve Ek Dosya 3). Silindirin bir tarafına bir dikdörtgen (kenarlar 44 mm ve 5 mm) çizin ve 2 mm sıkın.
- Yazdırmak için 3B yazıcı uyumlu yazılım (ör. Cura) kullanarak 3B modelleri Gcode formatına dönüştürün.
- Bir 3D yazıcı kullanarak kalıpları yazdırmak için bu Gcode'u kullanın (örneğin, burada polilaktik asit [PLA] φ1.75 mm, 1 kg eSun kullanarak).
NOT: Dikdörtgen, maskeleme kalıplarını askıya almak için çizilir. İstenilen diğer şekillere sahip fantomlar hazırlamak için farklı kalıplar tasarlanabilir ve üretilebilir.
- İstenilen şekil ve boyuta göre Bilgisayar Destekli Tasarım (CAD) yazılımını (ör. SolidWorks, Autodesk Inventor veya CATIA) kullanarak bir 3B model tasarlayın. Bu protokolü takip etmek için, Şekil 1B'de gösterildiği gibi bir içi boş silindir (iç çap 40 mm, kalınlık 2 mm ve yükseklik 12 mm; Ek Dosya 1'e bakın) ve iki katı silindirik maskeleme kalıbı (boyutlar φ20 x 6 mm ve φ14 x 3 mm) tasarlayın.
2. Tümör dokusunu taklit eden fantom solüsyonlarının hazırlanması25
NOT: Bu çalışmada, tümör dokusunu taklit eden silindirik geometriye sahip agaroz bazlı optik fantomlar, Şekil 2'de gösterildiği gibi, IT veya IV enjeksiyon yoluyla AuNR'ler enjekte edilen bir alt yüzey meme tümörüne benzeyecek şekilde hazırlanmıştır. IT fantomunun iki bölgesi vardır: AuNR'leri olan merkezi bir tümör bölgesi ve çevreleyen normal doku bölgesi. IV fantomun üç bölgesi vardır: tümör çevresinde AuNR'leri olan bir tümör bölgesi, AuNR'leri olmayan merkezi çıplak bir tümör bölgesi ve çevreleyen normal doku bölgesi. Optik özellikler (μa ve μs') tümör ve normal doku için farklılık gösterdiğinden, farklı bileşimlere sahip her bölge için ayrı fantom solüsyonları hazırlanır ve ayrı ayrı tartışılacaktır.
- Normal meme dokusunu taklit eden fantom solüsyonunun hazırlanması (Solüsyon 1)
NOT: Bu çözüm hem IT hem de IV fantomları için kullanılacaktır. Çözelti 1'in hazırlık adımları Şekil 3A'da gösterilmiştir.- Kalıbın boyutlarına göre çözümün teorik hacmini hesaplayın.
NOT: Burada, φ40 x 12 mm'lik silindirik kalıp için hesaplanan hacim, fantom başına 15cm3 veya 15 mL'dir. Bu tür iki fantomun hazırlanması gerektiğinden, toplam hacim 15 mL x 2'dir, bu da 30 mL'dir. Bu nedenle, fantom hazırlama adımı sırasında buharlaşmayı veya dökülmeyi hesaba katmak için 35 mL çözelti hazırlayın. - 35 mL çözeltiye eklenecek tüm fantom bileşenlerinin - agaroz (temel malzeme olarak) ve IL (saçılma bileşeni olarak) miktarını (ağırlık / konsantrasyon / hacim) hesaplayın.
- % 1 w / v konsantrasyonuna karşılık gelen 35 mL çözelti hazırlamak için 0.35 g agaroz ekleyin.
- Literatürde bulunan μ s' verilerine karşı IL konsantrasyonuna dayalı olarak istenen μs' normal meme dokusuna (ör., 10.1 cm-1 33) karşılık gelen IL konsantrasyonunu tahmin edin. Ardından, denklem (1)'i kullanarak fantom çözeltisine eklenecek IL hacmini (%20 emülsiyon stoğu) hesaplayın:
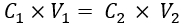 (1)
(1)
Burada C1 ve V1, sırasıyla reaktif stoğunun konsantrasyonu (burada %20 IL stoğu) ve eklenecek reaktif stok çözeltisinin hacmidir (burada hesaplanacaktır). C2, nihai çalışma çözeltisinde reaktifin (literatürden elde edilecek) gerekli konsantrasyonudur ve V2, son çalışma çözeltisinin toplam hacmidir (burada, 35 mL).
NOT: Burada, 10.1 cm-1'lik μiçin, bildirilen literatürden tahmin edilen IL konsantrasyonu %1.04'tür34,35. Yukarıdaki adımları kullanarak, eklenecek IL hacmi (%20 IL stoğu) 1.82 mL'dir.
- 0.35 g agarozu tartın ve bir beherde 33.18 mL deiyonize (DI) suya ekleyin. Su kaybını önlemek için kabı alüminyum folyo ile örtün.
- Çözeltiyi içeren kabı sıcak bir plaka üzerinde 120 °C'de ısıtın ve çözelti şeffaf hale gelene kadar karıştırın.
- Sıcak plakanın sıcaklığını 60 ºC'ye düşürün. 15 dakika sonra, karıştırırken 1.82 mL IL ekleyin. Elde edilen çözeltiyi, Çözelti 1'i, kullanıma kadar (dökülmeye hazır) 60 ºC'de karıştırarak tutun.
NOT: 60 ºC'deki fantom çözeltisinin karıştırma koşulları altında tutulması gerekir. Aksi takdirde, çözeltinin katılaşmasına yol açar.
- Kalıbın boyutlarına göre çözümün teorik hacmini hesaplayın.
- AuNR gömülü tümör fantom çözeltisinin hazırlanması (Çözelti 2)
NOT: Bu çözüm hem IT hem de IV fantomları için kullanılacaktır. Çözelti 2'nin hazırlık adımları Şekil 3B'de gösterilmiştir.- Doldurulacak tümör bölgesinin hacmini hesaplayın (φ20 x 6 mm).
NOT: Bu tür iki tümör fantomu için yaklaşık hacim 3.8 mL'dir. Bu nedenle, hazırlanacak çözelti hacmi 4.5 mL olacaktır. - Bölüm 2.1'de belirtildiği gibi benzer adımları kullanarak eklenecek tümör fantom bileşenlerinin miktarını (agaroz, IL ve AuNR'ler) hesaplayın.
- % 1 w / v konsantrasyonuna karşılık gelen 4.5 mL çözelti hazırlamak için 45 mg ekleyin.
- Meme tümörünün IL:μs' değeri 4.6 cm-1 33'tür ve aynı şeyi taklit etmek için gereken karşılık gelen IL konsantrasyonu %0.472'dir34,35. Bu nedenle,% 20 IL stoğundan 4.5 mL tümör fantom çözeltisine 106.2 μL IL ekleyin.
- Fantomda istenen AuNR konsantrasyonu 25 μg/mL'dir. Aynısını elde etmek için, tümör fantom çözeltisine 3.21 mL AuNRs çözeltisi (stok konsantrasyonu: 35 μg / mL) ekleyin.
- Bir beherdeki 1.18 mL DI suya 45 mg agaroz ekleyin ve bir alüminyum folyo ile kaplayın.
- Beheri sıcak bir tabağa koyun ve çözelti şeffaf hale gelene kadar 120 ºC'de karıştırın.
- Sıcak plakanın sıcaklığını 60 ºC'ye düşürün ve çözeltiyi 15 dakika bekletin.
- Karıştırma koşulları altında 106.2 μL IL ve 3.21 mL AuNR süspansiyonu (35 μg/mL) ekleyin. Elde edilen çözeltiyi, Çözelti 2'yi, dökülene kadar 60 ºC'de karıştırarak tutun.
- Doldurulacak tümör bölgesinin hacmini hesaplayın (φ20 x 6 mm).
- Çıplak tümörün hazırlanması (AuNR'ler olmadan) fantom çözeltisi (Çözüm 3)
NOT: Bu çözüm yalnızca IV fantom için kullanılacaktır. Çözelti 2'nin hazırlık adımları Şekil 3C'de gösterilmiştir.- Çıplak bir tümör bölgesi (~ φ20 x 6 mm) oluşturmak için eklenecek süspansiyonun teorik hacmini hesaplayın.
NOT: Tümör fantomları için yaklaşık hacim 1.9 mL'dir. Bu nedenle, hazırlanacak çözelti hacmi 2.5 mL olacaktır. - Bölüm 2.1'de belirtildiği gibi benzer adımları kullanarak eklenecek tümör fantom bileşenlerinin miktarını hesaplayın-agaroz ve IL.
- % 1 w / v konsantrasyon elde etmek için 2.5 mL çözelti hazırlamak için 25 mg agaroz ekleyin.
- Meme tümörünün IL:μs' değeri 4.6 cm-1 33'tür ve aynı şeyi taklit etmek için gereken karşılık gelen IL konsantrasyonu %0.472'dir34,35. 59 μL %20 IL stoğu ekleyin.
- Bir beherde 2.44 mL DI suya 25 mg agaroz ekleyin ve bir alüminyum folyo ile kaplayın.
- Beheri sıcak bir tabağa koyun ve çözelti şeffaf hale gelene kadar 120 ºC'de karıştırın.
- Sıcak plakanın sıcaklığını 60 ºC'ye düşürün ve çözeltiyi 15 dakika bekletin.
- Karıştırma koşulları altında çözeltiye 59 μL IL ekleyin. Elde edilen çözeltiyi, Çözelti 3'ü, dökülene kadar 60 ºC'de karıştırma koşulları altında tutun.
- Çıplak bir tümör bölgesi (~ φ20 x 6 mm) oluşturmak için eklenecek süspansiyonun teorik hacmini hesaplayın.
3. Tümör dokusunu taklit eden fantomun hazırlanması 24,25,36
- Dökme aşaması için kalıpları hazırlayın. Bunun için silindirik kalıpların altını parafilm ile kapatın ve maskeleme kalıbını (φ20 x 6 mm) merkeze yerleştirin.
- Çözelti 1'i maskeleme kalıbının üst işaretine kadar silindirik kalıplara dökün ve katılaşmasına izin verin (Şekil 4A).
- Katılaşmadan sonra, tümör bölgesi için bir boşluk oluşturmak için maskeleme kalıbını çıkarın (Şekil 4B).
NOT: Protokol, adım 3.3'e kadar hem IT hem de IV fantomları için aynı olacaktır. İşlem, adım 3.3'ten sonra BT ve IV fantomları için ayrı ayrı ele alınacaktır. - BT hayaleti 24,25,36
- Boşluğu Çözelti 2 ile doldurun ve katılaşmasına izin verin (Şekil 4C).
- Fantomun üstüne Çözelti 1'i ekleyin ve tamamen katılaşmasına izin verin (Şekil 4D).
- IV hayalet24,25
- Daha küçük bir maskeleme kalıbı (φ14 x 3 mm) yerleştirin ve etrafındaki boşluğu Çözelti 2 ile doldurun (Şekil 4E).
- Katılaştıktan sonra, daha küçük kalıbı çıkarın ve kalan boşluğu Çözelti 3 ile doldurun (Şekil 4F).
- Çözelti 1'i en üste ekleyin ve tam katılaşmaya izin verin (Şekil 4G).
4. Termokuplların fantom 24,25,36 içine yerleştirilmesi
NOT: Uzamsal sıcaklık dağılımını izlemek için, Şekil 2'de gösterildiği gibi, fantom içine çeşitli radyal (r) ve eksenel (z) konumlarda K tipi termokupllar yerleştirilir. Termokuplların doğru yerlere yerleştirilmesi için, hassasiyeti sağlamak için cam kılcal damarlar kılavuz olarak kullanılır. Termokupl konumları (r, z) olarak gösterilir, burada z = 3 mm derinlikteki tümörün üst yüzeyindeki orta nokta hem IT hem de IV fantomlar için referans noktası görevi görür ve Şekil 2A, B'de gösterildiği gibi (0, 3) olarak adlandırılır. Tümör bölgesindeki termal hasarı ölçmek için radyal ve eksenel konumlar seçilirken, tümör çevresindeki konumlar (hem radyal hem de eksenel) kritiktir. NIR ışınlaması sırasında bu periferik noktalarda gerekli sıcaklıklara ulaşılması, tam tümör ablasyonunu sağlar. Böylece, termokupllar z = 3 ve 9 mm'de, yani (10, 3) ve (10, 9) 'da radyal uç noktalara (tümörün) yerleştirilir ve bir termokupl, tümör-doku arayüzüne z = 9 mm'de (periferik eksenel konum), yani (0, 9) Şekil 2A, B'de gösterildiği gibi yerleştirilir. Ek olarak, eksenel sıcaklık dağılımını değerlendirmek için, (0, 3) ve (0, 9) konumları arasına (0, 6) olarak gösterilen bir termokupl yerleştirilir. Son olarak, çevredeki sağlıklı doku bölgesindeki sıcaklık artışını değerlendirmek için (15, 3) noktasına bir termokupl yerleştirilir.
- Cam kılcal damarları, fantom içinde istenen radyal ve eksenel konumlara ulaşacak şekilde uygun uzunluklarda kesin.
- Bu cam kılcal damarların içine termokupllar yerleştirin ve belirtilen radyal ve eksenel fantom konumlarında tek tek delin.
- Tüm termokupllar yerleştirildikten sonra, Şekil 5A'da gösterildiği gibi, sonraki NIR ışınlaması için fantomu dikkatlice bir cam Petri kabına yerleştirin.
5. NIR ışınlamasına maruz kalma ve elde edilen fototermal sıcaklıkların ölçümü36
- Fantomu içeren cam Petri kabını (termokupllarla yerleştirilmiş), fantomun üst yüzeyinin merkezi bölgesi, Şekil 5A'da gösterildiği gibi NIR ışık kaynağının optik fiberinin ucuna dik olacak şekilde yerleştirin.
NOT: Fantom yüzeyindeki ışın çapı, yüzey ile fiber optik uç arasındaki mesafe değiştirilerek ayarlanabilir. Burada, merkezi tümör bölgesini kaplayan 20 mm'lik bir ışın çapı elde etmek için 9 mm'lik bir mesafe tutulur. - Veri Toplama (DAQ) sistemini bilgisayara bağlayın ve LabVIEW yazılımını açın.
- Işınlamanın başlangıcında sıcaklık verilerini kaydetmek için NIR ışık kaynağını (Şekil 5B) ve yazılımdaki oynat düğmesini aynı anda açın.
- Fantomu 20 dakika boyunca ışınlayın, ardından NIR ışık kaynağını kapatın ve kaydı durdurun.
- Kaydedilen sıcaklık ve zaman verilerini çizin.
6. Simülasyon sonuçları ile sıcaklık karşılaştırması24,25
NOT: Deneyler genellikle tekrarlanır ve tüm termokupl konumlarında sıcaklıklar belirlenen zaman aralıklarında kaydedilir. Doğrulama için aşağıdaki adımlar gerçekleştirilir:
- Tüm termokupl konumlarında (r, z) deneysel sıcaklıkların ortalama ve standart sapmasını hesaplayın.
- Dikkate alınan termokupl konumlarındaki sıcaklıkları sayısal olarak hesaplayın.
- Şekil 6'da gösterilen, deneylerden elde edilen ortalama sıcaklık ve zamana göre tüm termokupl konumlarında simülasyon yoluyla elde edilen sıcaklık grafiği.
- Tablo 1'de gösterildiği gibi, doğrulamayı değerlendirmek için sıcaklık farkını ölçmek için tüm termokupl konumları için kök ortalama kare hatası (RMSE) ve ortalama mutlak hatayı (MAE) hesaplayın.
NOT: MAE ve RMSE, sırasıyla Denklem 2 ve 3 kullanılarak hesaplanır.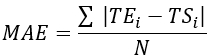 (2)
(2)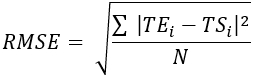 (3)
(3)
Burada TE, TS ve N deneysel olarak elde edilen sıcaklık, sayısal olarak hesaplanan sıcaklık ve veri noktalarının sayısıdır (burada, sıcaklıklar sırasıyla 20 dakika boyunca her saniye kaydedilir; dolayısıyla = 1.200). I, zaman anlarını temsil eder.
Sonuçlar
Şekil 6, Şekil 2'de gösterildiği gibi, tüm termokupl konumlarında AuNR'ye gömülü bir tümör dokusu fantomu ile yapılan deneyler sırasında elde edilen zamansal ortalama sıcaklıkları, ilgili termokupl konumlarında simülasyonlar sırasında elde edilen sıcaklıklarla karşılaştırıldığında göstermektedir. Burada, deneyler her bir dağılım için, yani AuNR'lerin IT ve IV d...
Tartışmalar
Bu makale, optik fantomları taklit eden agaroz bazlı tümör dokusunun hazırlanması için protokolü sunmaktadır. Fantomlar, PPTT çalışmalarında kullanılmak üzere tümör ve normal dokuların optik özelliklerini taklit edecek şekilde tasarlanmıştır. Bu çalışmada, PPTT sırasında sayısal yöntemlerin doğrulanması için bu fantomların uygulaması vurgulanmaktadır. Bu protokoldeki en kritik adım, agaroz ve IL içeren fantom çözeltilerinin sıcaklığının sürek...
Açıklamalar
Yazarların ifşa etmek için rekabet eden çıkarları yoktur.
Teşekkürler
Bu çalışma, herhangi bir kamu, ticari veya kar amacı gütmeyen finansman kuruluşundan herhangi bir mali destek almadan gerçekleştirilmiştir. Yazarlar, altyapı ve destek için CSIR-Central Scientific Instruments Organization, Chandigarh, Hindistan'a teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | 9012-36-6 | Base matrix for phantoms |
| Deionized (DI) water (18.2 MΩ) | NA | NA | Solvent for the preparation of phantom solutions |
| Gold nanorods (AuNRs) | Nanopartz | A12-10-808 | Plasmonic nanoparticles |
| Intralipid (20% emulsion stock) | Sigma-Aldrich | 68890-65-3 | Scattering agent of phantoms |
| Parafilm | Parafilm M | 380020 | To seal the bottom of cylindrical mold |
| Polylactic acid filament | eSun | NA | Material for molds (1.75 mm dia wire) |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| 3D Printer | Creality | Ender-3 | For printing molds |
| Data acquisition (DAQ) system | National Instruments | cDAQ-9171 | For recording temperatures |
| DI water unit | Merck Millipore | Direct-Q3 | For DI water |
| Hot plate with magnetic stirrer | IKA | C-MAG HS 4 | For phantom solutions preparation |
| NIR light source | NA (In-house developed) | NA | For NIR irradiation of phantoms, (800/50 nm; Center wavelength: 800 nm, Bandwidth: 50 nm) |
| Optical Fiber (1/2" × 12") | Edmund Optics | 38-659 | For NIR irradiation of phantoms |
| Type K thermocouples | RS Components | RS Pro 397-1589 | For temperature monitoring at various phantom locations during NIR irradiation |
| Weighing Balance | Wensar | PGB 200 | For weighing agarose |
| Name of Software | Company | Catalog Number | Comments/Description |
| Autodesk Inventor 2021 | Autodesk | NA | For mechanical designing of molds |
| Cura 5.7 | Ultimaker | NA | For converting mechanical design to Gcode for 3D printing |
| Matlab R2024b | MathWorks | NA | For numerical simulations and temperature data plots |
| Name of Labwares used | Company | Catalog Number | Comments/Description |
| Beakers (50 mL) | Borosil | 1000D12 | For phantom solution preparations |
| Beakers (10 mL) | Borosil | 1000006 | For phantom solution preparations |
| Pipette (100-1000 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 063 | For adding constituents into the phantom solution |
| Pipette (10-100 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 047 | For adding constituents into the phantom solution |
| Spatula | Borosil | LASC8888M06 | For weighing agarose and demolding the phantoms from the molds |
| Tips (100-1000 µL) | Tarsons | 521016 | For adding constituents into the phantom solution |
| Tips (10-100 µL) | Tarsons | 521010Y | For adding constituents into the phantom solution |
Referanslar
- Riley, R. S., Day, E. S. Gold nanoparticle-mediated photothermal therapy: applications and opportunities for multimodal cancer treatment. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (4), e1449 (2017).
- Webb, J. A., Bardhan, R. Emerging advances in nanomedicine with engineered gold nanostructures. Nanoscale. 6 (5), 2502-2530 (2014).
- Abadeer, N. S., Murphy, C. J. Recent progress in cancer thermal therapy using gold nanoparticles. J Phys Chem C. 120 (9), 4691-4716 (2016).
- Murphy, C. J., et al. Virus-sized gold nanorods: Plasmonic particles for biology. Acc Chem Res. 52 (8), 2124-2135 (2019).
- Overchuk, M., Weersink, R. A., Wilson, B. C., Zheng, G. Photodynamic and photothermal therapies: Synergy opportunities for nanomedicine. ACS Nano. 17 (9), 7979-8003 (2023).
- Goldberg, S. N., Gazelle, G. S., Mueller, P. R. Thermal ablation therapy for focal malignancy. Am J Roentgenol. 174 (2), 323-331 (2000).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Role of optical coefficients and healthy tissue-sparing characteristics in gold nanorod-assisted thermal therapy. Int J Hyperth. 29 (1), 87-97 (2013).
- Khurana, D., Vikas, A. K., Shaw, S., Soni, Polydopamine coated gold nano blackbodies for tumor-selective spatial thermal damage during plasmonic photothermal cancer therapy. IEEE Trans Nanobiosci. 21 (4), 482-489 (2021).
- Jung, H. S., Verwilst, P., Sharma, A., Shin, J., Sessler, J. L., Kim, J. S. Organic molecule-based photothermal agents: an expanding photothermal therapy universe. Chem Soc Rev. 47 (7), 2280-2297 (2018).
- Ge, R. L., Yan, P. N., Liu, Y., Li, Z. S., Shen, S. Q., Yu, Y. Recent advances and clinical potential of near infrared photothermal conversion materials for photothermal hepatocellular carcinoma therapy. Adv Func Mater. 33 (29), 2301138 (2023).
- Shabani, L., et al. An investigation into green synthesis of Ru template gold nanoparticles and the in vitro photothermal effect on the MCF-7 human breast cancer cell line. Appl Phys A. 129 (8), 564 (2023).
- Mosleh-Shirazi, S., et al. Investigation through the anticancer properties of green synthesized spinel ferrite nanoparticles in present and absent of laser photothermal effect. Ceram Int. 49 (7), 11293-11301 (2023).
- Amani, A. M., et al. Innovation applications of MXenes in biomedicine. Mater Today Commun. 40, 109929 (2024).
- Ali, M. R. K., Wu, Y., El-Sayed, M. A. Gold-nanoparticle-assisted plasmonic photothermal therapy advances toward clinical application. J Phys Chem C. 123 (25), 15375-15393 (2019).
- Lahonian, M., Golneshan, A. A. Numerical study of temperature distribution in a spherical tissue in magnetic fluid hyperthermia using Lattice Boltzmann method. IEEE Trans NanoBiosci. 10 (4), 262-268 (2011).
- Shaw, A. K., Soni, S. Role of periodic irradiation and incident beam radius for plasmonic photothermal therapy of subsurface tumors. J Therm Biol. 121, 103859 (2024).
- Pogue, B. W., Patterson, M. S. Review of tissue simulating phantoms for optical spectroscopy, imaging and dosimetry. J Biomed Opt. 11 (4), 041102 (2006).
- Mustari, A., et al. Agarose-based tissue mimicking optical phantoms for diffuse reflectance spectroscopy. J Vis Exp. (138), e57578 (2018).
- Dabbagh, A., Abdullah, B. J. J., Ramasindarum, C., Abu Kasim, N. H. Tissue-mimicking gel phantoms for thermal therapy studies. Ultrason imaging. 36 (4), 291-316 (2014).
- Khurana, D., et al. Experimental investigation of photothermal conversion and thermal conductivity of broadband absorbing gold nanoblackbodies and graphene oxide nanoparticles for plasmonic photothermal cancer therapy. Int Commun Heat Mass Transf. 156, 107597 (2024).
- Ortega-Palacios, R., Leija, L., Vera, A., Cepeda, M. F. J. Measurement of breast-tumor phantom dielectric properties for microwave breast cancer treatment evaluation. , 216-219 (2010).
- Wagnières, G., et al. An optical phantom with tissue-like properties in the visible for use in PDT and fluorescence spectroscopy. Phys Med Biol. 42 (7), 1415 (1997).
- Didychuk, C. L., Ephrat, P., Chamson-Reig, A., Jacques, S. L., Carson, J. J. L. Depth of photothermal conversion of gold nanorods embedded in a tissue-like phantom. Nanotechnology. 20 (19), 195102 (2009).
- Shaw, A. K., Khurana, D., Soni, S. Thermal damage analysis of sub-surface soft tissue sarcoma for Indocyanine Green mediated photothermal cancer therapy. Therm Sci Eng Prog. 46, 102168 (2023).
- Shaw, A. K., Khurana, D., Soni, S. Assessment of thermal damage for plasmonic photothermal therapy of subsurface tumors. Phys Eng Sci Med. 47 (3), 1107-1121 (2024).
- Khurana, D., Soni, S. Tissue-mimicking phantoms for photothermal performance evaluations. Recent Trends in Cancer Therapeutics: Plasmonic Photothermal-Based Multimodal Cancer Therapy. , 109-136 (2024).
- Eranki, A., et al. Tissue-mimicking thermochromic phantom for characterization of HIFU devices and applications. Int J Hyperth. 36 (1), 517-528 (2019).
- McLaughlan, J. R. Controllable nucleation of cavitation from plasmonic gold nanoparticles for enhancing high intensity focused ultrasound applications. J Vis Exp. (140), e58045 (2018).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Experimental and numerical investigation of heat confinement during nanoparticle-assisted thermal therapy. Int Commun Heat Mass Transf. 69, 11-17 (2015).
- Ntombela, L., Adeleye, B., Chetty, N. Low-cost fabrication of optical tissue phantoms for use in biomedical imaging. Heliyon. 6 (3), e03602 (2020).
- Lai, P., Xu, X., Wang, L. V. Dependence of optical scattering from Intralipid in gelatin-gel based tissue-mimicking phantoms on mixing temperature and time. J Biomed Opt. 19 (3), 035002 (2014).
- Aernouts, B., Van Beers, R., Watté, R., Lammertyn, J., Saeys, W. Dependent scattering in Intralipid®phantoms in the 600-1850 nm range. Opt Express. 22 (5), 6086-6098 (2014).
- Tromberg, B. J., et al. Non-invasive in vivo characterization of breast tumors using photon migration spectroscopy. Neoplasia. 2 (1-2), 26-40 (2000).
- Kanick, S. C., et al. Scattering phase function spectrum makes reflectance spectrum measured from Intralipid phantoms and tissue sensitive to the device detection geometry. Biomed Opt Express. 3 (5), 1086-1100 (2012).
- Yuan, B., Chen, N., Zhu, Q. Emission and absorption properties of indocyanine green in Intralipid solution. J Biomed Opt. 9 (3), 497-503 (2004).
- Khurana, D., et al. Gold nanoblackbodies-based multifunctional nanocomposite for multimodal cancer therapy. Int J Pharm. 642, 123112 (2023).
- Brough, D., Ramos, J., Delpech, B., Jouhara, H. Development and validation of a TRNSYS type to simulate heat pipe heat exchangers in transient applications of waste heat recovery. Int J Thermofluid. 9, 100056 (2021).
- Vardaki, M. Z., Kourkoumelis, N. Tissue phantoms for biomedical applications in Raman spectroscopy: A review. Biomed Eng Computational Biol. 11, 1179597220948100 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır