Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Плазмонная фототермическая терапия рака: встроенные в наночастицы фантомы, имитирующие опухоль-ткань, для визуализации фототермического распределения температуры
В этой статье
Резюме
В данной статье представлен протокол подготовки опухолево-тканевых фантомов, воспроизводящих оптические свойства, для плазмонной фототермической терапии. В нем подробно описывается фантомная подготовка, фототермическая оценка и валидация разработанной численной модели на основе фототермических измерений температуры для оценки терапевтических параметров, предлагая этичную, экономически эффективную альтернативу исследованиям in vivo для предварительного тестирования.
Аннотация
Плазмонная фототермическая терапия (PPTT), новый метод лечения рака, включает в себя доставку наночастиц (НЧ) в опухоль с последующим облучением в ближнем инфракрасном диапазоне (NIR) для получения локального тепла, которое разрушает раковые клетки. Перед введением ППТТ необходимо оценить терапевтические параметры - концентрацию НЧ, интенсивность и продолжительность облучения. Для этого выполняется численное моделирование. Тем не менее, чтобы обеспечить надежность вычислений, эти симуляции должны быть проверены с помощью фототермических экспериментов на фантомах, имитирующих опухоль-ткань, воспроизводящих оптические свойства опухолевой ткани. Для ППТТ терапевтические параметры регулируются рассеянием и поглощением падающего излучения тканями и НЧ. Таким образом, валидационные эксперименты могут быть проведены на фантомах, имитирующих приведенный коэффициент рассеяния (μс') и коэффициент поглощения (μa) опухоли/ткани-мишени.
В частности, этот протокол содержит инструкции по приготовлению фантомов, имитирующих μи μ опухоли молочной железы, вводимой с помощью золотых наностержней, окруженных нормальной тканью молочной железы. В протоколе также подробно описывается облучение в ближнем ИК-диапазоне, мониторинг температуры и проверка численных результатов путем сравнения пространственно-временных температур с температурами, измеренными с помощью термопар. Протоколы, представленные в данном исследовании, способствовали получению цилиндрических фантомов опухоли-ткани молочной железы на основе гидрогеля с размерами (φ40 x 12 мм) и центральной опухолевой областью (φ20 x 6 мм), содержащей 1% агарозы в качестве базовой матрицы и интралипидную в качестве рассеивающей составляющей и опухолевую область, внедренную золотыми наностержнями в концентрации 25 мкг/мл. Репрезентативные результаты тематического исследования иллюстрируют применение изготовленных фантомов для валидации численного моделирования PPTT. В исследовании сделан вывод о том, что продемонстрированные протоколы представляют ценность для проведения фототермических экспериментов, направленных на оптимизацию и планирование терапевтических параметров до проведения экспериментов in vivo и валидации численного моделирования для PPTT.
Введение
Плазмонная фототермическая терапия (ППТТ) — это новый метод локализованного лечения рака, который включает в себя доставку наночастиц (НЧ) к месту опухоли с последующим облучением ближним инфракрасным (БИК) излучением. НУП обычно вводятся внутриопухолевым (ИТ) или внутривенным (ВВ) путями1. При облучении в ближнем ИК-диапазоне плазмонное взаимодействие падающего излучения и НЧ приводит к образованию локализованного тепла на поверхности НЧ, которое затем рассеивается в окружающей опухолевой ткани 2,3. Этот локализованный нагрев повышает температуру в области опухоли, что приводит к гибели раковых клеток за счет термической абляции 4,5. Эффективное лечение рака может быть достигнуто путем поддержания определенных температур, таких как 46 ºC в течение 1 ч6, 50-52 ºC в течение 4-6 мин7 или 60 ºC при мгновенном повреждении8 с помощью различных биологических процессов.
Различные фототермические агенты были изучены и представлены для применения в фототермической терапии, а их терапевтическая эффективность была оценена в исследованиях in vitro или in vivo. Эти агенты включают органические материалы9, такие как красители ближнего инфракрасного диапазона (например, индоцианин зеленый, IR780, IR820), фототермические агенты на основе полимеров (например, полидопамин) и неорганические материалы10, включая НЧ на основе благородных металлов или плазмонные НЧ (например, золотые НЧ)11, серу/оксиды переходных металлов12 и MXenes13. Среди них плазмонные НЧ, в частности золотые НЧ, обладают рядом преимуществ по сравнению с традиционными фототермическими агентами (например, красителями), такими как лучшая фототермическая стабильность, более высокая эффективность фототермического преобразования и настраиваемый плазмонный отклик за счет вариаций формы иразмера. Эти свойства делают золотые НЧ идеальными кандидатами для фототермической терапии, некоторые из которых в настоящее время проходят клиническиеиспытания.
Для оптимизации терапевтической эффективности и обеспечения достаточного термического повреждения опухоли во время ППТТ перед доклиническим/клиническим применением ППТТ необходимо оценить такие параметры лечения, как доза НЧ (в терминах концентрации) и параметры излучения в ближнем ИК-диапазоне (включая интенсивность и продолжительность облучения). Для установления этих параметров обычно используется численное моделирование. Для оценки термических повреждений в опухолевой ткани были разработаны различные численные методы, одним изтаких подходов является метод решетки Больцмана. Однако для того, чтобы эти симуляции были надежными, они должны быть проверены с использованием аналогов тканей, известных как тканевые фантомы. Эти фантомы могут быть подготовлены для воспроизведения оптических, термических, биологических или механических свойств реальных тканей, выступая в качестве заменителей для проведения предварительных испытаний, оценки лечения и валидации вновь разработанных устройств, материалов или методов, предназначенных длябиологических применений. Это может уменьшить ненужные страдания животных или людей и решить этические проблемы, связанные стакими экспериментами.
Проектирование и изготовление фантома зависят от предполагаемого применения21. Например, во время фототерапии, такой как ППТТ, доза падающего излучения зависит от количества света, поглощенного или рассеянного НЧ и тканями22,23. Таким образом, оптические фантомы, которые имитируют оптические свойства, в частности, пониженный коэффициент рассеяния (μс') и коэффициент поглощения (μа) биологических тканей, используются для оценки PPTT и последующей валидации численного моделирования24,25. Оптические фантомы, как правило, состоят из трех основных компонентов: матрицы основания, рассеивающих агентов и поглощающих агентов 17,26. Базовая матрица содержит компоненты рассеяния и поглощения в подходящих концентрациях для воспроизведения желаемых оптических свойств. Эти фантомы можно классифицировать на твердые, жидкие и полутвердые (гидрогелевые) фантомы, в зависимости от типа базовой матрицы. Для теплотерапевтических исследований, таких как PPTT, гидрогелевые фантомы, особенно на основе агарозы, являются предпочтительными из-за их биосовместимости, незначительного внутреннего рассеяния и поглощения, простого процесса изготовления и гибкости для придания желаемых форм и размеров, соответствующих геометрии опухоли19,22. Самое главное, что приготовленные фантомы на основе агарозы можно использовать при объемных температурах до ~70-80 ºC, так как температура плавления фантомов агарозного типа составляет ~80 ºC19. Для PPTT, поскольку диапазон температур ~50-80 ºC является достаточным, такие фантомы на основе агарозы можно использовать для фототермических оценок на основе PPTT.
Были разработаны и представлены различные фантомы на основе гидрогеля для различных применений. Mustari et al. разработали фантомы, имитирующие ткани на основе агарозы, и продемонстрировали их полезность при валидации недавно разработанной оптической системы. В другом исследовании были подготовлены термохромные фантомы, имитирующие ткани, для измерения степени термического повреждения вовремя терапии высокоинтенсивным сфокусированным ультразвуком (HIFU). Фантомы на основе полиакриламида, имитирующие ткани, также были подготовлены для анализа эффекта кавитации во время терапии рака на основе HIFU28. Целью данного исследования является демонстрация пошагового метода изготовления фантомов, имитирующих опухоль-ткань, а также протокола фототермических экспериментов на основе фантомов для оценки PPTT. Предлагаемый подробный протокол направлен на содействие принятию и воспроизводимости фантомного препарата и последующих методов фототермических экспериментов на основе фантомов для тестирования фототермических характеристик вновь разработанных наноструктур, тем самым подтверждая численное моделирование и помогая в планировании предварительной обработки или оптимизации терапевтических параметров PPTT. В этой статье описывается протокол фантомной подготовки, специально разработанный для подповерхностных опухолей молочной железы; Тем не менее, те же этапы могут быть адаптированы для изготовления различных типов опухолевых тканей (различных форм и размеров) путем изменения состава оптических поглощающих и рассеивающих агентов. В качестве примера, продемонстрированные фототермические оценки на основе фантомов, имитирующие ткани, были использованы в ранее опубликованных исследованиях для валидации моделирования PPTT для подповерхностной опухоли предплечья24, подповерхностной IDC25 и опухолей кожи29.
В данной статье описываются этапы подготовки оптического фантома, который имитирует μподповерхностной или подкожной опухоли молочной железы, в частности, инвазивной протоковой карциномы (ИДК), расположенной на 3 мм ниже поверхности кожи и окруженной нормальной тканью молочной железы. Фантом имеет цилиндрическую геометрию, полученную с использованием агарозы в качестве матрицы основания и интралипида (IL) в качестве рассеивающего агента, добавляемого в подходящих концентрациях для имитации μ s нормальной и раковой ткани молочной железы. Агароза, прозрачный гидрогель с ничтожно малым рассеянием и абсорбцией, является идеальной базовой матрицей для оптических фантомов18,30. Кроме того, IL, 20% жировая эмульсия, которая имитирует двухслойную структуру клеточных мембран, широко используется в качестве рассеивающего агента31,32 и была выбрана для данного исследования для репликации μs нормальной и раковой ткани молочной железы. Фантом предназначен для имитации опухоли молочной железы (IDC), вводимой с помощью золотых наностержней (AuNR) в качестве плазмонных NP, окруженных нормальной тканью молочной железы без AuNR. Среди различных золотых НЧ, используемых в PPTT, для этого исследования были выбраны AuNR из-за их сильного плазмонного ответа в области NIR и их широкого использования в доклинических исследованиях PPTT, в том числе сучастием собак и кошек. Протокол демонстрирует получение двух типов фантомов: один с опухолью с распределением AuNR при внутривенном введении и другой с опухолью, отражающей распределение AuNR при внутривенном введении. В соответствии с протоколом подготовки фантомов описывается экспериментальная установка для облучения в ближнем ИК-диапазоне и этапы проведения фототермических оценок на фантомах. Наконец, приводится пошаговое руководство по интерпретации результатов распределения температуры, полученных в результате этих оценок, и по сравнению экспериментальных данных с результатами численного моделирования. Это сравнение помогает проверить разработанный численный метод, что позволяет настроить оптимальные параметры лечения, адаптированные специально для опухоли.
протокол
Примечание: Фантомы получали с использованием агарозы и интралипида на основе композиций, опубликованных в литературе, для достижения желаемых оптических свойств. Не использовалась реальная биологическая ткань пациентов или трупов. Таким образом, подготовка этих фантомов свободна от этических ограничений и не требует информированного согласия.
1. Выбор или изготовление подходящей пресс-формы
- . Выбор подходящей формы
- Выберите форму, которая соответствует нужной форме и размерам для фантомов. Для цилиндрических фантомов с опухолевым участком, равномерно распределенным по НЧ и окруженным нормальной тканью, используют стеклянную чашку Петри и небольшой стакан в качестве формы8 (рисунок 1А).
ПРИМЕЧАНИЕ: Эти шаги предназначены для подготовки фантомов, имитирующих опухоль-ткань, в цилиндрической геометрии. Для других форм или размеров выберите подходящую форму. Если подходящая форма недоступна, изготовьте ее с помощью трехмерной (3D) печати, как описано в шаге 1.2.
- Выберите форму, которая соответствует нужной форме и размерам для фантомов. Для цилиндрических фантомов с опухолевым участком, равномерно распределенным по НЧ и окруженным нормальной тканью, используют стеклянную чашку Петри и небольшой стакан в качестве формы8 (рисунок 1А).
- Изготовление пресс-формы методом 3D-печати
- Проектирование 3D-модели с помощью программного обеспечения системы автоматизированного проектирования (САПР) (например, SolidWorks, Autodesk Inventor или CATIA) в соответствии с требуемой формой и размером. Чтобы следовать этому протоколу, спроектируйте один полый цилиндр (внутренний диаметр 40 мм, толщина 2 мм и высота 12 мм; см. Дополнительный файл 1) и две цельные цилиндрические маскирующие формы (размеры φ20 x 6 мм и φ14 x 3 мм), как показано на рисунке 1B.
- Для проектирования/черчения полых цилиндров в программе CAD создайте две окружности диаметром 40 мм и 44 мм. Затем выдавите геометрию на 12 мм.
- Для твердотельных цилиндрических маскирующих форм создайте круги диаметром 20 мм и 14 мм, затем выдавите на 6 мм и 3 мм соответственно (см. Дополнительный файл 2 и Дополнительный файл 3). Нарисуйте прямоугольник (стороны 44 мм и 5 мм) с одной стороны цилиндра и выдавите его на 2 мм.
- Конвертируйте 3D-модели в формат Gcode с помощью программного обеспечения, совместимого с 3D-принтером (например, Cura) для печати.
- Используйте этот Gcode для печати пресс-форм (например, с использованием полимолочной кислоты [PLA] φ1,75 мм, 1 кг eSun) с помощью 3D-принтера.
ПРИМЕЧАНИЕ: Прямоугольник рисуется для подвешивания форм для маскировки. Различные формы могут быть спроектированы и изготовлены для получения фантомов с другими желаемыми формами.
- Проектирование 3D-модели с помощью программного обеспечения системы автоматизированного проектирования (САПР) (например, SolidWorks, Autodesk Inventor или CATIA) в соответствии с требуемой формой и размером. Чтобы следовать этому протоколу, спроектируйте один полый цилиндр (внутренний диаметр 40 мм, толщина 2 мм и высота 12 мм; см. Дополнительный файл 1) и две цельные цилиндрические маскирующие формы (размеры φ20 x 6 мм и φ14 x 3 мм), как показано на рисунке 1B.
2. Приготовление опухолевых-тканевых фантомных растворов25
Примечание: В этом исследовании оптические фантомы цилиндрической геометрии на основе агарозы, имитирующие опухолевую ткань, были подготовлены так, чтобы они напоминали подповерхностную опухоль молочной железы, вводимую с помощью AuNR через ИТ или внутривенное введение, как показано на рисунке 2. IT-фантом имеет две области: центральную область опухоли с AuNR и окружающую область нормальной ткани. Внутривенный фантом имеет три области: опухолевую область с AuNR на периферии опухоли, центральную оголенную область опухоли без AuNR и окружающую нормальную область ткани. Поскольку оптические свойства (μа и μс') различаются для опухолевой и нормальной ткани, для каждой области с разным составом готовятся отдельные фантомные растворы, о которых пойдет речь отдельно.
- Приготовление фантомного раствора, имитирующего нормальную ткань молочной железы (Раствор 1)
ПРИМЕЧАНИЕ: Это решение будет использоваться как для ИТ, так и для внутривенных фантомов. Этапы приготовления раствора 1 показаны на рисунке 3А.- Рассчитайте теоретический объем раствора на основе размеров пресс-формы.
ПРИМЕЧАНИЕ: Здесь для цилиндрической формы размером φ40 x 12 мм расчетный объем составляет 15см3 или 15 мл на фантом. Так как таких фантомов нужно подготовить два, то общий объем составляет 15 мл х 2, что составляет 30 мл. Поэтому приготовьте 35 мл раствора с учетом испарения или разлива на этапе фантомного приготовления. - Рассчитайте количество (масса/концентрация/объем) всех фантомных составляющих — агарозы (в качестве основного материала) и ИЛ (в качестве рассеивающего компонента) — которые должны быть добавлены в раствор объемом 35 мл.
- Добавьте 0,35 г агарозы для приготовления 35 мл раствора, что соответствует 1% мас.в.
- Оцените концентрацию ИЛ, соответствующую желаемым μс' нормальной ткани молочной железы (т.е. 10,1 см-1 33) на основе соотношения концентрации ИЛ с данными μс, имеющимися в литературе. Далее рассчитаем объем ИЛ (20% эмульсионного запаса), который будет добавлен в фантомный раствор с помощью уравнения (1):
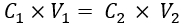 (1)
(1)
где C1 и V1 - концентрация запаса реагента (в данном случае 20% запаса IL) и объем добавляемого раствора запаса реагента (здесь его следует рассчитать) соответственно. C2 — необходимая концентрация реагента (которая должна быть получена из литературы) в конечном рабочем растворе, аV2 — общий объем конечного рабочего раствора (в данном случае 35 мл).
ПРИМЕЧАНИЕ: Здесь для μс' 10,1 см-1 концентрация ИЛ, оцененная по данным литературы, составляет 1,04%34,35. Используя вышеуказанные шаги, объем добавляемого ИЛ (20% запаса IL) составляет 1,82 мл.
- Взвесьте 0,35 г агарозы и добавьте ее к 33,18 мл деионизированной (DI) воды в стакане. Накройте стакан алюминиевой фольгой, чтобы избежать потери воды.
- Нагрейте стакан с раствором на горячей плите при температуре 120 °C, помешивая, пока раствор не станет прозрачным.
- Уменьшите температуру конфорки до 60 ºC. Через 15 минут добавьте 1,82 мл IL, помешивая. Держите полученный раствор, Раствор 1, при перемешивании при температуре 60 ºC до использования (готового к заливке).
ПРИМЕЧАНИЕ: Фантомный раствор при температуре 60 ºC необходимо хранить в условиях перемешивания. В противном случае это приводит к застыванию раствора.
- Рассчитайте теоретический объем раствора на основе размеров пресс-формы.
- Приготовление фантомного раствора опухолевого фантома, залитого AuNR (Раствор 2)
ПРИМЕЧАНИЕ: Это решение будет использоваться как для ИТ, так и для внутривенных фантомов. Этапы приготовления раствора 2 показаны на рисунке 3В.- Рассчитайте объем заполняемой опухолевой области (φ20 x 6 мм).
ПРИМЕЧАНИЕ: Примерный объем для двух таких опухолевых фантомов составляет 3,8 мл. Таким образом, объем раствора, который необходимо приготовить, составит 4,5 мл. - Рассчитайте количество добавляемых опухолевых фантомных компонентов — агарозы, IL и AuNR — с помощью шагов, аналогичных описанным в разделе 2.1.
- Добавьте 45 мг для приготовления 4,5 мл раствора, что соответствует 1% мас.v.
- IL:μs' опухоли молочной железы составляет 4,6 см-1 33, и для имитации того же значения соответствующая требуемая концентрация IL составляет 0,472%34,35. Поэтому добавьте 106,2 мкл ИЛ из 20% запаса ИЛ в 4,5 мл фантомного раствора опухоли.
- Желаемая концентрация AuNR в фантоме составляет 25 мкг/мл. Для достижения того же результата добавьте 3,21 мл раствора AuNRs (исходная концентрация: 35 мкг/мл) в раствор опухолевого фантома.
- Добавьте 45 мг агарозы в 1,18 мл воды DI в стакане и накройте его алюминиевой фольгой.
- Поместите стакан на горячую плиту и перемешивайте при температуре 120 ºC, пока раствор не станет прозрачным.
- Уменьшите температуру конфорки до 60 ºC и оставьте раствор на 15 минут.
- Добавьте 106,2 мкл IL и 3,21 мл суспензии AuNR (35 мкг/мл) в условиях перемешивания. Держите полученный раствор, Раствор 2, при перемешивании при температуре 60 ºC до заливки.
- Рассчитайте объем заполняемой опухолевой области (φ20 x 6 мм).
- Приготовление фантомного раствора голой опухоли (без AuNR) (Раствор 3)
ПРИМЕЧАНИЕ: Этот раствор будет использоваться только для внутривенного фантома. Этапы приготовления раствора 2 показаны на рисунке 3C.- Рассчитайте теоретический объем суспензии, которую необходимо добавить для создания голой опухолевой области (~ φ20 x 6 мм).
ПРИМЕЧАНИЕ: Приблизительный объем для опухолевых фантомов составляет 1,9 мл. Таким образом, объем раствора, который необходимо приготовить, составит 2,5 мл. - Рассчитайте количество добавляемых опухолевых фантомных компонентов агарозы и ИЛ, используя шаги, аналогичные указанным в разделе 2.1.
- Добавьте 25 мг агарозы для приготовления 2,5 мл раствора так, чтобы достичь 1% массовой концентрации.
- IL:μs' опухоли молочной железы составляет 4,6 см-1 33, и для имитации того же значения соответствующая требуемая концентрация IL составляет 0,472%34,35. Добавьте 59 μл 20% IL.
- Добавьте 25 мг агарозы в 2,44 мл воды DI в стакане и накройте его алюминиевой фольгой.
- Поместите стакан на горячую плиту и перемешайте при температуре 120 ºC, пока раствор не станет прозрачным.
- Уменьшите температуру конфорки до 60 ºC и оставьте раствор на 15 минут.
- Добавьте в раствор 59 мкл ИЛ при перемешивании. Выдержите полученный раствор, Раствор 3, при перемешивании при температуре 60 ºC до заливки.
- Рассчитайте теоретический объем суспензии, которую необходимо добавить для создания голой опухолевой области (~ φ20 x 6 мм).
3. Препарат опухолю-тканевого фантома 24,25,36
- Подготовьте формочки к этапу заливки. Для этого заклейте дно цилиндрических форм парапленкой и поместите малярную форму (φ20 x 6 мм) в центр.
- Залейте раствор 1 в цилиндрические формы до верхней отметки маскировочной формы и дайте ему застыть (рисунок 4A).
- После затвердевания удалите маскирующую форму, чтобы создать полость для опухолевой области (Рисунок 4B).
ПРИМЕЧАНИЕ: Протокол будет одинаковым как для ИТ, так и для внутривенных фантомов до шага 3.3. Этот процесс будет обсуждаться отдельно для ИТ и внутривенных фантомов после шага 3.3. - ИТ-фантом 24,25,36
- Заполните полость раствором 2 и дайте ему застыть (рисунок 4C).
- Добавьте Раствор 1 в верхнюю часть фантома и дайте ему полностью застыть (Рисунок 4D).
- Внутривенный фантом 24,25
- Вставьте меньшую маскирующую форму (φ14 x 3 мм) и заполните полость вокруг нее раствором 2 (рис. 4E).
- После затвердевания удалите меньшую форму и заполните оставшуюся полость раствором 3 (рис. 4F).
- Добавьте Раствор 1 наверх и дайте ему полностью застыть (Рисунок 4G).
4. Установка термопар в фантом 24,25,36
ПРИМЕЧАНИЕ: Для контроля пространственного распределения температуры термопары типа K вставляются внутрь фантома в различных радиальных (r) и осевых (z) местах, как показано на рисунке 2. Для введения термопары в точных местах стеклянные капилляры используются в качестве направляющих, чтобы обеспечить точность. Места расположения термопар обозначаются как (r, z), где средняя точка на верхней поверхности опухоли на глубине z = 3 мм служит точкой отсчета как для IT, так и для внутривенных фантомов и обозначается как (0, 3), как показано на рисунках 2A, B. При выборе радиального и аксиального расположения для количественной оценки термического повреждения в области опухоли решающее значение имеют места на периферии опухоли (как радиальные, так и осевые). Достижение требуемых температур в этих периферических точках во время NIR-облучения обеспечивает полную абляцию опухоли. Таким образом, термопары размещают в радиальных крайних точках (опухоли) при z = 3 и 9 мм, т.е. (10, 3) и (10, 9), а одну термопару размещают на границе опухоль-ткань при z = 9 мм (периферическое осевое расположение), т.е. (0, 9), как показано на рисунке 2A, B. Кроме того, для оценки осевого распределения температуры между точками (0, 3) и (0, 9) вставляется термопара, обозначенная как (0, 6). Наконец, для оценки повышения температуры в окружающей области здоровых тканей одну термопару вставляют в точке (15, 3).
- Разрежьте стеклянные капилляры до подходящей длины так, чтобы они достигали желаемых радиальных и осевых положений внутри фантома.
- Вставьте термопары в эти стеклянные капилляры и проколите их в указанных радиальных и аксиальных фантомных местах один за другим.
- После того, как все термопары будут на месте, осторожно поместите фантом в стеклянную чашку Петри для последующего NIR-облучения, как показано на рисунке 5A.
5. Воздействие ближнего ИК-излучения и измерение полученных фототермических температур36
- Поместите стеклянную чашку Петри, содержащую фантом (вставленную с помощью термопар), так, чтобы центральная область верхней поверхности фантома была перпендикулярна кончику оптического волокна источника света ближнего ИК-диапазона, как показано на рисунке 5А.
ПРИМЕЧАНИЕ: Диаметр луча на фантомной поверхности можно регулировать, изменяя расстояние между поверхностью и наконечником оптического волокна. Здесь расстояние 9 мм выдерживается для достижения диаметра луча 20 мм, охватывающего центральную область опухоли. - Подключите систему сбора данных (DAQ) к компьютеру и откройте программное обеспечение LabVIEW.
- Одновременно включите источник света NIR (рис. 5B) и кнопку воспроизведения в программном обеспечении, чтобы записать данные о температуре в начале облучения.
- Облучайте фантом в течение 20 минут, затем выключите источник света NIR и остановите запись.
- Построение графика зависимости записанных данных температуры от времени.
6. Сравнение температуры с результатами моделирования24,25
ПРИМЕЧАНИЕ: Эксперименты, как правило, повторяются, а температуры регистрируются через определенные промежутки времени во всех местах расположения термопар. Для валидации выполняются следующие шаги:
- Вычислить среднее значение и стандартное отклонение экспериментальных температур во всех местах расположения термопар (r, z).
- Численно вычислите температуры в рассматриваемых местах расположения термопар.
- График средней температуры, полученной в результате экспериментов, и температуры, полученной при моделировании, во всех местах расположения термопар по времени, показанных на рисунке 6.
- Рассчитайте среднеквадратическую ошибку (RMSE) и среднюю абсолютную ошибку (MAE) для всех мест расположения термопары, чтобы количественно оценить разницу температур для оценки валидации, как показано в таблице 1.
ПРИМЕЧАНИЕ: MAE и RMSE рассчитываются с использованием уравнений 2 и 3 соответственно.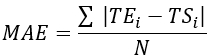 (2)
(2)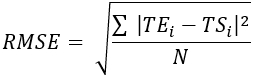 (3)
(3)
Где TE, TS и N — температура, полученная экспериментально, численно вычисленная температура и количество точек данных (здесь температуры регистрируются каждую секунду в течение 20 мин; следовательно, = 1200) соответственно. i представляет моменты времени.
Результаты
На рисунке 6 показаны средние временные температуры, полученные во время экспериментов с фантомом опухоли-ткани, встроенным в AuNR, во всех местах расположения термопары, как показано на рисунке 2, по сравнению с темпера?...
Обсуждение
В данной работе представлен протокол получения опухолевых и тканевых фантомов на основе агарозы, имитирующих оптические фантомы. Фантомы спроектированы таким образом, чтобы имитировать оптические свойства опухолевых и нормальных тканей для их использования в иссл?...
Раскрытие информации
Авторы не имеют конкурирующих интересов для раскрытия информации.
Благодарности
Это исследование было проведено без какой-либо финансовой поддержки со стороны каких-либо общественных, коммерческих или некоммерческих финансирующих органов. Авторы выражают признательность CSIR – Центральной организации по научным приборам, Чандигарх, Индия, за инфраструктуру и поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | 9012-36-6 | Base matrix for phantoms |
| Deionized (DI) water (18.2 MΩ) | NA | NA | Solvent for the preparation of phantom solutions |
| Gold nanorods (AuNRs) | Nanopartz | A12-10-808 | Plasmonic nanoparticles |
| Intralipid (20% emulsion stock) | Sigma-Aldrich | 68890-65-3 | Scattering agent of phantoms |
| Parafilm | Parafilm M | 380020 | To seal the bottom of cylindrical mold |
| Polylactic acid filament | eSun | NA | Material for molds (1.75 mm dia wire) |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| 3D Printer | Creality | Ender-3 | For printing molds |
| Data acquisition (DAQ) system | National Instruments | cDAQ-9171 | For recording temperatures |
| DI water unit | Merck Millipore | Direct-Q3 | For DI water |
| Hot plate with magnetic stirrer | IKA | C-MAG HS 4 | For phantom solutions preparation |
| NIR light source | NA (In-house developed) | NA | For NIR irradiation of phantoms, (800/50 nm; Center wavelength: 800 nm, Bandwidth: 50 nm) |
| Optical Fiber (1/2" × 12") | Edmund Optics | 38-659 | For NIR irradiation of phantoms |
| Type K thermocouples | RS Components | RS Pro 397-1589 | For temperature monitoring at various phantom locations during NIR irradiation |
| Weighing Balance | Wensar | PGB 200 | For weighing agarose |
| Name of Software | Company | Catalog Number | Comments/Description |
| Autodesk Inventor 2021 | Autodesk | NA | For mechanical designing of molds |
| Cura 5.7 | Ultimaker | NA | For converting mechanical design to Gcode for 3D printing |
| Matlab R2024b | MathWorks | NA | For numerical simulations and temperature data plots |
| Name of Labwares used | Company | Catalog Number | Comments/Description |
| Beakers (50 mL) | Borosil | 1000D12 | For phantom solution preparations |
| Beakers (10 mL) | Borosil | 1000006 | For phantom solution preparations |
| Pipette (100-1000 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 063 | For adding constituents into the phantom solution |
| Pipette (10-100 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 047 | For adding constituents into the phantom solution |
| Spatula | Borosil | LASC8888M06 | For weighing agarose and demolding the phantoms from the molds |
| Tips (100-1000 µL) | Tarsons | 521016 | For adding constituents into the phantom solution |
| Tips (10-100 µL) | Tarsons | 521010Y | For adding constituents into the phantom solution |
Ссылки
- Riley, R. S., Day, E. S. Gold nanoparticle-mediated photothermal therapy: applications and opportunities for multimodal cancer treatment. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (4), e1449 (2017).
- Webb, J. A., Bardhan, R. Emerging advances in nanomedicine with engineered gold nanostructures. Nanoscale. 6 (5), 2502-2530 (2014).
- Abadeer, N. S., Murphy, C. J. Recent progress in cancer thermal therapy using gold nanoparticles. J Phys Chem C. 120 (9), 4691-4716 (2016).
- Murphy, C. J., et al. Virus-sized gold nanorods: Plasmonic particles for biology. Acc Chem Res. 52 (8), 2124-2135 (2019).
- Overchuk, M., Weersink, R. A., Wilson, B. C., Zheng, G. Photodynamic and photothermal therapies: Synergy opportunities for nanomedicine. ACS Nano. 17 (9), 7979-8003 (2023).
- Goldberg, S. N., Gazelle, G. S., Mueller, P. R. Thermal ablation therapy for focal malignancy. Am J Roentgenol. 174 (2), 323-331 (2000).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Role of optical coefficients and healthy tissue-sparing characteristics in gold nanorod-assisted thermal therapy. Int J Hyperth. 29 (1), 87-97 (2013).
- Khurana, D., Vikas, A. K., Shaw, S., Soni, Polydopamine coated gold nano blackbodies for tumor-selective spatial thermal damage during plasmonic photothermal cancer therapy. IEEE Trans Nanobiosci. 21 (4), 482-489 (2021).
- Jung, H. S., Verwilst, P., Sharma, A., Shin, J., Sessler, J. L., Kim, J. S. Organic molecule-based photothermal agents: an expanding photothermal therapy universe. Chem Soc Rev. 47 (7), 2280-2297 (2018).
- Ge, R. L., Yan, P. N., Liu, Y., Li, Z. S., Shen, S. Q., Yu, Y. Recent advances and clinical potential of near infrared photothermal conversion materials for photothermal hepatocellular carcinoma therapy. Adv Func Mater. 33 (29), 2301138 (2023).
- Shabani, L., et al. An investigation into green synthesis of Ru template gold nanoparticles and the in vitro photothermal effect on the MCF-7 human breast cancer cell line. Appl Phys A. 129 (8), 564 (2023).
- Mosleh-Shirazi, S., et al. Investigation through the anticancer properties of green synthesized spinel ferrite nanoparticles in present and absent of laser photothermal effect. Ceram Int. 49 (7), 11293-11301 (2023).
- Amani, A. M., et al. Innovation applications of MXenes in biomedicine. Mater Today Commun. 40, 109929 (2024).
- Ali, M. R. K., Wu, Y., El-Sayed, M. A. Gold-nanoparticle-assisted plasmonic photothermal therapy advances toward clinical application. J Phys Chem C. 123 (25), 15375-15393 (2019).
- Lahonian, M., Golneshan, A. A. Numerical study of temperature distribution in a spherical tissue in magnetic fluid hyperthermia using Lattice Boltzmann method. IEEE Trans NanoBiosci. 10 (4), 262-268 (2011).
- Shaw, A. K., Soni, S. Role of periodic irradiation and incident beam radius for plasmonic photothermal therapy of subsurface tumors. J Therm Biol. 121, 103859 (2024).
- Pogue, B. W., Patterson, M. S. Review of tissue simulating phantoms for optical spectroscopy, imaging and dosimetry. J Biomed Opt. 11 (4), 041102 (2006).
- Mustari, A., et al. Agarose-based tissue mimicking optical phantoms for diffuse reflectance spectroscopy. J Vis Exp. (138), e57578 (2018).
- Dabbagh, A., Abdullah, B. J. J., Ramasindarum, C., Abu Kasim, N. H. Tissue-mimicking gel phantoms for thermal therapy studies. Ultrason imaging. 36 (4), 291-316 (2014).
- Khurana, D., et al. Experimental investigation of photothermal conversion and thermal conductivity of broadband absorbing gold nanoblackbodies and graphene oxide nanoparticles for plasmonic photothermal cancer therapy. Int Commun Heat Mass Transf. 156, 107597 (2024).
- Ortega-Palacios, R., Leija, L., Vera, A., Cepeda, M. F. J. Measurement of breast-tumor phantom dielectric properties for microwave breast cancer treatment evaluation. , 216-219 (2010).
- Wagnières, G., et al. An optical phantom with tissue-like properties in the visible for use in PDT and fluorescence spectroscopy. Phys Med Biol. 42 (7), 1415 (1997).
- Didychuk, C. L., Ephrat, P., Chamson-Reig, A., Jacques, S. L., Carson, J. J. L. Depth of photothermal conversion of gold nanorods embedded in a tissue-like phantom. Nanotechnology. 20 (19), 195102 (2009).
- Shaw, A. K., Khurana, D., Soni, S. Thermal damage analysis of sub-surface soft tissue sarcoma for Indocyanine Green mediated photothermal cancer therapy. Therm Sci Eng Prog. 46, 102168 (2023).
- Shaw, A. K., Khurana, D., Soni, S. Assessment of thermal damage for plasmonic photothermal therapy of subsurface tumors. Phys Eng Sci Med. 47 (3), 1107-1121 (2024).
- Khurana, D., Soni, S. Tissue-mimicking phantoms for photothermal performance evaluations. Recent Trends in Cancer Therapeutics: Plasmonic Photothermal-Based Multimodal Cancer Therapy. , 109-136 (2024).
- Eranki, A., et al. Tissue-mimicking thermochromic phantom for characterization of HIFU devices and applications. Int J Hyperth. 36 (1), 517-528 (2019).
- McLaughlan, J. R. Controllable nucleation of cavitation from plasmonic gold nanoparticles for enhancing high intensity focused ultrasound applications. J Vis Exp. (140), e58045 (2018).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Experimental and numerical investigation of heat confinement during nanoparticle-assisted thermal therapy. Int Commun Heat Mass Transf. 69, 11-17 (2015).
- Ntombela, L., Adeleye, B., Chetty, N. Low-cost fabrication of optical tissue phantoms for use in biomedical imaging. Heliyon. 6 (3), e03602 (2020).
- Lai, P., Xu, X., Wang, L. V. Dependence of optical scattering from Intralipid in gelatin-gel based tissue-mimicking phantoms on mixing temperature and time. J Biomed Opt. 19 (3), 035002 (2014).
- Aernouts, B., Van Beers, R., Watté, R., Lammertyn, J., Saeys, W. Dependent scattering in Intralipid®phantoms in the 600-1850 nm range. Opt Express. 22 (5), 6086-6098 (2014).
- Tromberg, B. J., et al. Non-invasive in vivo characterization of breast tumors using photon migration spectroscopy. Neoplasia. 2 (1-2), 26-40 (2000).
- Kanick, S. C., et al. Scattering phase function spectrum makes reflectance spectrum measured from Intralipid phantoms and tissue sensitive to the device detection geometry. Biomed Opt Express. 3 (5), 1086-1100 (2012).
- Yuan, B., Chen, N., Zhu, Q. Emission and absorption properties of indocyanine green in Intralipid solution. J Biomed Opt. 9 (3), 497-503 (2004).
- Khurana, D., et al. Gold nanoblackbodies-based multifunctional nanocomposite for multimodal cancer therapy. Int J Pharm. 642, 123112 (2023).
- Brough, D., Ramos, J., Delpech, B., Jouhara, H. Development and validation of a TRNSYS type to simulate heat pipe heat exchangers in transient applications of waste heat recovery. Int J Thermofluid. 9, 100056 (2021).
- Vardaki, M. Z., Kourkoumelis, N. Tissue phantoms for biomedical applications in Raman spectroscopy: A review. Biomed Eng Computational Biol. 11, 1179597220948100 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены