A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
طريقة لتلطيخ جسم الجامع في جبل الفرخ
In This Article
Summary
هذا الفيديو يوضح كل جبل المناعية ، وهي الطريقة التي نمط التعبير المكاني والزماني للمستضد يمكن تصور افراخ الدجاج في الشباب. وقدم أصلا من قبل هذه الطريقة ودود جين Jessell توم.
Abstract
الجنين الفرخ هو أداة قيمة في دراسة التطور الجنيني المبكر. شفافيته ، وسهولة الوصول وسهولة التلاعب ، وجعلها أداة مثالية لدراسة التعبير الأضداد في تطوير الدماغ ، والأنبوب العصبي والجسيدة. هذا الفيديو يوضح الخطوات المختلفة في تلطيخ الأضداد كلها يشن باستخدام الأجسام المضادة الثانوية HRP مترافق ؛ أولا ، يتم تشريح الجنين من بويضة والثابتة في بارافورمالدهيد. الثاني ، هو البيروكسيداز الذاتية المعطل ، ثم يتعرض الجنين إلى جسم الابتدائي. يغسل بعد عدة ، وحضنت الجنين مع الأجسام المضادة الثانوية مترافق لHRP. وكشف النشاط البيروكسيداز باستخدام التفاعل مع الركيزة diaminobenzidine. أخيرا ، يتم إصلاح الجنين ومعالجتها للتصوير الفوتوغرافي وsectioning. ميزة هذه الطريقة على استخدام الاجسام المضادة فلوري هو أنه يمكن معالجة الأجنة لsectioning الشمع ، مما يتيح للدراسة المواقع مستضد في المقطع العرضي. وقدم أصلا من قبل هذا الأسلوب دود جين وتوم Jessell
Protocol
أولا تخطيطي لمحة عامة :
هذا الفيديو يوضح الخطوات المختلفة في جبل المناعية كلها في جنين الفرخ. الأول ، هو ثابت في جنين PFA [IHC1]. إذن ، هو مروي الذاتية النشاط البيروكسيداز [IHC2]. ومن ثم حضنت الجنين في جسم الأولية [IHC3]. يغسل بعد عدة ، وحضنت في جسم الجنين الثانوية [IHC4] ؛ يكشف رد فعل اللون باستخدام DAB [IHC5] والضد يظهر البرتقالي تلطيخ [IHC6].
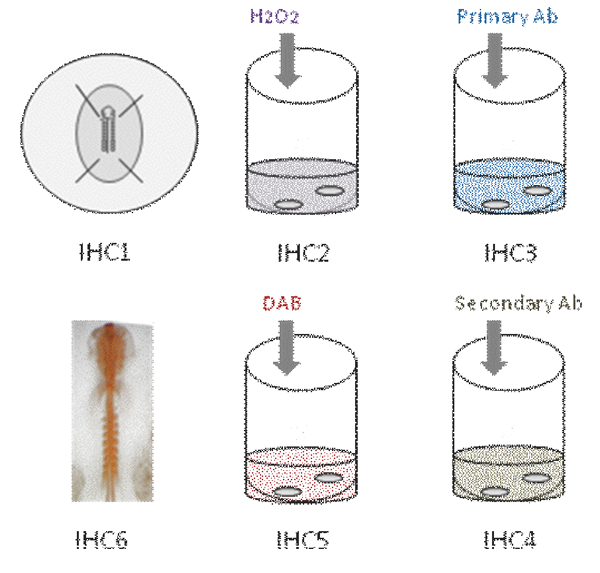
الجزء 1 : تحديد الأجنة
- لأداء كامل المناعية جبل على الاجنة فرخ ، أولا فتح بيضة من خلال الاستفادة من قذيفة بالملقط وإزالة قطعة من قذيفة.
- إزالة ألبومين سميك بالملقط ، والميل كيس المح مع ملقط الخشنة بحيث الجنين يواجه صعودا.
- باستخدام مقص غرامة ، وقطع مربعة من الكيس المحي حول الجنين. إزالة الجنين من صفار البيض مع ملعقة ، والمكان في صحن يحتوي على برنامج تلفزيوني.
- تشريح تحت المجهر ، وإزالة بعناية الأغشية وصفار البيض ونقل الجنين الى طبق الطازجة التي تحتوي على برنامج تلفزيوني.
- دبوس الجنين إلى أسفل مع ملقط ودبابيس الحشرات ، ونضح في برنامج تلفزيوني. استبدال هذا PFA مع 4 ٪ في برنامج تلفزيوني ، وتسمح للجنين لإصلاح 1H في RT.
الجزء 2 : التحضير للأجنة خطوة الأضداد
- لتقليل احتمال التلوث الميكروبي ، واستخدام DDH 2 O في جميع الخطوات التالية.
- بعد إصلاح الجنين ، نضح الحل تثبيتي ، والتصرف بشكل صحيح مع النفايات الكيميائية. ملء الطبق مع برنامج تلفزيوني.
- المقبل ، وذلك باستخدام سكين microdissection ، قطع مربعة حول الجنين لإزالة الأغشية خارج الجنين. إزالة المسامير الحشرة بالملقط.
- بعد إزالة المسامير ، واستخدام كليلة نهاية ماصة باستور لنقل الجنين الى قارورة تحتوي على التلألؤ مع PBT (PBS الرقم الهيدروجيني 7.4 ، و 0.5 ٪ X تريتون).
- غسل الجنين مع PBT ، 3 مرات لمدة 10 دقيقة لكل منهما.
- إزالة PBT من القارورة التلألؤ ، واستبدالها مع PBTx تحتوي على 0.3 ٪ H 2 O 2 من أجل تعطيل إمكانات البيروكسيداز الذاتية.
- احتضان لمدة 2 ساعة على RT على nutator.
- غسل الجنين مع PBT ، 3 مرات لمدة 10 دقيقة لكل منهما ، ثم 3 مرات لمدة 30 دقيقة لكل منهما.
الجزء 3 : الحضانة جسم
- وصمة عار على الجنين مع الأضداد ، تبدأ من خلال غسل الجنين لمدة ساعة واحدة في المخزن حجب أو 1 ٪ BSA / خ ع 1 ٪ / PBT (نستخدم NGS لأن رفع الأجسام المضادة الثانوية في الماعز). على احتضان nutator لمدة ساعة في RT.
- تمييع الضد الابتدائية في 01:01 العازلة حظر ، واحتضان الجنين في هذا الحل لمدة 2 يوما في 4 درجات مئوية على nutator. عامل أساسي تخفيف الضد يعتمد على اختيار الأضداد الابتدائي. هنا ، علينا استخدام الضد من البنك التنموي الدراسات ورم هجين ، وهو على النحو المنصوص عليه supernatent. نحن تمييع ذلك في عرقلة 01:01 العازلة.
- المقبل ، تنفيذ 3 10 دقيقة يغسل في PBT ، تليها يغسل 1 ساعة 3 في PBT.
- بعد الغسيل ، وتمييع 1:2500 الضد الثانوية في حجب العازلة (في هذه الحالة ، مترافق البيروكسيداز الماعز المضادة للمفتش الماوس (H + L) ، واحتضان الجنين في هذا الحل O / N عند 4 درجات مئوية على nutator.
- تنفيذ 3 10 دقيقة يغسل في PBT ، تليها يغسل 1 ساعة 3 في PBT.
الجزء 3 : رد فعل اللون
- لتطوير تفاعل لون الجنين الملون ، نفذ أول 2 20 دقيقة يغسل العازلة في تريس (تريس 100mM حمض الهيدروكلوريك ، ودرجة الحموضة 7.4).
- وفي الوقت نفسه بحل DAB الركيزة (3،3 '- diaminobenzidine tetrahydrochloride) في تريس العازلة في 500μg/ml تحت غطاء الدخان ؛ ابقاء الحل في الظلام ، وعلى الثلج.
- إزالة مشاركة غسل تريس العازلة من الجنين قارورة تحتوي على واستبدالها مع الحل DAB 5ml من الخطوة 3.2. نضع في الظلام لمدة 20 يوم nutator مليون سهم. التخلص من غيض إيبندورف في دلو يحتوي على محلول التبييض 10 ٪ من أجل تطهير DAB.
- وفي الوقت نفسه يعد مخزونا 0.3 ٪ H 2 O 2 درهم في 2 O على الجليد.
- إضافة 50μl الأسهم H 2 O 2 إلى قارورة تحتوي على الأجنة في DAB. نضع في الظلام. بعد 1-2 دقائق ، ورصد ردود الفعل تحت المجهر.
الجزء 4 : معالجة الأجنة والأنسجة للتصوير الفوتوغرافي
- رد الفعل عند اكتمال اللون ، والتخلص من DAB في دلو التبييض. استبدال مع 5 مل من ماء الصنبور.
- تنفيذ 2 10 دقيقة يغسل في برنامج تلفزيوني.
- لعملية التصوير وsectioning الشمع ، يذوى في سلسلة من الايثانول (25 ٪ ، 50 ٪ ، 75 ٪ و 100 ٪) لمدة 10 دقيقة لكل منهما.
- محل الايثانول مع 0،5-1 مل زيت خشب الأرز (وهذا سيجعل شفافة الجنين). عملية التصوير في زيت خشب الأرز.
- بعد التصوير ، والعودة إلى جنين واستبدال قنينة زيت خشب الأرز مع الإيثانول بنسبة 100 ٪. كرر الخطوة الايثانول.
- استبدال هthanol مع 5 ٪ FCF الأخضر السريع في الإيثانول بنسبة 100 ٪ ، واحتضان لمدة 3 دقائق (هذه الخطوة سوف تجعل مرئيا لأجنة الأنسجة). استبدال حل سريع FCF الأخضر مع الإيثانول بنسبة 100 ٪ وعملية لعلم الأنسجة.
ممثل النتائج :
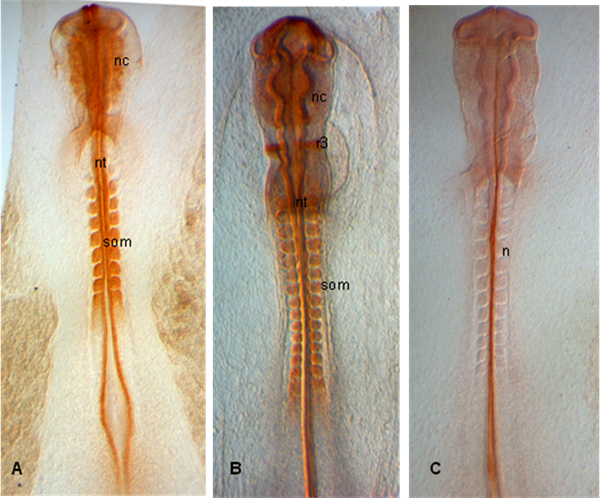
في الأمثلة الموضحة أدناه ، يتم تشريح الأجنة في المراحل سمو 10 (أ) و 12 (ب) و 11 (C) ؛ الأجنة إظهار التعبير عن PAX 7 في crestas العصبية الناشئة وكذلك في somites والأنبوب العصبي (A ، B) ؛ في (C) ، هو المسمى notochord مع 15.3B9 (غير - 1) (الأجسام المضادة التي يقدمها البنك التنموي الدراسات ورم هجين).
Discussion
هذا الفيديو يوضح الخطوات المختلفة في أداء كامل للأجسام المضادة في جبل تلطيخ افراخ الدجاج الشباب. ويستخدم هذا البروتوكول أساسا لتوصيف المكاني والزماني للرواية في الأضداد 2،3 الفرخ ، فضلا عن استخدام علامات مستضدي المعروفة لتحديد التشوهات الجنينية التالية اهانة...
Acknowledgements
تم الحصول على أجسام مضادة وحيدة النسيلة (15.3B9 ، PAX7) التي طورتها (دود ، TM Jessell وكواكامي ألف) من البنك التنموي ورم هجين الدراسات المتقدمة تحت رعاية معاهد الصحة القومية والحفاظ عليها من جامعة أيوا ، قسم العلوم البيولوجية ، ولاية ايوا. موانئ دبي هي المستفيدة من جائزة روث 1F32 - 01A1 كيرشتاين DA021977 من المعهد الوطني لتعاطي المخدرات. وأيد هذا العمل من قبل مؤسسة مارغريت Alkek M. إلى RHF.
Materials
| Name | Company | Catalog Number | Comments | |
| Eggs | Charles River Laboratories | Premium Fertile | Fertilized, HH4 (16 hr) | |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Marsh Automatic Incubator | Other | Lyon | RX | |
| Curved Forceps (1) | Tool | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Tool | Fine Science Tools | 11002-13 | |
| Fine scissors | Tool | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Microdissecting knife | Tool | Fine Science Tools | 10056-12 | Use to cut embryo from surrounding membranes following fixation |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Reagent | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| 16% PFA | Reagent | Electron Microscopy Sciences | 15710 | |
| 30% H2O2 | Reagent | Sigma-Aldrich | H1009 | |
| BSA | Reagent | Sigma-Aldrich | A3803 | |
| NGS | Reagent | Jackson ImmunoResearch | 005-000-121 | |
| Primary Antibodies | Reagent | Developmental Studies Hybridoma Bank | 4G11, 15.3B9, PAX7 | For these antibodies, investgators used mouse donnors |
| Peroxidase conjugated-Goat Anti-Mouse IgG (H+L) | Reagent | Jackson ImmunoResearch | 115-035-003 | |
| 3,3’-diaminobenzidine tetrahydrochloride | Reagent | Pierce, Thermo Scientific | 34001 | Store at -20; Allow bottle to warm to RT before use. |
| Cedar wood oil | Reagent | Sigma-Aldrich | W522503 | |
| Fast green FCF | Reagent | Sigma-Aldrich | F7252 | |
| Minuten pins 0.2mm diam | Fine Science Tools | 26002-20 |
References
- Yamada, T., Placzek, M., Tanaka, H., Dodd, J., Jessell, T. M. Control of cell pattern in the developing nervous system: Polarizing activity of the floor plate and notochord. Cell. 64, 635-647 (1991).
- Streit, A., Stern, C. D., Thery, C., Ireland, G. W., Aparicio, S., Sharpe, M. J., Gherardi, E. A role for HGF/SF in neural induction and its expression in Hensen's node during gastrulation. Development. 121, 813-824 (1995).
- Basch, M., Bronner-Fraser, M., Garcia-Castro, M. Specification of neural crest occurs during gastrulation and requires Pax7. Nature. 441, 218-222 (2006).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development. 122, 3263-3273 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved