È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Metodo per la colorazione intero anticorpi Monte a Chick
In questo articolo
Riepilogo
Questo video dimostra tutta montare immunoistochimica, un metodo con cui il modello di espressione spaziale e temporale di un antigene può essere visualizzata in embrioni di pollo giovani. Questo metodo è stato originariamente introdotto da Jane e Tom Dodd Jessell.
Abstract
L'embrione di pollo è uno strumento prezioso per lo studio dello sviluppo embrionale precoce. La sua trasparenza, accessibilità e facilità di manipolazione, lo rendono uno strumento ideale per studiare l'espressione di anticorpi nello sviluppo del cervello, del tubo neurale e somite. Questo video mostra le diverse fasi, in tutto il montaggio colorazione anticorpale utilizzando anticorpi coniugati con HRP secondaria; In primo luogo, l'embrione è sezionato dall'uovo e fissati in paraformaldeide. In secondo luogo, perossidasi endogena è inattivato; L'embrione viene quindi esposto a anticorpo primario. Dopo numerosi lavaggi, l'embrione viene incubato con l'anticorpo secondario coniugato con HRP. Perossidasi viene rivelato tramite la reazione con il substrato diaminobenzidina. Infine, l'embrione è fisso ed elaborati per la fotografia e sezionamento. Il vantaggio di questo metodo rispetto all'uso di anticorpi fluorescenti è che gli embrioni possono essere trattati per sezionamento cera, permettendo così lo studio dei siti antigene nella sezione trasversale. Questo metodo è stato originariamente introdotto da Jane e Tom Dodd Jessell
Protocollo
I. Panoramica schematica:
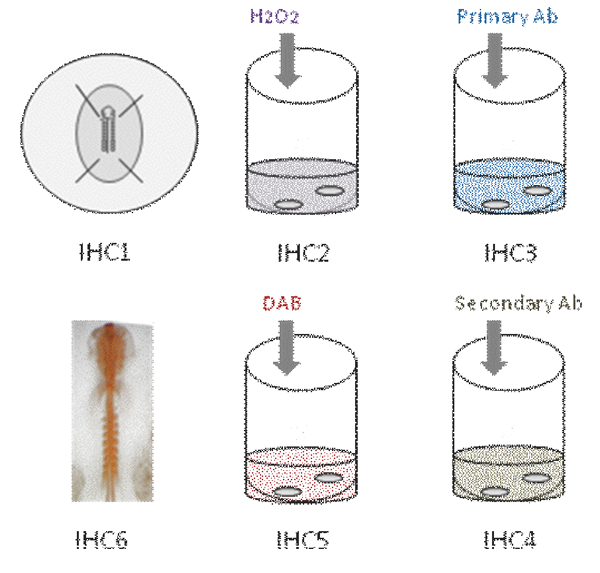
Questo video mostra le diverse fasi in immunoistochimica montare tutto in embrione di pollo. In primo luogo, l'embrione è fissato in PFA [IHC1]. Poi, l'attività della perossidasi endogena si spegne [IHC2]. L'embrione viene quindi incubato in anticorpo primario [IHC3]. Dopo numerosi lavaggi, l'embrione viene incubato in anticorpo secondario [IHC4]; reazione del colore è rivelato utilizzando DAB [IHC5] e colorazione anticorpale sembra arancione [IHC6].
Parte 1: fissaggio degli embrioni
- Per eseguire immunoistochimica intero montare su embrioni di pollo, per prima cosa aprire un uovo toccando il guscio con una pinza e rimuovere i pezzi del guscio.
- Rimuovere l'albumina spessore con una pinza, e inclinare il sacco vitellino con una pinza grossolana in modo che l'embrione verso l'alto.
- Utilizzando forbici, tagliare un quadrato di tutto il sacco vitellino dell'embrione. Rimuovere l'embrione dal tuorlo con un cucchiaio, e mettere in un piatto contenente PBS.
- Sotto un microscopio dissezione, rimuovere con attenzione le membrane e il tuorlo e il trasferimento degli embrioni per un piatto fresco contenente PBS.
- Perno l'embrione giù con una pinza e perni di insetti, e aspirare il PBS. Sostituirlo con PFA 4% in PBS, e consentire l'embrione di fissare 1 ora a temperatura ambiente.
Parte 2: Preparazione di embrioni per la fase di anticorpi
- Per ridurre al minimo potenziale contaminazione microbica, utilizzare DDH 2 O in tutti i passaggi successivi.
- Dopo che l'embrione è fisso, aspirare la soluzione di fissativo e smaltire come rifiuto chimico. Riempire il piatto con PBS.
- prossimo, con un coltello microdissezione, tagliare un quadrato attorno embrione per rimuovere membrane extraembrionali. Rimuovere le spine di insetti con una pinza.
- Dopo i perni sono stati rimossi, utilizzare una pipetta Pasteur smussato fine di trasferire l'embrione in una fiala contenente scintillazione con PBT (PBS pH 7,4, 0,5% Triton X).
- Lavare l'embrione con PBT, 3 volte per 10 minuti ciascuno.
- Rimuovere PBT dal flaconcino scintillazione, e sostituirlo con PBTx contenenti 0,3% di H 2 O 2 al fine di inattivare perossidasi potenziale endogeno.
- Incubare per 2 ore a temperatura ambiente su nutator.
- Lavare embrione con PBT, 3 volte per 10 minuti ciascuno, poi 3 volte per 30 minuti ciascuno.
Parte 3: incubazione anticorpi
- Per colorare l'embrione con l'anticorpo, inizia lavando l'embrione per un'ora in tampone di bloccaggio o 1% BSA / 1% NGS / PBT (usiamo NGS perché l'anticorpo secondario è sollevata in capra). Incubare su nutator per un'ora a temperatura ambiente.
- Diluire l'anticorpo primario 1:1 in tampone di bloccaggio, e incubare embrione in questa soluzione per 2 giorni a 4 ° C il nutator. Primario fattore di diluizione degli anticorpi dipende dalla scelta di anticorpo primario. Qui, usiamo un anticorpo dal Developmental Studies Ibridoma Banca, che viene fornito come supernatent. Noi diluirlo 1:1 in tampone di bloccaggio.
- successiva, eseguire 3 10 minuti lava in PBT, seguita da 3 1-ora lavaggi in PBT.
- Dopo il lavaggio, diluire l'anticorpo secondario 1:2500 in tampone di bloccaggio (in questo caso coniugato perossidasi-capra anti-topo IgG (H + L), embrione e incubare in questa soluzione O / N a 4 ° C su nutator.
- Eseguire 3 10 minuti di lavaggi in PBT, seguita da 3 1-ora lavaggi in PBT.
Parte 3: reazione del colore
- Per sviluppare la reazione colore dell'embrione macchiato, prima eseguire 2 20 minuti di lavaggi in tampone Tris (100mM Tris HCl, pH 7,4).
- Nel frattempo sciogliere substrato DAB (3,3 '-diaminobenzidina tetraidrocloruro) nel tampone Tris a 500μg/ml sotto cappa aspirante; tenere soluzione nel buio, sul ghiaccio.
- Rimuovere ultimi tampone di lavaggio Tris dall'embrione fiala contenente e sostituirlo con la soluzione DAB 5ml dal punto 3.2. Tenere in scuro su nutator per 20 mn. Smaltire Eppendorf punta nel secchio contenente una soluzione di candeggina al 10% per decontaminare DAB.
- Nel frattempo preparare uno stock 0,3% H 2 O 2 in dh 2 O sul ghiaccio.
- Aggiungere il brodo di 50μl H 2 O 2 al flacone contenente gli embrioni in DAB. Tenere al buio. Dopo 1-2 minuti, monitorare la reazione al microscopio.
Parte 4: embrioni per la fotografia e istologia
- Quando la reazione del colore è completa, smaltire DAB in secchio di candeggina. Sostituire con 5 ml di acqua del rubinetto.
- Eseguire 2 10 minuti di lavaggi in PBS.
- Al processo per la fotografia e sezionamento cera, disidratano in una serie di etanolo (25%, 50%, 75% e 100%) per 10 minuti ciascuno.
- Sostituire l'etanolo da 0,5 - 1 ml di olio di cedro legno (questo renderà il traslucido embrione). Processo per la fotografia in olio di legno di cedro.
- A seguito di fotografia, di ritorno embrione a fiala e sostituire l'olio di legno di cedro con il 100% di etanolo. Ripetere il punto etanolo.
- Sostituire ethanol con il 5% FCF veloce verde in 100% etanolo, e incubare per 3 minuti (questo passo renderà visibili gli embrioni per istologia). Sostituire rapida soluzione verde FCF con il 100% di etanolo e di processo per l'esame istologico.
Rappresentante dei risultati:
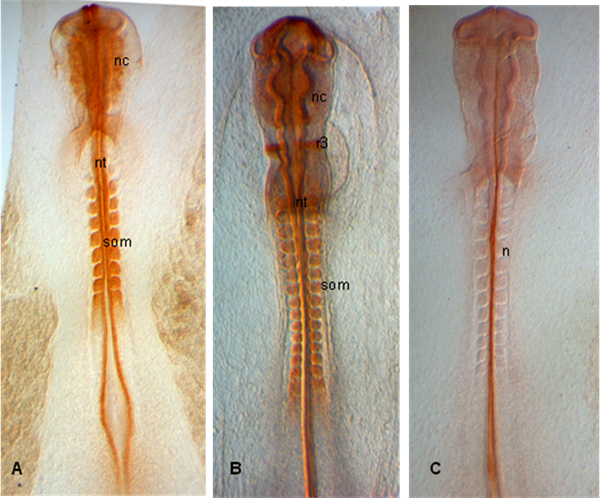
Negli esempi mostrati di seguito, gli embrioni vengono sezionati in fasi HH 10 (A), 12 (B) e 11 (C); Embrioni mostrano espressione di PAX 7 in emergenti Crestas neurali così come in somiti e del tubo neurale (A, B); In (C), notocorda è etichettato con 15.3B9 (Non-1) (Anticorpi fornite dal Developmental Studies Ibridoma Bank).
Discussione
Questo video mostra le varie fasi di esecuzione di tutto il montaggio colorazione anticorpi in embrioni di pollo giovani. Questo protocollo è essenzialmente utilizzato per la caratterizzazione spaziale e temporale di anticorpi romanzo in pulcino 2,3, così come per l'uso di marcatori antigenica nota per determinare malformazioni embrionali seguenti insulto 4.
Riconoscimenti
Gli anticorpi monoclonali (15.3B9, PAX7) sviluppato da (J. Dodd, TM Jessell e A. Kawakami) sono stati ottenuti dalla Banca dello Sviluppo Studi Ibridoma sviluppato sotto l'egida del NICHD e mantenuto dalla University of Iowa, Dipartimento di Scienze biologiche , Iowa. DP è destinatario del Premio Ruth Kirschstein DA021977 1F32-01A1 dal National Institute on Drug Abuse. Questo lavoro è stato sostenuto dal M. Margaret Alkek Fondazione RHF.
Materiali
| Name | Company | Catalog Number | Comments | |
| Eggs | Charles River Laboratories | Premium Fertile | Fertilized, HH4 (16 hr) | |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Marsh Automatic Incubator | Other | Lyon | RX | |
| Curved Forceps (1) | Tool | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Tool | Fine Science Tools | 11002-13 | |
| Fine scissors | Tool | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Microdissecting knife | Tool | Fine Science Tools | 10056-12 | Use to cut embryo from surrounding membranes following fixation |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Reagent | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| 16% PFA | Reagent | Electron Microscopy Sciences | 15710 | |
| 30% H2O2 | Reagent | Sigma-Aldrich | H1009 | |
| BSA | Reagent | Sigma-Aldrich | A3803 | |
| NGS | Reagent | Jackson ImmunoResearch | 005-000-121 | |
| Primary Antibodies | Reagent | Developmental Studies Hybridoma Bank | 4G11, 15.3B9, PAX7 | For these antibodies, investgators used mouse donnors |
| Peroxidase conjugated-Goat Anti-Mouse IgG (H+L) | Reagent | Jackson ImmunoResearch | 115-035-003 | |
| 3,3’-diaminobenzidine tetrahydrochloride | Reagent | Pierce, Thermo Scientific | 34001 | Store at -20; Allow bottle to warm to RT before use. |
| Cedar wood oil | Reagent | Sigma-Aldrich | W522503 | |
| Fast green FCF | Reagent | Sigma-Aldrich | F7252 | |
| Minuten pins 0.2mm diam | Fine Science Tools | 26002-20 |
Riferimenti
- Yamada, T., Placzek, M., Tanaka, H., Dodd, J., Jessell, T. M. Control of cell pattern in the developing nervous system: Polarizing activity of the floor plate and notochord. Cell. 64, 635-647 (1991).
- Streit, A., Stern, C. D., Thery, C., Ireland, G. W., Aparicio, S., Sharpe, M. J., Gherardi, E. A role for HGF/SF in neural induction and its expression in Hensen's node during gastrulation. Development. 121, 813-824 (1995).
- Basch, M., Bronner-Fraser, M., Garcia-Castro, M. Specification of neural crest occurs during gastrulation and requires Pax7. Nature. 441, 218-222 (2006).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development. 122, 3263-3273 (1996).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon