Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Метод полного окрашивания антител горе в Чик
Резюме
Это видео демонстрирует весь горе иммуногистохимии, метод, которым пространственной и временной экспрессии антигена могут быть визуализированы в молодых куриных эмбрионов. Этот метод впервые был введен Джейн Додд и Том Jessell.
Аннотация
Куриного эмбриона является ценным инструментом для изучения раннего эмбрионального развития. Его прозрачность, доступность и легкость манипуляций, делают его идеальным инструментом для исследования антител выражение в развитии мозга, нервной трубки и сомитов. Это видео демонстрирует различные этапы в целом монтажа антител окрашивания использования HRP сопряженных вторичными антителами; Во-первых, эмбрион расчлененное из яйца и зафиксирована в параформальдегида. Во-вторых, эндогенной пероксидазы инактивированная; эмбрион затем подвергаются первичного антитела. После нескольких промывок, эмбрион инкубировали с вторичными антителами конъюгированных с ПХ. Пероксидазы активность обнаруживаются с помощью реакции с диаминобензидина подложки. Наконец, зародыш фиксируется и обрабатывается для фотографирования и секционирования. Преимущество этого метода по сравнению с использованием флуоресцентных антител является то, что эмбрионы могут быть обработаны для воска секционирования, что позволяет изучать антигена сайтов в поперечном сечении. Этот метод впервые был введен Джейн Додд и Том Jessell
протокол
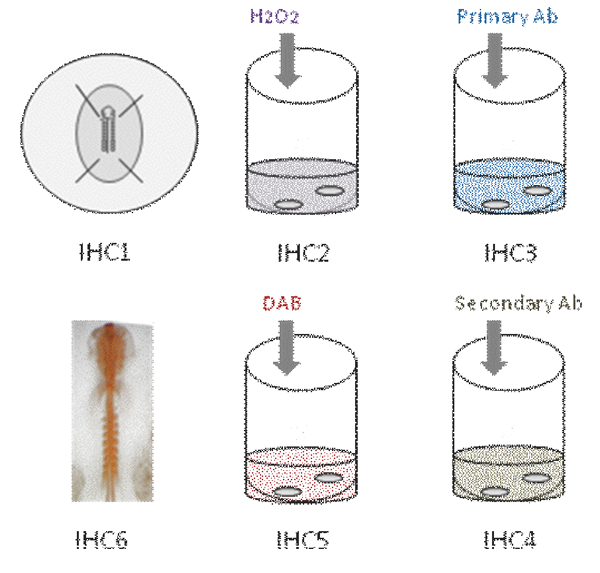
I. Схема Обзор:
Это видео демонстрирует различные этапы в целом иммуногистохимии монтирования в куриных эмбрионах. Во-первых, эмбрион закрепляется в PFA [IHC1]. Затем, эндогенной активности пероксидазы гасится [IHC2]. Эмбрион затем инкубировали в первичных антител [IHC3]. После нескольких промывок, эмбрион инкубировали в вторичными антителами [IHC4]; Цветная реакция проявляется использования DAB [IHC5] и антитела окрашивания цвет на оранжевый [IHC6].
Часть 1: Крепление эмбрионов
- Для выполнения целого иммуногистохимии крепление на куриных эмбрионах, сначала откройте яйца, нажав оболочки с пинцетом и удаление части корпуса.
- Удалить толстые альбумина с щипцами, и наклон желточного мешка с грубыми щипцами, чтобы эмбрион лица вверх.
- Использование тонких ножниц, вырезать квадратный желточного мешка вокруг эмбриона. Удалить из эмбриона желток с ложкой, и место в блюдо с PBS.
- Под микроскопом рассечение, осторожно удалите мембраны и желток и перенос эмбрионов в свежем блюдо с PBS.
- Pin эмбриона вниз щипцами и насекомых булавками, и аспирата PBS. Замените это с 4% PFA в ФБР, и позволить эмбриону исправить 1 час при комнатной температуре.
Часть 2: Подготовка эмбрионы на наличие антител шаг
- Чтобы свести к минимуму возможное загрязнение микробов, использования DDH 2 O во всех следующих шагов.
- После эмбриона фиксировано, аспирация фиксирующий раствор и распоряжаться надлежащим образом как химические отходы. Заполните блюдо с PBS.
- Далее, используя микродиссекции ножом, вырезать квадрат вокруг эмбриона, чтобы удалить экстраэмбриональных мембран. Удалить насекомых булавками с щипцами.
- После контакты были удалены, используйте тупым концом пипетки Пастера перенести эмбрион сцинтилляционный флакон с PBT (PBS рН 7,4, 0,5% Triton X).
- Вымойте эмбриона с PBT, 3 раза в течение 10 минут каждый.
- Удалить из PBT сцинтилляционный флакон, и заменить PBTx, содержащие 0,3% H 2 O 2, чтобы инактивировать потенциал эндогенной пероксидазы.
- Инкубируйте в течение 2 часов при комнатной температуре на nutator.
- Вымойте эмбриона с PBT, 3 раза по 10 минут каждый, а затем 3 раза по 30 минут каждый.
Часть 3: Антитела инкубации
- Для окраски эмбриона с антителами, начните с стиральной эмбрионов в течение одного часа в блокирующем буфере или 1% BSA / 1% NGS / PBT (мы используем NGS потому вторичными антителами возникает в козла). Инкубировать на nutator в течение одного часа при комнатной температуре.
- Развести первичного антитела 1:1 в блокирующий буфер, и инкубировать эмбриона в этом растворе в течение 2 дней при температуре 4 ° С на nutator. Первичный фактор разведения антител зависит от выбора первичного антитела. Здесь мы используем антитела из Развития Исследований Гибридома банка, который предоставляется в качестве supernatent. Мы разбавить его 1:1 в блокирующем буфере.
- Следующая, выполнять три 10-минутные моется в PBT, а затем 3 1-час моется в PBT.
- После мытья, разбавленных вторичных антител 1:2500 в блокирующем буфере (в данном случае пероксидазы сопряженным-антимышиного IgG (H + L) и инкубировать эмбриона в этом растворе O / N при температуре 4 ° С на nutator.
- Выполните три 10-минутные моется в PBT, а затем 3 1-час моется в PBT.
Часть 3: Цветная реакция
- Разработать цвет реакция окрашенных эмбриона, сначала выполнить две 20-минутные моется в трис-буфера (100 мМ Трис-HCl, рН 7,4).
- Тем временем растворяются DAB субстрата (3,3 '-диаминобензидина tetrahydrochloride) в трис-буфере на 500μg/ml под вытяжным шкафом; держать раствор в темноте, на льду.
- Удаление последнего буфера Трис вымыть из флакона эмбриона и заменить 5 мл раствор DAB с шагом 3.2. Хранить в темном на nutator на 20 млн. Утилизировать Эппендорф чаевые в емкость, содержащую 10% гипохлоритом натрия для того, чтобы обеззараживать DAB.
- Тем временем подготовить 0,3% акций H 2 O 2 в дН 2 O на льду.
- Добавить 50 мкл акции H 2 O 2 на флакон, содержащий эмбрионов в DAB. Имейте в темноте. Через 1-2 минут, контролировать реакции под микроскопом.
Часть 4: Эмбрион обработки фотографий и гистологии
- Когда цветная реакция завершена, распоряжаться DAB в отбеливатель ведро. Заменить на 5 мл водопроводной воды.
- Выполните 2 10-минуте моется в PBS.
- Для обработки для фотографии и воска секционирования, обезвоживаются в серии этанола (25%, 50%, 75% и 100%) в течение 10 минут каждый.
- Замените этанола с 0,5 - 1 мл масла кедрового дерева (это сделает эмбриона полупрозрачные). Процесс фотографии в масле кедрового дерева.
- После фотографии, вернуть эмбрион флакон и заменить масло кедрового дерева со 100% этанола. Повторите этанола шаг.
- Замените электроннойthanol с 5% Быстрый зеленый FCF в 100% этанола, и инкубировать в течение 3 минут (этот шаг сделает эмбрионов видимым для гистологии). Замените Быстрый зеленый раствор FCF со 100% этанола и процесс гистологии.
Представитель Результаты:
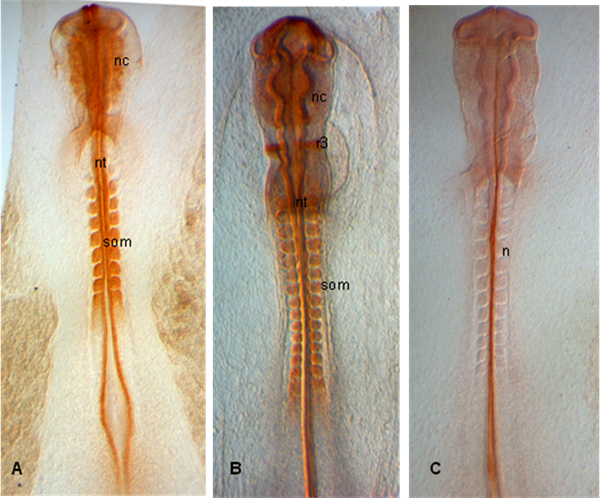
В примерах, приведенных ниже, эмбрионы расчлененный на этапах HH 10 (А), 12 (Б) и 11 (С); Эмбрионы показать выражение PAX 7 на развивающихся нейронных crestas также в сомитов и нервной трубки (А, В); В (С), хорда помечена 15.3B9 (Не-1) (Антитела предоставляемые развитием исследований Гибридома банк).
Обсуждение
Это видео демонстрирует различные этапы в выполнении целого монтажа антител окрашивания у молодых куриных эмбрионов. Этот протокол существенно используется пространственная и временная характеристика новых антител в куриных 2,3, а также для использования известных маркеров дл?...
Благодарности
Моноклональных антител (15.3B9, Pax7), разработанная (Дж. Додд, ТМ Jessell и А. Каваками) были получены из исследований развитием Гибридома Банке разработана под эгидой NICHD и поддерживается университете штата Айова, Отделение биологических наук , штат Айова. DP является получателем Рут Kirschstein премии 1F32-01A1 DA021977 из Национального института по злоупотреблению наркотиками. Эта работа была поддержана Маргарет М. Alkek Фонда РГНФ.
Материалы
| Name | Company | Catalog Number | Comments | |
| Eggs | Charles River Laboratories | Premium Fertile | Fertilized, HH4 (16 hr) | |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Marsh Automatic Incubator | Other | Lyon | RX | |
| Curved Forceps (1) | Tool | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Tool | Fine Science Tools | 11002-13 | |
| Fine scissors | Tool | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Microdissecting knife | Tool | Fine Science Tools | 10056-12 | Use to cut embryo from surrounding membranes following fixation |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Reagent | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| 16% PFA | Reagent | Electron Microscopy Sciences | 15710 | |
| 30% H2O2 | Reagent | Sigma-Aldrich | H1009 | |
| BSA | Reagent | Sigma-Aldrich | A3803 | |
| NGS | Reagent | Jackson ImmunoResearch | 005-000-121 | |
| Primary Antibodies | Reagent | Developmental Studies Hybridoma Bank | 4G11, 15.3B9, PAX7 | For these antibodies, investgators used mouse donnors |
| Peroxidase conjugated-Goat Anti-Mouse IgG (H+L) | Reagent | Jackson ImmunoResearch | 115-035-003 | |
| 3,3’-diaminobenzidine tetrahydrochloride | Reagent | Pierce, Thermo Scientific | 34001 | Store at -20; Allow bottle to warm to RT before use. |
| Cedar wood oil | Reagent | Sigma-Aldrich | W522503 | |
| Fast green FCF | Reagent | Sigma-Aldrich | F7252 | |
| Minuten pins 0.2mm diam | Fine Science Tools | 26002-20 |
Ссылки
- Yamada, T., Placzek, M., Tanaka, H., Dodd, J., Jessell, T. M. Control of cell pattern in the developing nervous system: Polarizing activity of the floor plate and notochord. Cell. 64, 635-647 (1991).
- Streit, A., Stern, C. D., Thery, C., Ireland, G. W., Aparicio, S., Sharpe, M. J., Gherardi, E. A role for HGF/SF in neural induction and its expression in Hensen's node during gastrulation. Development. 121, 813-824 (1995).
- Basch, M., Bronner-Fraser, M., Garcia-Castro, M. Specification of neural crest occurs during gastrulation and requires Pax7. Nature. 441, 218-222 (2006).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development. 122, 3263-3273 (1996).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены