Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Chick Tüm Dağı Antikor Boyama Yöntemi
Özet
Bu video tüm montaj immünhistokimya, bir antijen mekansal ve zamansal ifade desenini genç civciv embriyolarında görüntülendi edilebilecek bir yöntem gösteriyor. Bu yöntem başlangıçta Jane Dodd ve Tom Jessell tarafından piyasaya sürüldü.
Özet
Civciv embriyo erken embriyonik gelişim çalışmaya değerli bir araçtır. Şeffaflık, erişilebilirlik ve manipülasyon kolaylığı, beyin, nöral tüp ve hücre gruplarının gelişmekte olan antikor ifade çalışmak için ideal bir araçtır. Bu video tüm antikor boyama HRP konjuge sekonder antikor kullanarak farklı adımları gösteriyor; İlk yumurta, embriyo disseke ve paraformaldehid sabit. İkincisi, endojen peroksidaz inaktive olur; embriyo sonra primer antikor maruz kalmaktadır. Birkaç yıkamadan sonra, embriyo HRP konjuge sekonder antikor ile inkübe edilir. Peroksidaz aktivitesi diaminobenzidin substrat reaksiyonu ile ortaya çıkar. Son olarak, embriyo, sabit ve fotoğraf ve kesit için işlenir. Kullanımı üzerinde floresan antikor Bu yöntemin avantajı, embriyolar bu nedenle, balmumu kesit kesit antijeni sitelerin çalışma sağlayan işlenebilir. Bu yöntem başlangıçta Jane Dodd ve Tom Jessell tanıtıldı.
Protokol
I. Şematik Bakış:
Bu video civciv embriyo tüm montaj immünohistokimya farklı adımları gösteriyor. İlk olarak, embriyo PFA sabittir [IHC1]. Sonra, endojen peroksidaz aktivitesini söndürülür [IHC2]. Embriyo daha sonra primer antikor [IHC3] inkübe edilir. Birkaç yıkamadan sonra, embriyo sekonder antikoru inkübe [IHC4] Renk reaksiyonu DAB [IHC5] kullanarak ortaya ve antikor boyama görünür turuncu [IHC6].
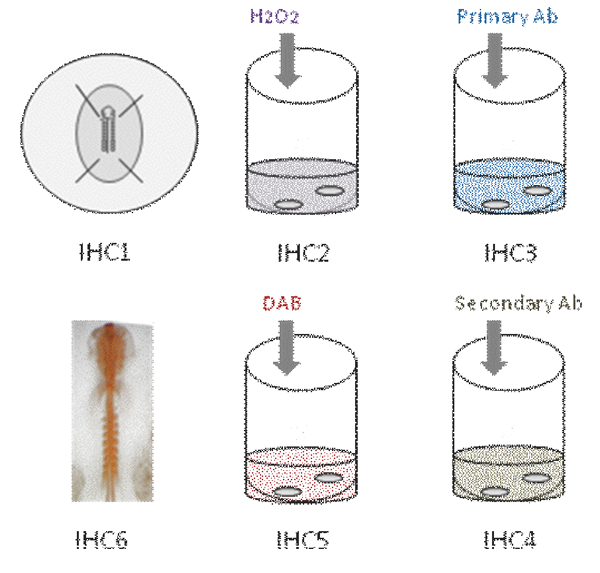
Bölüm 1: embriyoların Tespit
- Civciv embriyolarının tüm montaj immünohistokimya gerçekleştirmek için, ilk önce bir yumurta, forseps ile kabuk dokunarak ve kabuk parçaları kaldırarak açın.
- Forseps ile kalın albümin çıkarın ve embriyo yukarı bakacak şekilde kaba forseps ile yumurta sarısı kesesi eğin.
- Ince makas kullanarak, yolk kesesi embriyo etrafında bir kare kesti. Bir kaşık ile yumurta sarısı embriyonun çıkarın ve PBS içeren bir yemek yer.
- Diseksiyon mikroskobu altında, membranlar ve sarısı ve embriyo transferi PBS içeren yeni bir çanak dikkatle çıkarın.
- Forseps ve böcek pimleri ile embriyo Pin, PBS aspire. PBS içinde% 4 PFA ile değiştirin ve embriyo RT 1s düzeltmek için izin.
Bölüm 2: antikor adım için hazırlık embriyolar
- Potansiyel mikrobik kontaminasyonu en aza indirmek için, aşağıdaki adımları GKD 2 O kullanın.
- Embriyo sabittir sonra fiksatif çözüm aspirat ve düzgün kimyasal atık olarak atmayın. PBS ile çanak doldurun.
- yanında, bir Mikrodiseksiyonla bıçak kullanarak extraembryonic membranlar kaldırmak için embriyo etrafında bir kare kesilir. Forseps ile böcek pimleri çıkarın.
- Pimleri çıkarıldıktan sonra, PBT (PBS, pH 7.4,% 0.5 Triton X) içeren bir sintilasyon flakon embriyo transferi künt sonunda Pasteur pipet kullanın.
- Her biri için 10 dakika ile 3 kez, PBT embriyo yıkayın.
- Sintilasyon şişeden PBT çıkarın ve PBTx potansiyel endojen peroksidaz inaktif hale getirmek için% 0.3 H 2 O 2 içeren değiştirin.
- Nutator 2 saat oda sıcaklığında inkübe.
- PBT, 3 kez her biri için 10 dakika, 30 dakika her biri için 3 kez embriyo yıkayın.
Bölüm 3: Antikor inkübasyon
- Antikor ile embriyo leke için, tampon engelleme veya% 1 BSA /% 1 NGS / PBT (ikincil antikor keçi büyüdü çünkü biz NGS) bir saat boyunca embriyo yıkayarak başlayın. RT az bir saat için nutator inkübe edin.
- 2 gün, 4 ° C nutator üzerinde bu çözüm engelleme tampon, ve inkübe embriyo birincil antikor 01:01 sulandırınız. Primer antikor seyreltme faktörü primer antikor seçimine bağlıdır. Burada, supernatent olarak verilmiştir Gelişim Çalışmaları Hibridoma Bankası, antikor kullanın. Biz tampon engelleme 01:01 sulandırmak.
- yanında, PBT (3) 1 saat yıkar takip PBT 3 10 dakika yıkar, gerçekleştirin.
- Yıkandıktan sonra, ikincil antikor 1:2500 engelleme tampon seyreltilmiş (Bu durumda peroksidaz konjuge keçi anti-fare IgG (H + L) ve bu çözüm inkübe embriyo 4 O / N ° C nutator.
- PBT (3) 1 saat yıkar takip PBT 3 10 dakikalık yıkama yapın.
Bölüm 3: Renk reaksiyonu
- Renk reaksiyonu lekeli embriyo geliştirmek için, öncelikle Tris tamponu (100 mM Tris HCl, pH 7.4) 2 20 dakika yıkar gerçekleştirin.
- DAB 500μg/ml Tris tampon substrat (3,3 'diaminobenzidin tetrahydrochloride) Bu arada davlumbaz altında çözülür; karanlıkta çözüm tutmak, buz üzerinde.
- Flakon içeren embriyo son Tris tampon yıkama çıkarın ve adım 3.2 5ml DAB çözüm ile değiştirin. 20 milyon nutator koyu tutun. DAB dekontamine için% 10 çamaşır suyu çözeltisi içeren kova Eppendorf ucu atın.
- Bu arada% 0.3 stok dH 2 O H 2 O 2 buz üzerinde hazırlayın.
- DAB embriyoların içeren flakon 50μl stok H 2 O 2 ekleyin. Karanlıkta saklayın. 1-2 dakika sonra, mikroskop altında tepki izlemek.
Bölüm 4: Embriyo işleme fotoğraf ve histoloji
- Renk reaksiyonu tamamlandığında, çamaşır suyu kova DAB atmayın. 5 ml musluk suyu ile değiştirin.
- PBS içinde 2 adet 10 dakikalık yıkama yapın.
- Fotoğraf ve balmumu kesit işlemek için, her biri için 10 dakika (% 25,% 50,% 75 ve% 100) bir etanol dizi kurutmak.
- 0.5 - 1 ml sedir ağacı yağı (embriyo saydam hale getirecek) etanol değiştirin. Sedir ağacı yağı fotoğrafçılığı için Süreci.
- Fotoğrafçılık sonra, şişe embriyo dönmek ve% 100 etanol ile sedir ağacı yağı değiştirin. Etanol adımı tekrarlayın.
- E değiştirin.% 100 etanol% 5 Fast yeşil FCF thanol ve 3 dakika (bu adım embriyolar histoloji için görünür kılmak) inkübe edin. Hızlı yeşil FCF çözümü için% 100 etanol ve histoloji süreci ile değiştirin.
Temsilcisi Sonuçlar:
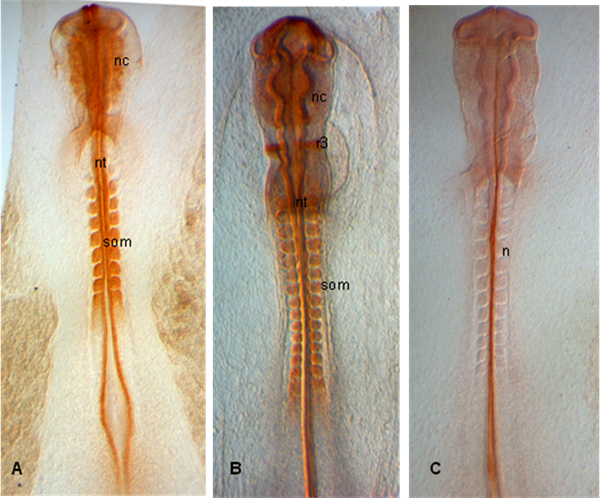
Aşağıda gösterilen örnekler, embriyoların aşamalarında HH 10 (A), 12 (B) ve 11 (C) disseke; Embriyolar PAX 7 gelişmekte olan sinir crestas ifade Somitlerin ve nöral tüp (A, B) yanı sıra; (C), notokord 15.3B9 (Not-1) (antikorlar Gelişim Çalışmaları Hibridoma Bankası tarafından sağlanan) ile etiketlenir.
Tartışmalar
Bu video genç civciv embriyolarında tüm montaj antikor boyama işlemi farklı adımları gösteriyor. Bu protokol esas civciv 2,3 roman antikorların mekansal ve zamansal karakterizasyonu için kullanılan yanı sıra hakaret 4 embriyonik malformasyonlar belirlemek için bilinen antijenik belirteçlerinin kullanımı için.
Teşekkürler
Biyolojik bilimler Bölümü, Iowa Üniversitesi tarafından NICHD ve bakımı himayesinde geliştirilen Gelişimsel Çalışmalar Hibridoma Bankası (J. Dodd, TM Jessell ve A. Kawakami) tarafından geliştirilen monoklonal antikorlar (15.3B9, PAX7) elde edildi , Iowa. DP Uyuşturucu İstismarı Ulusal Enstitüsü Ruth Kirschstein Ödülü 1F32 DA021977-01A1 alıcı. Bu çalışma, Margaret M. RHF Alkek Vakfı tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments | |
| Eggs | Charles River Laboratories | Premium Fertile | Fertilized, HH4 (16 hr) | |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Marsh Automatic Incubator | Other | Lyon | RX | |
| Curved Forceps (1) | Tool | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Tool | Fine Science Tools | 11002-13 | |
| Fine scissors | Tool | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Microdissecting knife | Tool | Fine Science Tools | 10056-12 | Use to cut embryo from surrounding membranes following fixation |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Reagent | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| 16% PFA | Reagent | Electron Microscopy Sciences | 15710 | |
| 30% H2O2 | Reagent | Sigma-Aldrich | H1009 | |
| BSA | Reagent | Sigma-Aldrich | A3803 | |
| NGS | Reagent | Jackson ImmunoResearch | 005-000-121 | |
| Primary Antibodies | Reagent | Developmental Studies Hybridoma Bank | 4G11, 15.3B9, PAX7 | For these antibodies, investgators used mouse donnors |
| Peroxidase conjugated-Goat Anti-Mouse IgG (H+L) | Reagent | Jackson ImmunoResearch | 115-035-003 | |
| 3,3’-diaminobenzidine tetrahydrochloride | Reagent | Pierce, Thermo Scientific | 34001 | Store at -20; Allow bottle to warm to RT before use. |
| Cedar wood oil | Reagent | Sigma-Aldrich | W522503 | |
| Fast green FCF | Reagent | Sigma-Aldrich | F7252 | |
| Minuten pins 0.2mm diam | Fine Science Tools | 26002-20 |
Referanslar
- Yamada, T., Placzek, M., Tanaka, H., Dodd, J., Jessell, T. M. Control of cell pattern in the developing nervous system: Polarizing activity of the floor plate and notochord. Cell. 64, 635-647 (1991).
- Streit, A., Stern, C. D., Thery, C., Ireland, G. W., Aparicio, S., Sharpe, M. J., Gherardi, E. A role for HGF/SF in neural induction and its expression in Hensen's node during gastrulation. Development. 121, 813-824 (1995).
- Basch, M., Bronner-Fraser, M., Garcia-Castro, M. Specification of neural crest occurs during gastrulation and requires Pax7. Nature. 441, 218-222 (2006).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development. 122, 3263-3273 (1996).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır