Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Método para la tinción de anticuerpos enteros en el monte del polluelo
En este artículo
Resumen
Este video muestra todo inmunohistoquímica montaje, un método por el cual el patrón de expresión espacial y temporal de un antígeno puede ser visualizado en embriones de pollo joven. Este método fue introducido originalmente por Jane Dodd y Tom Jessell.
Resumen
El embrión de pollo es una herramienta valiosa en el estudio del desarrollo embrionario temprano. Su transparencia, accesibilidad y facilidad de manipulación, lo convierten en una herramienta ideal para estudiar la expresión de anticuerpos en el desarrollo del cerebro, del tubo neural y somitas. Este video muestra las diferentes etapas de la tinción de anticuerpos todo el montaje con HRP secundaria anticuerpos conjugados, En primer lugar, el embrión se diseca del huevo y se fijaron en paraformaldehído. Peroxidasa en segundo lugar, endógena se inactiva, el embrión se expone a anticuerpo primario. Después de varios lavados, el embrión se incuba con el anticuerpo secundario conjugado con HRP. Actividad de la peroxidasa se reveló mediante la reacción con el sustrato diaminobencidina. Finalmente, el embrión se fija y se procesaron para la fotografía y el corte. La ventaja de este método sobre el uso de anticuerpos fluorescentes es que los embriones pueden ser procesados por el corte de cera, lo que permite el estudio de los sitios de antígeno en la sección transversal. Este método fue introducido originalmente por Jane Dodd y Tom Jessell
Protocolo
I. Esquema general:
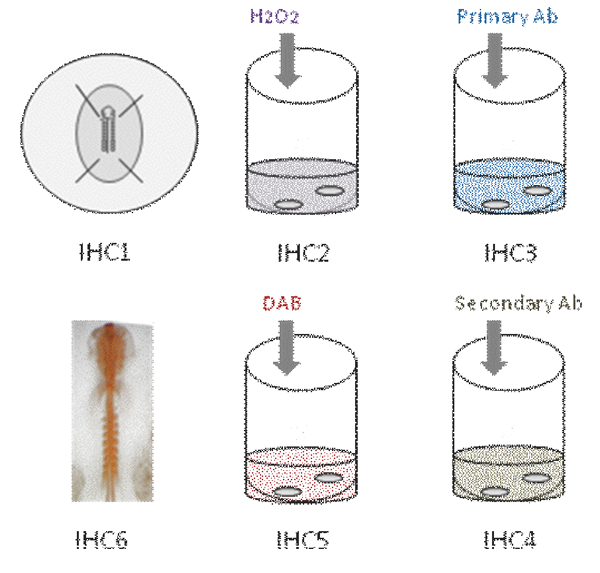
Este video muestra las diferentes etapas de inmunohistoquímica montar todo en embrión de pollo. En primer lugar, el embrión se fija en PFA [IHC1]. Entonces, la actividad peroxidasa endógena se apaga [IHC2]. El embrión se incuba en la primaria de anticuerpos [IHC3]. Después de varios lavados, el embrión se incuba en la secundaria de anticuerpos [IHC4], la reacción de color se revela con DAB [IHC5] y la tinción de anticuerpos parece naranja [IHC6].
Parte 1: La fijación de los embriones
- Para llevar a cabo la inmunohistoquímica montar todo en embriones de pollo, primero abra un huevo tocando la concha con una pinza y la eliminación de pedazos de la cáscara.
- Eliminar la albúmina de espesor con pinzas, y la inclinación del saco vitelino con pinzas gruesas para que el embrión hacia arriba.
- Con la tijera fina, cortar un cuadrado de alrededor del saco vitelino del embrión. Extraer el embrión de la yema de huevo con una cuchara, y colocar en un recipiente lleno de PBS.
- Bajo un microscopio de disección, retire con cuidado la membrana y la yema y la transferencia del embrión a un plato fresco que contiene PBS.
- Pin del embrión hacia abajo con unas pinzas y alfileres de insectos, y aspirar el PBS. Reemplazar esta con PFA al 4% en PBS, y permitir que el embrión para fijar 1h a temperatura ambiente.
Parte 2: Preparación de embriones para el paso de anticuerpos
- Para minimizar la contaminación microbiana, el uso ddH2O en todas las etapas siguientes.
- Después de que el embrión se fija, se aspira la solución fijadora y disponer adecuadamente de los desechos químicos. Llenar el recipiente con PBS.
- A continuación, utilizando un cuchillo de microdisección, cortar un cuadrado alrededor de embriones para eliminar las membranas extraembrionarias. Sacar las chavetas de insectos con unas pinzas.
- Después de los pines se han eliminado, utilice un contundente final pipeta Pasteur para la transferencia del embrión a un vial de centelleo que contienen con PBT (PBS pH 7,4, 0,5% Triton X).
- Lave el embrión con PBT, 3 veces durante 10 minutos cada uno.
- Quitar PBT del vial de centelleo, y reemplazarlo con PbTx contiene 0,3% de H 2 O 2 con el fin de inactivar la peroxidasa endógena potencial.
- Incubar durante 2 horas a temperatura ambiente en nutator.
- Lavado de embriones con PBT, 3 veces durante 10 minutos cada uno, luego tres veces durante 30 minutos cada uno.
Parte 3: incubación del anticuerpo
- Para la tinción del embrión con el anticuerpo, empezar por lavar el embrión durante una hora en tampón de bloqueo o el 1% de BSA / NGS 1% / PBT (NGS utilizamos ya que el anticuerpo secundario se plantea en cabra). Incubar en nutator durante una hora a temperatura ambiente.
- Diluir el anticuerpo primario de 1:1 en tampón de bloqueo, y el embrión se incuba en esta solución durante 2 días a 4 ° C en nutator. Principal factor de dilución de anticuerpos depende de la elección del anticuerpo primario. Aquí, nosotros usamos un anticuerpo del Desarrollo del Banco hibridoma Estudios, que se presenta como sobrenadante. Nos diluirlo 1:1 en tampón de bloqueo.
- A continuación, realizar tres lavados de 10 minutos en PBT, seguido de 3 lavados de 1 hora en PBT.
- Después del lavado, diluir el anticuerpo secundario 1:2500 en tampón de bloqueo (en este caso, conjugado con peroxidasa de cabra anti-ratón IgG (H + L), y el embrión se incuba en esta solución S / N a 4 ° C en nutator.
- Realizar tres lavados de 10 minutos en PBT, seguido de 3 lavados de 1 hora en PBT.
Parte 3: La reacción de color
- Para desarrollar la reacción de color del embrión teñido, primero realice dos lavados de 20 minutos en tampón Tris (100 mM Tris HCl, pH 7,4).
- Mientras tanto se disuelven sustrato DAB (3,3 '-diaminobenzidina tetrahidrocloruro) en tampón Tris a 500μg/ml bajo campana extractora de humos; mantener la solución en la oscuridad, en el hielo.
- Quitar el último lavado buffer Tris del embrión vial que contiene y reemplazarlo con solución DAB 5 ml de la etapa 3.2. Mantener en la oscuridad en nutator durante 20 mn. Disponer de Eppendorf punta en un cubo que contiene una solución de lejía al 10% con el fin de descontaminar el DAB.
- Mientras tanto, prepare una acción 0,3% de H 2 O 2 en dH 2 O en el hielo.
- Añadir el caldo de 50μl H 2 O 2 al vial que contiene los embriones en DAB. Mantener en la oscuridad. Después de 1-2 minutos, monitorear la reacción bajo el microscopio.
Parte 4: procesamiento de embriones para la fotografía y la histología
- Cuando la reacción de color se ha completado, a disponer de DAB en un cubo de lejía. Reemplazar con 5 ml de agua corriente.
- Realizar dos de 10 minutos lavados en PBS.
- Para el proceso de la fotografía y la sección de cera, se deshidrata en una serie de etanol (25%, 50%, 75% y 100%) durante 10 minutos cada uno.
- Vuelva a colocar el etanol con 0,5 a 1 ml de aceite de cedro de madera (esto hará que el embrión transparente). Proceso para la fotografía en el aceite de madera de cedro.
- Después de la fotografía, el retorno de embrión vial y sustituir el aceite de madera de cedro con etanol al 100%. Repita el paso de etanol.
- Vuelva a colocar ethanol con un 5% el verde sólido FCF en el 100% de etanol, y se incuba durante 3 minutos (este paso hará que los embriones visible para el estudio histológico). Reemplace la solución Fast Green FCF con 100% de etanol y el proceso de la histología.
Los resultados representativos:
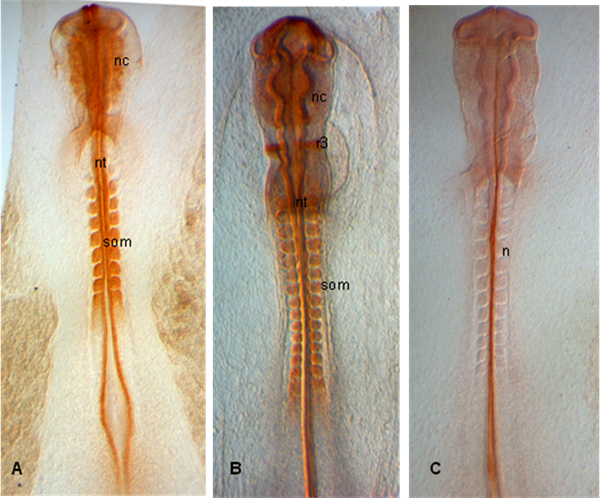
En los ejemplos mostrados a continuación, los embriones son disecados en las etapas HH 10 (A), 12 (B) y 11 (C), los embriones muestran una expresión de PAX 7 en las economías emergentes Crestas neurales así como en los somitas y el tubo neural (A, B); En (C), notocorda se etiqueta con 15.3B9 (no-1) (anticuerpos proporcionados por el Banco de Desarrollo de Estudios hibridoma).
Discusión
Este video muestra los diferentes pasos en la realización de todo el montaje la tinción de anticuerpos en embriones de pollo joven. Este protocolo se utiliza esencialmente para la caracterización espacial y temporal de nuevos anticuerpos en el pollito 2,3, así como para el uso de los marcadores antigénicos conocidos para determinar malformación embrionaria después de insultar 4.
Agradecimientos
Los anticuerpos monoclonales (15.3B9, PAX7) desarrollado por (J. Dodd, TM Jessell y Kawakami A.) se obtuvieron de los Estudios del Desarrollo del Banco hibridoma desarrollado bajo los auspicios del NICHD y mantenido por la Universidad de Iowa, Departamento de Ciencias Biológicas , Iowa. DP es receptor de Ruth Premio Kirschstein DA021977 1F32-01A1 del Instituto Nacional sobre Abuso de Drogas. Este trabajo fue apoyado por la Fundación Margaret M. Alkek a RHF.
Materiales
| Name | Company | Catalog Number | Comments | |
| Eggs | Charles River Laboratories | Premium Fertile | Fertilized, HH4 (16 hr) | |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Marsh Automatic Incubator | Other | Lyon | RX | |
| Curved Forceps (1) | Tool | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Tool | Fine Science Tools | 11002-13 | |
| Fine scissors | Tool | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Microdissecting knife | Tool | Fine Science Tools | 10056-12 | Use to cut embryo from surrounding membranes following fixation |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Reagent | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| 16% PFA | Reagent | Electron Microscopy Sciences | 15710 | |
| 30% H2O2 | Reagent | Sigma-Aldrich | H1009 | |
| BSA | Reagent | Sigma-Aldrich | A3803 | |
| NGS | Reagent | Jackson ImmunoResearch | 005-000-121 | |
| Primary Antibodies | Reagent | Developmental Studies Hybridoma Bank | 4G11, 15.3B9, PAX7 | For these antibodies, investgators used mouse donnors |
| Peroxidase conjugated-Goat Anti-Mouse IgG (H+L) | Reagent | Jackson ImmunoResearch | 115-035-003 | |
| 3,3’-diaminobenzidine tetrahydrochloride | Reagent | Pierce, Thermo Scientific | 34001 | Store at -20; Allow bottle to warm to RT before use. |
| Cedar wood oil | Reagent | Sigma-Aldrich | W522503 | |
| Fast green FCF | Reagent | Sigma-Aldrich | F7252 | |
| Minuten pins 0.2mm diam | Fine Science Tools | 26002-20 |
Referencias
- Yamada, T., Placzek, M., Tanaka, H., Dodd, J., Jessell, T. M. Control of cell pattern in the developing nervous system: Polarizing activity of the floor plate and notochord. Cell. 64, 635-647 (1991).
- Streit, A., Stern, C. D., Thery, C., Ireland, G. W., Aparicio, S., Sharpe, M. J., Gherardi, E. A role for HGF/SF in neural induction and its expression in Hensen's node during gastrulation. Development. 121, 813-824 (1995).
- Basch, M., Bronner-Fraser, M., Garcia-Castro, M. Specification of neural crest occurs during gastrulation and requires Pax7. Nature. 441, 218-222 (2006).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development. 122, 3263-3273 (1996).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados