Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Verfahren zur Whole Mount Antikörper-Färbung in Küken
In diesem Artikel
Zusammenfassung
Dieses Video zeigt whole mount Immunhistochemie, eine Methode, durch die die räumliche und zeitliche Expressionsmuster eines Antigens visualisiert werden bei jungen Hühnerembryonen kann. Diese Methode wurde ursprünglich von Jane Dodd und Tom Jessell eingeführt.
Zusammenfassung
Der Hühnerembryo ist ein wertvolles Werkzeug in der Studie der frühen Embryonalentwicklung. Seine Transparenz, Zugänglichkeit und einfache Handhabung machen ihn zu einem idealen Werkzeug zur Untersuchung der Antikörper-Expression im sich entwickelnden Gehirn, Neuralrohr und Somiten. Dieses Video zeigt die verschiedenen Schritte ganz-mount Antikörper-Färbung mit HRP konjugierte Sekundärantikörper; Erste, der Embryo aus dem Ei präpariert und fixiert in Paraformaldehyd. Zweitens endogene Peroxidase inaktiviert wird; Der Embryo wird dann in primärer Antikörper ausgesetzt. Nach mehrmaligem Waschen wird der Embryo mit sekundärem Antikörper, konjugiert mit HRP inkubiert. Peroxidase-Aktivität zeigte mit Reaktion mit Diaminobenzidin Substrat. Schließlich ist der Embryo fixiert und für die Fotografie und Schneiden. Der Vorteil dieser Methode gegenüber der Verwendung von fluoreszierenden Antikörpern ist, dass Embryonen für Wachs Schnitte verarbeitet werden, so dass die Untersuchung von Antigen-Sites im Querschnitt. Diese Methode wurde ursprünglich von Jane Dodd und Tom Jessell eingeführt
Protokoll
I. Schematische Übersicht:
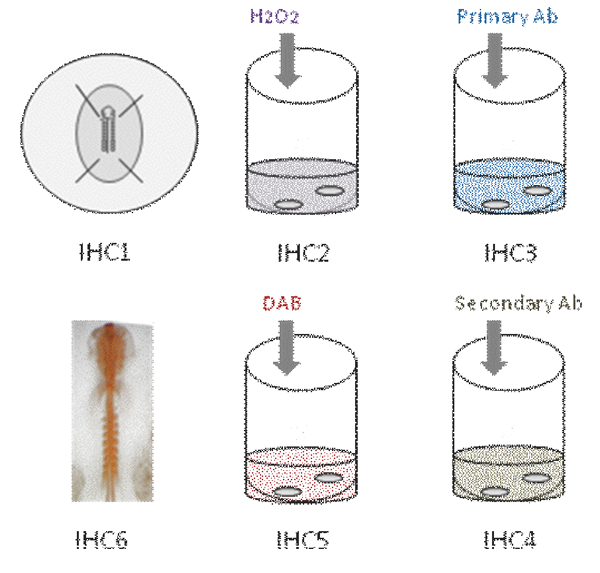
Dieses Video zeigt die verschiedenen Schritte in whole mount Immunhistochemie in Hühnerembryo. Zunächst wird der Embryo in PFA fixiert [IHC1]. Dann wird die endogene Peroxidase Aktivität abgeschreckt [IHC2]. Der Embryo wird dann in Primärantikörper [IHC3] inkubiert. Nach mehrmaligem Waschen wird der Embryo in sekundärem Antikörper [IHC4]; Farbreaktion zeigte mit DAB [IHC5] und Antikörper-Färbung erscheint orange [IHC6].
Teil 1: Befestigung des Embryos
- Um ganze Berg Immunhistochemie auf Hühnerembryonen, öffnen Sie zunächst ein Ei, indem Sie die Schale mit einer Pinzette und Entfernen von Teilen der Schale.
- Entfernen Sie die dicken Albumin mit einer Pinzette, und kippen Sie den Dottersack mit groben Pinzette so, dass der Embryo nach oben zeigt.
- Mit einer feinen Schere, schneiden Sie ein Quadrat der Dottersack rund um den Embryo. Entfernen Sie den Embryo aus dem Eigelb mit einem Löffel, und in eine Schale mit PBS.
- Unter einem Dissektionsmikroskop, entfernen Sie vorsichtig die Membranen und Eigelb und dem Embryotransfer eine frische Schale mit PBS.
- Pin der Embryo sich mit einer Pinzette und Insekten Pins, und saugen Sie den PBS. Ersetzen Sie diese mit 4% PFA in PBS und lassen den Embryo bis 1h bei RT fixieren.
Teil 2: Vorbereiten Embryonen für die Antikörper-Schritt
- Zur Minimierung der potenziellen mikrobiellen Kontamination, verwenden ddH 2 O in allen folgenden Schritten.
- Nach der Embryo fixiert ist, saugen die Fixierlösung und ordnungsgemäß entsorgen als chemischer Abfall. Füllen Sie die Schale mit PBS.
- nächsten, mit einer Mikrodissektion Messer, schneiden Sie ein Quadrat um Embryo extraembryonalen Membranen zu entfernen. Entfernen Insektennadeln mit einer Pinzette.
- Nach der Stifte entfernt wurden, mit einer stumpfen Ende Pasteurpipette auf den Embryo zu einem Szintillations Fläschchen mit PBT (PBS pH 7,4, 0,5% Triton X) zu übertragen.
- Waschen Sie den Embryo mit PBT, 3-mal für jeweils 10 Minuten.
- Entfernen PBT von der Scintillationsfläschchen, und ersetzen Sie mit PBTx mit 0,3% H 2 O 2, um mögliche endogene Peroxidase zu inaktivieren.
- Inkubieren für 2 h bei RT auf Kolbenpendel.
- Wash Embryo mit PBT, 3-mal für jeweils 10 Minuten, dann 3 mal für jeweils 30 Minuten.
Teil 3: Antikörper Inkubation
- Um Flecken auf den Embryo mit dem Antikörper durch Waschen der Embryo für eine Stunde in Blocking-Puffer oder 1% BSA / 1% NGS / PBT (wir verwenden NGS, weil der sekundäre Antikörper in Ziege angehoben wird) zu starten. Inkubieren auf Kolbenpendel für eine Stunde bei RT.
- Verdünnen Sie den Primärantikörper 1:1 in Blocking-Puffer, und inkubieren Embryo in dieser Lösung für 2 Tage bei 4 ° C auf Kolbenpendel. Primärer Antikörper Verdünnungsfaktor hängt von der Wahl des primären Antikörpers. Hier verwenden wir ein Antikörper aus dem Developmental Studies Hybridoma Bank, die als Überstand vorgesehen ist. Wir verdünnen 1:1 in Blocking-Puffer.
- Führen Sie danach 3 10-minütige Waschungen in PBT, um 3 1-Stunden-Wäschen in PBT gefolgt.
- Nach dem Waschen, verdünnte den sekundären Antikörper 1:2500 in Blocking-Puffer (in diesem Fall Peroxidase konjugierten Ziege anti-Maus IgG (H + L), und inkubieren Embryo in dieser Lösung O / N bei 4 ° C auf Kolbenpendel.
- Führen Sie 3 10-minütige Waschungen in PBT, um 3 1-Stunden-Wäschen in PBT gefolgt.
Teil 3: Farbreaktion
- Zur Entwicklung der Farbreaktion der gefärbten Embryo, führen Sie zuerst 2 20-minütige Waschungen in Tris-Puffer (100 mM Tris HCl, pH 7,4).
- Inzwischen lösen sich DAB Substrat (3,3 '-Diaminobenzidintetrahydrochlorid) in Tris-Puffer bei 500μg/ml unter Abzug; halten Lösung in dunklen, auf Eis.
- Entfernen letzten Tris-Puffer waschen aus dem Fläschchen mit Embryo und ersetzen mit 5 ml DAB-Lösung aus Schritt 3.2. Keep in Dunkelheit auf Kolbenpendel für 20 mn. Entsorgen Eppendorfspitze in Eimer mit einer 10% igen Bleichlösung um DAB zu dekontaminieren.
- In der Zwischenzeit bereiten 0,3% Lager H 2 O 2 in dH 2 O auf dem Eis.
- Add 50 ul Lager H 2 O 2 zu Fläschchen mit Embryonen in DAB. Keep in dunkel. Nach 1-2 Minuten, zu überwachen Reaktion unter dem Mikroskop.
Teil 4: Embryo-Verarbeitung für Fotografie und Histologie
- Wenn Farbreaktion abgeschlossen ist, von DAB verfügen in bleach Eimer. Ersetzen Sie mit 5 ml Leitungswasser.
- Führen Sie 2 10-minütige Waschungen in PBS.
- Für die Verarbeitung für die Fotografie und Wachs Schnitte, in einer Ethanol-Reihe dehydrieren (25%, 50%, 75% und 100%) für jeweils 10 Minuten.
- Ersetzen Sie das Ethanol mit 0,5 bis 1 ml Zedernholz Öl (dieser wird der Embryo durchscheinend zu machen). Prozess für die Fotografie in Zedernholz Öl.
- Nach Fotografie, Rückkehr Embryo Fläschchen und ersetzen Sie das Zedernholz Öl mit 100% Ethanol. Wiederholen Sie Schritt Ethanol.
- Ersetzen Sie ethanol mit 5% Fast Green FCF in 100% Ethanol und Inkubation für 3 Minuten (dieser Schritt wird sichtbar Embryonen für die Histologie). Ersetzen Fast Green FCF-Lösung mit 100% Ethanol und Verfahren für die Histologie.
Repräsentative Ergebnisse:
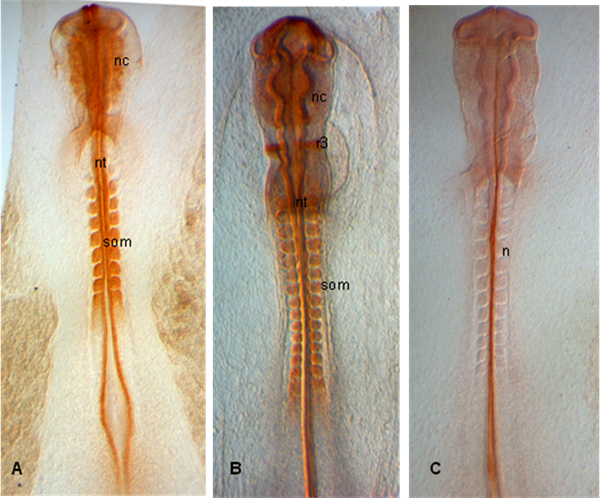
In den Beispielen unten gezeigt, sind Embryonen in den Stadien HH 10 (A), 12 (B) und 11 (C) seziert; Embryonen zeigen Ausdruck PAX 7 in Schwellenländern neuronalen Crestas sowie in Somiten und Neuralrohr (A, B); In (C), ist Chorda mit 15.3B9 (Not-1) (Antibodies by Developmental Studies Hybridoma Bank hat) gekennzeichnet.
Diskussion
Dieses Video zeigt die verschiedenen Schritte bei der Durchführung ganz-mount Antikörper-Färbung bei jungen Hühnerembryonen. Dieses Protokoll ist im Wesentlichen für die räumliche und zeitliche Charakterisierung neuartiger Antikörper in chick 2,3 verwendet, sowie für die Verwendung bekannter antigener Marker zu embryonalen Missbildungen folgenden Beleidigung 4 zu bestimmen.
Danksagungen
Die monoklonalen Antikörper (15.3B9, PAX7) durch (J. Dodd, TM Jessell und A. Kawakami) entwickelt wurden, aus dem Developmental Studies Hybridoma Bank unter der Schirmherrschaft der NICHD und von der University of Iowa gepflegt, Department of Biological Sciences entwickelt erhalten , Iowa. DP ist Empfänger von Ruth Kirschstein-Award 1F32 DA021977-01A1 aus dem National Institute on Drug Abuse. Diese Arbeit wurde von der Margaret M. Alkek Stiftung RHF unterstützt.
Materialien
| Name | Company | Catalog Number | Comments | |
| Eggs | Charles River Laboratories | Premium Fertile | Fertilized, HH4 (16 hr) | |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Marsh Automatic Incubator | Other | Lyon | RX | |
| Curved Forceps (1) | Tool | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Tool | Fine Science Tools | 11002-13 | |
| Fine scissors | Tool | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Microdissecting knife | Tool | Fine Science Tools | 10056-12 | Use to cut embryo from surrounding membranes following fixation |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Reagent | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| 16% PFA | Reagent | Electron Microscopy Sciences | 15710 | |
| 30% H2O2 | Reagent | Sigma-Aldrich | H1009 | |
| BSA | Reagent | Sigma-Aldrich | A3803 | |
| NGS | Reagent | Jackson ImmunoResearch | 005-000-121 | |
| Primary Antibodies | Reagent | Developmental Studies Hybridoma Bank | 4G11, 15.3B9, PAX7 | For these antibodies, investgators used mouse donnors |
| Peroxidase conjugated-Goat Anti-Mouse IgG (H+L) | Reagent | Jackson ImmunoResearch | 115-035-003 | |
| 3,3’-diaminobenzidine tetrahydrochloride | Reagent | Pierce, Thermo Scientific | 34001 | Store at -20; Allow bottle to warm to RT before use. |
| Cedar wood oil | Reagent | Sigma-Aldrich | W522503 | |
| Fast green FCF | Reagent | Sigma-Aldrich | F7252 | |
| Minuten pins 0.2mm diam | Fine Science Tools | 26002-20 |
Referenzen
- Yamada, T., Placzek, M., Tanaka, H., Dodd, J., Jessell, T. M. Control of cell pattern in the developing nervous system: Polarizing activity of the floor plate and notochord. Cell. 64, 635-647 (1991).
- Streit, A., Stern, C. D., Thery, C., Ireland, G. W., Aparicio, S., Sharpe, M. J., Gherardi, E. A role for HGF/SF in neural induction and its expression in Hensen's node during gastrulation. Development. 121, 813-824 (1995).
- Basch, M., Bronner-Fraser, M., Garcia-Castro, M. Specification of neural crest occurs during gastrulation and requires Pax7. Nature. 441, 218-222 (2006).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development. 122, 3263-3273 (1996).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten