需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在自觉大鼠高胰岛素 - 正常血糖钳
摘要
高胰岛素 - 正常血糖钳是胰岛素的作用进行评估的“金标准”。胰岛素是注入在一个恒定的刺激葡萄糖摄取率。注入外源性葡萄糖的量,以应对这一下降是胰岛素敏感性的指标。这里的程序是一种自觉的,奔放的大鼠上进行。
摘要
2型糖尿病(T2D)患病率迅速上升。其特点是无论是生产胰岛素不足或无法利用血糖水平升高的胰岛素产生,T2D结果。 “黄金标准”在评估胰岛素敏感性,是高胰岛素 - 正常血糖钳或胰岛素钳夹。在此过程中,胰岛素注入在一个恒定的,导致血糖下降率。为了保持血糖在一个恒定的水平,外源性葡萄糖(D50)注入静脉循环。注入的葡萄糖量保持动态平衡胰岛素敏感性的指标。在这里,我们展示在长期插管,奔放,有意识地鼠的基本钳程序。这种模式使血液收集,以最小的压力动物。麻醉诱导后,正中切口和左颈总动脉和右颈静脉插管。插入导管用肝素生理盐水冲洗,然后exteriorized和安全。动物被允许恢复实验前4-5天,每天监测体重增加。只有那些谁复胖到术前水平的动物用于实验。在一天的实验,老鼠被禁食含有胰岛素和D50泵相连。基线葡萄糖是从动脉行评估整个实验(血糖正常),并用一个基准。在此之后,是在一个恒定的速率进入静脉循环注入胰岛素。为了配合在血糖下降,D50的注入。如果D50的输液速度大于吸收率,血糖的上升会发生。同样的,如果利率是不够的,以配合整个身体对葡萄糖的摄取,下降会发生。葡萄糖的滴定继续进行,直到达到稳定血糖读数。血糖水平,在这个稳定的时期葡萄糖输注速率记录和报告。结果提供了一个全身胰岛素敏感性指数。该技术可以改进,以满足特定的实验要求。它进一步增强了使用的放射性示踪剂,可以决定组织特异性胰岛素刺激的葡萄糖摄取以及全身葡萄糖营业额。
研究方案
答:手术导管,动脉和静脉循环
第1部分:动脉和静脉导管的制备
- 切15厘米PE - 50(内部直径0.58毫米(0.023“)x外径0.965毫米(0.038”)。硅胶管切1毫米节(0.76毫米(0.030“)内部直径x1.65毫米(0.065“)外径),使用限制珠。限制珠防止拉出导管,一次到位的老鼠。
- 微解剖钳插入管腔的限制珠的技巧和镊子轻轻托起的秘诀除了伸展扩大开放。使用另一微解剖钳,滑入管腔限制珠硅橡胶管。具有较强的粘合胶(乐泰超级胶)安全。珠必须平躺导管周围。允许导管干(24小时)来完成。
- 对于一个300克重的老鼠,动脉行〜的限制珠颈行〜3.2厘米2.7厘米。从导管的制约长度是由0.5厘米调整为每100克体重的增加。不要船只在插入导管,因为这可能穿刺锥的边缘。
- 立即在手术前,填写与肝素生理盐水(10U/ml)线,密封两端用不锈钢管堵塞和乙醇(70%)放置在消毒。空气干燥前插入。
第2部分:手术准备
- 由卡尔加里动物保健大学和程序批准使用委员会和theCanadian协会遵守实验动物科学实验的准则。下面列出的程序进行了成年,雄性Sprague - Dawley大鼠(约300克)。所有程序下进行异氟醚,虽然也可以使用注射麻醉剂。所有的手术程序进行,确保无菌操作技术。外科设备,烧杯和肝素生理盐水高压灭菌消毒。从供应商购买的消毒,手术手套,注射器和棉倾斜涂药。
- 称量大鼠,并记录结果。在手术后的监测动物的重量将是重要的的。应使用重拾重量只有到手术前水平的动物实验。在麻醉中麻醉大鼠(3%异氟醚)。保持在手术使用鼻锥的大鼠在1〜2%异氟醚。在消毒领域,促进无菌手术必须进行。
- 准备消除手术部位的头发(颈部和肩胛骨)的动物。可以用一个小理发器或化学脱毛。从那里进行手术是在一个地区单独执行此过程。
- 安全动物手术台。确保通过检查脚/眼反射的存在是完全麻醉的动物。准备适当的皮肤消毒剂(70%的乙醇,70%的乙醇优碘擦洗)在手术部位。
第3部分:手术
- 小型垂直正中切口1厘米优于胸骨(拿起皮肤,纵向沿中轴与钳和剪刀或手术刀切割)。
- 使用微解剖钳暴露左侧胸锁乳突肌肌钝性解剖。反映这种肌肉暴露左侧颈内动脉约1厘米。使用微解剖钳下颈内动脉动脉举行的地方。轻轻挑逗,从颈动脉结缔组织。重要的是从动脉的迷走神经分离不破坏动脉或神经。孤立的动脉,然后用4-0丝线缝合(这将是用来操纵在手术过程中的颈动脉)结扎头侧结束。注:70%的乙醇,使用前应消毒4-0缝线。
- 带有锯齿的船只,微解剖钳钳。 21号VENOJECT多重采样露儿适配器的结扎穿刺结束。取出不锈钢管堵塞,小心地插入导管承认到动脉无菌导管导引援助。确保导管钳安全,部分放开微观解剖钳,夹闭动脉,并继续插入导管珠。此时,导管尖端应在主动脉弓。小心不要释放导管,血管的压力将迫使它。
- 铁两个4-0缝合牢固下面珠和一个以上,并确认导管将样品。 10U/ml肝素生理盐水冲洗行。重新插入导管用不锈钢管堵塞的外部结束。
- 使用相同的切口,钝性解剖暴露右侧颈外静脉。仔细分离,并用丝线缝合结扎头侧结束。静脉穿刺21号VENOJECT多重采样露儿适配器。取出不锈钢管堵塞,插入导管用无菌彗星atheter介绍人珠和配合下面的两个珠缝线。领带上面珠第三缝合,并确认它的样品。与静脉行10U/mL肝素生理盐水冲洗。不锈钢管插头重新插上外部导管末端。
- 隧道14号钝针下的皮肤,使切口在肩胛骨之间的背部。穿过针的导管exteriorize大鼠背面。大约4厘米行是可见的。切的聚乙烯的S - 50 - HL医用导管0.5厘米,周围放置的exteriorized导管和安全需要(蓝色静脉,动脉红色)的录像带。复试的导管,以确保通畅,冲洗和填写与150U/ml肝素生理盐水,以防止凝血。
- 关闭所有的切口,用3-0丝线缝合。放置鼠易发生,在预热,干净笼笼底的食物。
B:术后护理
第1部分:术后护理和监测
- 一旦老鼠重新获得充分的日间能力和警觉性大鼠返回畜舍。
- 允许大鼠为3-5天恢复。
- 每日监测感染,疼痛和体重的变化。如果放电观察切口网站,一般嗜睡和/或疼痛,感染可能是关注。疼痛是驼背的姿势,竖起背毛皮及日间和/或饮食行为的情况下表示。然而,可能会经历的减肥手术后手术后3天立即重量应稳定和/或增加在术前体重的10%在5天之内。严重的体重减轻可能表明感染,中风和/或疼痛。
- 复试导管每天以确保通畅。
第2部分:保持导管通畅
- 术后恢复期间的每一天,150U/ml肝素生理盐水填充1毫升滑提示注射器和第22号钝针。 23规格的不锈钢管耦合器的另一端插入到PE - 50管20厘米钝针。
- 取下放置管耦合器的一端高于其余1ml注射器,推行的气泡,气泡。
- 钳断动脉线从老鼠与止血略低于插件外部。
- 使用止血第二对拆下的钢导管堵塞。
- 插入动脉线连接到注射器管耦合,并释放止血,阻断外部的动脉导管。
- 动脉导管的血液吸进注射器。如果导管不容易画,它可能需要轻轻推少量的清洗液通过导管打跑导管尖端情况下,它是对血管壁楔形。导管已完全清除,当血液中达到注射器。
- PE - 50管接近钳1ml注射器,注射器和处置。更换一个新的注射器充满新鲜150U/ml肝素生理盐水。松开油管,并举行新的注射器直立,手指轻弹与新的注射器逐出任何可能的新的气泡向上远离行。注意:必须确保气泡可导致中风。
- 直到导管行是明确的和无血,注入150U/ml heparinzed生理盐水。
- 从大鼠外部略低于管耦合器止血钳断动脉。从动脉导管行取出注射器连接器,并用不锈钢管堵塞替换。
- 松开止血,阻断外部的动脉导管。
- 重复静脉行。然而,由于静脉压力低采样往往是不可能的。如果150U/ml heparinzed生理盐水注入可以以最小的阻力很可能定位静脉导管。
C:高胰岛素 - 正常血糖钳
第1部分:钳设置和准备
- 称量大鼠和记录重量。这将需要确定胰岛素和葡萄糖输注率。快速的大鼠实验前至少5H。这将确保动物在餐后状态和食物来源的葡萄糖的贡献最小。放置在一个小容器/腾笼换床上用品,限制过度运动大鼠。动物应该能够扭转和新郎自由。
- 设置如图1所示的线条和输液泵。 P50连接管长度如下:Y型连接器是注射器8厘米,对大鼠的Y型连接器是15厘米,动脉行20厘米,静脉行是在长10cm。删除不锈钢管插头,并刷新颈静脉和动脉线,以确保输液和采样10U/ml肝素生理盐水分别。
- 确定胰岛素所需体积。这将取决于对大鼠胰岛素水平和重量。在这里,4mU/kg/min管理的2uL/min率。这是一种高生理剂量。在可能的情况下,应努力限制输液量。胰岛素应适当稀释后,在血浆中存在的管理。 3%的生理盐水中大鼠血浆的解决方案是用来稀释在本实验室的胰岛素。胰岛素是HumulinR 100U/ml(礼莉莉),虽然可以采用其他快速长效胰岛素。确保稀释胰岛素混合之前,把输液注射器。
- 准备50%葡萄糖。这可以注射器直接放入输液泵。标记“葡萄糖”泵“,以避免将来出现混乱。请记住,以确保足够数量的胰岛素和葡萄糖的研究。夹具一般〜2H。在本议定书中,3毫升注射器使用。
- 到哈佛仪器11型加注射泵,将葡萄糖和胰岛素注射器。提前葡萄糖Y型连接用止血钳和夹钳线。事先胰岛素动物,钳止血线。钳线,让老鼠放宽为30分钟前开始实验。注:止血钳尖端警卫建议,以避免永久性线压着。
- 准备离心的血浆采集和EDTA涂层管。在本研究中,将获得额外的血液样本,一旦动物被夹住。
第2部分:试验协议
- 一个基线胰岛素样和血细胞比容样品应被收购。血细胞比容采样,确保整个实验过程中保持血容量。一般情况下,血细胞比容水平不应该下降超过10%的初始值。
- 获取基线葡萄糖样本(单键超,LIFESCAN公司),并确定整个被夹住的血糖水平。在这里,我们在正常血糖钳,或5.0 - 5.5mm的( 图2)。每个血液样本后,冲洗的10U/ml体积小动脉行肝素生理盐水,以防止凝血。注意:确保无凝块或气泡,在注入前行。这些可以给动物中风。
- 启动胰岛素输注。在每个时间点的血糖监测血糖,以5 - 10分钟的时间间隔。调整葡萄糖输液速度,直到达到稳定状态。这个过程通常是一个试错的过程,可以采取30分钟> 2H。须维持血糖水平的葡萄糖依赖于实验的协议,物种和条件( 图2) 。
- 稳态血糖水平的定义范围内的三个连续读数。在这里,〜1mm的内三读被认为是钳制(如4.8,5.2,5.6mM)。一旦达到稳定状态,记录为30分钟内必须保持血糖的葡萄糖输注率。在这段时间内,可以得到更多的血液样本。至少,第二血浆胰岛素样和血细胞比容样品应获得。
- 钳完成后,可用于进一步的测试或安乐死,并作进一步的分析收集组织使用动物。根据动物,导管线可以保持5-7天的专利。
D:高胰岛素 - 正常血糖钳结果(胰岛素)
当正确执行,钳程序评估稳态大鼠胰岛素敏感性。在介绍钳从获得的数据,它是必不可少的文件血糖水平和葡萄糖输注率。稳定血糖水平超过最低的30分钟的时间( 图3)当然是一个稳定的状态指示。葡萄糖被认为是只有全血葡萄糖〜1mm的范围内保持稳定。葡萄糖输注率表明外源性葡萄糖来维持血糖水平。在可能的情况下,这些数字应显示为一个时间过程,而不是单一,平均值(图4)。
建议报告的其他措施,血浆胰岛素和红细胞压积。空腹的决心和夹紧确认胰岛素水平,胰岛素已经成功地管理和将检测在治疗组之间的水平(图 5)任何差异。在基线和胰岛素钳夹结束时获得的血细胞比容措施建议(图 6 )。这是为了确保血细胞比容水平不属于血液的流量和流速的实验,并在所附的改建期间超过5%,不会影响血糖处置。
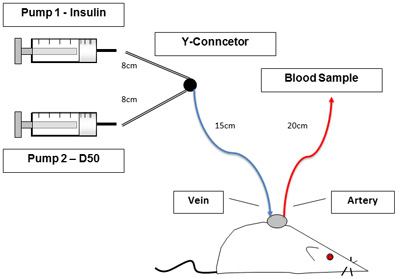
图1实验装置。图1显示了在夹紧过程奔放,有意识地鼠。导管允许未经处理的动物的血液样本和输液。到左边的泵含有胰岛素和葡萄糖。

图2。有望在夹紧过程中的数据。为了获得钳在基准水平(血糖正常,5MM),外源性葡萄糖的水平(D50)操纵直到达到基线或“钳”。
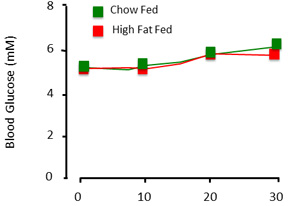
图3:预期的钳制程序的血糖结果。当动物是“钳制”,血糖相对稳定,跨越了时间和实验组。
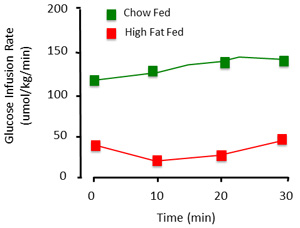
图4。代表的钳制程序的葡萄糖输注速率。要求,以保持血糖正常的外源性葡萄糖量是不同的。这是说明与控制(议员美联储)和高脂肪喂养动物(胰岛素抵抗)。高脂肪喂养的动物,需要较少的葡萄糖注入来维持血糖,主要是因为它是不敏感的胰岛素注入的。
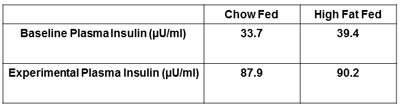
图5代表对大鼠血浆胰岛素。血浆胰岛素在胰岛素钳夹应禁食,基线血浆胰岛素水平。这将确保胰岛素正常管理过程中的动物胰岛素钳夹。
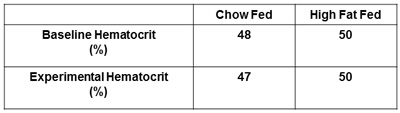
图6。报告血细胞比容。以下实验的基线血细胞比容和红细胞压积,必须获得和报告。这将确保血细胞比容水平不下降超过5%的基准水平造成过多的动脉血取样。
Access restricted. Please log in or start a trial to view this content.
讨论
最初调查在人类胰岛素敏感性的发展,现在已经被钳制程序适应其他物种,包括实验大鼠和小鼠。调查胰岛素抵抗的动物模型提供了一个了解对胰岛素的敏感性和相关的病症的病理生理,以及确定的临床应用价值1,2的治疗性干预的大量援助。已受聘的几种方法,以评估在动物体内胰岛素的敏感性。这些技术包括糖耐量试验(GTTs)的变化和胰岛素糖耐量试验(ITTS)4-6以及?...
Access restricted. Please log in or start a trial to view this content.
披露声明
致谢
这项研究是由加拿大健康研究和基因组Canada.JS研究院的支持下,拥有来自阿尔伯塔省文物Foundationfor医学研究,心脏及中风基金会,加拿大糖尿病协会的Canadaand的薪金支持奖。特别感谢博士大卫沃瑟曼和宾格尔布雷西此过程希勒实验室教学。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论(可选) |
| Intramedic聚乙烯管(PE - 50) | Fisher Scientific则 | 14 - 170 - 12B | 内部直径0.58毫米(0.023“)的X外径0.965毫米(0.038”) |
| 道康宁的硅橡胶实验室套管 | Fisher Scientific则 | 11 - 189 - 15C | 内部直径0.76毫米(0.030“)的X1.65毫米外径(0.065”) |
| 聚乙烯小号- 50 - HL医用导管 | 哈佛器械 | PY2 72-1251 | 内部直径为3.2mm(0.125“)的X4.7毫米外径(0.1875”) |
| 乐泰超级胶水 | 大和玩具 | 32237 | 凝胶控制 |
| 无菌手术刀片 | VWR | BD371610 | |
| 弧形微解剖钳 | 乔治Tiemann&CO。 | 160-20 | × 2 |
| 直微解剖钳 | 乔治Tiemann&CO。 | 160-15 | × 2 |
| 弯止血钳 | 乔治Tiemann&CO。 | 105-1135 | × 2 |
| 直止血钳 | 乔治Tiemann&CO。 | 105-1130 | × 2 |
| 止血提示警卫 | 罗宾斯仪器公司 | 15.09-2-004 | |
| 直外科剪刀 | 乔治Tiemann&CO。 | 105-402 | |
| VENOJECT多样品露儿适配器 | 泰尔茂医疗产品 | 810127A | 21计,1英寸 |
| 无菌导管导引 | 碧迪 | 406999 | |
| 14号钝针 | 碧迪 | 511310 | 14号,2英寸 |
| 无菌手术缝合 | 强生公司医药产品 | 1679H | 丝绸,大小3-0 |
| 非无菌手术缝合线 | Angiotech制药公司 | SP116 | 丝绸,大小4-0 |
| 棉签 | VWR | 10806-005 | |
| 4ply纱布垫 | VWR | CA43845 - 062 | |
| 小动物无绳快船 | 哈佛器械 | 729063 | |
| 异氟醚 | 卤烃产品公司 | IPN - 45 | |
| 麻醉车 | 森医疗等行业,公司 | ||
| 70%的乙醇 | Fisher Scientific则 | HC - 1000 | |
| 优碘消毒液 | 西药配送中心有限公司 | 105267 | |
| 11型加注射泵 | 哈佛器械 | 702208 | |
| 不锈钢油管耦合 | 哈佛器械 | 72-4434 | 23计,0.3英寸 |
| 不锈钢管插头 | 哈佛器械 | 72-4436 | 23计,0.5英寸 |
| 不锈钢钝性针 | Instech实验室,公司 | LS22 | 22号 |
| 60度Y型连接器 | 小零件 | STCY - 22 - 05 | 22号 |
| CritSpin微血细胞比容离心机 | 虹膜来样加工 | CS12 | |
| 迷你离心机 | Fisher Scientific则 | 05-090-100 | |
| 微型离心管 | VWR | 53550-778 | |
| 50毫升聚丙烯离心管 | VWR | 89004-364 | |
| 1毫升塑料滑提示注射器 | 碧迪 | 309602 | |
| 3毫升塑料Luerlok提示注射器 | 碧迪 | 309585 | |
| 肝素抗凝注射液 | 西药配送中心有限公司 | 102824 | 生产商:LEO制药公司浓。 1000国际单位 |
| EDTA溶液 | Promega公司的公司 | V4231 | 0.5米,pH值8.0 |
| 盐水 | 西药配送中心有限公司 | ABB7983154 | 制造商:Hospira公司0.9%的氯化钠 |
| 50%葡萄糖 | Vetoquinol | 8DEX012D | |
| 优泌林 - R | 礼来公司 | HI - 210 | 100U/ml |
| 1毫升胰岛素注射器 | 碧迪 | 309311 | |
| Fisherbrand *造血密封胶 | Fisher Scientific则 | 02-678 | |
| Fisherbrand * Microhematocrit毛细管 | Fisher Scientific则 | 22-362-574 | |
| 单键超试纸 | LIFESCAN,公司 | AW 085 - 314H | |
| 单键Ultra血糖仪 | LIFESCAN,公司 | AW 085 - 314B | |
| 钠Pentobarbitol | 塞瓦三特,石兽 | 1715 138 | 浓。 54.7mg/ml |
| 红实验室标签带 | VWR | 89097-932 | |
| 蓝实验室标签带 | VWR | 89097-936 | |
| 电子秤 | Fisher Scientific则 | 01-913-88 | |
| 涡旋 | VWR | 58815-234 | |
| 定时器 | VWR | 62344-641 |
参考文献
- Halseth, A. E., Bracy, D. P., Wasserman, D. H. Limitations to basal and insulin-stimulated skeletal muscle glucose uptake in the high-fat-fed rat. Am J Physiol Endocrinol Metab. 279, E1064-E1071 (2000).
- Halseth, A. E., Bracy, D. P., Wasserman, D. H. Limitations to muscle glucose uptake due to high fat feeding. Am. J. Physiol. 279, E1064-E1071 (2000).
- Muniyappa, R., Lee, S., Chen, H., Quon, M. J. Current approaches for assessing insulin sensitivity and resistance in vivo: advantages, limitations, and appropriate usage. Am J Physiol Endocrinol Metab. 294, 15-26 (2008).
- Cho, H. Insulin resistance and a diabetes mellitus-like syndrome in mice lacking the protein kinase Akt2 (PKB beta). Science. 292, 1728-1731 (2001).
- Dubois, M. J. The SHP-1 protein tyrosine phosphatase negatively modulates glucose homeostasis. Nat Med. 12, 549-556 (2006).
- Pacini, G., Thomaseth, K., Ahren, B. Contribution to glucose tolerance of insulin-independent vs. insulin-dependent mechanisms in mice. Am J Physiol Endocrinol Metab. 281, 693-703 (2001).
- Herbach, N. Dominant-negative effects of a novel mutated Ins2 allele causes early-onset diabetes and severe beta-cell loss in Munich Ins2C95S mutant mice. Diabetes. 56, 1268-1276 (2007).
- Maeda, N. Diet-induced insulin resistance in mice lacking adiponectin/ACRP30. Nat Med. 8, 731-737 (2002).
- Potenza, M. A., Marasciulo, F. L., Tarquinio, M., Quon, M. J., Montagnani, M. Treatment of spontaneously hypertensive rats with rosiglitazone and/or enalapril restores balance between vasodilator and vasoconstrictor actions of insulin with simultaneous improvement in hypertension and insulin resistance. Diabetes. 55, 3594-3603 (2006).
- Ayala, J. E., Bracy, D. P., McGuinness, O. P., Wasserman, D. H. Considerations in the design of hyperinsulinemic-euglycemic clamps in the conscious mouse. Diabetes. 55, 390-397 (2006).
- Wasserman, D. H., Ayala, J. E., McGuinness, O. P. Lost in translation. Diabetes. 58, 1947-1950 (2009).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。