Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Hyperinsulinämische-euglykämische Clamp in der Conscious Rat
In diesem Artikel
Zusammenfassung
Die hyperinsulinämische-euglykämische Clamp ist der "Goldstandard" für die Beurteilung der Wirkung von Insulin. Insulin ist mit einer konstanten Rate anregende Glukoseaufnahme infundiert. Die Höhe der exogenen Glucose infundiert, um diese Tropfenzähler ist ein Hinweis auf die Insulinsensitivität. Hier ist das Verfahren auf einer bewussten, hemmungslos Ratte durchgeführt.
Zusammenfassung
Typ-2-Diabetes (T2D) steigt rasant in der Prävalenz. Gekennzeichnet durch entweder unzureichend Insulin-Produktion oder die Unfähigkeit, Insulin produziert, T2D zu erhöhten Blutzuckerwerten zu nutzen. Die "Gold-Standard" bei der Beurteilung der Insulin-Sensitivität ist ein hyperinsulinämische-euglykämische Clamp-oder Insulin zu klemmen. In diesem Verfahren wird Insulin mit einer konstanten Rate was zu einem Abfall des Blutzuckerspiegels infundiert. Zur Aufrechterhaltung des Blutzuckers auf einem konstanten Niveau, ist exogen Glucose (D50) in den venösen Blutkreislauf infundiert. Die Menge an Glukose infundiert, um die Homöostase aufrechtzuerhalten ist bezeichnend für die Insulinsensitivität. Hier zeigen wir die grundlegenden Clamp Verfahren in der chronisch katheterisiert, hemmungslos, bewusste Ratte. Dieses Modell ermöglicht es Blut mit minimalem Stress für das Tier abgeholt werden. Nach der Einleitung der Narkose, ist ein Mittellinienschnitt gemacht und die linke A. carotis communis und rechte Jugularvene sind katheterisiert. Eingefügte Katheter sind mit heparinisierten Kochsalzlösung gespült, dann exteriorisierten und gesichert. Tiere sind erlaubt, für 4-5 Tage vor der Experimente zu erholen, mit einer Gewichtszunahme täglich überwacht. Nur jene Tiere, die ihr Gewicht wieder vor der Operation Ebenen sind für Experimente verwendet. Am Tag des Experiments werden Ratten gefastet und an Pumpen mit Insulin und D50. Baseline Glukose aus dem arteriellen Linie beurteilt und eine Benchmark während des ganzen Experiments (Normoglykämie). Im Anschluss daran wird Insulin mit einer konstanten Rate in den venösen Blutkreislauf infundiert. Zur Anpassung an den Rückgang der Blutzuckerspiegel ist D50 infundiert. Wenn die Rate der D50 Infusion ist größer als die Geschwindigkeit der Aufnahme wird ein Anstieg der Glukose auftreten. Auch wenn die Rate nicht ausreichen, um ganze Körper Glukoseaufnahme Spiel ist, wird ein Tropfen auftreten. Titration von Glukose wird fortgesetzt, bis stabile Blutzuckerwerte erreicht werden. Blutzuckerspiegel und Glukose-Infusion Preise in diesem Zeitraum stabil erfasst und gemeldet. Ergebnisse liefern einen Index der ganze Körper Insulin-Empfindlichkeit. Die Technik kann verfeinert werden, um spezifische experimentelle Anforderungen gerecht zu werden. Es wird ferner durch die Verwendung radioaktiver Tracer, dass gewebespezifische Insulin-stimulierte Glukoseaufnahme sowie ganzen Körper Glukose Umsatz bestimmen kann, verbessert.
Protokoll
A: Chirurgische Katheterisierung von arteriellen und venösen Blutkreislauf
Teil 1: arterielle und venöse Katheter Vorbereitung
- Cut 15 cm von PE-50 (Innendurchmesser 58 mm (0,023 ") x einen Außendurchmesser von 0,965 mm (0,038"). Schneiden Sie einen 1mm Abschnitt Silastic Schlauch (0,76 mm (0,030 ") Innendurchmesser x 1,65 mm (0,065 ") Außendurchmesser) für den Einsatz als einstweilige Wulst. Die einstweilige Wulst verhindert, dass die Ratte aus Herausziehen des Katheters, sobald es in Kraft ist.
- Legen Sie die Spitzen der Mikro-Pinzette in das Lumen der zurückhaltenden Wulst und sanft halten die Spitzen der Pinzette auseinander zu dehnen die Öffnung größer. Mit einem weiteren Paar von Mikro-Pinzette, schieben Sie die Silastic Schlauch in das Lumen der zurückhaltenden Wulst. Sicher mit starken Klebstoff Kleber (Loctite Super Glue). Die Sicke liegen muss um den Katheter flach. Lassen Katheter zum Trocknen (24 Stunden).
- Für eine 300-Gramm-Ratte, wird die Arterie line ~ 2.7cm aus dem einstweilige Perle, während die Vena line ~ 3.2cm ist. Katheter Längen von der Eindämmung von 0,5 cm für jede 100g Zunahme des Körpergewichts angepasst. Nicht Abschrägung der Kanten des Katheters, da dies Punktion des Gefäßes während der Einführung.
- Unmittelbar vor der Operation, füllen Sie die Zeilen mit heparinisierten Kochsalzlösung (10U/ml), Dichtung beiden Enden mit einem Edelstahlrohr Plug-and-Platz in Ethanol (70%) zu sterilisieren. Air vor dem Einsetzen trocken.
Teil 2: Chirurgische Vorbereitung
- Die Verfahren wurden von der University of Calgary Animal Care genehmigt und Verwenden Ausschuss und einzuhalten theCanadian Association for Laboratory Animal Science-Richtlinien für Experimente. Die unten beschriebenen Verfahren wurden an adulten männlichen Sprague-Dawley Ratten (~ 300g) durchgeführt. Alle Verfahren werden unter Isofluran durchgeführt, obwohl es möglich ist, injizierbaren Anästhetika verwenden. Alle chirurgischen Eingriffe durchgeführt werden sicherstellen aseptischen Techniken. Chirurgische Geräte, Becher und heparinisierten Kochsalzlösung sind Autoklaven sterilisiert. OP-Handschuhe, Spritzen und Wattestäbchen Applikatoren sind erhältlich beim Lieferanten sterilisiert.
- Wiegen der Ratte und vermerkt das Ergebnis. Das Gewicht wird in der post-chirurgischen Überwachung der Tiere wichtig. Nur Tiere, die erneute Gewichtszunahme vor der Operation sollten für Experimente verwendet werden. Anesthetize Ratte (3% Isofluran) in Narkose ein. Halten Sie die Ratte bei ~ 2% Isofluran während der Operation mit einer Nase Kegel. Chirurgie ist in einem Gebiet, das desinfiziert Asepsis fördert durchgeführt werden.
- Bereiten Sie das Tier durch das Entfernen von Haaren aus dem OP-Gebiet (Hals und Schulterblätter). Eine kleine Haarschneidemaschine oder chemische Enthaarungsmittel verwendet werden kann. Führen Sie dieses Verfahren in einem Bereich zu trennen, von wo aus die Operation durchgeführt werden soll.
- Sichere Tier OP-Tisch. Stellen Sie sicher, Tier ist voll narkotisiert, indem Sie auf das Vorhandensein von Fuß / Augenreflexe. Bereiten Sie die chirurgische Seiten mit einem geeigneten Hautdesinfektionsmittel (70% Ethanol betadine Gestrüpp von 70% Ethanol, gefolgt).
Teil 3: Chirurgie
- Machen Sie kleine vertikale Mittellinienschnitt 1cm über dem Brustbein (Pick up Haut längs medial Achse mit einer Pinzette und schneiden mit Schere oder Skalpell).
- Blunt sezieren mit Mikro Pinzette auf der linken M. sternocleidomastoideus aussetzen. Reflect dieses Muskels auf ca. 1cm von der linken Halsschlagader freizulegen. Verwenden Sie Mikro-Pinzette unter Halsschlagader, um die Arterie in Position zu halten. Gently tease aus Bindegewebe aus der Halsschlagader. Es ist wichtig, den Vagusnerv aus der Arterie ohne Beschädigung entweder die Arterie oder die Nerven zu isolieren. Isolieren Sie die Arterie dann ligieren die kraniale Ende mit 4-0 Seidenfaden (diese werden verwendet, um die Halsschlagader während der Operation zu manipulieren). Hinweis: 4-0 Nähte sollten mit 70% Ethanol vor dem Gebrauch sterilisiert werden.
- Spannen Sie das Gefäß mit Wellenschliff, Mikro-Pinzette. Punktion der ligierten Ende mit einer 21-Gauge VENOJECT Multi-Sample Luer Adapter. Entfernen Sie das Edelstahlrohr Stecker und vorsichtig einführen Katheter mit Hilfe einer sterilen Katheter Einführhilfe, um es in die Arterie zugeben. Die Sicherstellung der Katheter ist sicher mit einer Pinzette, teilweise Freisetzung micro Pinzette Spannen der Arterie und weiterhin Einführen des Katheters an dem Wulst. An diesem Punkt sollte die Spitze des Katheters in den Aortenbogen werden. Achten Sie darauf, Katheter loslassen, wird der Druck des Gefäßes Kraft it out.
- Binden Sie zwei 4-0 Nähten sicher unter Raupe und einer oben und bestätigen, dass der Katheter Probe. Spülen Sie die Zeile mit 10U/ml heparinisierten Kochsalzlösung. Re-plug das äußere Ende des Katheters mit einem rostfreien Stahlrohr-Stecker.
- Mit dem gleichen Schnitt, stumpf sezieren nach rechts externen Halsschlagader freizulegen. Isolieren Sie sorgfältig und ligieren die kraniale Ende mit Seidenfaden. Punktion der Vene mit einer 21-Gauge VENOJECT Multi-Sample Luer Adapter. Entfernen Sie das Edelstahlrohr Plug-and-Insert-Katheter mit sterilem cAtheter Einführschleuse an dem Wulst und Krawatte zwei Nähten unterhalb der Wulst. Tie ein Drittel Naht oben Wulst und bestätigen, dass es Proben. Flush mit der venösen Leitung 10U/mL heparinisierten Kochsalzlösung. Re-Stecker des externen Katheters Ende mit Edelstahlrohren Stecker.
- Tunnel 14-Gauge-Nadel stumpf unter die Haut und machen Einschnitt in den Rücken zwischen den Schulterblättern. Thema der Katheter durch die Nadel, um sie an der Rückseite der Ratte exteriorisieren. Etwa 4cm der Linie sichtbar ist. Cut 0.5cm von Tygon S-50-HL Medizinische Schläuche, legen Sie sie um sowohl die exteriorisierten Katheter und sichern mit einem Band nach Bedarf (blau für Vene, rot für Arterie). Retest-Katheter, um die Durchgängigkeit zu gewährleisten, bündig und füllen sich mit 150U/ml heparinisierten Kochsalzlösung Gerinnen zu verhindern.
- Schließen Sie alle Schnitte mit 3-0 Seidenfaden. Legen Ratte neigt, in vorgewärmte, saubere Käfig mit Lebensmitteln in den Boden des Käfigs.
B: Postoperative Pflege
Teil 1: unmittelbare postoperative Pflege und Überwachung
- Sobald die Ratte wieder das volle ambulante Fähigkeit und Aufmerksamkeit wieder der Ratte zu Tierhaltung.
- Lassen Sie die Ratte für 3-5 Tage zu erholen.
- Monitor täglich für Infektionen, Schmerzen und Veränderungen in Gewicht. Die Infektion kann von Bedeutung sein, wenn der Entlassung aus Inzisionsstellen, allgemeine Lethargie und / oder Schmerzen zu beobachten ist. Der Schmerz wird durch gekrümmte Haltung, gekräuselte Fell zurück und das Fehlen von ambulanten und / oder das Essverhalten angegeben. Ein Gewichtsverlust sofort können nach der Operation bis zu drei Tage nach der Operation erlebt werden, jedoch sollte Gewicht zu stabilisieren und / oder zu erhöhen, um innerhalb von 10% der präoperativen Gewicht innerhalb von 5 Tagen. Schwere Gewichtsverlust kann darauf hindeuten, Infektionen, Schlaganfällen und / oder Schmerzen.
- Retest Katheter täglich, um die Durchgängigkeit zu gewährleisten.
Teil 2: Pflege-Katheter Durchgängigkeit
- Jeden Tag während der post-op Erholung, füllen 1ml Rutsch Tip Spritzen mit 150U/ml heparinisierten Kochsalzlösung und Kappe mit einer 22-Gauge-Nadel stumpf. Die stumpfe Nadel in 20cm von PE-50-Schlauch mit 23 mm-Edelstahl-Rohr Kupplung am anderen Ende eingefügt.
- Luftblasen entfernen, indem Sie das Ende mit dem Schlauch Koppler höher als der Rest der 1ml Spritze und drücken die Blasen aus der Leitung.
- Clamp off der arteriellen Linie von der Ratte mit Hämostatika knapp unterhalb des Steckers externalisiert.
- Entfernen Sie die Stahl Katheterstopfen mit dem zweiten Paar von Hämostatika.
- Legen Sie den Schlauch-Koppler mit der Spritze in den arteriellen und lassen Sie die Hämostatika Verschließen des externalisiert arteriellen Katheter.
- Saugen Sie das arterielle Blut des Katheters in die Spritze. Wenn der Katheter nicht leicht zu ziehen, kann es notwendig, sehr vorsichtig in eine kleine Menge Spüllösung Push durch den Katheter an der Spitze des Katheters zu vertreiben, falls sie gegen die Gefäßwand eingekeilt ist. Der Katheter wurde komplett gelöscht, wenn das Blut gelangt der Spritze.
- Klemmen Sie die PE-50-Schlauch in der Nähe des 1ml Spritze und entsorgen Sie die Spritze. Ersetzen durch eine neue Spritze mit frischen 150U/ml heparinisierten Kochsalzlösung gefüllt. Ausspannen Schlauch und Halten der neuen Spritze aufrecht, Flick die neue Spritze mit dem Finger, um mögliche neue Luftblasen nach oben und weg von der Linie zu entfernen. Hinweis: Es muss sichergestellt werden, wie Luftblasen einen Schlaganfall verursachen kann.
- Spritzen Sie die 150U/ml heparinzed Kochsalzlösung, bis der Katheter Linie ist klar und frei von Blut.
- Clamp off der arteriellen Linie von der Ratte mit Hämostatika knapp unterhalb der Schläuche Koppler externalisiert. Entfernen Sie die Spritze Stecker aus dem arteriellen Katheter Zeile und ersetzen Sie es mit dem Edelstahlrohr-Stecker.
- Lassen Sie die Hämostatika Verschließen des externalisiert arteriellen Katheter.
- Wiederholen Sie dies für Venenkatheter. Doch wegen der niedrigen Venendruck Probenahme ist oft nicht möglich. Wenn die 150U/ml heparinzed Kochsalzlösung mit minimalem Widerstand infundiert werden kann ist es wahrscheinlich, dass der Katheter gut in die Vene positioniert.
C: hyperinsulinämische-euglykämische Clamp
Teil 1: Clamp Set-up und Vorbereitung
- Wiegen der Ratte und das Gewicht aufgezeichnet. Dies wird benötigt, um Insulin und Glukose-Infusion Preise zu bestimmen. Schnell die Ratte für mindestens 5h vor, zu experimentieren. Dadurch wird sichergestellt, das Tier in einem postprandialen Zustand und den Beitrag von Glukose aus der Nahrung wird minimiert. Legen Sie die Ratte in einen kleinen Behälter / Käfig mit Einstreu, dass eine übermäßige Bewegung Grenzen. Das Tier sollte in der Lage sein, sich umzudrehen und Bräutigam frei.
- Set up Linien und Infusionspumpen, wie in Abbildung 1 zu sehen. P50-Verbindung Schlauchlängen sind wie folgt: Spritze Y-Stecker ist 8cm, Y-Stecker an Ratte 15cm ist, ist die arterielle Linie 20cm, und die venöse Linie ist 10cm lang. Entfernen Edelstahlrohren Stecker und bündig jugulare und arterielle Linien der Infusion zu gewährleisten und Probenahme jeweils mit 10U/ml heparinisierten Kochsalzlösung.
- Bestimmen Sie Insulin Volumen benötigt. Dies ist abhängig von der Insulinspiegel und das Gewicht der Ratte. Hier ist 4mU/kg/min mit einer Rate von 2uL/min verwaltet. Dies ist eine hohe physiologische Dosis. Soweit möglich, sollte versucht werden, Infusionsvolumina zu begrenzen. Insulin sollte entsprechend verdünnt werden und in Anwesenheit von Plasma verabreicht werden. Eine 3% Rattenplasma in Kochsalzlösung wird verwendet, um das Insulin in diesem Labor zu verdünnen. Insulin ist HumulinR 100U/ml (Eli Lily), obwohl andere schnell wirkendes Insulin eingesetzt werden können. Stellen Sie sicher, verdünnt Insulin gut durchmischt ist vor der Inbetriebnahme in der Infusions-Spritze.
- Bereiten Sie 50% Dextrose. Dies kann direkt in die Spritze gesetzt werden auf der Infusionspumpe. Mark Pumpe mit "Glukose", um zukünftige Verwirrung zu vermeiden. Denken Sie daran, ausreichende Mengen von Insulin und Glukose für die Prüfung zu gewährleisten. Clamps dauern in der Regel ~ 2h. Im vorliegenden Protokoll sind 3ml Spritzen verwendet.
- Legen Glukose und Insulin-Spritzen auf Harvard Apparatus Modell 11 Plus Spritzenpumpen. Advance-Glucose in Y-Stecker und Klemme Linie mit einem hemostat. Advance-Insulin, um Tier-, Klammer mit hemostat. Clamp-Linien und ermöglichen Ratte nach 30min vor entspannen Beginn des Experiments. HINWEIS: Hemostat Spitze Wachen werden vorgeschlagen, um eine dauerhafte Vermeidung Crimpen der Linien.
- Bereiten Zentrifuge und EDTA-beschichtete Röhrchen für Plasma-Sammlung. In der vorliegenden Studie werden weitere Blutproben erhalten, sobald das Tier eingespannt werden.
Teil 2: Experimentelles Protokoll
- Eine Baseline Insulin Probe und Hämatokrit Probe sollte erworben werden. Hämatokrit Sampling sorgt Blutvolumen während des gesamten Experiments wird beibehalten. Generell sollte Hämatokritwerte nicht fallen mehr als 10% des Ausgangswertes.
- Besorgen Sie sich eine Grundlinie Glukose Probe (One Touch Ultra, LifeScan, Inc.) und bestimmen die gesamte Blutzuckerspiegel zu spannen. Hier haben wir bei Normoglykämie Klammer oder 5,0-5.5mm (Abbildung 2). Nach jeder Blutprobe, bündig arteriellen Linie mit einem kleinen Volumen 10U/ml heparinisierten Kochsalzlösung Gerinnen zu verhindern. HINWEIS: Sicherstellen, dass keine Klumpen oder Luftblasen in der Leitung vor Infusion. Diese können dem Tier einen Schlaganfall.
- Starten Insulin-Infusion. Nehmen Blutzucker bei 5-10min Intervallen, Überwachung Glukose zu jedem Zeitpunkt. Passen Glukose Infusionsgeschwindigkeit wie erforderlich, bis ein steady state erreicht ist. Dieser Prozess ist in der Regel ein Trial-and-Error-Prozess und kann 30min auf> 2h. Das Niveau der Glukose benötigt, um den Blutzucker zu halten sind abhängig von der experimentellen Protokoll, Arten und Voraussetzungen vorhanden (Abb. 2).
- Steady-State-Glukosewerte sind drei aufeinander folgenden Messungen innerhalb eines definierten Bereiches. Hier wird drei Lesungen innerhalb ~ 1mm als geklemmt (z. B. 4,8, 5,2, 5,6 mm). Sobald Steady State erreicht ist, notieren Sie die Glukose Infusionsrate benötigt, um den Blutzucker für eine 30min Zeitraum aufrecht zu erhalten. Während dieser Zeit zusätzliche Blutproben erhalten werden kann. Zumindest sollte eine zweite Plasmainsulins Probe und Hämatokrit-Probe erhalten werden.
- Sobald Klammer abgeschlossen ist, Tiere für weitere Tests oder eingeschläfert und Gewebe zur weiteren Analyse gesammelt genutzt werden kann. Je nach Tier können Katheter Linien Patent für 5-7 Tage zu bleiben.
D: hyperinsulinämische-euglykämische (Insulin) Clamp Ergebnisse
Wenn richtig ausgeführt, beurteilt der Klemme Verfahren der steady state Insulinempfindlichkeit der Ratte. Bei der Darstellung von Daten aus der Klemme erhalten, ist es wichtig, Glukose und Glukose-Infusion Preise zu dokumentieren. Stabile Blutzuckerspiegel über einen zeitlichen Verlauf von mindestens 30 Minuten (Abbildung 3) sind bezeichnend für einen stabilen Zustand. Glucose wird als stabil angesehen, wenn Vollblut Glucose innerhalb ~ 1mm eingehalten wird. Glucose Infusionsraten zeigen die Pegel von exogenen Glukose benötigt, um den Blutzucker zu halten. Wo möglich, sollten diese Zahlen als einen zeitlichen Verlauf als Einzel-, Mittelwert (Abbildung 4) gezeigt werden.
Weitere empfohlene Maßnahmen zu übermitteln sind, Plasma-Insulin und Hämatokrit. Die Bestimmung sowohl der Nüchtern-geklemmt Insulinspiegel bestätigen, dass Insulin wurde erfolgreich angewendet und wird keine Unterschiede in Ebenen zwischen den Behandlungsgruppen (Abbildung 5) zu erkennen. Beziehen Hämatokrit Maßnahmen zu Beginn und am Ende der Insulin-Clamp vorgeschlagen (Abbildung 6). Damit soll sichergestellt werden Hämatokrit fallen nicht mehr als 5% während des Experiments und die damit einhergehende Veränderungen im Blutvolumen und Flow haben keinen Einfluss auf Glukose zur Verfügung.
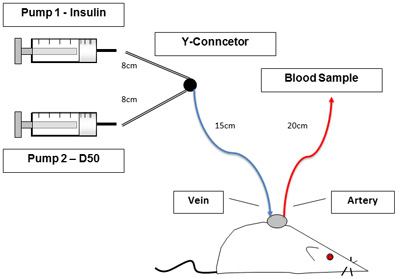
Abbildung 1. Versuchsaufbau. Abbildung 1 zeigt hemmungslos, bewusste Ratte während der Klemme Verfahren. Katheter ermöglichen Blutentnahme und Infusionen ohne Umgang mit dem Tier. Pumps auf der linken Seite enthalten Insulin und Glukose.

Abbildung 2. Erwartete Daten während des Clamp Verfahren. Um eine Klemme an den Ausgangswerten (Normoglykämie, 5mm), die Höhe der exogenen Glucose (D50) manipuliert, bis die Grundlinie oder 'Klammer' erreicht ist.
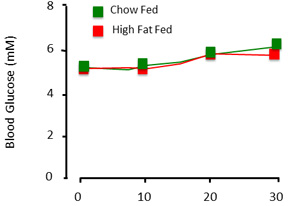
Abbildung 3. Erwartete Plasma-Glukose-Ergebnisse der Klemme Verfahren. Wenn das Tier ist "eingeklemmt" ist Blutzuckerwerte relativ stabil über die Zeit und experimentellen Gruppen.
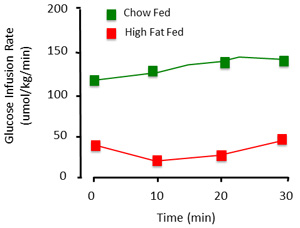
Abbildung 4. Representative Glukose-Infusion Preise der Klemme Verfahren. Die Höhe der exogenen Glucose benötigt, um Normoglykämie halten unterscheidet. Dies ist mit einer Kontrolle (chow zugeführt) und fettreiche zugeführt (Insulinresistenz) Tiere dargestellt. Der hohe Fett zugeführt Tier benötigt weniger Glukose infundiert, um den Blutzucker zu halten, vor allem weil es unempfindlich gegenüber Insulin infundiert wird.
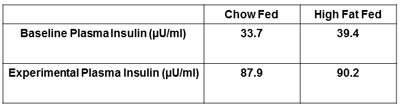
Abbildung 5. Representative Plasmainsulins der Ratte. Die Plasma-Insulin bei der Insulin-Schelle sollte höher sein als die nüchternen, baseline Plasma Insulin. Dadurch wird sichergestellt, Insulin richtig war, das Tier während der Insulin Clamp verwaltet.
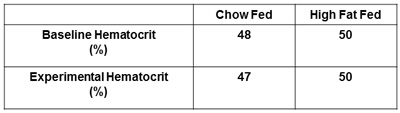
Abbildung 6. Reporting Hämatokrit. Die Baseline-Hämatokrit-und Hämatokrit nach dem Experiment muss erhalten und gemeldet werden. Dadurch wird sichergestellt, Hämatokrit fallen nicht mehr als 5% der Ausgangswerte durch übermäßigen arteriellen Blutentnahme.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Zunächst für die Untersuchung der Insulinsensitivität beim Menschen entwickelt wurde, hat die Klemme Verfahren nun auf andere Tierarten einschließlich Labor Ratten und Mäusen angepasst. Die Untersuchung von Tiermodellen der Insulinresistenz eine bedeutende Hilfe für das Verständnis der Pathophysiologie der Insulinsensitivität und damit verbundene Krankheiten sowie die Identifizierung therapeutischer Interventionen, die klinischen Wert 1,2 haben. Mehrere Methoden zur Insulinsensitivität bei Tieren zu ...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Danksagungen
Diese Studie wurde von der Canadian Institutes of Health Research and Genome Canada.JS unterstützt hat Gehaltszuschüssen Auszeichnungen von der Alberta Heritage Foundationfor Medical Research, Heart and Stroke Foundation von Canadaand der kanadischen Diabetes Association. Besonderer Dank geht an Dr. David Wasserman und Bingle Bracy für die Lehre dieses Verfahren, um die Shearer Labor.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
| Intramedic Polyethylene Tubing (PE-50) | Fisher Scientific | 14 bis 170-12B | Innendurchmesser von 58 mm (0,023 ") x Außendurchmesser von 0,965 mm (0,038") |
| Dow Corning Silastic Laboratory Tubing | Fisher Scientific | 11 bis 189-15C | Innendurchmesser von 0,76 mm (0,030 ") x Außendurchmesser von 1,65 mm (0,065") |
| Tygon S-50-HL Medizinische Schläuche | Harvard Apparatus | PY2 72-1251 | Innendurchmesser von 3,2 mm (0,125 ") x Außendurchmesser von 4,7 mm (0,1875") |
| Loctite Super Glue | Grand & Toy | 32237 | Gel Kontrolle |
| Sterile OP-Klinge | VWR | BD371610 | |
| Curved Micro Präparierklemmen | George Tiemann & Co. | 160-20 | x 2 |
| Gerade Micro Präparierklemmen | George Tiemann & Co. | 160-15 | x 2 |
| Curved Hemostat | George Tiemann & Co. | 105-1135 | x 2 |
| Gerade Hemostat | George Tiemann & Co. | 105-1130 | x 2 |
| Hemostat Tipp Guards | Robbins Instruments, Inc. | 15.09-2-004 | |
| Gerade Chirurgie Scissors | George Tiemann & Co. | 105-402 | |
| VENOJECT Multi-Sample Luer Adapter | Terumo Medical Products | 810127A | 21 Gauge, 1 Zoll |
| Sterile Katheter Introducer | Becton Dickinson | 406999 | |
| 14-Gauge-Nadel-Blunt | Becton Dickinson | 511310 | 14 gauge, 2 in. |
| Steriles chirurgisches Nahtmaterial | Johnson & Johnson Medical Products | 1679H | Silk, Größe 3-0 |
| Non-steriles chirurgisches Nahtmaterial | Angiotech Pharmaceuticals, Inc. | SP116 | Silk, Größe 4-0 |
| Wattestäbchen | VWR | 10806-005 | |
| 4ply Gazekompressen | VWR | CA43845-062 | |
| Small Animal Cordless Clippers | Harvard Apparatus | 729063 | |
| Isofluran | Halocarbon Products Corp | IPN-45 | |
| Betäubungsmittel Warenkorb | Benson Medical Industries, Inc. | ||
| 70% Ethanol | Fisher Scientific | HC-1000 | |
| Betadine antiseptischen Lösung | West-Drug Distribution Centre Ltd | 105267 | |
| Modell 11 Plus Spritzenpumpe | Harvard Apparatus | 702208 | |
| Edelstahlrohre Kupplungen | Harvard Apparatus | 72-4434 | 23 Gauge, 0,3 in. |
| Edelstahlrohre Plugs | Harvard Apparatus | 72-4436 | 23 Gauge, 0,5 Zoll |
| Stainless Steel Blunt Needles | Instech Laboratories, Inc. | LS22 | 22 Gauge |
| 60 Grad Y-Connectors | Kleinteile | STCY-22 bis 05 | 22 Gauge |
| CritSpin Micro-Hämatokrit-Zentrifuge | Iris Sample Processing | CS12 | |
| Mini-Zentrifuge | Fisher Scientific | 05-090-100 | |
| Micro Zentrifugenröhrchen | VWR | 53550-778 | |
| 50ml Polypropylenzentrifugenröhrchen | VWR | 89004-364 | |
| 1ml Plastic Rutsch Tip Spritzen | Becton Dickinson | 309602 | |
| 3ml Plastic Luerlok Tip Spritzen | Becton Dickinson | 309585 | |
| Heparin als Antikoagulans Injection | West-Drug Distribution Centre Ltd | 102824 | Hersteller: LEO Pharma Inc. Conc. 1000 IE |
| EDTA-Lösung | Promega Corp | V4231 | 0,5 M, pH 8,0 |
| Saline | West-Drug Distribution Centre Ltd | ABB7983154 | Hersteller: Hospira 0,9% Natriumchlorid |
| 50% Dextrose | Vetoquinol | 8DEX012D | |
| Humulin-R | Eli Lilly | HALLO-210 | 100U/ml |
| 1ml Insulinspritzen | Becton Dickinson | 309311 | |
| Fisherbrand * Hämato-Seal-Versiegelung | Fisher Scientific | 02-678 | |
| Fisherbrand * Mikrohämatokrit Kapillarröhrchen | Fisher Scientific | 22-362-574 | |
| One Touch Ultra Teststreifen | LifeScan, Inc. | AW 085-314H | |
| One Touch Ultra Blutzuckermessgerät | LifeScan, Inc. | AW 085-314B | |
| Sodium Pentobarbitol | Ceva Sante Animale | 1715 138 | Conc. 54.7mg/ml |
| Red Laboratory Labeling Band | VWR | 89097-932 | |
| Blau Laboratory Labeling Band | VWR | 89097-936 | |
| Waagen | Fisher Scientific | 01-913-88 | |
| Wirbel | VWR | 58815-234 | |
| Timer | VWR | 62344-641 |
Referenzen
- Halseth, A. E., Bracy, D. P., Wasserman, D. H. Limitations to basal and insulin-stimulated skeletal muscle glucose uptake in the high-fat-fed rat. Am J Physiol Endocrinol Metab. 279, E1064-E1071 (2000).
- Halseth, A. E., Bracy, D. P., Wasserman, D. H. Limitations to muscle glucose uptake due to high fat feeding. Am. J. Physiol. 279, E1064-E1071 (2000).
- Muniyappa, R., Lee, S., Chen, H., Quon, M. J. Current approaches for assessing insulin sensitivity and resistance in vivo: advantages, limitations, and appropriate usage. Am J Physiol Endocrinol Metab. 294, 15-26 (2008).
- Cho, H. Insulin resistance and a diabetes mellitus-like syndrome in mice lacking the protein kinase Akt2 (PKB beta). Science. 292, 1728-1731 (2001).
- Dubois, M. J. The SHP-1 protein tyrosine phosphatase negatively modulates glucose homeostasis. Nat Med. 12, 549-556 (2006).
- Pacini, G., Thomaseth, K., Ahren, B. Contribution to glucose tolerance of insulin-independent vs. insulin-dependent mechanisms in mice. Am J Physiol Endocrinol Metab. 281, 693-703 (2001).
- Herbach, N. Dominant-negative effects of a novel mutated Ins2 allele causes early-onset diabetes and severe beta-cell loss in Munich Ins2C95S mutant mice. Diabetes. 56, 1268-1276 (2007).
- Maeda, N. Diet-induced insulin resistance in mice lacking adiponectin/ACRP30. Nat Med. 8, 731-737 (2002).
- Potenza, M. A., Marasciulo, F. L., Tarquinio, M., Quon, M. J., Montagnani, M. Treatment of spontaneously hypertensive rats with rosiglitazone and/or enalapril restores balance between vasodilator and vasoconstrictor actions of insulin with simultaneous improvement in hypertension and insulin resistance. Diabetes. 55, 3594-3603 (2006).
- Ayala, J. E., Bracy, D. P., McGuinness, O. P., Wasserman, D. H. Considerations in the design of hyperinsulinemic-euglycemic clamps in the conscious mouse. Diabetes. 55, 390-397 (2006).
- Wasserman, D. H., Ayala, J. E., McGuinness, O. P. Lost in translation. Diabetes. 58, 1947-1950 (2009).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten