このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
覚醒ラットにおける高インスリン血症、正常血糖クランプ
要約
高インスリン血症、正常血糖クランプは、インスリン作用の評価のための"ゴールドスタンダード"です。インスリンはグルコース取り込みを刺激する一定の速度で注入する。このドロップダウンに対抗するために注入された外因性グルコースの量は、インスリン感受性の指標である。ここで手順は意識、無拘束のラットで実行されます。
要約
2型糖尿病(T2D)が急速に罹患率が高まっています。不十分なインスリンの生産や高血糖のレベルでインスリン生産、T2D結果を利用することができないことのいずれかによって特徴付け。インスリン感受性を評価する"ゴールドスタンダード"は高インスリン血症、正常血糖クランプまたはインスリンクランプです。この手順では、インスリンは血糖値の低下、その結果一定の速度で注入する。一定のレベルで血糖値を維持するために、外因性グルコース(D50)は、静脈循環に注入される。恒常性を維持するために注入されたグルコースの量は、インスリン感受性の指標である。ここで、我々は慢性的にカテーテルを挿入、無拘束、覚醒ラットにおける基本的なクランプの手順を示しています。このモデルでは、血液が動物に最小限のストレスで収集することができます。麻酔の誘導後、正中切開が行われ、左総頸動脈と右頸静脈はカテーテルをされています。挿入されたカテーテルは、体外と確保、ヘパリン生理食塩水でフラッシュされます。動物を毎日監視体重増加で、実験の前に4〜5日で回復されている。手術前のレベルに体重を取り戻すだけの動物が実験に使用されています。実験当日、ラットを絶食させるとインスリンとD50を含むポンプに接続されています。ベースラインのグルコースは、動脈ラインから評価し、実験(血糖値)全体でベンチマークを使用されています。これに続いて、インスリンを静脈循環に一定の速度で注入する。血糖値の低下を一致させるには、D50が注入される。 D50注入速度は、取り込みの速度よりも大きい場合、グルコースの上昇が発生します。同様に、速度が全身のグルコース取り込みを一致させるには不十分な場合、ドロップが発生します。安定した血糖測定値が達成されるまでグルコースの滴定は継続。この安定した期間中の血糖値およびグルコース注入率を記録し、報告されている。結果は、全身のインスリン感受性のインデックスを提供しています。技術は特定の実験的な要件を満たすように改良できます。それは組織特異的インスリン刺激によるグルコース取り込みだけでなく、全身のブドウ糖の代謝回転を決定することができる放射性トレーサーの使用によってさらに強化されています。
プロトコル
:動脈および静脈循環の外科的カテーテル法
パート1:動脈と静脈カテーテルの準備
- PE - 50の15センチカット(0.58ミリメートル(0.023の内径)")0.965ミリメートル(0.038のx外径"。シラスティックチューブの1mmのセクション(0.76ミリメートル(0.030")の内部直径× 1.65ミリメートルをカットビーズの抑制として使用するために(0.065")外径)。差し止めビーズは、それを設置したらカテーテルを引き出してからラットを防ぐことができます。
- 抑制ビーズと優しく広い開口部を伸ばすために離れて鉗子の先端を保持するの内腔にマイクロ切開鉗子の先端を挿入します。ミクロ解剖鉗子の別のペアを使用して、抑制ビーズの内腔にシラスティックチューブをスライドさせます。強力な接着剤の接着剤(ロックタイトスーパー接着剤)で固定します。ビーズは、カテーテルの周りに平ら必要があります。カテーテルが乾燥することができます(24時間)。
- 頸静脈ラインが〜3.2センチメートルている間に300グラムのラットの場合、動脈ラインが抑制ビーズから〜2.7センチメートルです。差し止めからカテーテルの長さは体重の各100グラム増加のために0.5センチメートルによって調整されます。ベベルこの5月の穿刺挿入時に血管のようなカテーテルの端をしないでください。
- 手術の直前に、ヘパリン加生理食塩水(10U/ml)を持つ行を塗りつぶし、ステンレス鋼チューブのプラグおよび滅菌にエタノールの場所(70%)で、両端をシール。空気は、挿入する前に乾燥させます。
パート2:手術の準備
- 手順は、カルガリー動物ケアの大学および使用委員会によって承認され、実験用の実験動物科学のガイドラインについてはtheCanadian協会が遵守された。以下に概説する手順は、成人、雄Sprague - Dawleyラット(〜300グラム)で実施した。それは注射麻酔薬を使用することは可能ですが、すべての手順は、イソフルランの下で実行されています。すべての外科的処置は無菌操作を確実に実行されます。手術用機器、ビーカーやヘパリン生理食塩水は、オートクレーブ滅菌する。手術用手袋、注射器や綿ひっくり返されたアプリケーターは、購入した業者から滅菌されています。
- ラットを秤量し、その結果を記録する。重量は、動物の外科手術後のモニタリングに重要になります。手術前のレベルに体重を取り戻す唯一の動物は、実験に使用する必要があります。麻酔箱にラット(イソフルラン3%)麻酔。ノーズコーンを使って手術中にイソフルラン〜2%で、ラットをしてください。手術は無菌状態を促進する消毒地域で実施されている必要があります。
- 手術部位(首と肩甲骨)から毛を除去することによって動物を準備します。小さなバリカンまたは化学的脱毛剤を使用することができます。手術が実施される場所から別の領域では、この手順を実行します。
- 手術台に動物を固定します。動物の足/眼反射の有無をチェックすることで完全に麻酔であることを確認してください。適切な皮膚の消毒剤(70%エタノール、続いbetadineスクラブに続いて70%エタノール)で外科のサイトを準備します。
パート3:手術
- 胸骨(鉗子と中心軸に沿って長手方向に皮膚をピックアップし、はさみやメスでカット)に小さな垂直正中切開の1センチメートルが優れたものとなっています。
- 左胸鎖乳突筋を公開するために、ミクロ解剖ピンセットを用いて解剖鈍らせる。左頸動脈の約1cmを公開するには、この筋肉を反映している。場所で動脈を保持するために頸動脈の下ミクロ解剖ピンセットを使用してください。ゆっくりと頸動脈からの結合組織を薄くそぐ。動脈や神経のいずれかを損なうことなく、動脈からの迷走神経を分離することが重要です。 4から0絹縫合糸(これは手術中の頸動脈を操作するために使用される)と頭の方に端を連結して動脈を分離します。注:4から0縫合糸は、使用前に70%エタノールで滅菌してください。
- 、ミクロ解剖ピンセットを鋸歯状で血管をクランプする。穿刺21ゲージVENOJECTマルチサンプルルアーアダプターをライゲーション終了。ステンレス鋼チューブのプラグを外し、慎重に動脈にそれを認めざるを滅菌カテーテルイントロデューサーの助けを借りて、カテーテルを挿入する。カテーテルを確保することはピンセットで保護されて、部分的に動脈をクランプミクロ解剖鉗子を解放し、ビーズにカテーテルを挿入し続ける。この時点で、カテーテルの先端が大動脈弓にする必要があります。カテーテルを解放しないように注意して、容器の圧力はそれを強制されます。
- two 4から0以下にしっかりと縫合糸ビーズと上記のものを結ぶと、カテーテルがサンプリングされることを確認してください。 10U/mlヘパリン生理食塩水でラインをフラッシュする。再プラグステンレス鋼チューブのプラグ付きカテーテルの外端。
- 同じ切開を使用して、右外頸静脈を露出するために解剖鈍らせる。慎重に隔離し、絹縫合糸で頭の方に端を連結する。 21ゲージVENOJECTマルチサンプルルアーアダプター付き穿刺静脈。ステンレス鋼チューブのプラグを取り外し、滅菌cを使用してカテーテルを挿入するビード下のビードとネクタイtwo縫合糸にatheterイントロ。ビーズ上記第縫合糸を結ぶと、それはサンプルがいることを確認します。 10U/mLは生理食塩水をヘパリン静脈ラインをフラッシュします。再プラグステンレス鋼チューブのプラグ付き外部カテーテルの端。
- 皮膚の下のトンネルを14ゲージの鈍針をし、肩甲骨の間の後ろに切開を行います。ラットの背面に、それらを体外に出すために針を通してカテーテルを通します。ラインの約4センチメートル表示されます。 、タイゴンS - 50 - HLメディカルチューブの0.5センチメートルを切り取り、必要な(動脈の赤、静脈は青)のようなテープで体外カテーテルおよびセキュリティで保護された両方の周りに置きます。 、開存性を確保するフラッシュし、150U/mlで埋めるために再検査カテーテルは、血液凝固を防ぐために生理食塩水ヘパリン化。
- 3から0絹縫合糸ですべての切開を閉じます。ケージの底部に食物と一緒に予め温めておいた、清潔なケージでは、ラットが発生しやすい置きます。
B:術後ケア
パート1:即時術後ケアとモニタリング
- かつてラットは、完全な歩行能力と覚醒動物のハウジングにラットを返すを取り戻します。
- ラットは3-5日で回復することができます。
- 感染症、疼痛および体重の変化を毎日監視する。切開部位、一般的な嗜眠及び/または痛みからの放電が観測されている場合、感染が懸念される場合があります。痛みは猫背の姿勢、フリルバックの毛皮と外来及び/または摂食行動の不在によって示されます。重量の損失は最大3日後の手術に手術直後に発生する可能性がある、しかし、体重は安定および/または5日以内に術前重量の10%以内に増やす必要があります。重度の体重減少は感染症、脳卒中および/または痛みを示している可能性があります。
- 開存性を確保するために毎日再テストカテーテル。
パート2:維持カテーテルの開存
- 術後回復期間中毎日、150U/mlヘパリン生理食塩水で1ミリリットルスリップチップシリンジを記入し、22ゲージの鈍針でそれをキャップ。鈍針は、もう一方の端に23ゲージのステンレス鋼チューブカプラを使用してPE - 50チューブの20センチメートルに挿入されます。
- 1ミリリットル注射器の残りの部分よりも高いチューブカプラーと端に配置し、ラインの気泡を押し出すことによって、気泡を取り除きます。
- ちょうどプラグ下記の止血とラットから外部動脈ラインをオフにクランプ。
- 止血の2番目のペアを使用して鋼のカテーテルのプラグを取り外します。
- 動脈ラインにシリンジに接続してチューブカプラを挿入し、外部化された動脈カテーテルを閉塞止血を離します。
- シリンジにカテーテルの動脈の血液を吸引除去する。カテーテルが容易に描画されない場合は、それは非常に軽く、それが血管の壁に挟まれている場合にはカテーテルの先端を取り除くために、カテーテルを介してフラッシュ液の少量にプッシュする必要があります。血液が注射器に到達したときにカテーテルが完全にクリアされている。
- 1ミリリットル注射器の近くにPE - 50チューブをクランプしてシリンジを処分。新鮮な150U/mlヘパリン生理食塩水で満たされた新しい注射器と交換してください。チューブをクランプし、垂直に新しい注射器を持って、上向きと離れてラインから任意の可能な新たな気泡を取り除くために指で新しいシリンジをはじく。注:気泡は、脳卒中の原因になりますので注意が確保されなければならない。
- カテーテルのラインがはっきりと血液の自由になるまで、150U/ml heparinzed生理食塩水を注入する。
- ちょうどチューブカプラ下止血でラットから外部動脈ラインをオフにクランプ。動脈カテーテルラインからシリンジのコネクタを取り外し、ステンレス鋼チューブのプラグに交換してください。
- 外部化された動脈カテーテルを閉塞止血を離します。
- 静脈ラインのために繰り返します。しかし、低い静脈圧のサンプリングができないことがよくあります。 150U/ml heparinzed生理食塩水が最小限の抵抗を注入することができる場合には、カテーテルがうまく静脈内に配置している可能性が高いです。
C:高インスリン血症、正常血糖クランプ
パート1:クランプセットアップと準備
- ラットを秤量し、重量を記録する。これは、インスリンとグルコース注入率を決定する必要があります。前の実験に少なくとも5時間のための速いネズミ。これは、動物は、食後の状態にあると食餌療法の源からのグルコースの寄与が最小化されるようにします。過度の運動を制限する寝具付きの小さな容器/ケージにラットを置きます。動物は、向きを変えて自由にグルーミングすることができるはずです。
- 図1に示すように線と輸液ポンプを設定します。 P50の接続チューブの長さは次のとおりです:Yコネクターにシリンジは8cmである、ラットへのYコネクタは15センチメートルである、動脈ラインは20cmです、と静脈ラインの長さは10センチメートルです。ステンレス鋼チューブのプラグを外し、注入および10U/mlヘパリン生理食塩水でそれぞれサンプリングを確実にするために頸静脈と動脈ラインをフラッシュする。
- インスリンを決定するボリュームが必要です。これは、インスリンレベルとラットの体重によって異なります。ここで、4mU/kg/minは2uL/minの速度で投与される。これは、高い生理的用量である。可能であれば、試みは注入量を制限するためになされるべきである。インスリンを適切に希釈してくださいと血漿の存在下で投与すること。生理食塩水で3%のラット血漿のソリューションは、この研究室でインスリンを希釈するために使用されます。インスリンはHumulinR 100U/ml(イーライリリー)であり、他の高速動作型のインスリンを用いることができるが。希釈インスリンが十分に注入シリンジに入れて前に混合されていることを確認します。
- 50%のブドウ糖を準備します。これは、注入ポンプにシリンジ内に直接配置することができます。将来の混乱を避けるために"グルコース"とポンプをマークします。研究のためにインスリンとグルコースの十分な量を確保することを忘れないでください。一般的には最後のクランプ〜2時間。現在のプロトコルでは、3ミリリットル注射器が使用されます。
- ハーバード装置モデル11 Plusのシリンジポンプの上に場所のグルコースとインスリンの注射器。 Y -コネクタと止血鉗子でクランプラインへ事前のグルコース。動物のインスリンを進め、止血剤でラインをクランプする。線をクランプし、ラットが実験を開始する前に30分間リラックスすることができます。注記:止血剤の先端ガードが線の圧着パーマネントを避けるために提案されています。
- プラズマのコレクションのために遠心分離とEDTA -被覆管を準備する。動物がクランプされると、本研究では、追加の血液サンプルが得られる。
パート2:実験プロトコール
- ベースラインのインスリンのサンプルおよびヘマトクリット値のサンプルを取得しておく必要があります。ヘマトクリットサンプリングは、血液量が実験全体を通して維持されることを保証します。一般的に、ヘマトクリットレベルは初期値の10%以上の低下ではない。
- ベースラインのグルコースのサンプルを入手する(ワンタッチウルトラ、LifeScan、株式会社)とクランプする全血中グルコースレベルを決定します。ここでは、正常血糖値にクランプ、または5.0 - 5.5mmの( 図2)。各血液サンプルの後、凝固を防ぐために生理食塩水ヘパリン10U/mlの小さなボリュームで動脈ラインをフラッシュする。注:は血栓や気泡が前に注入するために並んでいないことを確認してください。これらは動物のストロークを与えることができます。
- インスリンの注入を開始します。各時点でのブドウ糖を監視し、5 - 10分間隔で血糖値を取る。定常状態が達成されるまで、必要に応じてブドウ糖の注入速度を調整します。このプロセスは、一般的に、試行錯誤のプロセスであると> 2hに30分かかることがあります。血糖を維持するために必要なグルコースのレベルは、現在の実験プロトコル、種及び条件( 図2)に依存しています。
- 定常状態の血糖値は、定義された範囲内の3つの連続した測定値です。ここで、〜1mMの内の3つの測定値(例えば4.8、5.2、5.6mM)クランプとみなされます。定常状態が達成されると、30分間にわたって血糖を維持するために必要なグルコース注入率を記録。この時間の間に追加の血液サンプルが得られる。最低でも、第2のプラズマインスリンのサンプルおよびヘマトクリット値のサンプルを入手する必要があります。
- クランプが完了すると、動物は、さらなる分析のために収集、さらにテストまたは安楽死させ、組織のために使用することができます。動物によっては、カテーテルのラインは5-7日間の特許を滞在することができます。
D:高インスリン血症、正常血糖(インスリン)クランプ結果
正しく実行するときに、クランプの手順では、ラットの定常状態のインスリン感受性を評価する。クランプから取得したデータを提示するには、血糖値とブドウ糖の注入速度を文書化することが不可欠です。 30分の最小値( 図3)の時間の経過とともに安定した血糖値は、定常状態の指標となる。全血のグルコースが〜1mm以内に維持されている場合にのみ、グルコースが安定したと見なされます。グルコース注入率は、血糖を維持するために必要な外因性グルコースのレベルを示しています。可能であれば、これらの数値は時間経過ではなく、単一の、平均値(図4)として表示されていなければなりません。
報告されるその他の推奨策は、血漿インスリンおよびヘマトクリット値です。両方の空腹時の測定とそのインスリンを確認インスリンレベルをクランプが正常に投与されていると治療群(図5)の間のレベルの違いを検出します。ベースライン時とインスリンクランプの終了時にヘマトクリット値の措置を得ることが(図6)提案されている。これは、ヘマトクリット値は、実験中に5%以上に該当しないと血液量と流量に伴う変化は、グルコースの処理に影響しないようにすることです。
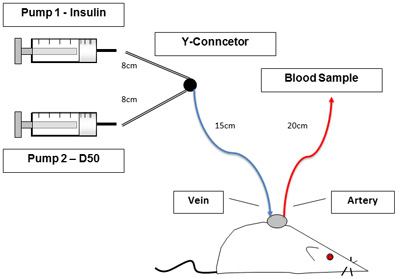
図1。セットアップ実験。図1は、クランプの手順の間無制限な、覚醒ラットを示しています。カテーテルは、動物を扱うことなく、採血と注入を可能にする。左のポンプは、インスリンとブドウ糖が含まれています。

図2は、。クランプ手順の実行中にデータが期待される。ベースラインまたは"クランプ"が達成されるまでベースラインのレベルでクランプ(血糖値、5mMの)を取得するには、外因性グルコース(D50)のレベルが操作されます。
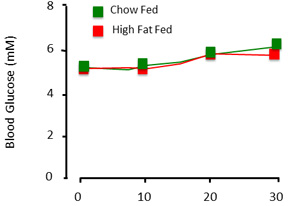
図3は、。クランプ手続きの血漿グルコースの結果を期待される。動物が"クランプ"の場合、血糖値は、時間と実験グループ間で比較的安定している。
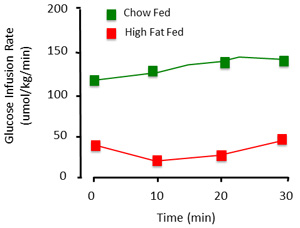
図4。クランプの手続きの代表的なグルコース注入率。正常血糖を維持するために必要な外因性グルコースの量は異なります。これは、コントロール(チャウ供給)と高脂肪飼料(インスリン抵抗性)の動物で示されています。高脂肪飼料の動物は、注入インスリンに対して非感受性であるため、主に、血糖を維持するために注入された以下のグルコースを必要とします。
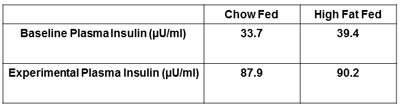
図5。ラットの代表血漿インスリン。インスリンクランプ時の血漿インスリンは絶食、ベースライン血漿インスリンよりも高くする必要があります。これは、インスリンが適切にインスリンクランプ中に動物に投与された保証。
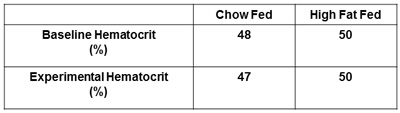
図6。ヘマトクリット値をレポート。実験は、次のベースラインのヘマトクリット値とヘマトクリット値が得られ、報告する必要があります。これは、ヘマトクリット値が過剰な動脈採血に起因するベースラインのレベルの5%以上に該当しないようにします。
ディスカッション
最初にヒトのインスリン感受性の調査のために開発、クランプの手順は、現在、実験用ラットやマウスなど他の種に適応されています。インスリン抵抗性の調査を動物モデルでは、インスリン感受性と関連する病理の病態生理を理解するだけでなく、臨床的価値の1,2を持っている治 療的介入を特定するのに重要な援助を提供します。動物のインスリン感受性を評価するいくつか?...
開示事項
謝辞
この研究は、ヘルスリサーチおよびゲノムCanada.JSのカナダの協会によってサポートされていたがアルバータ遺産Foundationfor医学研究、心臓とCanadaandの脳卒中財団カナダ糖尿病協会から給与を支援賞を保持しています。シアラーの実験室には、この手順を教えるデビッドワッサーマンと氷楽Bracyに感謝。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
| Intramedicポリエチレンチューブ(PE - 50) | フィッシャーサイエンティフィック | 14から170 - 12B | 0.58ミリメートル(0.023")0.965ミリメートルのX外径(0.038")の内径 |
| ダウコーニングシラスティックラボチューブ | フィッシャーサイエンティフィック | 11から189 - 15C | 0.76ミリメートル(0.030")の内部直径1.65ミリメートルのX外径(0.065") |
| タイゴンS - 50 - HLメディカルチューブ | ハーバード装置 | PY2 72から1251 | 3.2ミリメートルの内径(0.125")4.7ミリメートルのX外径(0.1875") |
| ロックタイトスーパー接着剤 | グランド&玩具 | 32237 | ゲルコントロール |
| 無菌手術ブレード | VWR | BD371610 | |
| 湾曲したマイクロ解剖鉗子 | ジョージティーマンアンドカンパニー | 160から20 | × 2 |
| ストレートマイクロ解剖鉗子 | ジョージティーマンアンドカンパニー | 160から15 | × 2 |
| 湾曲した止血剤 | ジョージティーマンアンドカンパニー | 105-1135 | × 2 |
| ストレート止血剤 | ジョージティーマンアンドカンパニー | 105-1130 | × 2 |
| 止血鉗子の先端ガード | ロビンスインスツルメンツ株式会社 | 15.09-2-004 | |
| ストレート外科用はさみ | ジョージティーマンアンドカンパニー | 105から402 | |
| VENOJECTマルチサンプルルアーアダプター | テルモメディカルプロダクツ | 810127A | 21ゲージ、1インチ |
| 滅菌カテーテルイントロデューサー | ベクトンディッキンソン | 406999 | |
| 14ゲージのブラントニードル | ベクトンディッキンソン | 511310 | 14ゲージ、2インチ |
| 滅菌縫合糸 | ジョンソン&ジョンソンメディカルプロダクツ | 1679H | シルク、サイズ3〜0 |
| 非滅菌外科用縫合糸 | アンジオテックファーマシューティカルズ | SP116 | シルク、サイズ4から0 |
| 綿棒 | VWR | 10806-005 | |
| 4plyガーゼパッド | VWR | CA43845 - 062 | |
| 小動物コードレスクリッパーズ | ハーバード装置 | 729063 | |
| イソフルレン | ハロカーボン製品株式会社 | IPN - 45 | |
| 麻酔カート | ベンソン医療産業、(株) | ||
| 70%エタノール | フィッシャーサイエンティフィック | HC - 1000 | |
| Betadineの消毒液 | 西洋医薬品流通センター株式会社 | 105267 | |
| モデル11 Plusのシリンジポンプ | ハーバード装置 | 702208 | |
| ステンレス鋼チューブカプラ | ハーバード装置 | 72から4434 | 23ゲージ、インチ0.3 |
| ステンレス鋼チューブのプラグ | ハーバード装置 | 72から4436 | 23ゲージ、0.5インチ |
| ステンレス鋼ブラント針 | インステックラボラトリーズ、(株) | LS22 | 22ゲージ |
| 60 ° Y -コネクタ | スモールパーツ | STCY - 22から05 | 22ゲージ |
| CritSpinマイクロヘマトクリット遠心機 | アイリスのサンプル処理 | CS12 | |
| ミニ遠心機 | フィッシャーサイエンティフィック | 05-090-100 | |
| マイクロ遠心チューブ | VWR | 53550-778 | |
| 50ミリリットルポリプロピレン遠心チューブ | VWR | 89004-364 | |
| 1ミリリットルプラスチックスリップのヒントシリンジ | ベクトンディッキンソン | 309602 | |
| 3ミリリットルプラスチックLuerlokヒントシリンジ | ベクトンディッキンソン | 309585 | |
| ヘパリン抗凝固剤の注入 | 西洋医薬品流通センター株式会社 | 102824 | メーカー:LEO製薬株式会社コンク。 1000 IU |
| EDTA溶液 | プロメガ株式会社 | V4231 | 0.5 M、pH8.0の |
| 生理食塩水 | 西洋医薬品流通センター株式会社 | ABB7983154 | メーカー:ホスピーラ0.9%塩化ナトリウム |
| 50%のブドウ糖 | Vetoquinol | 8DEX012D | |
| ヒューマリン- R | イーライリリー | HI - 210 | 100U/ml |
| 1ミリリットルインスリン用注射筒 | ベクトンディッキンソン | 309311 | |
| Fisherbrand * Hematoシールシーラント | フィッシャーサイエンティフィック | 02から678 | |
| Fisherbrand * Microhematocritキャピラリーチューブ | フィッシャーサイエンティフィック | 22-362-574 | |
| ワンタッチウルトラテストストリップ | LifeScan、(株) | AW 085 - 314H | |
| ワンタッチウルトラ血糖測定器 | LifeScan、(株) | AW 085 - 314B | |
| Pentobarbitolナトリウム | チェバサンテAnimale | 1715 138 | コンク。 54.7mg/ml |
| レッド研究所ラベリングテープ | VWR | 89097-932 | |
| 青い研究所ラベリングテープ | VWR | 89097-936 | |
| 計量器 | フィッシャーサイエンティフィック | 01-913-88 | |
| 渦 | VWR | 58815-234 | |
| タイマー | VWR | 62344-641 |
参考文献
- Halseth, A. E., Bracy, D. P., Wasserman, D. H. Limitations to basal and insulin-stimulated skeletal muscle glucose uptake in the high-fat-fed rat. Am J Physiol Endocrinol Metab. 279, E1064-E1071 (2000).
- Halseth, A. E., Bracy, D. P., Wasserman, D. H. Limitations to muscle glucose uptake due to high fat feeding. Am. J. Physiol. 279, E1064-E1071 (2000).
- Muniyappa, R., Lee, S., Chen, H., Quon, M. J. Current approaches for assessing insulin sensitivity and resistance in vivo: advantages, limitations, and appropriate usage. Am J Physiol Endocrinol Metab. 294, 15-26 (2008).
- Cho, H. Insulin resistance and a diabetes mellitus-like syndrome in mice lacking the protein kinase Akt2 (PKB beta). Science. 292, 1728-1731 (2001).
- Dubois, M. J. The SHP-1 protein tyrosine phosphatase negatively modulates glucose homeostasis. Nat Med. 12, 549-556 (2006).
- Pacini, G., Thomaseth, K., Ahren, B. Contribution to glucose tolerance of insulin-independent vs. insulin-dependent mechanisms in mice. Am J Physiol Endocrinol Metab. 281, 693-703 (2001).
- Herbach, N. Dominant-negative effects of a novel mutated Ins2 allele causes early-onset diabetes and severe beta-cell loss in Munich Ins2C95S mutant mice. Diabetes. 56, 1268-1276 (2007).
- Maeda, N. Diet-induced insulin resistance in mice lacking adiponectin/ACRP30. Nat Med. 8, 731-737 (2002).
- Potenza, M. A., Marasciulo, F. L., Tarquinio, M., Quon, M. J., Montagnani, M. Treatment of spontaneously hypertensive rats with rosiglitazone and/or enalapril restores balance between vasodilator and vasoconstrictor actions of insulin with simultaneous improvement in hypertension and insulin resistance. Diabetes. 55, 3594-3603 (2006).
- Ayala, J. E., Bracy, D. P., McGuinness, O. P., Wasserman, D. H. Considerations in the design of hyperinsulinemic-euglycemic clamps in the conscious mouse. Diabetes. 55, 390-397 (2006).
- Wasserman, D. H., Ayala, J. E., McGuinness, O. P. Lost in translation. Diabetes. 58, 1947-1950 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved