JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
의식 랫에서 인슈린 과다 - Euglycemic 클램프
요약
인슈린 과다 - euglycemic 클램프은 인슐린 작용의 평가에 대한 "황금 표준"입니다. 인슐린은 포도당의 이해를 자극 일정한 속도로 주입합니다. 이 드롭에 대응하기 위해 주입 외인성 포도당의 양은 인슐린 감도 나타내는 것입니다. 여기 절차는 의식, 억제 쥐에서 수행됩니다.
초록
2 형 당뇨병 (T2D)는 빠르게 유행에 증가합니다. 불충 분한 인슐린 생산 또는 고가 혈당 수준에서 인슐린 생산 T2D 결과를 활용하는 무능력에 의해 특징. 인슐린 민감도를 평가의 "금 표준"은 인슈린 과다 - euglycemic 클램프 또는 인슐린 클램프입니다. 이 절차에서는 인슐린은 혈당의 드롭 결과 일정한 속도로 주입합니다. 일정한 수준의 혈당을 유지하려면, 외인성 포도당 (D50)은 정맥 순환에 주입합니다. 항상성을 유지하기 위해 주입 포도당의 양은 인슐린 감도 나타내는 것입니다. 여기서 우리는 만성 catheterized, 억제, 의식 쥐의 기본 클램프 절차를 보여줍니다. 이 모델은 혈액이 동물에게 최소한의 스트레스와 회수 수 있습니다. 마취의 유도에 따라, 정중선 절개가 만들어이며 왼쪽 일반 경동맥과 경정맥 정맥은 오른쪽 catheterized 있습니다. 삽입된 카테터는 다음 exteriorized 및 보안, heparinized 식염수에 플러시됩니다. 동물은 체중 증가가 매일 모니터링과 사전 실험 4-5일에 대한 복구하는 허용됩니다. 사전 수술 수준에 체중을 회복만이 이러한 동물 실험에 사용됩니다. 실험의 날, 쥐가은 금식하고 인슐린과 D50을 포함하는 펌프에 연결되어 있습니다. 베이스 라인 포도당은 동맥 라인에서 평가 및 실험 (euglycemia)에 걸쳐 벤치 마크를 사용합니다. 이 다음, 인슐린은 정맥 순환에 일정한 속도로 주입합니다. 혈당의 드롭을 일치시키려면, D50이 들어갈 수 있습니다. D50 주입의 속도는 이해의 속도보다 큰 경우, 포도당의 증가가 발생합니다. 마찬가지로, 속도는 온 몸이 포도당 이해에 맞게 부족한 경우, 드롭 발생합니다. 안정적인 혈당 수치를 얻을 때까지 포도당의 적정가 계속됩니다. 이 기간 동안 안정적인 포도당 수준 및 포도당 주입 속도는 기록하고보고됩니다. 결과는 온 몸이 인슐린 민감도의 인덱스를 제공합니다. 이 기술은 특정 실험 요구 사항을 충족시킬 수 정제된 수 있습니다. 그것은 조직을 특정 인슐린 자극 포도당 이해뿐만 아니라 몸 전체의 포도당 회전율을 확인할 수 있습니다 방사성 추적기를 사용하여 좀 더 향상됩니다.
프로토콜
A : 아티와 정맥 순환 외과 Catheterization
1 부 : 아티와 정맥 카테 테르 준비
- 의 15cm를 잘라 PE - 50 (0.58 mm의 내경 (0.023 ") X 0.965 mm (0.038의 외경"). silastic 튜브의 1mm 섹션 (내부 직경은 1.65mm X 0.76mm를 (0.030 ") 컷 비드 금지로 사용하기 위해 (0.065 ") 외경). 금지 구슬은 장소에 한번 카테터를 당기는 쥐를 방지할 수 있습니다.
- 금지 비드의 루멘에 마이크로 해부 포셉의 도움말을 넣고 부드럽게 자리가 넓은 스트레칭 분리 포셉의 끝을 잡고. 마이크로 해부 포셉의 다른 쌍을 사용하여 억제 비드의 루멘에 silastic 튜빙을 슬라이드. 강력한 접착제 접착제 (Loctite 슈퍼 접착제)로 고정합니다. 구슬은 카테터 주위에 평평하게 누워 있어야합니다. 카테터가 건조하도록 허용 (24).
- 300g 랫은 동맥 라인 경정맥 라인 ~ 3.2cm되는 동안 억제 비드에서 ~ 2.7cm이다. 금지의 카테 테르의 길이는 체중의 모든 100g 증가 0.5cm로 조정됩니다. 베벨이 수의 주사 삽입 동안 그릇으로 카테터의 가장자리를하지 마십시오.
- 수술 즉시 이전, heparinized 호수 (10U/ml)로 라인을 채우기, 스테인레스 스틸 튜브 플러그 및 소독에 에탄올의 장소 (70 %)로 양쪽을 밀봉합니다. 에어 전에 삽입을 건조.
2 부 : 외과 준비
- 절차는 캘거리 애니멀 케어 대학 승인 및위원회를 사용하여 실험을위한 실험실 동물 과학 지침 theCanadian 협회가 준수했다. 아래에 설명된 절차는 성인 남성 스프 라그 - 돌리 쥐 (~ 300g)에서 수행되었다. 그것이 주사용 anesthetics을 사용할 수 있지만 모든 절차는 isoflurane에 따라 수행됩니다. 모든 수술 절차는 무균 기술을 확보 수행됩니다. 수술 장비, 비커와 heparinized 호수는 압력솥 소독하고 있습니다. 수술 장갑, 주사기 및 면화 밀고 applicators는 구입 업체로부터 소독을하고 있습니다.
- 쥐 무게와 그 결과를 기록합니다. 무게는 동물의 사후 수술 모니터링에서 중요한 것입니다. 사전 수술 수준에 체중을 회복만이 동물 실험에 사용해야합니다. 마취 상자에 쥐 (isoflurane 3 %) 마취. 코 콘을 사용하여 수술 중에 isoflurane 2% ~에서 쥐를 보관하십시오. 수술은 무균을 촉진 소독 지역에서 실시해야합니다.
- 외과 사이트 (목과 어깨 블레이드)에서 머리를 제거하여 동물을 준비합니다. 작은 머리 깎기 또는 화학 depilatory 사용할 수 있습니다. 수술 실시하는 곳에서 별도의 영역에서이 절차를 수행합니다.
- 수술 테이블에 동물을 고정합니다. 동물 발 / 안구 반사의 존재를 확인하여 완전히 anesthetized 있는지 확인하십시오. 적절한 피부 소독제 (70 % 에탄올이 70 % 에탄올 다음 betadine 스크럽 다음)와 외과 사이트를 준비합니다.
파트 3 : 수술
- 흉골 (포셉와 중간 축을 따라 길이 방향 피부를 들고 가위 또는 메스로 절단) 작은 수직 정중선 절개의 1cm가 우수합니다.
- 왼쪽 sternomastoid 근육을 폭로 마이크로 해부 집게를 사용하여 절개하다 블런트. 왼쪽 경동맥의 약 1cm 노출이 근육을 반영합니다. 장소에 동맥을 가질 경동맥에 따라 미세 해부 집게를 사용하십시오. 부드럽게 경동맥의 결합 조직을 애타게. 동맥이나 신경 중 하나를 손상하지 않고 동맥에서 미주 신경을 분리하는 것이 중요합니다. 4-0 실크 봉합사 (이것은 수술하는 동안 경동맥을 조작하는 데 사용됩니다)와 cephalad 끝을 ligate 후 동맥을 분리. 참고 : 4-0 봉합은 사용하기 전에 70 % 에탄올로 소독해야합니다.
- 마이크로가 포셉을 해부하고, 톱니와 함선을 클램프. 21 게이지 VENOJECT 멀티 샘플 Luer 어댑터와 함께 찔린 출혈도 잡았 끝. 스테인레스 스틸 튜브 플러그를 제거하고 조심스럽게 동맥으로 인정하기 멸균 카테터의 introducer의 도움을 카테터를 삽입합니다. 카테 테르를 보장하는 집게와 안전, 부분적으로 동맥을 클램핑 마이크로 해부 포셉을 해제하고 비드에 카테터를 삽입을 계속합니다. 이 시점에서, 카테터의 끝이 대동맥 아치에 있어야합니다. 카테 테르를 공개하지 돌보고, 선박의 압력이 그것을 강제합니다.
- 이 4-0 안전하게 아래 구슬 봉합 이상 하나를 묶어하고 카테 테르는 샘플 것을 확인합니다. 10U/ml heparinized 식염수에 뚫어. 스테인레스 스틸 튜브 플러그와 카테터의 다시 연결하면 외부 끝.
- 같은 절개를 사용하여, 오른쪽 외부 경정맥 정맥을 폭로 해부하다 퉁명스러운. 신중하게 격리하고 실크 봉합사로 cephalad 끝을 ligate. 21 게이지 VENOJECT 멀티 샘플 Luer 어댑터와 함께 찔린 정맥. 스테인레스 스틸 튜브 플러그를 제거하고 살균 C와 카테터를 삽입비드 아래 비드와 넥타이이 봉합에 atheter의 introducer. 비드 위 삼분의 일 봉합을 묶어하고 샘플 그것을 확인합니다. 10U/mL가 호수 heparinized 정맥 라인 플러쉬. 스테인레스 스틸 튜브 플러그를 다시 연결하면 외부 카테터 끝.
- 터널 14 게이지 무딘 피부 밑에 바늘과 양어깨 사이 뒤쪽에 절개를합니다. 암흑의 뒷면에 그들을 외면 화하다에 바늘을 통해 카테터를 스레드. 라인의 약 4cm가 표시됩니다. Tygon S - 50 - HL 의료 튜브의 0.5cm를 잘라 exteriorized 카테터 모두 주위를 장소와 필요 (정맥 블루 동맥에 대한 적색)으로 테이프로 고정하십시오. , 명백을 보장 플러시하고 150U/ml와 채우기 위해 다시 테스트 카테터이 응고 방지하기 위해 염분 heparinized.
- 3-0 실크 봉합사 모든 incisions를 닫습니다. 새장 바닥에 음식과 함께 미리 예열, 깨끗한 새장에 발생하기 쉬운 장소 쥐.
B : 수술후 관리
1 부 : 즉각적인 수술 후 관리 및 모니터링
- 일단 생쥐가 전체 외래 능력과 경보 동물 주택에 쥐를 반환을 차릴.
- 쥐가 3~5일에 대한 복구를 허용합니다.
- 감염, 통증, 체중의 변화에 대해 매일 모니터링합니다. 절개 사이트, 일반 혼수 및 / 또는 고통에서 분비물이 관찰하는 경우에는 감염이 우려 수 있습니다. 고통은 hunched 자세, 쓸 백 모피 및 외래 및 / 또는 먹는 행위 부재로 표시됩니다. 무게 손실은 최대 삼일 수술로 수술 직후 경험이있을 수 있습니다, 그러나, 무게 안정화 및 / 또는 5 일 이내에 미리 수술 무게의 10 % 이내로 증가한다. 심한 체중 감소는 감염, 뇌졸중 및 / 또는 통증을 나타낼 수 있습니다.
- 명백을 보장하기 위해 매일 다시 테스트 카테터.
2 부 : 유지 카테 테르의 명백
- 수술 회복 기간 동안 매일, 150U/ml heparinized 식염수에 1ml 슬립 팁 주사기를 작성하여 22 게이지 바늘로 뭉툭한 그것을 모자. 무딘 바늘은 다른 끝에 23 게이지 스테인레스 스틸 튜브의 커플러와 PE - 50 튜브의 20cm에 삽입됩니다.
- 1ml 주사기의 나머지 부분보다 높은 튜브의 커플러와 끝부분을 배치하고 라인의 거품을 밀어 기포를 제거합니다.
- 그냥 플러그 아래 hemostats와 쥐에서 externalized 동맥 라인을 고정.
- hemostats의 두 번째 쌍의를 사용하여 철강 카테 테르 플러그를 제거합니다.
- 동맥 선에 주사기에 연결된 튜브의 커플러를 삽입하고 externalized 동맥 카테터를 occluding hemostats를 놓습니다.
- 주사기에 카테터의 동맥혈을 대기음. 카테터 쉽게 그려하지 않는 경우 아주 부드럽게 그것이 혈관 벽에 끼어 경우에는 카테터의 팁을 이동시키다하는 카테터를 통해 물을 솔루션의 소량에 푸시해야 할 수도 있습니다. 혈액이 주사기에 도달하면 카테 테르는 완전히 삭제되었습니다.
- PE - 50 튜브 가까이 1ml 주사기로 고정하고 주사기 폐기. 신선한 150U/ml heparinized 호수 가득한 새로운 주사기로 바꿉니다. 튜빙을 Unclamp하고 새 주사기를 들고 것은 직립, 이상과 멀리 떨어진 라인에서 모든 가능한 새로운 기포를 이동시키다하는 손가락으로 새로운 주사기 버려. 참고 : 공기 방울이 뇌졸중을 일으킬 수 있으므로 관리가 보장되어야합니다.
- 카테 테르 라인이 명확하고 피를 무료 때까지 150U/ml heparinzed 호수 주사.
- 그냥 튜브의 커플러 아래 hemostats와 쥐에서 externalized 동맥 라인을 고정. 동맥 카테 테르 라인에서 주사기 커넥터를 제거하고 스테인레스 스틸 튜빙 플러그로 교체하십시오.
- externalized 동맥 카테터를 occluding hemostats를 놓습니다.
- 정맥 라인 반복합니다. 그러나, 때문에 낮은 정맥 압력 샘플링은 종종 불가능합니다. 150U/ml heparinzed 호수가 최소한의 저항과 함께 들어갈 수 있으면 그것은 카테 테르가 잘 정맥의 위치는 가능성이있다.
C : 인슈린 과다 - Euglycemic 클램프
1 부 : 클램프 설정 및 준비
- 쥐 무게와 무게를 기록합니다. 이것은 인슐린과 포도당 주입 속도를 결정하기 위해 필요합니다. 이전 실험 최소한 5h에 대한 빠른 쥐. 이것은 동물이 식후 상태 확인하고식이 소스에서 포도당의 공헌이 최소화됩니다. 과도한 운동을 제한 침구와 작은 용기 / 케이지에 쥐를 놓습니다. 동물 돌아서 자유롭게 신랑 수 있습니다.
- 그림 1에서 볼 라인과 주입 펌프를 설정합니다. P50 연결 튜브의 길이는 다음과 같습니다 : Y 커넥터에 주사기는 8cm이고, 배반 Y 커넥터는 15cm이며, 동맥 라인은 20cm이며, 정맥 라인의 길이는 10cm입니다. 스테인레스 스틸 튜브 플러그를 제거하고 주입을 보장하고 10U/ml heparinized 식염수에 각각 샘플링하기 위해 경정맥과 동맥 라인을 플러시.
- 인슐린 결정 볼륨이 필요합니다. 이것은 인슐린 수준과 암흑의 무게에 따라 달라집니다. 여기 4mU/kg/min는 2uL/min의 속도로 관리합니다. 이것은 높은 생리 복용량이다. 어디 가능한 시도가 주입 볼륨을 제한하여야한다. 인슐린이 적절하게 희석되어야하며 플라즈마의 면전에서 관리합니다. 생리의 3 % 쥐 플라즈마 솔루션이 실험실에서 인슐린을 희석하는 데 사용됩니다. 인슐린은 HumulinR 100U/ml (일라이 릴리)입니다, 다른 빠른 행동의 인슐린은 고용 수 있지만. 희석 인슐린 전에 주입 주사기에 넣어에 잘 혼합한지 확인하십시오.
- 50 %의 덱스 트로 오스를 준비합니다. 이것은 주입 펌프에 주사기에 직접 삽입할 수 있습니다. 미래의 혼동을 피하기 위해 '포도당'으로 펌프를 표시합니다. 인슐린과 포도당의 학습을위한 충분한 볼륨을 보장하기 위해 기억하십시오. 클램프 일반적으로 마지막 ~ 2 시간. 현재 프로토콜, 3ml 주사기를 사용합니다.
- 하버드 장치 모델 11 플러스 주사기 펌프에 플레이스 포도당 및 인슐린 주사기. Y - 커넥터와 hemostat와 클램프 라인에 사전 포도당. 동물 사전 인슐린은 hemostat와 라인을 클램프. 대사를 클램프하고 쥐가 실험을 시작하기 전에 30 분위한 휴식하실 수 있습니다. 참고 : Hemostat 팁 간수가 라인 crimping 영구를 방지하기 위해 제안합니다.
- 플라즈마 수집 원심 분리기 및 EDTA (에틸렌 다이아 민 테트라 초산) - 코팅 튜브를 준비합니다. 동물 고정되어되면 현재의 연구에서는 추가적인 혈액 샘플을 얻을 것입니다.
2 부 : 실험 프로토콜
- 베이스 라인 인슐린 샘플 및 혈소판 샘플 취득해야합니다. 혈소판 샘플링 혈액 볼륨이 실험을하는 동안 유지됩니다 보장합니다. 일반적으로, 혈소판 수치가 초기 값 이상 10 % 가을 안됩니다.
- 베이스 라인 포도당 샘플을 구합니다 (원터치 울트라, LifeScan 주식 회사)와 고정되어으로 전체 혈당 수준을 결정합니다. 여기, 우리는 euglycemia에 클램프, 또는 5.0 - 5.5mM (그림 2). 각 혈액 샘플 후 응고 방지하기 위해 염분 heparinized 10U/ml의 작은 볼륨 동맥 뚫어. 참고 : 혈전이나 공기 방울 이전 일으키는하기 위해 라인에 있는지 확인하지 않습니다. 이것은 동물에게 스트로크를 줄 수 있습니다.
- 인슐린 주입을 시작합니다. 각 시점에서 혈당을 모니터링, 5 10 분 간격으로 혈당을 가져가라. 안정된 상태를 얻을 때까지 필요한 포도당 주입 속도를 조정합니다. 이 과정은 일반적으로 시행 착오 과정이고> 2 시간에 30 분 걸릴 수 있습니다. glycemia을 유지하는 데 필요한 포도당의 수준은 현재 실험 프로토콜 종류 및 조건 (그림 2)에 의존하고 있습니다.
- 스테디 상태 포도당 수치가 정의된 범위 내에서 세번이나 수치입니다. 여기 ~ 1mM 안에 3 신호 (예 : 4.8, 5.2, 5.6mM) 채워 간주됩니다. 정상 상태가 달성되면 30 분 동안 glycemia을 유지하기 위해 필요한 포도당 주입 속도를 기록합니다. 이 시간 동안 추가 혈액 샘플을 얻을 수 있습니다. 최소한 두 번째 플라즈마 인슐린 샘플 및 혈소판 샘플 획득해야합니다.
- 일단 클램프는 동물 자세한 분석을 위해 수집 자세한 테스트 또는 euthanized 및 조직에 사용될 수 있습니다, 완료됩니다. 동물에 따라 카테 테르 라인는 5-7 일 동안 특허를 유지하실 수 있습니다.
D : 인슈린 과다 - Euglycemic (인슐린) 클램프 결과
제대로 수행되면, 클램프 절차는 암흑의 안정 상태의 인슐린 민감도를 평가합니다. 클램프에서 얻은 데이터를 발표에서는 포도당 수준 및 포도당 주입 속도를 문서화하는 것이 필수적입니다. 30 분 최소 (그림 3)의 시간 과정을 통해 안정적인 포도당 수치가 안정 상태 나타내는 있습니다. 전체 혈당이 ~ 1mM 내에 유지하는 경우에만 혈당이 안정적으로 간주됩니다. 포도당 주입 속도는 glycemia을 유지하는 데 필요한 외인성 포도당의 수준을 보여줍니다. 가능하다면,이 수치는 오히려 하나의 평균 값 (그림 4)보다 시간 코스로 표시되어야합니다.
보고 기타 권장 조치 플라즈마 인슐린 및 혈소판 수 있습니다. 모두 금식 결정하고 인슐린 확인 인슐린 수준을 채워이 성공적으로 시행되었으며 치료 그룹 (그림 5) 사이의 수준에 차이를 감지합니다. 기준에서, 인슐린 클램프의 결론에서 구하기 혈소판의 조치는 (그림 6) 제안입니다. 이것은 혈소판 수치가 포도당 처리에 영향을하지 혈액 볼륨과 흐름의 실험과 함께 변경하는 동안 이상이 5 %를 빠지지 않도록하는 것입니다.
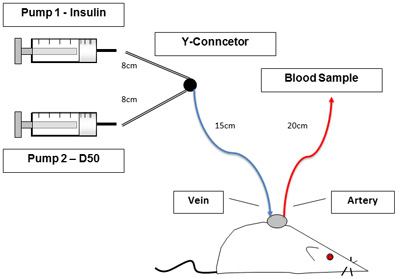
그림 1. 설정 실험. 그림 1은 클램프 절차 동안 억제, 의식 쥐를 보여줍니다. 카테터는 동물을 취급하지 않고 혈액 샘플링과 혼합을 허용합니다. 왼쪽에있는 펌프는 인슐린과 포도당이 포함되어 있습니다.

그림 2. 클램프 절차를 수행하는 동안 데이터를 예상. 기준 또는 '클램프'이 달성 때까지 기본 수준에서 클램프 (euglycemia, 5mM)를 얻으려면, 외인성 포도당 (D50)의 수준을 조작하고 있습니다.
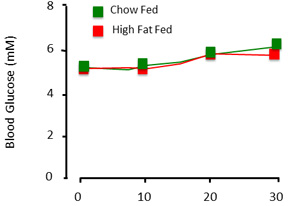
그림 3. 클램프 절차의 플라즈마 혈당 결과를 예상. 동물 '고정되어'때, 혈당은 시간과 실험 그룹간에 상대적으로 안정됩니다.
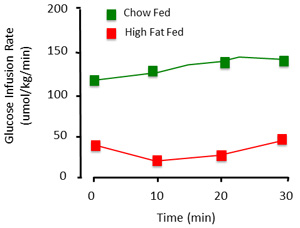
그림 4. 클램프 절차의 대표 포도당 주입 속도. euglycemia을 유지하는 데 필요한 외인성 포도당의 양은 다릅니다. 이것은 컨트롤 (차우 공급)와 높은 지방 먹이 (인슐린 저항) 동물 그림입니다. 높은 지방 자란 동물은 주입 인슐린에 둔감하기 때문에 주로, glycemia을 유지하기 위해 생긴 적은 포도당이 필요합니다.
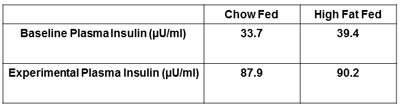
그림 5. 쥐의 대표 플라즈마 인슐린. 인슐린 클램프 동안 플라즈마 인슐린은 금식, 기본 플라즈마 인슐린보다 높은해야합니다. 이것은 인슐린이 제대로 인슐린 클램프 동안 동물에 투여되었다 보장합니다.
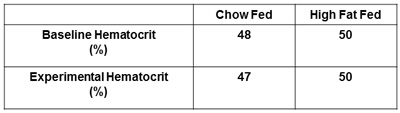
그림 6. 혈소판보고. 실험 다음과 같은 기준 혈소판과 혈소판을 얻을하고보고해야합니다. 이것은 혈소판의 수치가 지나치게 동맥혈 샘플링으로 인한 기본 수준 이상의 5 %를 빠지지 마십시오 보장합니다.
토론
처음에는 인간의 인슐린 민감도의 조사 개발, 클램프 절차는 현재 실험실 쥐 및 쥐 등 다른 수종에 적응되었습니다. 인슐린 저항 조사 동물 모델은 인슐린 민감성과 관련 pathologies의 pathophysiology을 이해뿐만 아니라 임상 가치 1,2을 치료 개입을 식별에 큰 도움을 제공합니다. 동물의 인슐린 민감도를 평가하는 여러 가지 방법 3을 고용하고 있습니다. 이러한 기술은 포도당 내성 검사...
공개
감사의 말
이 연구는 건강 연구와 게놈 Canada.JS의 캐나다 연구소에 의해 지원 되었음 앨버타 유산 Foundationfor 의료 연구, 심장 및 Canadaand의 행정 재단 캐나다 당뇨병 협회에서 급여 지원 수상 경력을 보유하고 있습니다. 데이빗 Wasserman과 시어러 실험실이 절차를 가르치는 빙글의 브레이에 특별 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 (옵션) |
| Intramedic 폴리에틸렌 튜브 (PE - 50) | 피셔 사이 언티픽 | 14-170 - 12B | 0.58 mm (0.023 ") 0.965 mm의 X 외경 (0.038")의 내경 |
| 다우 코닝 Silastic의 실험실 튜브 | 피셔 사이 언티픽 | 11-189 - 15C | 0.76 mm의 내경 (0.030 ") 1.65mm의 X 외경 (0.065") |
| Tygon S - 50 - HL 의료 튜브 | 하버드 장치 | PY2 72-1251 | 3.2mm의 내부 직경 (0.125 ") 4.7mm의 X 외경 (0.1875") |
| Loctite 슈퍼 접착제 | 그랑 & 토이 | 32,237 | 젤 제어 |
| 무균 외과 블레이드 | VWR | BD371610 | |
| 곡선 마이크로 분석 해 봅시다 집게 | 조지 티만 & (주) | 160-20 | X 2 |
| 스트레이트 마이크로 분석 해 봅시다 집게 | 조지 티만 & (주) | 160-15 | X 2 |
| 곡선 Hemostat | 조지 티만 & (주) | 105-1135 | X 2 |
| 스트레이트 Hemostat | 조지 티만 & (주) | 105-1130 | X 2 |
| Hemostat 팁 경비 | 로빈스 인 스트 루먼트 주식 회사 | 15.09-2-004 | |
| 스트레이트 외과 가위 | 조지 티만 & (주) | 105-402 | |
| VENOJECT 멀티 샘플 Luer 어댑터 | Terumo 의약품 | 810127A | 21 게이지, 1 인치 |
| 멸균 카테터의 Introducer | 백톤 디킨슨 | 406999 | |
| 14 게이지 블런트 니들 | 백톤 디킨슨 | 511310 | 14 게이지, 2 인치 |
| 무균 외과 봉합사 | 존슨 앤 존슨 의료 제품 | 1679H | 실크, 크기 3-0 |
| 비 무균 외과 봉합사 | Angiotech 제약 주식 회사 | SP116 | 실크, 크기 4-0 |
| 커튼 면봉 | VWR | 10806-005 | |
| 4ply 고즈 패드 | VWR | CA43845 - 062 | |
| 스몰 애니멀 무선 클리퍼스 | 하버드 장치 | 729063 | |
| Isoflurane | 할로 카본 제품 주식 회사 | IPN - 45 | |
| 마취 카트 | 벤슨 의료 산업 주식 회사 | ||
| 70 % 에탄올 | 피셔 사이 언티픽 | HC - 1000 | |
| Betadine의 방부제 솔루션 | 서양 의약품 유통 센터 (주) | 105267 | |
| 모델 11 플러스 주사기 펌프 | 하버드 장치 | 702208 | |
| 스테인레스 스틸 튜브의 Couplers | 하버드 장치 | 72-4434 | 23 게이지, 0.3 인치 |
| 스테인레스 스틸 튜브가 플러그 | 하버드 장치 | 72-4436 | 23 게이지, 0.5 인치 |
| 스테인레스 스틸 블런트 니들스 | Instech 연구소 주식 회사 | LS22 | 22 게이지 |
| 60 학위 Y - 커넥터 | 소형 부품 | STCY - 22-05 | 22 게이지 |
| CritSpin 마이크로 혈소판의 원심 분리기 | 이리스 샘플 처리 | CS12 | |
| 미니 원심 분리기 | 피셔 사이 언티픽 | 05-090-100 | |
| 마이크로 원심 분리기 튜브 | VWR | 53550-778 | |
| 50ml 폴리 프로필렌의 원심 분리기 튜브 | VWR | 89004-364 | |
| 1ml 플라스틱 슬립 팁 주사기 | 백톤 디킨슨 | 309602 | |
| 3ml 플라스틱 Luerlok 팁 주사기 | 백톤 디킨슨 | 309585 | |
| 헤파린 항응고제 주입 | 서양 의약품 유통 센터 (주) | 102824 | 제조 업체 : LEO 제약 주식 회사 콩크. 1,000 IU |
| EDTA (에틸렌 다이아 민 테트라 초산) 솔루션 | Promega 주식 회사 | V4231 | 0.5 M, pH를 8.0 |
| 식염 | 서양 의약품 유통 센터 (주) | ABB7983154 | 제조 업체 : Hospira 0.9 %의 나트륨 염화물 |
| 50 % 덱스 트로 오스 | Vetoquinol | 8DEX012D | |
| Humulin - R | 엘리 릴리 | HI - 210 | 100U/ml |
| 1ml 인슐린 주사기 | 백톤 디킨슨 | 309311 | |
| Fisherbrand * Hemato - 인감 밀봉제 | 피셔 사이 언티픽 | 02-678 | |
| Fisherbrand * Microhematocrit 모세관 튜브 | 피셔 사이 언티픽 | 22-362-574 | |
| 원터치 울트라 테스트 스트립 | LifeScan 주식 회사 | AW 085 - 314H | |
| 원터치 울트라 혈당 측정기 | LifeScan 주식 회사 | AW - 314B 085 | |
| Pentobarbitol 나트륨 | Ceva 쌍떼 Animale | 1715 138 | 콩크. 54.7mg/ml |
| 레드 연구실 라벨 테이프 | VWR | 89097-932 | |
| 블루 연구소 라벨 테이프 | VWR | 89097-936 | |
| 크기를 달다 | 피셔 사이 언티픽 | 01-913-88 | |
| 와동 | VWR | 58815-234 | |
| 타이머 | VWR | 62344-641 |
참고문헌
- Halseth, A. E., Bracy, D. P., Wasserman, D. H. Limitations to basal and insulin-stimulated skeletal muscle glucose uptake in the high-fat-fed rat. Am J Physiol Endocrinol Metab. 279, E1064-E1071 (2000).
- Halseth, A. E., Bracy, D. P., Wasserman, D. H. Limitations to muscle glucose uptake due to high fat feeding. Am. J. Physiol. 279, E1064-E1071 (2000).
- Muniyappa, R., Lee, S., Chen, H., Quon, M. J. Current approaches for assessing insulin sensitivity and resistance in vivo: advantages, limitations, and appropriate usage. Am J Physiol Endocrinol Metab. 294, 15-26 (2008).
- Cho, H. Insulin resistance and a diabetes mellitus-like syndrome in mice lacking the protein kinase Akt2 (PKB beta). Science. 292, 1728-1731 (2001).
- Dubois, M. J. The SHP-1 protein tyrosine phosphatase negatively modulates glucose homeostasis. Nat Med. 12, 549-556 (2006).
- Pacini, G., Thomaseth, K., Ahren, B. Contribution to glucose tolerance of insulin-independent vs. insulin-dependent mechanisms in mice. Am J Physiol Endocrinol Metab. 281, 693-703 (2001).
- Herbach, N. Dominant-negative effects of a novel mutated Ins2 allele causes early-onset diabetes and severe beta-cell loss in Munich Ins2C95S mutant mice. Diabetes. 56, 1268-1276 (2007).
- Maeda, N. Diet-induced insulin resistance in mice lacking adiponectin/ACRP30. Nat Med. 8, 731-737 (2002).
- Potenza, M. A., Marasciulo, F. L., Tarquinio, M., Quon, M. J., Montagnani, M. Treatment of spontaneously hypertensive rats with rosiglitazone and/or enalapril restores balance between vasodilator and vasoconstrictor actions of insulin with simultaneous improvement in hypertension and insulin resistance. Diabetes. 55, 3594-3603 (2006).
- Ayala, J. E., Bracy, D. P., McGuinness, O. P., Wasserman, D. H. Considerations in the design of hyperinsulinemic-euglycemic clamps in the conscious mouse. Diabetes. 55, 390-397 (2006).
- Wasserman, D. H., Ayala, J. E., McGuinness, O. P. Lost in translation. Diabetes. 58, 1947-1950 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유