Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Hyperinsulinemic-Euglycemic зажим в Сознавая Крыса
В этой статье
Резюме
Hyperinsulinemic-euglycemic зажим "золотым стандартом" для оценки действия инсулина. Инсулин инфузии с постоянной скоростью, стимулирующие потребление глюкозы. Сумма экзогенной глюкозы проникнуты для борьбы с этим падение указывает на чувствительность к инсулину. Здесь процедура выполняется на сознательном, безудержного крысы.
Аннотация
Диабет 2 типа (сахарным диабетом 2 типа) быстро растет в распространенности. Характеризуется либо неадекватными производство инсулина или неспособности использовать инсулин производится, сахарным диабетом 2 типа приводит к повышенным уровнем глюкозы в крови. "Золотым стандартом" при оценке чувствительности к инсулину является hyperinsulinemic-euglycemic зажим или инсулин зажимом. В этой процедуре, инсулин переплетаются с постоянной скоростью, в результате чего падение глюкозы в крови. Для поддержания глюкозы в крови на постоянном уровне, экзогенной глюкозы (D50) является вливаются в венозное кровообращение. Количество глюкозы инфузии для поддержания гомеостаза является показателем чувствительности к инсулину. Здесь мы показываем основные процедуры зажим в хронически катетерами, несдержан, сознательное крысы. Эта модель позволяет крови должны быть собраны с минимальным стрессом для животных. После вводного наркоза, срединный разрез делается и левой общей сонной артерии и яремной вены прямо в катетеризации. Извините, катетеры промыть гепарином солевой раствор, затем экстериоризируется и закреплены. Животные имеют право восстановиться в течение 4-5 дней до экспериментов с увеличением веса отслеживаются ежедневно. Только те животные, которые восстановить вес перед операцией уровней используются для экспериментов. В день эксперимента, крысы постился и подключен к насосов, содержащие инсулин, и D50. Базовый глюкозы оценивается от артериальной линии и использовали тест в течение всего эксперимента (euglycemia). После этого, инсулин переплетаются с постоянной скоростью в венозное кровообращение. Чтобы соответствовать падение глюкозы в крови, D50 придают. Если скорость инфузии D50 больше, чем скорость поглощения, повышение глюкозы произойдет. Аналогичным образом, если скорость недостаточна, чтобы соответствовать целом усвоения глюкозы тела, падение будет происходить. Титрование глюкозы продолжается, пока стабильные показания глюкозы будут достигнуты. Уровни глюкозы и цены глюкозы вливания в этот стабильный период, отражаются и сообщил. Результаты обеспечить индекс чувствительности к инсулину весь организм. Техника может быть уточнена в соответствии с конкретными экспериментальными требованиям. Это еще более усиливается за счет использования радиоактивных индикаторов, которые могут определить конкретные ткани стимулируемое инсулином потребление глюкозы, а также весь оборот глюкозы тела.
протокол
: Хирургическое Катетеризация артериального и венозного кровообращения
Часть 1: артериального и венозного катетера подготовка
- Отрежьте 15 см из ПЭ-50 (внутренний диаметр 0,58 мм (0,023 ") х внешний диаметр 0,965 мм (0,038"). Cut разделе 1 мм силиконовой трубки (0,76 мм (0,030 ") внутренний диаметр х 1.65mm (0,065 "), наружный диаметр) для использования в качестве сдерживающих шарик. сдерживающим бусинка предотвращает крыс от вытаскивания катетер, когда он будет на месте.
- Вставьте кончики микро рассекает щипцов в просвет сдерживающим шарик и аккуратно держать кончики пинцета друг от друга, чтобы растянуть открытие шире. Использование другую пару микро рассекает щипцы, слайд-силиконовой трубки в просвет сдерживающим шарик. Крепится с помощью сильного клея клей (супер клей Loctite). Бусинка должна лежать вокруг катетера. Разрешить катетер для сухой (24).
- За 300 грамм крысы, артерии линии составляет ~ 2.7cm из сдерживающих шарик в то время как яремной линии составляет ~ 3,2 см. Катетер длиной от сдерживающих регулируются 0,5 см на каждые 100 г увеличение массы тела. Не скос края катетер, поскольку это пункция может судна во время вставки.
- Непосредственно перед операцией, заполнить линии с гепарином физиологического раствора (10U/ml), печать с обоих концов с нержавеющей плагин стальных труб и место в этаноле (70%) для стерилизации. Воздух сухой до установки.
Часть 2: Хирургическая подготовка
- Процедуры были одобрены Университета Калгари уходу и использованию животных комитета и соблюдать theCanadian ассоциация лабораторных животных науки руководящие принципы для экспериментов. Процедуры, изложенные ниже, были проведены на взрослых, мужские Sprague-Dawley крыс (~ 300 г). Все процедуры проводятся под изофлуран, хотя возможно использование инъекционных анестетиков. Все хирургические процедуры выполняются обеспечения асептических методов. Хирургическое оборудование, стаканы и гепаринизированной солевой являются автоклава стерилизацию. Хирургические перчатки, шприцы и хлопка наконечником аппликаторы приобретаются стерилизовать от поставщика.
- Взвесьте крысы и записывать результат. Вес будет иметь важное значение в послеоперационный мониторинг животных. Только животные, восстановить вес перед операцией уровни должны использоваться для экспериментов. Обезболить крыса (3% ИФ) в окне анестезии. Держите крысу на ~ 2% изофлуран во время операции с применением носового обтекателя. Операция должна проводиться дезинфекция области, что способствует асептики.
- Подготовка животных, удаляя волосы от места операции (шея и лопатки). Небольшой стрижки волос или химической депиляции могут быть использованы. Выполнить эту процедуру в области, где отдельно от операции, которые будут проводиться.
- Безопасные животного к хирургическому столу. Обеспечить животное полностью под наркозом, проверяя наличие фут / глаз рефлексов. Подготовка хирургического сайты с дезинфицирующим раствором кожу (70% этанола, затем бетадин скраб затем 70% этанола).
Часть 3: Хирургия
- Сделайте небольшой вертикальный разрез 1 см выше средней линии грудины (Возьмите кожу продольно вдоль медиальной оси пинцетом и разрезать ножницами или скальпелем).
- Блант анализировать с помощью микро рассекает щипцы подвергать мышцу левого грудино-сосцевидный. Отражение этой мышцы подвергать примерно 1 см левой сонной артерии. Использование микро рассекает щипцов под сонной артерии провести артерии на месте. Аккуратно дразнить от соединительной ткани из сонной артерии. Важно, чтобы изолировать блуждающего нерва из артерии, не повреждая либо артерии или нерва. Изолировать артерии затем перевязывать краниально заканчиваются 4-0 шва шелка (это будет использоваться для управления сонной артерии во время операции). Примечание: 4-0 швы должны быть стерилизованы 70% этанолом до начала использования.
- Зажим сосуд с зубчатыми, микро рассекает щипцами. Прокол лигируют заканчиваются номер 21 VENOJECT Multi-Пример Адаптер Luer. Удалить из нержавеющей плагин стальных труб и осторожно вставить катетер с помощью стерильного катетера интродьюсер признать ее в артерии. Обеспечение безопасных катетер щипцами, частично выпуска микро рассекает щипцы зажимные артерии и впредь размещать катетер, чтобы шарик. На данный момент, кончик катетера должно быть в дуге аорты. Будьте осторожны, не выпустить катетером, давление судна заставит его.
- Tie две 4-0 швами надежно ниже шарика и один выше и убедитесь, что катетер образца. Флеш соответствии с 10U/ml гепаринизированной физиологического раствора. Повторно подключите внешние конце катетера с нержавеющей плагин стальных труб.
- Используя тот же разрез, тупая рассекать подвергать правой наружной яремной вены. Изолировать тщательно и перевязывать краниально конце шелком швом. Прокол вены с номер 21 VENOJECT Multi-Пример Адаптер Luer. Удалить из нержавеющей плагин стальных труб и вставить катетер стерильным сatheter интродьюсер на шарик и связать две нити ниже шарика. Tie 1 / 3 шва выше шарика и подтвердить, что это образцы. Промыть венозной линии 10U/mL гепаринизированной физиологического раствора. Повторно подключите внешние конце катетера с нержавеющей плагин стальных труб.
- Туннель 14 калибра тупой иглой под кожу и сделать разрез на спине между лопатками. Тема катетера через иглу, чтобы их воплощать в задней части крысы. Около 4 см линии видна. Отрежьте 0,5 см от Tygon S-50-HL труб медицинский, поместите его вокруг обоих экстериоризируется катетеры и закрепите ленту по мере необходимости (синий для вен, красный для артерии). Retest катетеры для обеспечения проходимости, промойте и залейте 150U/ml гепаринизированной физиологическим раствором для предотвращения свертывания крови.
- Закрыть все разрезы с 3-0 шелковые нити. Место крысы лежа, в подогретого, чистой клетке с пищей в нижней части клетки.
B: Послеоперационный уход
Часть 1: послеоперационный уход и контроль
- Как только крысы вновь обретает полный амбулаторно способности и боевой готовности вернуть крысу содержания животных.
- Разрешить крысы для восстановления в течение 3-5 дней.
- Монитор в день в течение инфекции, боль и изменения в весе. Инфекция может вызывать озабоченность, если выделения из разреза участков, общая вялость и / или боли не наблюдается. Боль указывает выгибание спины, взъерошенные спине мех и отсутствие амбулаторной и / или пищевого поведения. Потеря в весе может быть испытано сразу после операции до трех дней после операции, однако, масса должна стабилизироваться и / или увеличения в пределах 10% от предоперационного веса в течение 5 дней. Тяжелая потеря веса может свидетельствовать инфекция, инсульт и / или боли.
- Retest катетеры ежедневно для обеспечения проходимости.
Часть 2: Поддержание катетера
- Каждый день во время послеоперационного восстановления, заполните 1мл Шприцы Совет скольжения с 150U/ml гепаринизированной засоленных и шапка его с 22 калибра тупой иглой. Тупая игла вводится в 20 см из ПЭ-50 трубка с 23 калибр нержавеющей ответвитель стальных труб на другом конце.
- Удалить пузырьки воздуха путем размещения заканчиваются трубки ответвитель выше, чем остальные 1 мл шприц и нажав пузырьки из линии.
- Зажим с артериальной линии вовне от крыс с hemostats чуть ниже вилки.
- Снять заглушку стали катетер используя вторую пару hemostats.
- Вставьте трубку ответвитель подключен к шприца в артериальной линии и отпустите hemostats окклюзии вовне артериального катетера.
- Аспирируйте артериальной крови катетер в шприц. Если катетер не рисует легко может быть необходимо очень аккуратно вставьте в небольшом количестве заподлицо раствор через катетер, чтобы сместить кончике катетера в случае его заклинило от стенки сосуда. Катетер был полностью очищен, когда кровь достигает шприц.
- Зажим PE-50 трубки близка к 1 мл шприц и распоряжаться шприц. Заменить на новую шприц со свежими 150U/ml гепаринизированной физиологического раствора. Разжимать труб и проведении новый шприц в вертикальном положении, Флик новый шприц с пальцем, чтобы выбить любые возможные новые пузырьки воздуха вверх и в сторону от линии. Примечание: Забота должна быть обеспечена как пузырьки воздуха может привести к инсульту.
- Inject 150U/ml heparinzed солевой пока катетер линия ясна и без крови.
- Зажим с артериальной линии вовне от крыс с hemostats чуть ниже трубы муфты. Удалите шприц разъем от артериальной линии катетер и заменить его нержавеющей плагин стальных труб.
- Выпуск hemostats окклюзии вовне артериального катетера.
- Повторите эти действия для венозной линии. Однако из-за низкой выборки венозное давление часто не представляется возможным. Если 150U/ml heparinzed солевой могут вводиться с минимальным сопротивлением вполне вероятно, что катетер хорошие позиции в вену.
C: Hyperinsulinemic-Euglycemic Clamp
Часть 1: Зажим Установка и подготовка
- Взвесьте крысы и записывать вес. Это будет необходимо для определения ставок инсулина и глюкозы в инфузии. Быстрый крысы, по крайней мере 5 часов до эксперимента. Это гарантирует, животное находится в состоянии после приема пищи и вклад глюкозы из пищевых источников сводится к минимуму. Место крыса в небольшой контейнер / клетку с постельными принадлежностями, которые ограничивают чрезмерное движение. Животное должно иметь возможность развернуться и жених свободно.
- Настройка линии и инфузионных насосов, как показано на рисунке 1. P50 Длина соединения трубки являются: шприц, чтобы Y разъем диаметром 8 см, Y разъем для крысы 15 см, артериальной линии 20 см, и венозной линии 10 см в длину. Удалить из нержавеющей пробки стальных труб и флеш яремной и артериальной линии для обеспечения вливания и отбора проб, соответственно, с 10U/ml гепаринизированной физиологического раствора.
- Определение инсулина необходимом объеме. Это будет зависеть от уровня инсулина и веса крысы. Здесь 4mU/kg/min вводится в размере 2uL/min. Это высокой физиологической дозы. Где это возможно, попытки следует ограничить вливания томов. Инсулин должен быть соответствующим образом разбавляют и вводить в присутствии плазмы. 3% раствор плазме крови крыс в физиологическом растворе используется для разбавления инсулина в этой лаборатории. Инсулин HumulinR 100U/ml (Эли Лили), хотя и другие быстрые действия инсулина могут быть использованы. Обеспечить разбавленный инсулина хорошо перемешивается до ввода в вливания шприцем.
- Подготовка 50% декстрозы. Это могут быть размещены непосредственно в шприц на инфузионного насоса. Марка насоса с "глюкоза", чтобы в будущем избежать путаницы. Не забудьте обеспечить достаточные объемы инсулина и глюкозы для исследования. Зажимы обычно длятся ~ 2 часа. В настоящее время протокол, 3 мл шприцы используются.
- Глюкозы Место и инсулиновые шприцы на Гарвардского Аппарат Модель 11 Plus шприцевые насосы. Advance глюкозы в Y-разъем и зажим соответствии с кровоостанавливающего. Advance инсулина для животных, зажим соответствии с кровоостанавливающего. Зажим линии и позволяют крысы, чтобы расслабиться в течение 30 минут до начала эксперимента. ПРИМЕЧАНИЕ: охранники Hemostat наконечник предлагается, чтобы избежать постоянного опрессовки линий.
- Подготовка центрифуги и EDTA покрытием труб для плазмы коллекции. В настоящем исследовании, дополнительные образцы крови будет получен один раз животное зажимается.
Часть 2: экспериментальный протокол
- Образец базового инсулина и гематокрита образца должны быть приобретены. Гематокрит выборки обеспечивает объем крови сохраняется в течение всего эксперимента. Как правило, гематокрита уровня не должна опускаться более чем на 10% от первоначального значения.
- Получить образец базового уровня глюкозы (One Touch Ultra, LifeScan, Inc) и определить весь уровень глюкозы в крови, чтобы быть перекрыты. Здесь мы зажим на euglycemia, или 5.0-5.5мм (рис. 2). После каждого крови, промойте артериальной линии с небольшим объемом 10U/ml гепаринизированной физиологическим раствором для предотвращения свертывания крови. ПРИМЕЧАНИЕ: Убедитесь, нет сгустков или пузырьки воздуха в линии до вливая. Они могут дать животного инсульт.
- Начало инфузии инсулина. Возьмите глюкозы в крови на 5-10мин промежутки времени, мониторинга уровня глюкозы в каждый момент времени. Отрегулируйте скорость инфузии глюкозы по мере необходимости, пока устойчивое состояние достигается. Этот процесс, как правило, методом проб и ошибок и может занять 30 минут до> 2h. Уровни глюкозы, необходимые для поддержания гликемии зависят от экспериментальных протоколов, виды и условия настоящего времени (рис. 2).
- Устойчивый уровень глюкозы в государстве трех последовательных чтений в пределах определенного диапазона. Здесь, в трех чтениях в течение ~ 1 мМ считается зажат (4,8 например, 5.2, 5.6мм). После стационарного состояния достигается, записывать скорость инфузии глюкозы, необходимые для поддержания гликемии за 30мин периода. За это время дополнительные образцы крови могут быть получены. Как минимум, второй образец инсулина плазмы и гематокрита образец должен быть получен.
- После завершения зажим, животные могут быть использованы для дальнейших испытаний или эвтаназии и тканей, собранных для дальнейшего анализа. В зависимости от животного, катетер линии могут оставаться патент на 5-7 дней.
D: Hyperinsulinemic-Euglycemic (инсулин) Результаты Clamp
При правильном выполнении процедуры зажим оценивает устойчивый чувствительности к инсулину состояние крысы. Представляя данные, полученные от зажима, важно, чтобы документ уровни глюкозы и цены глюкозы инфузии. Стабильный уровень глюкозы за время хода не менее 30 мин (рис. 3) свидетельствуют о стабильном состоянии. Глюкоза считается стабильным, только если весь глюкозы в крови поддерживается в пределах ~ 1 мм. Ставки Глюкоза инфузии показать уровни экзогенной глюкозы, необходимые для поддержания гликемии. Где возможно, эти цифры должны быть показаны как раз конечно, а не одного, усредненное значение (рис. 4).
Другие рекомендуемые меры, которые необходимо сообщили являются инсулина плазмы и гематокрита. Определение как натощак, так и зажимается уровень инсулина подтвердить, что инсулин успешно управляется и обнаружит любые различия в уровнях между группами лечения (рис. 5). Получение гематокрита меры в начале и в заключение инсулина зажим предлагается (рис. 6). Это делается для того гематокрита уровни не падают более чем на 5% в течение эксперимента и сопровождающие изменения в объем крови и поток не влияют на глюкозу распоряжении.
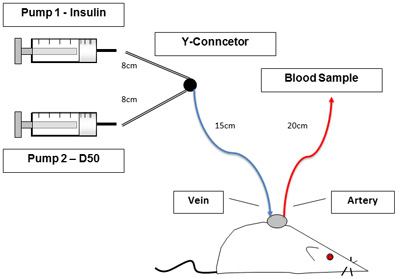
Рисунок 1. Экспериментальная установка. На рисунке 1 показан безудержный, сознательное крыс при зажим процедуры. Катетеры позволяют отбор проб крови и вливания без обработки животных. Насосы слева содержат инсулина и глюкозы.

Рисунок 2. Ожидаемые данные во время процедуры зажим. Для получения зажим на базовых уровнях (euglycemia, 5мм), уровни экзогенной глюкозы (D50) манипулируют до базового или «зажим» достигнута.
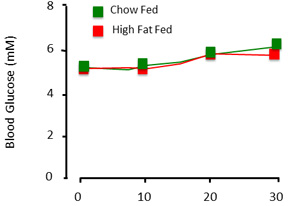
Рисунок 3. Ожидаемое глюкозы в плазме крови результаты зажим процедуры. Когда животное "зажат", глюкозы в крови является относительно стабильной во времени и в экспериментальных группах.
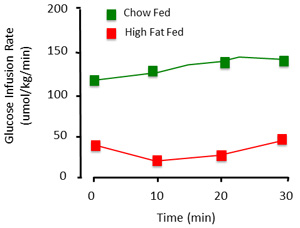
Рисунок 4. Представителю глюкозы вливание темпы зажим процедуры. Сумма экзогенной глюкозы, необходимые для поддержания euglycemia отличается. Это иллюстрируется с контролем (чау кормили) и высоким содержанием жиров кормили (инсулинорезистентность) животных. С высоким содержанием жиров животного кормили требует меньше глюкозы проникнуты для поддержания гликемии, в первую очередь потому что он не чувствителен к инсулину инфузии.
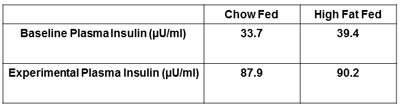
Рисунок 5. Представителю инсулина плазмы крысы. Инсулина в плазме крови во время инсулин зажим должен быть выше, чем постился, базовые инсулина плазмы. Это гарантирует, инсулин должным образом вводят животным в течение инсулина зажимом.
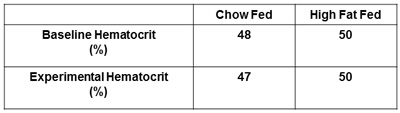
Рисунок 6. Отчетность гематокрита. Гематокрита базовой и гематокрита следующий эксперимент должен быть получен и сообщил. Это гарантирует, гематокрита уровни не падают более чем на 5% от базового уровня в результате чрезмерной артериальной забора крови.
Обсуждение
Изначально разработанный для исследования чувствительности к инсулину у людей, зажим процедуры в настоящее время адаптированы для других видов, включая лабораторных крыс и мышей. Исследование животных моделях инсулинорезистентности обеспечивает значительную помощь в понимании пат...
Раскрытие информации
Благодарности
Работа выполнена при поддержке Канадского института исследований в области здравоохранения и Геном Canada.JS занимает заработная плата поддержку награды от Наследие Альберты Foundationfor медицинских исследований, сердца и инсульта Фонд Canadaand Канадской Ассоциации Диабета. Особая благодарность д-р Дэвид Вассерман и Бингл Браси для преподавания этой процедуры в лабораторию Ширер.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (необязательно) |
| Intramedic труб из полиэтилена (ПЭ-50) | Fisher Scientific | 14-170-12B | Внутренний диаметр 0,58 мм (0,023 ") х внешний диаметр 0,965 мм (0,038") |
| Dow Corning Silastic лаборатории труб | Fisher Scientific | 11-189-15C | Внутренний диаметр 0,76 мм (0,030 ") х Наружный диаметр 1.65mm (0,065") |
| Tygon S-50-HL медицинской труб | Гарвардский аппарата | PY2 72-1251 | Внутренний диаметр 3,2 мм (0,125 ") х Наружный диаметр 4.7mm (0,1875") |
| Супер клей Loctite | Великий и игрушки | 32237 | Гель управления |
| Стерильные хирургические Клинок | VWR | BD371610 | |
| Изогнутые Micro Анатомический пинцет | Джордж Тиманн & Ко | 160-20 | х 2 |
| Прямо Micro Анатомический пинцет | Джордж Тиманн & Ко | 160-15 | х 2 |
| Изогнутые Hemostat | Джордж Тиманн & Ко | 105-1135 | х 2 |
| Прямо Hemostat | Джордж Тиманн & Ко | 105-1130 | х 2 |
| Гвардейская Hemostat Совет | Robbins Instruments, Inc | 15.09-2-004 | |
| Прямые ножницы хирургии | Джордж Тиманн & Ко | 105-402 | |
| VENOJECT Multi-Пример Luer адаптер | Terumo изделий медицинского назначения | 810127A | Номер 21, 1 дюйма |
| Стерильный катетер Introducer | Becton Dickinson | 406999 | |
| 14 калибра тупой иглой | Becton Dickinson | 511310 | 14 калибра, 2 дюйма |
| Стерильные хирургические шовные | Johnson & Johnson Medical продукты | 1679H | Шелк, размер 3-0 |
| Нестерильные хирургические шовные | Angiotech Pharmaceuticals, Inc | SP116 | Шелк, размер 4-0 |
| Ватные тампоны | VWR | 10806-005 | |
| 4ply марлевые компрессы | VWR | CA43845-062 | |
| Маленькое Существо Беспроводная Машинки для стрижки | Гарвардский аппарата | 729063 | |
| Изофлюрана | Хладон Продукты корпорации | СПИ-45 | |
| Анестетики Корзина | Бенсон Медицинские Industries, Inc | ||
| 70% этанола | Fisher Scientific | HC-1000 | |
| Решение Бетадин Антисептические | Западные наркотиками распределительный центр ООО | 105267 | |
| Модель 11 Plus шприцевой насос | Гарвардский аппарата | 702208 | |
| Муфты из нержавеющей стали трубы | Гарвардский аппарата | 72-4434 | 23 калибр, 0,3 дюйма |
| Трубки из нержавеющей стали Вилки | Гарвардский аппарата | 72-4436 | 23 калибр, 0,5 дюйма |
| Нержавеющая сталь тупые иглы | Instech Laboratories, Inc | LS22 | 22 калибра |
| 60 градусов Y-соединители | Мелкие детали | STCY-22-05 | 22 калибра |
| CritSpin Micro-гематокрита Центрифуга | Ирис обработки образцов | CS12 | |
| Мини центрифуга | Fisher Scientific | 05-090-100 | |
| Micro трубы центрифуги | VWR | 53550-778 | |
| 50 мл пробирки центрифуги полипропилена | VWR | 89004-364 | |
| 1 мл пластиковые шприцы Совет скольжения | Becton Dickinson | 309602 | |
| 3 мл пластиковых Совет Luerlok Шприцы | Becton Dickinson | 309585 | |
| Введение гепарина Антикоагулянтная | Западные наркотиками распределительный центр ООО | 102824 | Производитель: LEO Pharma Инк Конц. 1000 МЕ |
| Решение ЭДТА | Promega корпорации | V4231 | 0.5 М, рН 8,0 |
| Солевой | Западные наркотиками распределительный центр ООО | ABB7983154 | Производитель: Hospira 0,9% натрия хлорида |
| 50% раствор глюкозы | Vetoquinol | 8DEX012D | |
| Хумулин-R | Eli Lilly | HI-210 | 100U/ml |
| 1мл Шприцы инсулин | Becton Dickinson | 309311 | |
| Fisherbrand * гемато-Seal Герметик | Fisher Scientific | 02-678 | |
| Fisherbrand * Microhematocrit капилляров | Fisher Scientific | 22-362-574 | |
| One Touch Ультра тест-полоски | LifeScan, Inc | AW 085-314H | |
| One Touch Ультра глюкометр | LifeScan, Inc | AW 085-314B | |
| Натрий Pentobarbitol | Сева Санте Animale | 1715 138 | Конц. 54.7mg/ml |
| Красный лаборатории Маркировка ленты | VWR | 89097-932 | |
| Синий лаборатории Маркировка ленты | VWR | 89097-936 | |
| Весами | Fisher Scientific | 01-913-88 | |
| Вихревой | VWR | 58815-234 | |
| Таймер | VWR | 62344-641 |
Ссылки
- Halseth, A. E., Bracy, D. P., Wasserman, D. H. Limitations to basal and insulin-stimulated skeletal muscle glucose uptake in the high-fat-fed rat. Am J Physiol Endocrinol Metab. 279, E1064-E1071 (2000).
- Halseth, A. E., Bracy, D. P., Wasserman, D. H. Limitations to muscle glucose uptake due to high fat feeding. Am. J. Physiol. 279, E1064-E1071 (2000).
- Muniyappa, R., Lee, S., Chen, H., Quon, M. J. Current approaches for assessing insulin sensitivity and resistance in vivo: advantages, limitations, and appropriate usage. Am J Physiol Endocrinol Metab. 294, 15-26 (2008).
- Cho, H. Insulin resistance and a diabetes mellitus-like syndrome in mice lacking the protein kinase Akt2 (PKB beta). Science. 292, 1728-1731 (2001).
- Dubois, M. J. The SHP-1 protein tyrosine phosphatase negatively modulates glucose homeostasis. Nat Med. 12, 549-556 (2006).
- Pacini, G., Thomaseth, K., Ahren, B. Contribution to glucose tolerance of insulin-independent vs. insulin-dependent mechanisms in mice. Am J Physiol Endocrinol Metab. 281, 693-703 (2001).
- Herbach, N. Dominant-negative effects of a novel mutated Ins2 allele causes early-onset diabetes and severe beta-cell loss in Munich Ins2C95S mutant mice. Diabetes. 56, 1268-1276 (2007).
- Maeda, N. Diet-induced insulin resistance in mice lacking adiponectin/ACRP30. Nat Med. 8, 731-737 (2002).
- Potenza, M. A., Marasciulo, F. L., Tarquinio, M., Quon, M. J., Montagnani, M. Treatment of spontaneously hypertensive rats with rosiglitazone and/or enalapril restores balance between vasodilator and vasoconstrictor actions of insulin with simultaneous improvement in hypertension and insulin resistance. Diabetes. 55, 3594-3603 (2006).
- Ayala, J. E., Bracy, D. P., McGuinness, O. P., Wasserman, D. H. Considerations in the design of hyperinsulinemic-euglycemic clamps in the conscious mouse. Diabetes. 55, 390-397 (2006).
- Wasserman, D. H., Ayala, J. E., McGuinness, O. P. Lost in translation. Diabetes. 58, 1947-1950 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены