需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在富含GC KISS1受体序列与人类生殖系统紊乱中确定的诱变和基因突变分析
摘要
kisspeptin受体(KISS1R)的突变与患者的生殖系统紊乱。在这里,我们描述如何引入利益的突变的KISS1R富含GC的序列以及使用KISS1R结构特点免疫沉淀和免疫印迹的受体的降解途径
摘要
kisspeptin受体(KISS1R)确认为青春期的触发和生殖能力的成年 1,2,3调节G蛋白偶联受体。已与iodiopathic hypogonadotropic性腺功能低下症(IHH)1,2和性早熟4的患者确定KISS1R失活的突变。这些突变体的功能研究为我们理解再生产的这种受体的调节,以及背后的机制是至关重要的那些塑造的疾病结果,导致异常KISS1R信令和功能。然而,的高度富含GC序列的KISS1R基因,使得它相当困难的引入突变或扩增PCR这种受体的基因编码。
在这里,我们描述了一种方法,引入利益的突变,这种高度富含GC的序列,已成功地用于产生超过十几KISS1R突变体在我们的实验室。我们已经优化了PCR反应条件,以方便KISS1R包括在KISS1R序列的替换,删除或插入的突变体,放大。的另外一个PCR增强剂解决方案,以及二甲基亚砜的一个很小的比例,尤其是有利于提高放大。这种优化过程可能是有用的,以及其他富含GC的模板。
表达载体编码KISS1R是被用来描述这种受体的信号和功能,以了解如何突变可能会改变KISS1R功能,导致生殖相关的表型。因此,定点突变产生KISS1R的突变体的潜在应用1,4,5,6,7,8许多研究可以说明。作为一个例子,在KISS1R(Arg386Pro),这是与性早熟有关,获得性功能突变已被证明延长受体的反应配体刺激4以及改变的降解率KISS1R 9 。有趣的是,我们的研究表明,KISS1R被蛋白酶体降解,而不是大多数G蛋白偶联受体 9所描述的经典的溶酶体降解。在这里介绍的例子,KISS1R退化是在人胚胎肾细胞(HEK - 293)瞬时表达Myc基因标记KISS1R(MycKISS1R)调查和与蛋白酶或溶酶体抑制剂治疗。使用琼脂糖标记的抗myc抗体免疫印迹分析免疫沉淀的细胞裂解液。使用LI - COR的奥德赛红外线系统进行检测和定量上的污点MycKISS1R。这种方法可能是有用的,以及其他感兴趣的蛋白质降解的研究。
研究方案
1。定点突变的基因序列高度富含GC KISS1R
- 模板:Myc基因标记与融合其N -末端的人类KISS1R完整的cDNA序列。这个序列克隆到的pCS2 +的表达载体,这是其后用于转染哺乳动物细胞线兼容。这表达载体被称为本pCS2 + Myc基因KISS1R。
- 引物设计:引物设计进行所需的突变,根据Quikchange定点突变试剂盒(Stratagene公司)的说明。总结:
- 两者(正向和反向引物)必须包含所需的突变和退火对面链的质粒以相同的顺序(如正向和反向引物的互补性)
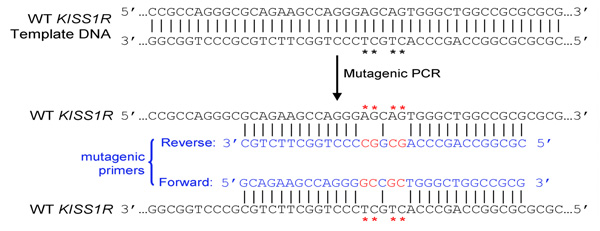
- 底漆应25至45个碱基长,最终在一个或多个C或G基地
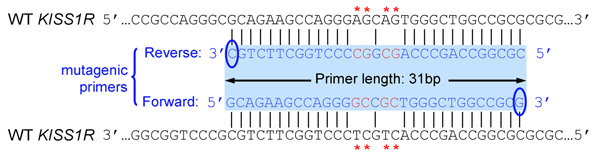

- 引入的突变(S)应在底漆中,正确的顺序〜10-15基地两侧两侧
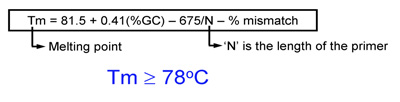
- 引物的熔点温度(TM)应等于或大于78 ° C。使用下列公式来估算的Tm:
- 当引入突变:TM = 81.5 + 0.41(%GC) - 675 / N - %的失配(N是在基地的引物长度)
- 当引入插入或缺失:TM = 81.5 + 0.41(%GC) - 675 / N(n不包括基地正在插入或删除)
- 使用脱盐引物(没有必要的进一步纯化)。
- 两者(正向和反向引物)必须包含所需的突变和退火对面链的质粒以相同的顺序(如正向和反向引物的互补性)
- 最好的扩增条件包括除PCRx增强解决方案(Invitrogen公司)和DMSO。至少有2浓度的DMSO,如4%和8%,应进行测试。我和图1和一个有代表性的PCR扩增的pCS2 + MycKISS1R的结果,如图2所示,PCR条件列于表。
- 消除父母的DNA甲基化的DNA与DpnI消化扩增产物为1小时30分钟在37 ° C:2μL10X NEBuffer 4 DpnI0.5μL(10U; New England Biolabs公司)的PCR产物的离心管17.5μl混合。
- 变换DpnI处理的PCR产物:XL10金Ultracompetent大肠杆菌45μlDpnI处理的DNA混合2μL 大肠杆菌中预冷15 ml细胞培养管(Stratagene公司)。 β-巯基乙醇添加2μL,并按照Stratagene公司的指示。板100 -400μl转化菌在LB琼脂板含100μg/ml氨苄青霉素和孵化,在37 ° C。
- 小量2至4个单个菌落分离质粒DNA。确认成功引进孤立的DNA测序和分析所需的突变。
2。 MycKISS1R到HEK - 293细胞的瞬时转染
- 以下实验进行人类胚胎肾细胞(HEK - 293)中的CO 2培养箱(5%CO 2)培养37 ° C的10%胎牛血清(FBS)和1%青霉素/链霉素的DMEM补充。
- 种子的HEK - 293细胞在6孔板在2.5 × 10 5细胞/ ml,让他们成长在37℃过夜°转染前彗星。注:(i)使用一式三份每个实验条件下的井;(二)在转染时的理想的细胞汇合30%-50%。
- 转染的HEK - 293细胞使用的GenePorter转染试剂(Genlantis),根据制造商的指示:将一半的无血清DMEM0.5μgpCS2 + MycKISS1R加0.5μg控制(空)向量总和的DNA /1μg。每转微克的DNA加入10μl转染试剂混合的另一半。注意:理想的质粒DNA的浓度可能会有所不同。
3。细胞治疗和裂解
- 转染24小时后,细胞培养基取代1毫升DMEM培养液含2.5%胎牛血清(降低细胞代谢)。注意:这可能有助于减少血清中和/或放大的检测结果。
- 直接添加到每一个完整的6孔板以及溶酶体抑制剂(100μg/孔的亮肽素)。孵育37℃,6或16 h(或其他所需的时间)
- 直接添加到所有井的两个整个6孔板新鲜准备的蛋白酶抑制剂(10μM/的MG132)。孵育于37℃,2,4,6或16小时(或所需的时间)。新增车辆的第四次6孔板(0时间点)的所有水井和37 ° C为16H
- 当孵化结束后,移动板冰,冰,以防止蛋白质的降解和执行整个裂解过程:
- 为了增加蛋白质的产量,结合在一个单一的CENTR 6孔板一式三份ifuge管
- 吸冰冷的磷酸1毫升中期和洗细胞一次缓冲液(PBS)
- 添加含有蛋白酶抑制剂(1X鸡尾酒含有100MM AEBSF盐酸,80μm的抑肽酶,5MM bestatin冰冷的裂解液100μL(20MM HEPES,pH值7.4,1%NP - 40,150mm的氯化钠,为1mM EDTA,0.25%脱氧胆酸钠), 1.5MM E - 64,0.5M EDTA,2MM亮肽素和胃酶抑素一个1MM,加上2mm的PMSF),每孔
- 与取出一个细胞刮刀和转移细胞,细胞裂解液离心管
- 细胞通过20号针头传递〜10倍。注意:不要超声用于膜蛋白免疫印迹检测的样品。超声导致膜蛋白的聚集,不会在电泳迁移
- 细胞裂解液在4 ° C孵育一个摇摆的平台上为1h
- 离心机细胞裂解液4 ° C为10分钟10,000 × RPM和上清转移到新管。注意:请勿打扰颗粒在此步骤
- 确定使用的BCA法的上清中加入10μl的蛋白浓度(皮尔斯)
- 稀释裂解液中含有蛋白酶抑制剂的裂解缓冲1mg/ml的。
4。免疫沉淀和Western blot检测的MycKISS1R
- 执行以下冰免疫步骤(或在4 ° C):
- 冰冷PBS洗两次琼脂糖标记的抗myc抗体(2.5μg/样品)适量添加裂解液蛋白400μg。
- 免疫沉淀裂解液的MycKISS1R一夜之间在4 ° C在一个轻轻摇动摇椅平台。
- 离心脉冲离心琼脂糖珠在4 ° C(高达10,000 × RPM)
- 吸并丢弃上清液(不扰民的颗粒)
- 一次用冰冷的裂解液和两次冰冷PBS清洗珠。纺前,轻轻地反转管
- 在2X上样缓冲液含10%β-巯基乙醇含有抗体的约束MycKISS1R Ressuspend珠。
- MycKISS1R免疫复合物的免疫印迹:
- 热样品,30分钟在37 ° C。 注意 :不要煮沸用于膜蛋白免疫印迹检测的样品。如超声,煎煮,也导致这些蛋白质的聚集
- 5分钟立即移动到冰管
- 经SDS - PAGE分离蛋白在4-15%梯度凝胶。
- 在25V的Immobilon - FL PVDF膜(红外线检测)30分钟传输缓冲区使用Bio - Rad公司的半干转移(Tris碱48MM,39mm的甘氨酸,1.2mm的SDS,20%甲醇,pH值9.2)仪器
- 洗膜在室温下5分钟的TRIS缓冲液(TBS)和1H块在室温阻断上的摇摆平台(或者可用于阻止非特异性结合,5%的牛奶的TBS)与Licor奥德赛。
- 在4℃过夜孵育膜° C的兔抗Myc抗体阻断含有0.1%Tween - 20的解决方案(1:500)
- 删除的主要抗体,洗膜5分钟3次用TBS含有0.1%Tween - 20的(TBST)
- 在室温与山羊红外线RedDye ® 800CW标记的抗兔IgG(1:10,000)在封闭液含0.1%Tween - 20的0.01%SDS孵育1h后膜
- 删除第二抗体,洗膜5分钟3次的TBS(删除剩余的吐温20)用TBST和最后一次
- 使用LI - COR的奥德赛红外线成像仪成像和定量MycKISS1R:
- 膜MycKISS1R将使用LI - COR的奥德赛红外线成像仪成像。首先,放置在底部左上角奥德赛扫描器膜,使其与电网。封面用的橡胶垫,理顺与滚子的气泡,并盖上盖子
- 在计算机上创建一个新的项目文件。命名该文件,点击“完成”,然后进入扫描仪“扫描”登录。尺寸扫描仪控制台框,以适应你的膜,然后选择169μm分辨率和图像质量中等
- 选择强度设置为700(红色)和800(绿色)通道,根据每个信号的强度预计。这是信号可视化的目的,并不会影响量化。点击“开始扫描”。
- 名称和保存的扫描,然后点击“确定”,打开一个新窗口定量。 MycKISS1R单体应该是可见的的,在约43kD
- 使用的“盒子”的工具(左侧侧边栏上),一个盒子周围绘制的第一个乐队。拖动框周围,以确保所有频段适合,然后“复制”和“粘贴”框中的所有频段
- 选择所有盒使用“Ctrl + A键”,然后选择选项减去中位数的背景。点击顶部菜单上的“报告”,并与量化值的电子表格将出现。这里显示的代表结果是represented倍以上未经处理的细胞增加(零时间)
5。代表性的成果:
- 定点突变的基因序列高度富含GC KISS1R:
表1显示的试剂组合,以提高KISS1R放大效率。这种组合被成功地用于引进几个突变针对KISS1R cDNA序列不同的区域,以及为这个高度富含GC的基因扩增。图1显示了KISS1R诱变骑自行车和扩增条件。这些条件已被修改,从QuikChange定点突变试剂盒(Stratagene公司)。
图2显示了一个代表性的结果,使用这种优化的协议。另外4%或8%DMSO结合PCRx增强,显着提高富含GC KISS1R的cDNA含有质粒的扩增产量。在此代表的实验,提供4%DMSO扩增条件稍微好一点,比8%DMSO。 DpnI处理的扩增产物转化大肠杆菌ultracompetent 大肠杆菌通常产量100 1000多个殖民地,并成功引进所需的突变率是80-90%,通过DNA测序确定。 - MycKISS1R结构,来研究受体生理:
在此代表的实验中,野生型pCS2 + MycKISS1R扩增根据优化的协议,这里描述的是用来研究在体内KISS1受体的退化有关的细胞株中瞬时表达MycKISS1R(HEK - 293)。治疗溶酶体(亮肽素)或蛋白酶(MG132)抑制剂的方法中所描述的协议,转染HEK - 293细胞后,细胞裂解和免疫印迹处理。图3顶部面板显示扫描MycKISS1R单体,而底部面板中显示的顶部面板上显示的频段的量化。定量分析表明,既不6H也不亮肽素治疗16H影响MycKISS1R蛋白水平的乐队。相反,治疗与MG132在MycKISS1R蛋白在这些细胞中的时间依赖性增加,这与孵化后16H受体的45倍,与MG132积累高潮。这些观测结果表明,不同于大多数G蛋白偶联受体,KISS1R退化的蛋白酶体(而非溶酶体)。
| 二甲基亚砜 | |||
| 试剂 | 0 | 4% | 8% |
| 水 | 35 | 33 | 31 |
| 10X PFU超Taq酶缓冲 | 5 | 5 | 5 |
| dNTP混合液(10MM) | 1 | 1 | 1 |
| 引物感(25pmol/μl) | 1 | 1 | 1 |
| 引物反义(25pmol/μl) | 1 | 1 | 1 |
| 10X PCRx增强解决方案 | 5 | 5 | 5 |
| 二甲基亚砜 | 0 | 2 | 4 |
| PFU超Taq DNA聚合酶(2.5U/μl) | 1 | 1 | 1 |
| 质粒DNA(20ng/μl) | 1 | 1 | 1 |
表1。试剂组合,成功地用于变异和放大GC 丰富 KISS1R
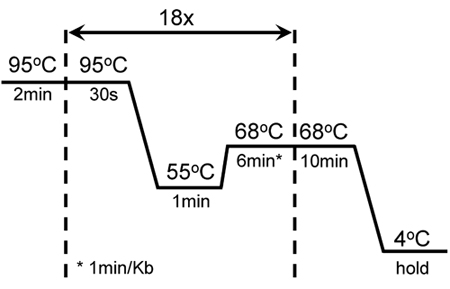
图1。骑自行车成功的突变和扩增GC丰富KISS1R条件:一个2分钟的热启动18秒30的融化周期在95 ° C,1分钟退火,在55 ° C和6时68分延长° C。额外的10的68分钟延长° C被添加在最后一个周期的结束。这些设置进行了调整,从原诱变QuikChange II XL -定点突变试剂盒(Stratagene公司)的协议。
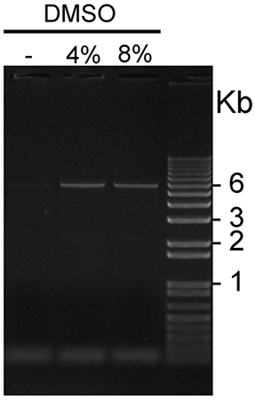
图2。富含GC pCS2 + Myc基因KISS1R DMSO的存在或缺乏扩增的可视化:五pCS2μL等份+ Myc基因扩增在0存在KISS1R,4个或8%DMSO被装在此代表的1%琼脂糖凝胶与乙锭染色溴化物和可视化使用紫外线灯。 6KB质粒带装载在4%存在PCR产物和8%DMSO两个车道上可见,但不是在第一线,这是用PCR加载二甲基亚砜的情况下扩增的产品。
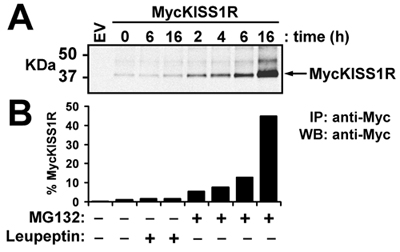
图3。亮肽素或MG132对HEK - 293细胞中的MYC KISS1R蛋白水平:HEK - 293细胞表达Myc基因KISS1R分别用100μg/ml亮肽素或10μMMG132在37 ° C时指定的时间。 Myc基因细胞裂解液400μgKISS1R是2.5μg琼脂糖标记的抗myc抗体免疫沉淀和免疫印迹分析。 (一)LI - COR的奥德赛Myc基因KISS1R用兔抗- Myc基因标记抗体的检测与IRDye 800CW标记的抗兔孵化后免疫印迹孵化;(二)Myc基因KISS1R频带的量化所示: (一)使用LI - COR的奥德赛量化软件。结果表示为倍,增加了未经处理的细胞(时间0)。
讨论
定点突变已被用于研究蛋白质的功能,通过引进超过三十年的靶基因的编码序列的核苷酸变化。原来的技术是于1978年由英国加拿大化学家和诺贝尔经济学奖得主迈克尔史密斯10。迈克尔史密斯分享1993年诺贝尔化学奖与雨霏,美国生物化学家穆利斯是谁发明的聚合酶链式反应(PCR)11。迈克尔史密斯所描述的原始方法多年来已改善。此过程中的高精确度和成功率,以及在一个相对较...
披露声明
没有利益冲突的声明。
致谢
这项工作是部分资金由国家儿童健康和人类发展研究所(NICHD的 - R21 HD059015)的生殖科和查尔斯H.胡德基金会青年研究者儿童健康研究奖(马萨诸塞州波士顿)。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
| 10X PCRx增强解决方案 | Invitrogen公司 | 52391 | |
| PfuUltra高保真DNA聚合酶替代洗涤剂 | Stratagene公司 | 600385 | |
| DPN -我 | New England Biolabs公司 | R0176 | |
| XL10金Ultracompetent 大肠杆菌大肠杆菌细胞 | Stratagene公司 | 200314 | |
| DMEM培养液 | Cellgro | 10 - 013 - CV | |
| 胎牛血清 | 亚特兰大生物 | S11550 | |
| Geneporter转染试剂 | Genlantis | T201007 | |
| 亮肽素 | Calbiochem | 108975 | |
| MG132 | Calbiochem | 47491 | |
| 10xPBS | Ambion公司 | AM9625 | |
| 蛋白酶抑制剂的鸡尾酒和PMSF | 圣克鲁斯生物技术 | SC - 24948 | |
| 皮尔斯BCA蛋白检测试剂盒 | Thermo Scientific的 | 23225 | |
| 抗- Myc的标签(克隆4A6)琼脂糖共轭 | Millipore公司 | 16-219 | |
| 2X加载缓冲区 | BioRad公司 | 161-0737 | |
| 标准的Tris - HCl,4-15%的坡度预制凝胶 | BioRad公司 | 345-0028 | |
| 的Immobilon - FL PVDF膜 | Millipore公司 | IPFL00010 | |
| 奥德赛封闭液 | COR Biosciences公司 | 927-40000 | |
| 10xTBS | BioRad公司 | 170-6435 | |
| 兔抗Myc抗体 | 细胞信号转导 | 2272 | |
| 羊抗兔IRDye 800CW | COR Biosciences公司 | 926-32211 | |
| 奥德赛成像红外系统 | COR Biosciences公司 | ||
| 暂停蛋白酶抑制剂(100X) | Thermo Scientific的 | 78430 |
参考文献
- Seminara, S. B., Messager, S., Chatzidaki, E. E. The GPR54 Gene as a Regulator of Puberty. N Engl J Med. 349, 1614-1627 (2003).
- de Roux, N., Genin, E., Carel, J. C. Hypogonadotropic Hypogonadism Due to Loss of Function of the KiSS1-Derived Peptide Receptor GPR54. Proc Natl Acad Sci U S A. 100, 10972-10976 (2003).
- Messager, S., Chatzidaki, E. E., Ma, D. Kisspeptin Directly Stimulates Gonadotropin-Releasing Hormone Release via G Protein-Coupled Receptor 54. Proc Natl Acad Sci U S A. 102, 1761-1766 (2005).
- Teles, M. G., Bianco, S. D., Brito, V. N. A GPR54-Activating Mutation in a Patient with Central Precocious Puberty. N Engl J Med. 358, 709-715 (2008).
- Tenenbaum-Rakover, Y., Commenges-Ducos, M., Iovane, A. Neuroendocrine Phenotype Analysis in Five Patients with Isolated Hypogonadotropic Hypogonadism due to a L102P Inactivating Mutation of GPR54. J Clin Endocrinol Metab. 92, 1137-1144 (2007).
- Semple, R. K., Achermann, J. C., Ellery, J. Two Novel Missense Mutations in G Protein-Coupled Receptor 54 in a Patient with Hypogonadotropic Hypogonadism. J Clin Endocrinol Metab. 90, 1849-1855 (2005).
- Wacker, J. L., Feller, D. B., Tang, X. B. Disease-Causing Mutation in GPR54 Reveals the Importance of the Second Intracellular Loop for Class A G-Protein-Coupled Receptor Function. J Biol Chem. 283, 31068-31078 (2008).
- Szereszewski, J. M., Pampillo, M., Ahow, M. R. GPR54 regulates ERK1/2 activity and hypothalamic gene expression in a Galpha(q/11) and beta-arrestin-dependent manner. PLoS One. 5, e12964-e12964 (2010).
- Bianco, S. D. C., Vandepas, L., Correa-Medina, M., Gereben, B., Mukherjee, A., Kuohung, W., Carroll, R., Teles, M. G., Latronico, A. C., Kaiser, U. B. KISS1R Intracellular Trafficking and Degradation: Effect of the Arg386Pro Disease-Associated Mutation. Endocrinology. , (2011).
- Hutchison, C. A., Phillips, S., Edgell, M. H. Mutagenesis at a Specific Position in a DNA Sequence. J Biol Chem. 253, 6551-6560 (1978).
- Mullis, K. B. The Unusual Origin of the Polymerase Chain Reaction. Sci Am. 262, 56-61 (1990).
- Henke, W., Herdel, K., Jung, K., Schnorr, D., Loening, S. A. Betaine improves the PCR amplification of GC-rich DNA sequences. Nucleic Acids Res. 25, 3957-3958 (1997).
- Sahdev, S., Saini, S., Tiwari, P., Saxena, S., Singh Saini, K. Amplification of GC-rich genes by following a combination strategy of primer design, enhancers and modified PCR cycle conditions. Mol Cell Probes. 21, 303-307 (2007).
- Kong, K. C., Poyner, D. R., Wheatly, M. Chapter 10. MSTA. in G Protein-Coupled Receptors: Essential Methods. , 197-204 (2010).
- Hall, R. A., George, S. R., O'Dowd, B. F. Chapter 9. G protein-Coupled Receptor-Protein Interactions. , 170-171 (2005).
- Chaturvedi, K., Bandari, P., Chinen, N., Howells, R. D. Proteasome Involvement in Agonist-Induced Down-Regulation of Mu and Delta Opioid Receptors. J Biol Chem. 276, 12345-12355 (2001).
- Shenoy, S. K., McDonald, P. H., Kohout, T. A., Lefkowitz, R. J. Regulation of Receptor Fate by Ubiquitination of Activated Beta 2-Adrenergic Receptor and Beta-Arrestin. Science. 294, 1307-1313 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。