A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Mutagenesis וניתוח של מוטציות גנטיות ברצף KISS1 GC-עשיר קולטן לזהות בני אדם עם הפרעות פוריות
In This Article
Summary
מוטציות בקולטן kisspeptin (KISS1R) קשורים עם הפרעות הרבייה אצל חולים. כאן אנו מתארים כיצד להציג מוטציות עניין ברצף GC-עשיר של KISS1R כמו גם השימוש בונה KISS1R לאפיין את מסלול הפירוק של הקולטן על ידי immunoprecipitation ומערב כתם
Abstract
קולטן kisspeptin (KISS1R) הוא קולטן G-חלבון בשילוב מוכר ההדק של גיל ההתבגרות וגם הרגולטור של יכולת הרבייה לבגרות 1,2,3. מוטציות ב inactivating KISS1R זיהו בחולים קושרו עם 1,2 iodiopathic hypogonadotropic (IHH) hypogonadism ואת גיל ההתבגרות מוקדמת 4. מחקרים פונקציונלי של מוטציות אלה חיוני להבנת המנגנונים הרגולציה של רבייה על ידי קולטן זה, כמו גם אלה המעצבים את תוצאות המחלה, אשר כתוצאה איתות KISS1R לתפקד נורמלי. עם זאת, רצף מאוד GC-עשיר של הגן KISS1R עושה את זה די קשה להכניס מוטציות או להגביר את הגן המקודד קולטן זה על ידי PCR.
כאן אנו מתארים שיטה להציג מוטציות של עניין זה לתוך רצף מאוד GC-עשירה שימש בהצלחה לייצר מעל KISS1R עשרות מוטציות במעבדה שלנו. יש לנו אופטימיזציה התנאים PCR כדי להקל על הגברה של מגוון רחב של מוטציות KISS1R הכוללים החלפות, השמטות או הוספות ברצף KISS1R. התוספת של פתרון ה-PCR משפר, כמו גם אחוז קטן של DMSO היה מועיל במיוחד כדי לשפר את ההגברה. הליך זה מותאם עשוי להיות שימושי עבור GC-עשיר תבניות אחרות.
וקטור הביטוי קידוד KISS1R הוא שימש לאפיין איתות פונקציה של קולטן זה על מנת להבין כיצד מוטציות עשויים להשתנות פונקציה KISS1R להוביל פנוטיפים הקשורים הרבייה. לפיכך, יישומים פוטנציאליים של מוטנטים KISS1R שנוצר על ידי mutagenesis באתר ביים ניתן לתיאור על ידי מחקרים רבים 1,4,5,6,7,8. כדוגמה, המוטציה להרוויח-of-פונקציה של KISS1R (Arg386Pro), אשר מזוהה עם ההתבגרות מוקדמת, הוכח כדי להאריך את התגובה של הקולטן לגירויים ליגנד 4, כמו גם לשנות את קצב הפירוק של KISS1R 9 . מעניין לציין, כי מחקרים שלנו מצביעות על כך KISS1R הוא מושפל על ידי הפרוטאזום, בניגוד לזילות lysosomal קלאסי שתואר עבור רוב החלבון מצמידים קולטני G 9. בדוגמה המוצגת כאן, השפלה של KISS1R הוא נחקר האדם תאים עובריים כליה (HEK-293) transiently להביע myc-tagged KISS1R (MycKISS1R) ומטופלים עם מעכבי פרוטאזום או ליזוזום. Lysates סלולריים הם immunoprecipitated באמצעות agarose-מצומדות אנטי-myc נוגדן ואחריו ניתוח כתם המערבי. איתור וכימות של MycKISS1R על כתמים מתבצעת באמצעות מערכת LI-COR אודיסיאה אינפרא אדום. גישה זו עשויה להיות שימושית בחקר פירוק של חלבונים אחרים בעלי עניין גם כן.
Protocol
1. אתר מכוונת mutagenesis רצף KISS1R מאוד GC-עשיר גן
- תבנית: רצף cDNA מלא KISS1R האדם עם תג-myc התמזגו הסופית N-שלה. רצף זה משובטים לתוך וקטור pCS2 + הביטוי, אשר תואם את שורות תאים יונקים לאחר מכן נעשה שימוש עבור transfections. וקטור זה הביטוי תיקרא להלן pCS2 + myc KISS1R.
- עיצוב פריימר: primers נועדו לשאת מוטציות הרצוי, בהתאם להוראות של Quikchange לאתר בימוי mutagenesis Kit (Stratagene). לסיכום:
- שניהם (קדימה הפוכה) primers חייב להכיל את המוטציה הרצויה לחשל רצף זהה גדילי היפוכו של פלסמיד (קדימה לדוגמה ו primers הפוך משלימים אחד את השני)
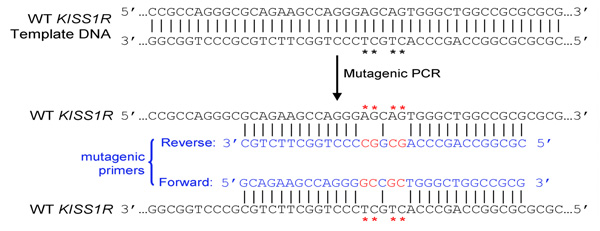
- Primers צריך להיות 25-45 בסיסים ארוך סוף ב-C אחד או יותר או בסיסים G
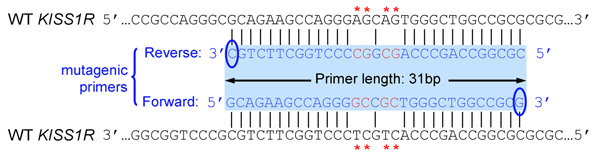

- מוטציה הציג (ים) צריך להיות באמצע פריימר ומשני צדיה ~ 10-15 בסיסים של הרצף הנכון של שני הצדדים
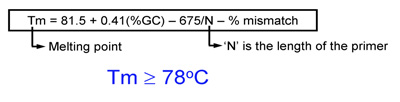
- טמפרטורת התכה (TM) של primers צריכה להיות שווה או גדול מ 78 ° C. השתמש בנוסחאות הבאות כדי להעריך אני:
- כאשר החדרת מוטציות: אני = 81.5 + 0.41 (% GC) - 675 / N - אי התאמה% (N הוא אורך פריימר בבסיסי)
- כאשר מציגים הוספות או מחיקות: אני = 81.5 + 0.41 (% GC) - 675 / N (N אינו כולל את הבסיסים שבהם הם להיות מוכנס או נמחק)
- השתמש primers desalted (אין purifications עוד צורך).
- שניהם (קדימה הפוכה) primers חייב להכיל את המוטציה הרצויה לחשל רצף זהה גדילי היפוכו של פלסמיד (קדימה לדוגמה ו primers הפוך משלימים אחד את השני)
- התנאים הטובים ביותר כוללים הגברה תוספת של PCRx Enhancer פתרון (Invitrogen) ו DMSO. לפחות 2 ריכוזים של DMSO, כגון 4% ו -8%, צריך להיבדק. התנאים PCR מוצגות בטבלה I ו באיור 1, והתוצאות של הגברה PCR נציג pCS2 + MycKISS1R מוצג באיור 2.
- ביטול ה-DNA של ההורים על מוצרי הגברה ידי עיכול של ה-DNA מפוגל עם DpnI עבור 1h 30 דקות בשעה 37 ° C: לערבב 17.5μl צנטריפוגה שפופרת של מוצר ה-PCR עם 2μl של NEBuffer 10x 4 ו 0.5μl של DpnI (10U, ניו אינגלנד Biolabs).
- המרה DpnI שטופלו מוצר ה-PCR: 2μl תערובת של דנ"א DpnI שטופלו עם 45μl של XL10-Gold E. Ultracompetent coli (Stratagene) מראש צינור תא מקורר 15 מ"ל תרבות. הוסף 2μl של mercaptoethanol-β ופעל לפי ההוראות Stratagene. פלייט 100-400μl של חיידקים הפך ב LB-אגר צלחות המכילות אמפיצילין ו 100μg/ml לדגור על 37 ° C.
- Miniprep 2-4 מושבות הפרט לבודד פלסמיד דנ"א. אישור הכנסת מוצלח של מוטציות הרצוי על ידי רצפי DNA ואנליזה של בודדים.
2. Transfection חלוף של MycKISS1R לתוך HEK-293 תאים
- הניסויים הבאים מבוצעות בתאי כליה עובריים אנושיים (HEK-293) בתרבית CO 2 באינקובטור (5% CO 2) ב 37 מעלות צלזיוס DMEM בתוספת 10% בסרום שור העובר (FBS) ו -1% פניצילין / סטרפטומיצין.
- זרעים HEK-293 תאים ב 2.5x10 5 תאים / מ"ל 6-גם צלחות ולתת להם לגדול בין לילה ב 37 ° C לפני transfection. הערה: (i) להשתמש בבארות בשלושה עותקים עבור כל תנאי הניסוי (ii) מפגש תא אידיאלי בזמן transfection הוא 30% -50%.
- Transfect HEK-293 תאים באמצעות transfection GenePorter מגיב (Genlantis), על פי הוראות היצרן: חצי מיקס של סרום ללא DMEM עם 0.5μg pCS2 + MycKISS1R פלוס שליטה 0.5μg (ריק) וקטור כדי לסכם 1μg של דנ"א / היטב. מערבבים את החצי השני עם מגיב transfection 10μl לכל מיקרוגרם של ה-DNA transfected. הערה: דנ"א אידיאלי ריכוז הפלסמיד עשוי להשתנות.
3. Cell טיפול תמוגה
- 24 שעות לאחר transfection, להחליף תאים בינוניים עם 1ml DMEM המכיל FBS 2.5% (ירידה מטבוליזם התא). הערה: זו ירידה נסיוב עשוי להקל ו / או להגביר את הגילוי של התוצאות.
- הוסף מעכב ליזוזום (100μg / היטב Leupeptin) ישירות לתוך הבאר כל צלחת אחת 6-היטב כולו. לדגור על 37 מעלות צלזיוס במשך 6 או 16 שעות (או פעמים הרצוי אחרים)
- הוסף טרי מעכבי פרוטאזום מוכן (10μM / היטב MG132) ישירות לתוך כל הבארות של שני 6-גם צלחות כולו. לדגור על 37 מעלות צלזיוס למשך 2, 4, 6 או 16h (או פי הצורך). הוסף הרכב לכל בארות הצלחת 6-היטב הרביעי (זמן 0 נקודות) ו לדגור על 37 מעלות צלזיוס למשך 16h
- כאשר הדגירה הוא מעל, להעביר צלחות קרח לבצע הליך זה תמוגה כולו על הקרח כדי למנוע פירוק חלבונים:
- כדי להגדיל את התשואה חלבון, לשלב את triplicates על 6 צלחות היטב centr יחידifuge צינור
- לשאוב תאים בינוניים לשטוף פעם עם 1ml של פוספט קרים כקרח בופר סליין (PBS)
- הוסף 100μl של חיץ קרים כקרח תמוגה (HEPES 20mm, pH 7.4, 1% NP-40, 150mm NaCl, 1mm EDTA, deoxycholate נתרן 0.25%) המכיל מעכבי פרוטאז (1x קוקטייל המכיל 100mm AEBSF-HCl, 80μM aprotinin, bestatin 5mm, 1.5mm E-64, EDTA 0.5m, 2mm leupeptin ו 1mm pepstatin, בתוספת 2mm PMSF) זה טוב
- הסרת תאים עם מגרד תא ותא העברת lysates כדי צנטריפוגות מבחנות
- Pass תאים ~ 10 פעמים באמצעות מחט 20-מד. הערה: אל sonicate דגימות מיועד לאיתור כתם המערבי של חלבונים בממברנה. Sonication מוביל אגרגציה של חלבונים בממברנה, אשר לא יעברו כראוי במהלך אלקטרופורזה
- דגירה lysates התא 1h ב 4 ° C על פלטפורמת נדנדה
- תא צנטריפוגה lysates על 4 מעלות צלזיוס למשך 10 דקות בסל"ד x ו - 10,000 supernatants להעביר צינורות חדשים. הערה: נא לא להפריע כדורי במהלך שלב זה
- קביעת ריכוז החלבון 10μl של supernatants בשיטת BCA (פירס)
- מדולל lysates כדי 1mg/ml עם חיץ תמוגה המכיל מעכבי פרוטאז.
4. Immunoprecipitation וזיהוי המערבי כתם של MycKISS1R
- בצע את השלבים הבאים immunoprecipitation על הקרח (או 4 ° C):
- לשטוף את הכמות המתאימה של נוגדן אנטי-myc-agarose מצומדות (2.5μg / לדוגמה) פעמיים עם קרים כקרח PBS ולהוסיף את זה 400μg של חלבון lysate.
- Immunoprecipitate MycKISS1R על lysates לילה ב 4 ° C במצע נדנדה עם תסיסה עדינה.
- ספין למטה חרוזים agarose ידי צנטריפוגה הדופק 4 ° C (עד 10,000 x סל"ד)
- לשאוב ולזרוק supernatants (מבלי להפריע את כדורי)
- לשטוף חרוזים פעם עם חיץ קרים כקרח תמוגה ופעמיים עם קרים כקרח PBS. היפוך צינורות בעדינות לפני ספינינג
- חרוזים Ressuspend המכיל נוגדנים הנכנס MycKISS1R במאגר טעינת 2x מדגם המכיל 10% β-mercaptoethanol.
- כתם המערבי של immunocomplexes MycKISS1R:
- דגימות חום למשך 30 דקות ב 37 ° C. הערה: אין להרתיח דגימות מיועד לאיתור כתם המערבי של חלבונים בממברנה. כמו sonication, רותחים מוביל גם אגרגציה של חלבונים אלה
- העברת צינורות מיד קרח דק 5
- חלבונים נפרדת על ידי SDS עמודים ג'ל שיפוע 4-15%.
- העברה קרום PVDF Immobilon-FL (לגילוי אינפרא אדום) בשעה 25V למשך 30 דקות במאגר העברה (48mM טריס בסיס, 39mM גליצין, 1.2 מ"מ SDS, מתנול 20%, pH 9.2) באמצעות Bio-Rad חצי יבש העברה מנגנון
- לשטוף ממברנות 5 דקות בטמפרטורת החדר עם טריס שנאגרו מלוחים (TBS) ולחסום עבור 1h בטמפרטורת החדר עם אודיסיאה Licor חסימה על פלטפורמת נדנדה (לחלופין, חלב 5% ב TBS יכול לשמש כדי לחסום הלא ספציפית מחייב).
- ממברנות דגירה לילה ב 4 ° C עם נוגדן אנטי-myc ארנב (1:500) בתמיסה המכילה חוסם 0.1% Tween-20
- הסר נוגדן ראשוני לשטוף ממברנות 3 פעמים של 5 דקות כל אחד עם כפות המכיל 0.1% Tween-20 (TBST)
- דגירה ממברנות עבור 1h בטמפרטורת החדר עם אינפרא RedDye ® 800CW שכותרתו עז נגד ארנב IgG (1:10,000) בחסימת חוצץ המכיל 0.1% Tween-20 ו 0.01% SDS
- הסר נוגדנים משנית, לשטוף ממברנות 3 פעמים של 5 דקות כל אחד עם TBST ו בפעם האחרונה עם כפות בלבד (כדי להסיר הנותרים Tween-20)
- הדמיה וכימות MycKISS1R באמצעות LI-COR אינפרא אדום Imager אודיסיאה:
- MycKISS1R על ממברנות יהיה צילמו באמצעות LI-COR אינפרא אדום Imager אודיסיאה. כדי להתחיל, מקום קרום בפינה השמאלית התחתונה של סורק אודיסיאה, ליישר אותו עם הרשת. עם כיסוי שטיח הגומי, להחליק את הבועות עם רולר ולסגור את המכסה
- צור קובץ פרוייקט חדש על המחשב. שם הקובץ, לחץ על "נעשה", ולאחר מכן להזין את פרטי ההתחברות סורק על "סריקה". גודל סורק מסוף תיבת להתאים קרום שלך, ולאחר מכן לבחור ברזולוציה 169μm איכות תמונה בינונית
- בחר את הגדרות עוצמת עבור 700 (אדום) ו - 800 (ירוק) הערוצים על פי חוזק הצפוי של כל אות. זה נועד למטרות ויזואליזציה אות בלבד ולא ישפיעו על כימות. לחץ על "התחל סריקה"
- שם ולשמור את הסריקה, ואז ללחוץ על "אישור" כדי לפתוח אותה בחלון חדש כימות. מונומרים MycKISS1R צריך להיות גלוי על כ 43kD
- באמצעות הכלי "התיבה" (בסרגל הצידי השמאלי), צייר תיבה מסביב הלהקה הראשונה. גרור את תיבת מסביב כדי לוודא את כל להקות מתאים, ואז "העתק" ו "להדביק" את התיבה על כל להקות
- בחר את כל תיבות באמצעות "Ctrl + A", ולאחר מכן לבחור את האפשרות להפחית רקע חציון. לחץ על "דו"ח" בתפריט העליון גיליון אלקטרוני עם הערכים כימות יופיע. תוצאות נציג המוצגים כאן הם represented כמו מתקפלת להגדיל מעל בתאים שלא טופלו (זמן אפס)
5. נציג תוצאות:
- אתר מכוונת mutagenesis רצף מאוד GC-עשיר גן KISS1R:
טבלה 1. מציגה את השילוב של חומרים כימיים כדי לשפר את היעילות של הגברה KISS1R. שילוב זה הוא שימש בהצלחה להציג כמה מוטציות מכוונות נגד אזורים שונים של רצף KISS1R cDNA, כמו גם הגברה של הגן הזה מאוד GC-עשיר. איור 1 מציג רכיבה על אופניים הגברה התנאים mutagenesis של KISS1R. תנאים אלה שונו מן QuikChange לאתר בימוי mutagenesis Kit (Stratagene).
איור 2. מציגה תוצאה נציג בפרוטוקול זה אופטימיזציה. תוספת של DMSO 4% או 8% בשילוב עם Enhancer PCRx משפר משמעותית את התשואה של הגברה של GC-עשיר KISS1R cDNA המכילים פלסמיד. בניסוי זה נציג, DMSO 4% סיפק תנאים הגברה מעט טוב יותר לעומת 8% DMSO. טרנספורמציה של DpnI שטופלו מוצרי הגברה עם ה ultracompetent coli בדרך כלל מניבה 100 מעל 1,000 במושבות, ואת שיעור מבוא מוצלח של מוטציות הרצויה היא 80-90% כפי שנקבע על ידי רצפי DNA. - השימוש בונה MycKISS1R ללמוד פיזיולוגיה הקולטן:
בניסוי זה נציג, סוג בר pCS2 + MycKISS1R מוגבר פי פרוטוקול אופטימיזציה המתואר כאן משמש ללמוד השפלה KISS1 קולטן vivo בקו תא הרלוונטיים (HEK-293) transiently להביע MycKISS1R. לאחר טיפול transfected HEK-293 תאים (MG132) מעכבי ליזוזום (leupeptin) או הפרוטאזום לפי הפרוטוקול המתואר שיטות, התאים lysed ומעובד כתם המערבי. הפאנל העליון של איור 3 מראה את הסריקה של מונומרים MycKISS1R בעוד הפאנל התחתון מראה את כימות של להקות מוצגים בלוח העליון. כימות של להקות מציין כי לא 6 שעות ולא 16h הטיפול leupeptin מושפע רמות MycKISS1R חלבון. לעומת זאת, טיפול עם MG132 הביאה לעלייה תלוי זמן בחלבון MycKISS1R בתאים אלה, המגיע לשיאו עם הצטברות של פי 45 של הקולטן לאחר 16h של דגירה עם MG132. תצפיות אלו מצביעות על כך, בניגוד לרוב G-חלבון בשילוב קולטנים, KISS1R הוא מושפל על ידי הפרוטאזום (ולא ליזוזום).
| DMSO | |||
| ריאגנטים | 0 | 4% | 8% |
| מים | 35 | 33 | 31 |
| 10x Pfu Ultra תקי חיץ | 5 | 5 | 5 |
| dNTP לערבב (10mm) | 1 | 1 | 1 |
| פריימר תחושה (25pmol/μl) | 1 | 1 | 1 |
| פריימר antisense (25pmol/μl) | 1 | 1 | 1 |
| הפתרון 10x PCRx Enhancer | 5 | 5 | 5 |
| DMSO | 0 | 2 | 4 |
| Pfu Ultra תקי פולימראז (2.5U/μl) | 1 | 1 | 1 |
| ה-DNA פלסמיד (20ng/μl) | 1 | 1 | 1 |
טבלה 1. שילוב של חומרים כימיים המשמשים בהצלחה להשתנות ולהגביר את KISS1R GC-עשיר
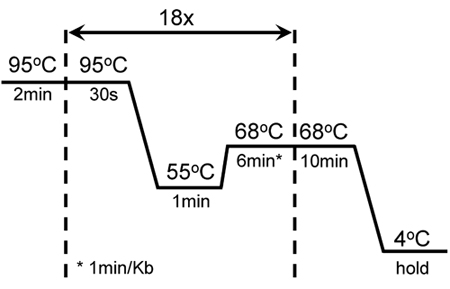
באיור 1. רכיבה על אופניים בתנאי mutagenesis הגברה מוצלחת של KISS1R GC-עשיר: להתחיל חם 2min בעקבות 18 מחזורים של 30 שניות נמס ב 95 מעלות צלזיוס; 1 דקות חישול ב 55 ° C ו 6 דקות הארכה ב 68 ° C. הארכה נוספת 10 דקות ב 68 מעלות צלזיוס נוספה בסוף המחזור האחרון. הגדרות אלה הותאמו מן הפרוטוקול mutagenesis המקורי של XL-II QuikChange לאתר בימוי mutagenesis Kit (Stratagene).
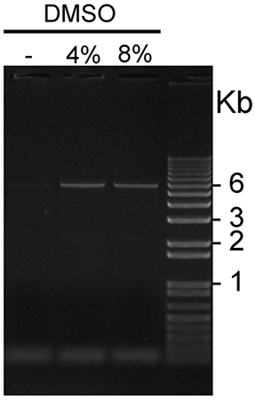
איור 2. ויזואליזציה של GC-myc עשיר pCS2 + KISS1R מוגבר בנוכחות או העדר DMSO: KISS1R myc חמש aliquots μl של pCS2 + מוגבר בנוכחות 0, 4 או 8% DMSO הועמסו זו נציג 1% agarose ג'ל מוכתם ethidium ברומיד ו UV דמיינו באמצעות אור. להקות של פלסמיד 6Kb נראים משני נתיבים עמוסים מוצרים PCR מוגבר בנוכחות של 4% ו DMSO 8%, אך לא על המסלול הראשון, שהיה טעון עם PCRמוצר מוגבר בהעדר DMSO.
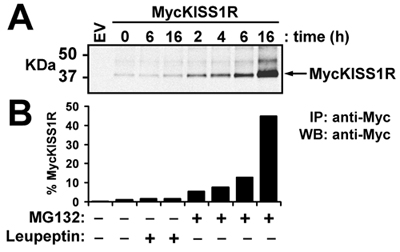
איור 3. השפעת leupeptin או MG132 על רמות של חלבון KISS1R myc ב HEK-293 תאים: HEK-293 תאים להביע myc KISS1R טופלו 100μg/ml leupeptin או 10μM MG132 על 37 מעלות צלזיוס במשך פעמים המיועד. Myc KISS1R על 400μg של lysate התא היה immunoprecipitated עם 2.5μg של נוגדן אנטי-myc-agarose מצומדות ונותחו על ידי כתם המערבי. (א) LI-COR אודיסיאה זיהוי של KISS1R myc לאחר דגירה של immunoblots עם נוגדן אנטי-myc תג ארנב ואחריו הדגירה עם IRDye 800CW שכותרתו ארנבת אנטי (ב) כימות של להקות KISS1R myc שמוצג (א) באמצעות LI-COR כימות אודיסיאה תוכנה. תוצאות מיוצגים מתקפלת להגדיל מעל בתאים שלא טופלו (זמן 0).
Discussion
אתר מכוונת mutagenesis שימש ללמוד תפקוד החלבון על ידי החדרת שינויים נוקלאוטיד ברצף קידוד של גנים ממוקד עבור למעלה משלושה עשורים. הטכניקה המקורית תוארה בשנת 1978 על ידי הכימאי הבריטי הקנדי, חתן פרס נובל מייקל סמית' 10. מייקל סמית חלקו את 1993 פרס נובל לכימיה עם Kary מוליס, ב...
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
עבודה זו מומנה בחלקה על ידי אגף הרבייה של המכון הלאומי לבריאות הילד והתפתחות האדם (NICHD - R21 HD059015) ועל ידי ה 'הוד קרן פרס צ'רלס יאנג הילד החוקר למחקר בריאות (בוסטון, MA).
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | |
| הפתרון 10x PCRx Enhancer | Invitrogen | 52391 | |
| PfuUltra באיכות גבוהה פולימראז ה-DNA אלטרנטיבית דטרגנט | Stratagene | 600385 | |
| DPN-I | ניו אינגלנד Biolabs | R0176 | |
| XL10-Gold E. Ultracompetent coli תאים | Stratagene | 200314 | |
| DMEM | Cellgro | 10-013-CV | |
| בסרום שור עוברית | אטלנטה הביולוגיים | S11550 | |
| Geneporter מגיב transfection | Genlantis | T201007 | |
| Leupeptin | Calbiochem | 108975 | |
| MG132 | Calbiochem | 47491 | |
| 10xPBS | Ambion | AM9625 | |
| מעכבי פרוטאז קוקטייל PMSF | סנטה קרוז ביוטכנולוגיה | SC-24948 | |
| פירס Assay BCA חלבון Kit | Thermo Scientific | 23225 | |
| אנטי-myc תג (שיבוט 4A6) agarose המצומד | Millipore | 16-219 | |
| 2x חיץ העמסה | BioRad | 161-0737 | |
| קריטריון טריס-HCl precast ג'ל, שיפוע 4-15% | BioRad | 345-0028 | |
| Immobilon-FL PVDF קרום | Millipore | IPFL00010 | |
| אודיסיאה חסימת הצפת | LI-COR Biosciences | 927-40000 | |
| 10xTBS | BioRad | 170-6435 | |
| נוגדנים נגד ארנב-myc | תא האיתות | 2272 | |
| נגד ארנב עיזים IRDye 800CW | LI-COR Biosciences | 926-32211 | |
| הדמיה אודיסיאה אינפרא אדום מערכת | LI-COR Biosciences | ||
| מעכבי פרוטאז האלט קוקטייל (100x) | Thermo Scientific | 78430 |
References
- Seminara, S. B., Messager, S., Chatzidaki, E. E. The GPR54 Gene as a Regulator of Puberty. N Engl J Med. 349, 1614-1627 (2003).
- de Roux, N., Genin, E., Carel, J. C. Hypogonadotropic Hypogonadism Due to Loss of Function of the KiSS1-Derived Peptide Receptor GPR54. Proc Natl Acad Sci U S A. 100, 10972-10976 (2003).
- Messager, S., Chatzidaki, E. E., Ma, D. Kisspeptin Directly Stimulates Gonadotropin-Releasing Hormone Release via G Protein-Coupled Receptor 54. Proc Natl Acad Sci U S A. 102, 1761-1766 (2005).
- Teles, M. G., Bianco, S. D., Brito, V. N. A GPR54-Activating Mutation in a Patient with Central Precocious Puberty. N Engl J Med. 358, 709-715 (2008).
- Tenenbaum-Rakover, Y., Commenges-Ducos, M., Iovane, A. Neuroendocrine Phenotype Analysis in Five Patients with Isolated Hypogonadotropic Hypogonadism due to a L102P Inactivating Mutation of GPR54. J Clin Endocrinol Metab. 92, 1137-1144 (2007).
- Semple, R. K., Achermann, J. C., Ellery, J. Two Novel Missense Mutations in G Protein-Coupled Receptor 54 in a Patient with Hypogonadotropic Hypogonadism. J Clin Endocrinol Metab. 90, 1849-1855 (2005).
- Wacker, J. L., Feller, D. B., Tang, X. B. Disease-Causing Mutation in GPR54 Reveals the Importance of the Second Intracellular Loop for Class A G-Protein-Coupled Receptor Function. J Biol Chem. 283, 31068-31078 (2008).
- Szereszewski, J. M., Pampillo, M., Ahow, M. R. GPR54 regulates ERK1/2 activity and hypothalamic gene expression in a Galpha(q/11) and beta-arrestin-dependent manner. PLoS One. 5, e12964-e12964 (2010).
- Bianco, S. D. C., Vandepas, L., Correa-Medina, M., Gereben, B., Mukherjee, A., Kuohung, W., Carroll, R., Teles, M. G., Latronico, A. C., Kaiser, U. B. KISS1R Intracellular Trafficking and Degradation: Effect of the Arg386Pro Disease-Associated Mutation. Endocrinology. , (2011).
- Hutchison, C. A., Phillips, S., Edgell, M. H. Mutagenesis at a Specific Position in a DNA Sequence. J Biol Chem. 253, 6551-6560 (1978).
- Mullis, K. B. The Unusual Origin of the Polymerase Chain Reaction. Sci Am. 262, 56-61 (1990).
- Henke, W., Herdel, K., Jung, K., Schnorr, D., Loening, S. A. Betaine improves the PCR amplification of GC-rich DNA sequences. Nucleic Acids Res. 25, 3957-3958 (1997).
- Sahdev, S., Saini, S., Tiwari, P., Saxena, S., Singh Saini, K. Amplification of GC-rich genes by following a combination strategy of primer design, enhancers and modified PCR cycle conditions. Mol Cell Probes. 21, 303-307 (2007).
- Kong, K. C., Poyner, D. R., Wheatly, M. Chapter 10. MSTA. in G Protein-Coupled Receptors: Essential Methods. , 197-204 (2010).
- Hall, R. A., George, S. R., O'Dowd, B. F. Chapter 9. G protein-Coupled Receptor-Protein Interactions. , 170-171 (2005).
- Chaturvedi, K., Bandari, P., Chinen, N., Howells, R. D. Proteasome Involvement in Agonist-Induced Down-Regulation of Mu and Delta Opioid Receptors. J Biol Chem. 276, 12345-12355 (2001).
- Shenoy, S. K., McDonald, P. H., Kohout, T. A., Lefkowitz, R. J. Regulation of Receptor Fate by Ubiquitination of Activated Beta 2-Adrenergic Receptor and Beta-Arrestin. Science. 294, 1307-1313 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved