Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mutagenese und Analyse von genetischen Mutationen in den GC-reichen KISS1 Rezeptor-Sequenz in Menschen mit Fortpflanzungsstörungen Identified
In diesem Artikel
Zusammenfassung
Mutationen in den kisspeptin Rezeptor (KISS1R) sind mit reproduktiven Störungen bei Patienten assoziiert. Hier beschreiben wir, wie Mutationen der Interesse an der GC-reiche Sequenz von KISS1R sowie die Verwendung von KISS1R Konstrukte einzuführen, um die Abbauweg des Rezeptors durch Immunpräzipitation und Western-Blot charakterisieren
Zusammenfassung
Die kisspeptin Rezeptor (KISS1R) ist ein G-Protein-gekoppelten Rezeptor als Auslöser der Pubertät und ein Regulator des reproduktiven Kompetenz im Erwachsenenalter 1,2,3 anerkannt. Inaktivierende Mutationen in KISS1R bei Patienten identifiziert haben mit iodiopathic Hypogonadismus (IHH) 1,2 und vorzeitiger Pubertät 4 wurde verbunden. Funktionelle Untersuchungen dieser Mutanten sind entscheidend für unser Verständnis der Mechanismen der Regulation der Fortpflanzung durch diesen Rezeptor als auch die Gestaltung der Krankheitsverläufe, die sich aus abnormen KISS1R Signalisierung und Funktion. Allerdings macht der hohe GC-reiche Sequenz des Gens KISS1R es ziemlich schwierig zu Mutationen einzuführen oder zu verstärken Gen für diesen Rezeptor durch PCR.
Hier beschreiben wir eine Methode, um Mutationen von Interesse in diesem sehr GC-reiche Sequenz, die verwendet wurde erfolgreich zu generieren mehr als ein Dutzend KISS1R Mutanten in unserem Labor einzuführen. Wir haben die PCR-Bedingungen optimiert, um die Verstärkung von einer Reihe von KISS1R Mutanten, die Substitutionen, Deletionen oder Insertionen in der KISS1R Sequenz enthalten erleichtern. Die Zugabe eines PCR-Enhancer-Lösung, sowie ein kleiner Prozentsatz von DMSO wurden besonders hilfreich, um Verstärkung zu verbessern. Dieses optimierte Verfahren kann sinnvoll sein, für andere GC-reiche Templates als auch.
Der Expressionsvektor kodiert KISS1R ist benutzt worden, um Signalisierung und Funktion dieses Rezeptors zu charakterisieren, um zu verstehen, wie Mutationen können KISS1R Funktion zu ändern und zu den damit verbundenen reproduktiven Phänotypen. Dementsprechend können mögliche Anwendungen KISS1R Mutanten durch Mutagenese erzeugt durch viele Studien 1,4,5,6,7,8 dargestellt werden. Als Beispiel hat das gain-of-function-Mutation in der KISS1R (Arg386Pro), die mit vorzeitiger Pubertät verbunden ist, gezeigt worden, um die Reaktionsfähigkeit des Rezeptors an Ligand Stimulation 4 sowie zu verlängern, um die Geschwindigkeit des Abbaus von KISS1R 9 verändern . Interessanterweise zeigen unsere Studien, dass KISS1R durch das Proteasom degradiert wird, im Gegensatz zu den klassischen lysosomalen Abbau für die meisten G-Protein gekoppelte Rezeptoren 9 beschrieben entgegen. In dem hier vorgestellten Beispiel wird der Abbau der KISS1R in humanen embryonalen Nierenzellen (HEK-293) transient exprimierenden Myc-markierten KISS1R (MycKISS1R) untersucht und behandelt mit Proteasom-Inhibitoren oder Lysosom. Zelllysate werden immunpräzipitiert mit einem Agarose-konjugierten anti-myc-Antikörper durch Western-Blot-Analyse. Detektion und Quantifizierung von MycKISS1R auf Blots erfolgt mit dem LI-COR Odyssey Infrarot-System. Dieser Ansatz kann in der Studie der Abbau anderer Proteine von Interesse als auch nützlich.
Protokoll
1. Die ortsspezifische Mutagenese von hoch GC-reiche KISS1R Gensequenz
- Vorlage: volle cDNA-Sequenz des menschlichen KISS1R mit einem Myc-tag fusioniert an seinem N-Terminus. Diese Sequenz wird in die pCS2 + Expressionsvektor, der kompatibel mit dem Säugerzelllinien anschließend für Transfektionen verwendet wird geklont. Dieser Expressionsvektor wird hier als pCS2 + Myc KISS1R bezeichnet.
- Primer-Design: Primer sind so konzipiert, gewünschten Mutationen tragen, nach den Anweisungen des Quikchange ortsspezifische Mutagenese-Kit (Stratagene). Zusammengefasst:
- Beide (vorwärts und rückwärts) Primer müssen die gewünschte Mutation und Glühen auf der gleichen Reihenfolge auf gegenüberliegenden Strängen des Plasmids (zB Vorwärts-und Rückwärts-Primer sind komplementär zueinander)
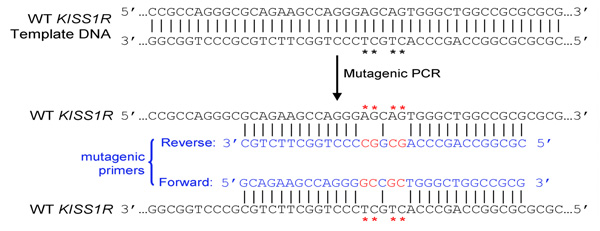
- Grundierungen sollten 25 bis 45 Basen lang und am Ende in einem oder mehreren C-oder G-Basen
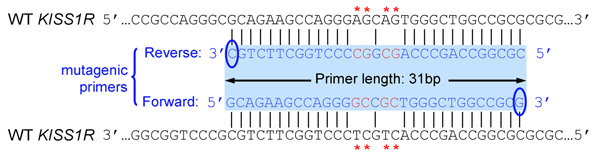

- Eingeführt Mutation (en) sollte in der Mitte der Primer und flankiert von ~ 10-15 Grundlagen der richtigen Reihenfolge auf beiden Seiten
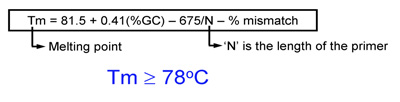
- Schmelztemperatur (Tm) der Primer sollte gleich oder größer als 78 ° C. Verwenden Sie die folgenden Formeln, um Tm Schätzung:
- Bei der Einführung von Mutationen: Tm = 81,5 + 0,41 (% GC) - 675 / N -% mismatch (N ist die Grundierung Länge in Basen)
- Bei der Einführung von Insertionen oder Deletionen: Tm = 81,5 + 0,41 (% GC) - 675 / N (N umfasst nicht die Basen, die als eingefügt oder gelöscht werden)
- Verwenden Sie entsalzt Primer (keine weiteren Reinigungen notwendig).
- Beide (vorwärts und rückwärts) Primer müssen die gewünschte Mutation und Glühen auf der gleichen Reihenfolge auf gegenüberliegenden Strängen des Plasmids (zB Vorwärts-und Rückwärts-Primer sind komplementär zueinander)
- Die beste Verstärkung Bedingungen umfassen die Zugabe von PCRx Enhancer-Lösung (Invitrogen) und DMSO. Mindestens 2-Konzentrationen von DMSO, wie z. B. 4% und 8% liegt, sollte geprüft werden. Und Ergebnisse einer repräsentativen PCR-Amplifikation von pCS2 + MycKISS1R in Abbildung 2 dargestellt ist; PCR-Bedingungen sind in Tabelle I und in Abbildung 1 dargestellt.
- Beseitigen Sie die elterliche DNA auf Amplifikationsprodukte durch Verdauung von methylierter DNA mit DpnI für 1h 30min bei 37 ° C: mix in ein Zentrifugenröhrchen 17.5μl von PCR-Produkt mit 2μl 10x NEBuffer 4 und 0.5μl von DpnI (10U, New England Biolabs).
- Mix 2μl der DpnI-behandelten DNA mit 45μl der XL10-Gold Ultracompetent E.: Transform PCR-Produkt DpnI behandelten coli (Stratagene) in vorgekühlte 15 ml Zellkultur Röhre. Add 2μl von β-Mercaptoethanol und folgen Stratagene Anweisungen. Platte 100-400μl der transformierten Bakterien in LB-Agarplatten mit 100μg/ml Ampicillin und bei 37 ° C.
- Miniprep 2 bis 4 einzelne Kolonien zu isolieren Plasmid-DNA. Bestätigen Sie die erfolgreiche Einführung der gewünschten Mutationen durch Sequenzierung und Analyse der isolierten DNA.
2. Transiente Transfektion von MycKISS1R in HEK-293 Zellen
- Die folgenden Versuche sind in humanen embryonalen Nierenzellen (HEK-293) in einer CO 2-Inkubator (5% CO 2) bei 37 ° C durchgeführt in DMEM mit 10% fötalem Rinderserum (FBS) und 1% Penicillin / Streptomycin ergänzt.
- Seed HEK-293 Zellen in 2.5x10 5 Zellen / ml in 6-Well-Platten und lasse sie wachsen über Nacht bei 37 ° C vor der Transfektion. HINWEIS: (i) Verwendung dreifachen Wells für jede experimentelle Bedingung (ii) ideal Zellkonfluenz zum Zeitpunkt der Transfektion 30% -50%.
- Transfizieren HEK-293 Zellen unter Verwendung des GenePorter Transfektionsreagenz (Genlantis), nach den Anweisungen des Herstellers: Mix Hälfte des serumfreien DMEM mit 0.5μg pCS2 + MycKISS1R Plus 0.5μg Kontrolle (leer) Vektor summieren 1 g DNA / well. Mix die andere Hälfte mit 10 &mgr; l Transfektionsreagenz pro ug DNA transfiziert. Hinweis: Ideal Plasmid-DNA-Konzentration variieren.
3. Zell-Lyse-Behandlung und
- 24 Stunden nach der Transfektion ersetzen Zellmedium mit 1 ml DMEM mit 2,5% FBS (den Zellstoffwechsel Abnahme). Hinweis: Dieser Rückgang im Serum kann zu erleichtern und / oder verstärken den Nachweis von Ergebnissen.
- Add Lysosom Inhibitor (100 &mgr; g / Vertiefung Leupeptin) direkt in jede Vertiefung einer gesamten 6-Well-Platte. Bei 37 ° C für 6 oder 16 h (oder anderen gewünschten Zeiten)
- Fügen Sie frisch zubereitete Proteasom-Inhibitor (10 um / Vertiefung MG132) direkt in alle Vertiefungen von zwei ganzen 6-well Platten. Bei 37 ° C für 2, 4, 6 oder 16 Uhr (oder gewünschten Zeiten). Add Fahrzeug in alle Vertiefungen der vierten 6-Well-Platte (0 Zeit-Punkt) und bei 37 ° C für 16h
- Als Inkubationszeit vorbei ist, bewegen Platten zu Eis, und führen Sie diese ganze Lyseverfahren auf Eis zu Proteinabbau zu verhindern:
- Zur Erhöhung der Ausbeute an Protein, verbinden die dreifach auf 6-well Platten in einer einzigen centrifuge Rohr
- Saugen Sie mittel-und waschen Sie die Zellen einmal mit 1 ml eiskaltem Phosphat-gepufferter Kochsalzlösung (PBS)
- Add 100 &mgr; eiskaltem Lysepuffer (20 mM HEPES, pH 7,4, 1% NP-40, 150 mM NaCl, 1 mM EDTA, 0,25% Natriumdeoxycholat) mit Protease-Inhibitoren (1x Cocktail mit 100 mM AEBSF-HCl, 80 um Aprotinin, 5 mM Bestatin, 1,5 mM E-64, 0,5 M EDTA, 2 mM Leupeptin und 1 mM Pepstatin A, plus 2 mM PMSF) in jede Vertiefung
- Entfernen Sie Zellen mit einem Zellschaber und Transfer Zelllysaten zu Röhren-Zentrifuge
- Pass-Zellen ~ 10 mal durch eine 20-Gauge-Nadel. HINWEIS: Nicht beschallen Proben für Western-Blot-Detektion von Membranproteinen soll. Ultraschallbehandlung führt zur Aggregation von Membranproteinen, die nicht migrieren ordnungsgemäß während der Elektrophorese
- Inkubieren Zelllysaten für 1h bei 4 ° C auf einem Wippschüttler
- Centrifuge Zelllysate bei 4 ° C für 10 min bei 10.000 x rpm und Transfer Überstände auf neue Röhren. HINWEIS: Bitte nicht stören Pellets bei diesem Schritt
- Bestimmen Protein-Konzentration in 10 &mgr; l der Überstände mit dem BCA-Methode (Pierce)
- Verdünnen Lysaten mit Lysepuffer Proteaseinhibitoren 1mg/ml.
4. Immunpräzipitation und Western-Blot-Detektion von MycKISS1R
- Führen Sie die folgenden Schritte Immunpräzipitation auf Eis (oder bei 4 ° C):
- Waschen Sie die entsprechende Menge an Agarose-konjugierten anti-myc Antikörper (2.5μg / Probe) zweimal mit eiskaltem PBS und stell 'das zu 400μg Lysat Protein.
- Immunopräzipitat die MycKISS1R auf Lysate über Nacht bei 4 ° C in einem Schaukelstuhl Plattform unter leichtem Schütteln.
- Spin down Agaroseperlen durch Puls-Zentrifugation bei 4 ° C (bis zu 10.000 x min)
- Absaugen und entsorgen Überständen (ohne Störung des Pellets)
- Wash Perlen einmal mit eiskaltem Lysepuffer und zweimal mit eiskaltem PBS. Invert Röhrchen leicht vor dem Spinnen
- Ressuspend Kügelchen, Antikörper-gebundenen MycKISS1R in 2x Probe Ladepuffer mit 10% β-Mercaptoethanol.
- Western-Blot von MycKISS1R Immunkomplexen:
- Hitze Proben für 30 min bei 37 ° C Hinweis: Nicht kochen Proben für Western-Blot-Detektion von Membranproteinen soll. Wie Beschallung, Kochen führt auch zu Aggregation dieser Proteine
- Bewegen Rohre sofort in Eis für 5 min
- Separate Proteine durch SDS-PAGE in einem 4-15% Gradienten-Gel.
- Transfer zum Immobilon-FL PVDF-Membran (für Infrarot-Detektion) bei 25V für 30 min in Transfer-Puffer (48mm Tris-Base, 39mm Glycin, 1,2 SDS, 20% Methanol, pH 9,2) unter Verwendung des Bio-Rad Semi-Dry Transfer- Apparat
- Wash-Membranen für 5 min bei Raumtemperatur mit Tris-Buffered Saline (TBS) und Block für 1h bei Raumtemperatur mit Licor Odyssey Blocking auf einer schaukelnden Plattform (alternativ 5% Milch in TBS kann verwendet werden, um unspezifische Bindung zu blockieren).
- Inkubieren Membranen über Nacht bei 4 ° C mit Kaninchen-anti-myc-Antikörper (1:500) in Blocking-Lösung mit 0,1% Tween-20
- Entfernen Primärantikörper und waschen Membranen 3 mal jeweils 5 min mit TBS mit 0,1% Tween-20 (TBST)
- Inkubieren Membranen für 1h bei Raumtemperatur mit Ziegen-Infra-RedDye ® 800CW-markierten Anti-Kaninchen-IgG (1:10000) in Blocking-Puffer mit 0,1% Tween-20 und 0,01% SDS
- Entfernen sekundären Antikörper, sie zu waschen 3 mal jeweils 5 min mit TBST und ein letztes Mal mit TBS nur (zum Löschen verbleibender Tween-20)
- Imaging und Quantifizierung von MycKISS1R mit dem LI-COR Odyssey Infra-Red Imager:
- Die MycKISS1R auf den Membranen wird abgebildet mit dem LI-COR Odyssey Infra-Red Imager werden. Um zu beginnen, statt Membran auf der linken unteren Ecke der Odyssey-Scanner, indem er sie mit dem Netz. Deckel mit der Gummimatte, glätten Blasen mit Walze und schließen Sie den Deckel
- Erstellen Sie eine neue Projekt-Datei auf dem Computer. Benennen Sie die Datei, klicken Sie auf "Fertig", und geben Sie dann den Scanner Login auf "Scan". Größe der Scanner-Konsole zu Ihrem Membran passen, und wählen Sie dann 169μm Auflösung und mittlerer Bildqualität
- Wählen Sie die Intensität Einstellungen für 700 (rot) und 800 (grün)-Kanäle entsprechend der erwarteten Stärke der einzelnen Signal. Dies ist für das Signal nur der Visualisierung und wird keinen Einfluss auf die Quantifizierung. Klicken Sie auf "Start scan"
- Benennen und speichern Sie den Scan, klicken Sie dann auf "OK", um es auf ein neues Fenster für die Quantifizierung zu öffnen. MycKISS1R Monomere sollte bei ca. 43kD sichtbar
- Mit der "Box"-Tool (auf der linken Seitenleiste), zeichnen Sie ein Feld um den ersten Band. Ziehen Sie den Rahmen um sicherzustellen, dass alle Bands passen, dann "Kopieren" und "Einfügen" das Feld über alle Bänder
- Wählen Sie alle Felder mit "Strg + A", und wählen Sie dann die Option zum Median Hintergrund subtrahieren. Klicken Sie auf "Bericht" in der oberen Menüleiste und eine Tabelle mit der Quantifizierung Werte erscheint. Repräsentative Ergebnisse hier gezeigten represented als über unbehandelten Zellen-facher Anstieg (Zeitpunkt Null)
5. Repräsentative Ergebnisse:
- Die ortsspezifische Mutagenese von hoch GC-reiche KISS1R Gensequenz:
Tabelle 1. Zeigt die Kombination von Reagenzien, um die Effizienz der KISS1R Verstärkung zu verbessern. Diese Kombination ist erfolgreich eingesetzt, um mehrere Mutationen gegen verschiedene Regionen der KISS1R cDNA-Sequenz gerichtet ist, sowie für die Verstärkung von diesem hoch GC-rich Gen einzuführen. Abbildung 1 zeigt Radfahren und Verstärkung Bedingungen für die Mutagenese von KISS1R. Diese Bedingungen wurden von der QuikChange ortsspezifische Mutagenese-Kit (Stratagene) geändert worden.
Abbildung 2. Zeigt ein repräsentatives Ergebnis mit dieser optimierten Protokoll. Der Zusatz von 4% bzw. 8% DMSO mit dem PCRx Enhancer kombiniert deutlich verbessert Ertrag Verstärkung der GC-reichen KISS1R cDNA-haltigen Plasmid. In dieser repräsentativen Experiment, vorausgesetzt, 4% DMSO etwas besser Amplifikationsbedingungen im Vergleich zu 8% DMSO. Transformation von DpnI behandelten Amplifikationsprodukte mit ultracompetent E. coli typischerweise Erträge von 100 bis über 1.000 Kolonien, und die Rate der erfolgreichen Einführung der gewünschten Mutationen liegt bei 80-90%, wie durch DNA-Sequenzierung bestimmt. - Verwendung von MycKISS1R Konstrukte Rezeptor Physiologie zu studieren:
In dieser repräsentativen Experiment, das Wildtyp-pCS2 + MycKISS1R nach dem optimierten Protokoll hier beschriebene wird verwendet, um in vivo KISS1 Rezeptor Abbau in einem relevanten Zelllinie (HEK-293) transient exprimierenden MycKISS1R Studie verstärkt. Nach der Behandlung der transfizierten HEK-293 Zellen mit Lysosomen (Leupeptin) oder Proteasom (MG132)-Hemmer nach dem Protokoll in Methoden beschrieben, werden die Zellen lysiert und verarbeitet Western-Blot. Die obere Teil der Abbildung 3 zeigt die Untersuchung des MycKISS1R Monomere während der untere Feld zeigt die Quantifizierung der Banden am oberen Bedienfeld angezeigt. Die Quantifizierung der Banden zeigt an, dass weder 6h noch 16h von Leupeptin Behandlung MycKISS1R Protein-Ebene betroffen. Umgekehrt führte die Behandlung mit MG132 in einem zeitabhängigen Anstieg der MycKISS1R Protein in diesen Zellen, die mit einem 45-fachen Anreicherung des Rezeptors nach 16h Inkubation mit MG132 gipfelt. Diese Beobachtungen deuten darauf hin, dass anders als die meisten G-Protein gekoppelte Rezeptoren, KISS1R durch das Proteasom degradiert (anstatt das Lysosom) ist.
| DMSO | |||
| Reagenzien | 0 | 4% | 8% |
| Wasser | 35 | 33 | 31 |
| 10x Pfu Ultra-Taq-Puffer | 5 | 5 | 5 |
| dNTP-Mix (10 mM) | 1 | 1 | 1 |
| Primer Sinn (25pmol/μl) | 1 | 1 | 1 |
| Primer antisense (25pmol/μl) | 1 | 1 | 1 |
| 10x PCRx Enhancer Solution | 5 | 5 | 5 |
| DMSO | 0 | 2 | 4 |
| Pfu Ultra-Taq-Polymerase (2.5U/μl) | 1 | 1 | 1 |
| Plasmid-DNA (20ng/μl) | 1 | 1 | 1 |
Tabelle 1. Kombination von Reagenzien erfolgreich eingesetzt zu mutieren und verstärken die GC-reiche KISS1R
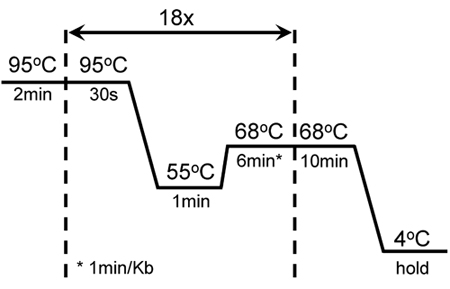
Abbildung 1. Radfahren Bedingungen für eine erfolgreiche Mutagenese und Amplifikation von GC-reichen KISS1R: A 2min Warmstart wurde von 18 Zyklen von 30 sec mit einem Schmelzpunkt von 95 ° C, 1 min Annealing bei 55 ° C und 6 min Verlängerung bei 68 ° C. Ein weiterer 10 min Verlängerung bei 68 ° C wurde am Ende des letzten Zyklus aufgenommen. Diese Einstellungen wurden aus dem ursprünglichen Mutagenese Protokoll der QuikChange II XL-Site-Mutagenese-Kit (Stratagene) eingestellt.
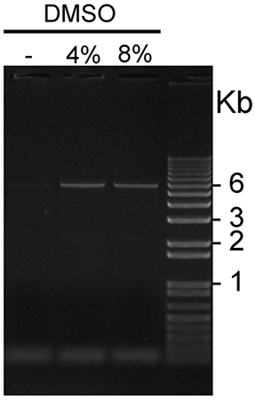
Abbildung 2. Visualisierung von GC-reichen pCS2 + Myc KISS1R in der Anwesenheit oder Abwesenheit von DMSO verstärkt: Fünf ul Aliquots pCS2 + Myc KISS1R in Gegenwart von 0 verstärkt, 4 oder 8% DMSO wurden in dieser repräsentativen 1% Agarosegel geladen gefärbt mit Ethidiumbromid Bromid und visualisiert mit UV-Licht. Die Plasmid-Bands 6Kb sichtbar auf beiden Fahrspuren mit PCR-Produkten in Gegenwart von 4% verstärkt und 8% DMSO geladen, aber nicht auf der ersten Spur, die mit einer PCR geladenProdukt in der Abwesenheit von DMSO verstärkt.
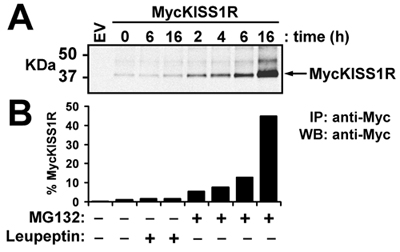
Abbildung 3. Wirkung von Leupeptin oder MG132 über die Höhe der Myc-Protein KISS1R in HEK-293 Zellen: HEK-293 Zellen, die Myc KISS1R wurden mit 100μg/ml Leupeptin oder 10 um MG132 bei 37 ° C für den bestimmten Zeiten. Myc KISS1R auf 400μg Zelllysat wurde mit 2.5μg Agarose-konjugierten anti-myc-Antikörper immunpräzipitiert und mittels Western Blot. (A) LI-COR Odyssey Nachweis von Myc KISS1R nach Inkubation von Immunoblots mit Kaninchen-anti-Myc-tag Antikörper durch Inkubation mit IRDye 800CW-markierten Anti-Kaninchen gefolgt; (B) Quantifizierung von Myc KISS1R Bands in (A) mit dem LI-COR Odyssey Quantifizierung Software. Die Ergebnisse sind dargestellt als über unbehandelten Zellen (Zeitpunkt 0)-facher Anstieg.
Diskussion
Die ortsspezifische Mutagenese wurde verwendet, um Protein-Funktion durch die Einführung von Nukleotid-Veränderungen in der kodierenden Sequenz von gezielten Gene für mehr als drei Jahrzehnten zu studieren. Die ursprüngliche Technik wurde 1978 von dem britisch-kanadische Chemiker und Nobelpreisträger Michael Smith 10 beschrieben. Michael Smith gemeinsam die 1993 den Nobelpreis für Chemie mit Kary Mullis, der amerikanische Biochemiker, der die Polymerase Chain Reaction (PCR) 11 erfunden. Die u...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Und von der Charles H. Hood Foundation Young Investigator Child Health Research Award (Boston, MA) - Diese Arbeit wurde teilweise durch die Reproduktionsmedizin Abteilung der National Institute of Child Health and Human Development (R21 HD059015 NICHD) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| 10x PCRx Enhancer Solution | Invitrogen | 52391 | |
| PfuUltra High-Fidelity DNA Polymerase Alternative Reinigungsmittel | Stratagene | 600385 | |
| DPN-I | New England Biolabs | R0176 | |
| XL10-Gold Ultracompetent E. coli-Zellen | Stratagene | 200314 | |
| DMEM | CellGro | 10 bis 013-CV | |
| Rinderfötenserum | Atlanta Biologicals | S11550 | |
| Geneporter Transfektionsreagenz | Genlantis | T201007 | |
| Leupeptin | Calbiochem | 108975 | |
| MG132 | Calbiochem | 47491 | |
| 10xPBS | Ambion | AM9625 | |
| Protease-Inhibitor-Cocktail und PMSF | Santa Cruz Biotechnology | Sc-24948 | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| anti-Myc-Tag (Klon 4A6) Agarose-Konjugat | Millipore | 16-219 | |
| 2x Ladepuffer | BioRad | 161-0737 | |
| Criterion Tris-HCl Fertigteil-Gel, 4-15% Steigung | BioRad | 345-0028 | |
| Immobilon-FL PVDF-Membran | Millipore | IPFL00010 | |
| Odyssey Blocking Buffer | LI-COR Biosciences | 927-40000 | |
| 10xTBS | BioRad | 170-6435 | |
| Rabbit anti-myc-Antikörper | Zelluläre Signale | 2272 | |
| Ziege Anti-Kaninchen-IRDye 800CW | LI-COR Biosciences | 926-32211 | |
| Odyssey Imaging Infrared Systems | LI-COR Biosciences | ||
| Halt Protease Inhibitor Cocktail (100x) | Thermo Scientific | 78430 |
Referenzen
- Seminara, S. B., Messager, S., Chatzidaki, E. E. The GPR54 Gene as a Regulator of Puberty. N Engl J Med. 349, 1614-1627 (2003).
- de Roux, N., Genin, E., Carel, J. C. Hypogonadotropic Hypogonadism Due to Loss of Function of the KiSS1-Derived Peptide Receptor GPR54. Proc Natl Acad Sci U S A. 100, 10972-10976 (2003).
- Messager, S., Chatzidaki, E. E., Ma, D. Kisspeptin Directly Stimulates Gonadotropin-Releasing Hormone Release via G Protein-Coupled Receptor 54. Proc Natl Acad Sci U S A. 102, 1761-1766 (2005).
- Teles, M. G., Bianco, S. D., Brito, V. N. A GPR54-Activating Mutation in a Patient with Central Precocious Puberty. N Engl J Med. 358, 709-715 (2008).
- Tenenbaum-Rakover, Y., Commenges-Ducos, M., Iovane, A. Neuroendocrine Phenotype Analysis in Five Patients with Isolated Hypogonadotropic Hypogonadism due to a L102P Inactivating Mutation of GPR54. J Clin Endocrinol Metab. 92, 1137-1144 (2007).
- Semple, R. K., Achermann, J. C., Ellery, J. Two Novel Missense Mutations in G Protein-Coupled Receptor 54 in a Patient with Hypogonadotropic Hypogonadism. J Clin Endocrinol Metab. 90, 1849-1855 (2005).
- Wacker, J. L., Feller, D. B., Tang, X. B. Disease-Causing Mutation in GPR54 Reveals the Importance of the Second Intracellular Loop for Class A G-Protein-Coupled Receptor Function. J Biol Chem. 283, 31068-31078 (2008).
- Szereszewski, J. M., Pampillo, M., Ahow, M. R. GPR54 regulates ERK1/2 activity and hypothalamic gene expression in a Galpha(q/11) and beta-arrestin-dependent manner. PLoS One. 5, e12964-e12964 (2010).
- Bianco, S. D. C., Vandepas, L., Correa-Medina, M., Gereben, B., Mukherjee, A., Kuohung, W., Carroll, R., Teles, M. G., Latronico, A. C., Kaiser, U. B. KISS1R Intracellular Trafficking and Degradation: Effect of the Arg386Pro Disease-Associated Mutation. Endocrinology. , (2011).
- Hutchison, C. A., Phillips, S., Edgell, M. H. Mutagenesis at a Specific Position in a DNA Sequence. J Biol Chem. 253, 6551-6560 (1978).
- Mullis, K. B. The Unusual Origin of the Polymerase Chain Reaction. Sci Am. 262, 56-61 (1990).
- Henke, W., Herdel, K., Jung, K., Schnorr, D., Loening, S. A. Betaine improves the PCR amplification of GC-rich DNA sequences. Nucleic Acids Res. 25, 3957-3958 (1997).
- Sahdev, S., Saini, S., Tiwari, P., Saxena, S., Singh Saini, K. Amplification of GC-rich genes by following a combination strategy of primer design, enhancers and modified PCR cycle conditions. Mol Cell Probes. 21, 303-307 (2007).
- Kong, K. C., Poyner, D. R., Wheatly, M. Chapter 10. MSTA. in G Protein-Coupled Receptors: Essential Methods. , 197-204 (2010).
- Hall, R. A., George, S. R., O'Dowd, B. F. Chapter 9. G protein-Coupled Receptor-Protein Interactions. , 170-171 (2005).
- Chaturvedi, K., Bandari, P., Chinen, N., Howells, R. D. Proteasome Involvement in Agonist-Induced Down-Regulation of Mu and Delta Opioid Receptors. J Biol Chem. 276, 12345-12355 (2001).
- Shenoy, S. K., McDonald, P. H., Kohout, T. A., Lefkowitz, R. J. Regulation of Receptor Fate by Ubiquitination of Activated Beta 2-Adrenergic Receptor and Beta-Arrestin. Science. 294, 1307-1313 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten