需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
交付的治疗药物通过侧脑室(ICV)和静脉(IV)注射液在小鼠
摘要
本文演示了两种非常不同的方法:注射入脑(脑室)和2)全身(静脉注射)1)引入到中央的新生小鼠的中枢神经系统治疗药物。
摘要
尽管血脑屏障的保护作用,起着屏蔽大脑,中枢神经系统(CNS)的访问限制, 设计 1,2神经退行性疾病的潜在疗法的失败中最常见的结果。神经退行性疾病,如脊髓性肌萎缩症(SMA),下运动神经元受到影响,可以极大地受益,从引进治疗药物进入中枢神经系统。此视频的目的是为了演示两种不同的注射范式传递到新生小鼠出生后不久,治疗材料。其中一个方法是直接注射入脑侧脑室(侧脑室)材料传递到中枢神经系统通过脑脊液3,4结果。第二种方法是一个时间的静脉注射(静脉注射),可以引入不同的循环系统的疗法,导致全身交付,包括中枢神经系统5。如果一个合适的病毒载体和病毒血清型是利用广泛的中枢神经系统传导是可以实现的的。颞静脉注射的可视化和利用是可行的出生后第6天。但是,如果传递的材料是为了达到中枢神经系统,这些注射应采取血脑屏障,同时由于其不成熟的状态,更渗透,最好到产后第2天之前。充分发展的血脑屏障,极大地限制了静脉交付的成效。一次手术aptitude是实现两个输送系统是简单而有效的的。他们不需要任何广泛的手术设备,可以由一个人完成。然而,这些技术并非没有挑战。产后第2天的幼崽和随后的小目标领域的体积小,可以使注射难以执行,最初具有挑战性的复制。
研究方案
1。侧脑室注射
- 第一步是准备注入股市的解决方案,这些解决方案是病毒载体,质粒DNA,药物,应在无菌条件下注入。
- 混合0.05%的注射部位的可视化W / V台盼蓝的PBS所需滴度的病毒载体(5-7微升总)。
- 质粒DNA溶液(5升微升总)包含的D -(+) - 葡萄糖20%(W / V)(1μL),台盼蓝(0.05%),PBS(1μL),质粒(约5〜G /〜L )(2〜L)和2.5 kDa的线性PEI均聚物(150毫米)(1〜L)。
- 通过1-2分钟,低温麻醉,固定的PND 2新生儿。
- 使用此注射针微升校准灭菌的玻璃微管,是通过长管连接到一个3毫升3毫升汉密尔顿注射器。
- 打破(锅铲)调整为2毫米渗透入颅的针头的针尖。斜中含有的微量注射液管将针头。仔细地拉动注射器的柱塞装入针注射液。
- 摄取的解决方案后,脱离管注射器;拉柱塞进一步,然后再次连接到针。
- 在右手拇指和食指之间保持的针头和地方注射器柱塞摸右手手掌的中指和无名指之间。
- 抓紧背后的头部皮肤使用左手和地方在光纤光照亮相关的解剖结构,可作为指导使用固定的鼠标。
- 针2毫米深,垂直插入颅骨表面,在一个位置约0.25毫米,横向的矢状缝和0.50-0.75毫米,喙新生儿冠状动脉缝合( 图 1A)。然后,用手掌推柱塞右手非常缓慢和谨慎。监测破裂的船只或面部肿胀。
- 取出针15秒后停止活塞运动,以防止回流。
- 要恢复,保持5-10分钟的小鼠,在加热的容器中,直到恢复运动和一般的响应。
2。通过时间/面部静脉的静脉注射
- 被注入的解决方案应该是准备在1:100稀释,并辅以过滤绿色食用色素和无菌条件下注入。
- 将一个小塑料露儿100μL玻璃汉密尔顿注射器年底。露儿,附加33计0.25英寸的注射针。确保所有部件连接牢固。
- 被注入量装入注射器,确保在注射器注射入血管的空气,没有空气是致命的。它往往是有益的吸管要你们一块的封口膜注射量。这允许摄取到注射器的解决明确的可视化。
- 一个极小的景象透射是用来方便地可视化的颞浅静脉,或在新生儿的面部静脉(图2A)。注射前,确保新生儿使用手术磁带的透射。纱布应该放在新生儿和破坏动物的皮肤,以防止磁带的磁带。安全的动物,在其一侧的透射,确保磁带并不妨碍呼吸。新生儿的脖子上,应轻轻打开,使面部静脉是很容易看到,贴在鼻子应该是稳定的头部。
- 使用2.25X头带放大镜,以便更容易可视化,慢慢地插入静脉的针。使针头应保持可见皮下的静脉是很肤浅的。
- 静脉缓慢注入溶液的体积。绿色染料允许注射容易可视化。
- 前等待15秒,取出针有一个完全压下注射器的柱塞和驱逐剩余的解决方案,由于极其狭窄的针孔之间的滞后。
- 取出针后,用纱布注射部位施加压力,直到出血停止。
- 监测新生儿窘迫的迹象。正确的注射后,没有明显的窘迫应得到遵守。新生儿应给予恢复它返回到笼前约5分钟。
- 针/注射器单位之间的注射用PBS冲洗针的血液会很快堵塞由于小口径。
3。代表性的成果:
侧脑室注射:大脑可以在不同的时间点注射后收获和可视化,以证明成功的注射技术。如果不添加染料注射液,将很难检查中的准确性jection。适当注射脑室之一,将允许在注射侧大脑的台盼蓝分布,注射后( 图 1B)约10-15分钟。一台盼蓝均匀分布在左,右大脑半球和嗅球将可见注射后约60分钟( 图1C)。这是由于连接将允许传播到相邻的脑室蓝色染料的脑室。精确的注射,也可以由散布在约12小时内注射后( 图1D)延髓中央椎管蓝色染料的可视化。不准确的注射可以区分蓝色缺乏大脑半球。在这种情况下,进针深度是不足够的注射液有可能分布在皮肤下。另一种可能性是,针穿透过深在大脑中,从而超越了脑室及脑室底下掏空的解决方案是传递。
静脉注射:准确,高效的时间/面部静脉注射,可以可视化紧随注射。由于注入的解决方案,绿色染料允许可视化解决方案的进入和流经面部静脉( 图2A)。此外,改变皮肤颜色的鼠标将遵守以下注射。新生儿正常的粉红色转换为绿色,由于绿色食品染料注射液存在( 图2B) 。观察新生儿的绿色变化的程度取决于所使用的染料浓度。注射,并在实践期间的简单的可视化,1:50稀释建议。然而,显着地改变肤色,结果往往是小狗被母亲拒绝,因此,去除的染料或一个显著减少的浓度应在实验程序考虑。一个不准确的注入将导致绿色染料的积累,在注射部位的皮肤下。注射不完整的,它发生时没有完全插入静脉内针开幕,在静脉中流动时,会出现一些解决方案和一些积聚在皮肤下。如果发生此种情况,应插入针入血管。
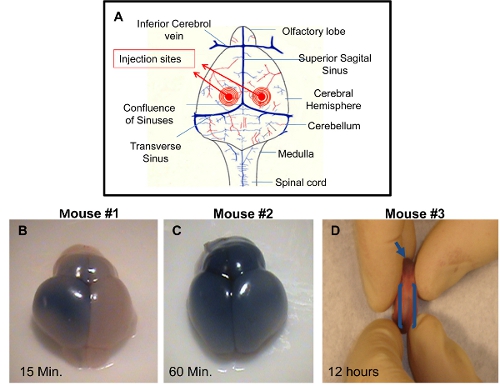
图1示范成功的ICV PDN2小鼠注射。 一个利用侧脑室注射入脑室注射部位)示意图B)从ICV的大脑注入左心室与台盼蓝的PBS小狗,合影留念注射后15分钟,C左心室)侧脑室脑注射台盼蓝的PBS小狗,合影留念注射后60分钟,D)延髓中央椎管在侧脑室注射用台盼蓝的PBS小狗左心室上,采取12小时注射后的照片。

图2示范成功的第四PDN2小鼠注射。静脉注射剂使用的面部静脉)示意图 B)小狗注射绿色染料第四的PBS相比,联合国注入littermate,照片立即注射后。
讨论
疾病的小鼠模型的研究往往需要药物或其他物质的管理,新生儿。在这段视频中,我们展示了一步一步程序,利用侧脑室(ICV)注射CNS涉及两种类型的注射战略目标的中枢神经系统,可用于:1)直接注射;或2)静脉注射针对时间/面部静脉。这些注射的时间是非常重要的。由于ICV注射写意,头骨必须相对可塑性。这种类型的注射是唯一可能通过的第一个星期的生活,变得越来越具有挑战性的和有害...
披露声明
没有利益冲突的声明。
致谢
作者想感谢约翰马斯顿畜牧业专家和博士马可波罗A. Passini技术援助,在这个项目的早期阶段。这项工作是由资助的国立卫生研究院慢性淋巴细胞白血病(R01NS41584; R01HD054413)。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论(可选) |
|---|---|---|---|
| 绿色食用色素 | 麦考密克 | N / A | 必须过滤 |
| 汉密尔顿玻璃注射器(100微升) | 西格玛Aldrick | 20702 | |
| LuerMxF主题风格的白色尼龙 | 小零件, | VPLF - LC78 - 1 - 25 | |
| 细针距注射针头 | 波普尔 | 7111 | 尺寸:33号(SWG)× ¼“(6.35毫米) |
| 凌晨视透射 | 呼吸 | 1017920 | |
| 2.25X头戴放大镜 | MagEyes | 型号5 | 选择适合个人喜好的放大倍率 |
参考文献
- Blanchette, M., Fortin, D. Blood-brain barrier disruption in the treatment of brain tumors. Methods Mol. Biol. 686, 447-463 (2011).
- Foust, K. D., Kaspar, B. K. Over the barrier and through the blood: to CNS delivery we go. Cell Cycle. 24, 4017-4018 (2009).
- Snyder, E. Y., Taylor, R. M., Wolfe, J. H. Neural progenitor cell engraftment corrects lysosomal storage throughout the MPS VII mouse brain. Nature. 374, 367-370 (1995).
- Passini, M. A., Wolfe, J. H. Widespread gene delivery and structure-specific patterns of expression in the brain after intraventricular injections of neonatal mice with an adeno-associated virus vector. J. Virol. 24, 12382-12392 (2001).
- Kienstra, K. A., Freysdottir, D., Gonzales, N. M., Hirschi, K. K. Murine neonatal intravascular injections: modeling newborn disease. J. Am. Assoc. Lab. Anim. Sci. 46, 50-54 (2007).
- Sands, M. S., Barker, J. E. Percutaneous intravenous injection in neonatal mice. Lab. Anim. Sci. 49, 328-330 (1999).
- Foust, K. D. Rescue of the spinal muscular atrophy phenotype in a mouse model by early postnatal delivery of SMN. Nat. Biotechnol. 28, 271-274 (2010).
- Foust, K. D. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat. Biotechnol. 27, 59-65 (2009).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene delivery to the mouse brain with adeno-associated virus. Methods Mol. Biol. 246, 225-236 (2004).
- Coady, T. H., Lorson, C. L. Trans-splicing-mediated improvement in a severe mouse model of spinal muscular atrophy. J. Neurosci. 30, 126-130 (2010).
- Baughan, T. D., Dickson, A., Osman, E. Y., Lorson, C. L. Delivery of bifunctional RNAs that target an intronic repressor and increase SMN levels in an animal model of spinal muscular atrophy. Hum. Mol. Genet. 18, 1600-1611 (2009).
- Coady, T. H., Baughan, T. D., Shababi, M., Passini, M. A., Lorson, C. L. Development of a single vector system that enhances trans-splicing of SMN2 transcripts. PLoS One. 3, e3468-e3468 (2008).
- Dickson, A., Osman, E., Lorson, C. A. Negatively-Acting Bifunctional RNA Increases Survival Motor Neuron in vitro and in vivo. Hum. Gene. Ther. 19, 1307-1315 .
- Mattis, V. B., Ebert, A. D., Fosso, M. Y., Chang, C. W., Lorson, C. L. Delivery of a read-through inducing compound, TC007, lessens the severity of a spinal muscular atrophy animal model. Hum. Mol. Genet. 18, 3906-3913 (2009).
- Williams, J. H. Oligonucleotide-mediated survival of motor neuron protein expression in CNS improves phenotype in a mouse model of spinal muscular atrophy. J. Neurosci. 29, 7633-7638 (2009).
- Passini, M. A. CNS-targeted gene therapy improves survival and motor function in a mouse model of spinal muscular atrophy. J. Clin. Invest. 120, 1253-1264 (2010).
- Shababi, M., Glascock, J., Lorson, C. L. Combination of SMN Trans-Splicing and a Neurotrophic Factor Increases the Life Span and Body Mass in a Severe Model of Spinal Muscular Atrophy. Hum. Gene. Ther. 22, 1-10 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。