このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスの脳室内(ICV)と静脈(IV)注入による治療薬のデリバリー
要約
新生児マウスの中枢神経系への治療薬を導入する脳(脳室)と(静脈内)2)全身に1):この記事では、注入の2つの非常に異なる方法を示しています。
要約
血液脳関門は、脳をシールドで果たす保護的な役割にもかかわらず、それはどの神経変性疾患の1,2のために設計された潜在的な治療の失敗の最も頻繁にその結果中枢神経系(CNS)へのアクセスを制限します。このような脊髄性筋萎縮症(SMA)などの神経変性疾患は、下位運動ニューロンが影響される、CNSへの治療薬を導入するメリットは非常に大きくなります。このビデオの目的は、生後間もなく新生児マウスに治療材料を提供するために二つの異なる注入のパラダイムを示すことです。これらのいずれかの方法では、脳脊髄液3,4を介して中枢神経系への物質の配信で、その結果脳側脳室(脳室内)に直接注入される。第二の方法は、中枢神経系5を含む全身送達につながる、循環系にさまざまな治療法を導入することができる時間的な静脈注射(点滴)です。適切なウイルスベクターとウイルス血清型が利用される場合、CNSの広範な伝達が達成可能です。注射のための一時的な静脈の可視化と利用率は生後6日目まで可能です。納入材はCNSに到達することを意図されている場合、血液脳関門が原因で、その未熟な状況に、より透過性のある間しかし、これらの注射は、好ましくは、事前の生後2日目に、場所を取る必要があります。完全に開発された血液脳関門は、大幅に静脈内送達の有効性を制限する。手術の適性が達成されれば、両方の配信システムは、シンプルで効果的です。彼らはあらゆる広範な外科的装置を必要とせず、一人で行うことができます。しかし、これらの技術は課題がないわけではない。生後2日目子犬とそれに続く小さな対象地域の小さなサイズは、注射を行うことが困難と複製に最初に挑戦することができます。
プロトコル
1。脳室内注入
- 最初のステップは、注入ストック溶液の調製であり、これらのソリューションは、ウイルスベクター、プラスミドDNA、薬物、そして無菌条件下で注入されるべきです。
- 注射部位の可視化のためにPBSでw / vのトリパンブルー0.05%ウイルスベクター(5-7μL合計)の所望の力価を混ぜる。
- プラスミドDNA溶液(5リットルμL合計)は、D -(+) - グルコース20%(w / v)の(1μL)、トリパンブルー(0.05%)PBS(1μL)、プラスミドを(〜5〜G /〜Lが含まれています)(2〜L)、および2.5 kDaの線形PEIホモポリマー(150 mM)の(1〜L)。
- 1〜2分のための低温麻酔を介してPND 2新生児を固定化する。
- この注射用針は、長い管を通って3ミリリットル3mLのハミルトンシリンジに接続されているマイクロリットルのキャリブレーション滅菌ガラスのマイクロピペットです。
- 頭蓋骨に2mmの浸透のために調整するために針の先端を(スパチュラ付)ブレイク。注入溶液の入ったマイクロ遠心チューブに斜めに針を置きます。慎重に注射器のプランジャーを引いて、針に注射のソリューションを読み込みます。
- ソリューションの取り込み後に、チューブからシリンジを切り離し、さらにプランジャーを引き上げてから、再度針を取り付けます。
- 親指と人差し指の間に右手の針を持ち、右手の手のひらに触れるプランジャーと中指、薬指の間に注射器を置きます。
- ガイドとして使用することができる、関連する解剖学的構造を照らすために光ファイバの光で左手と場所を使って頭の後ろの皮膚がしっかりと固定されたマウスをつかみます。
- 場所矢状縫合の外側約0.25 mmおよび新生児の冠状縫合( 図1A)の吻側0.50〜0.75ミリメートルで、頭蓋骨の表面に垂直に、深く針2mmの挿入し、の手のひらを使用してプランジャーを押し右手非常にゆっくりと慎重に。破裂血管や顔の腫れのために監視する。
- 逆流を防ぐために、プランジャーの動きの中止後に針15秒を削除します。
- 運動と一般的な応答性が復元されるまで回復するには、温めておいた容器に5〜10分間マウスを保つ。
2。時間/顔面静脈を経由して静脈注射
- 注入される溶液を調製し、濾過緑色食品色素で補足1:100希釈で、無菌条件下で注入する必要があります。
- 100μLガラスハミルトンシリンジの最後にルアー小さなプラスチックを取り付けます。ルアーに、33ゲージ0.25インチ皮下注射針を取り付けます。すべての部品がしっかりと接続されていることを保証する。
- 容器への空気の注入は致命的であるようにシリンジ内に空気がないことを確認し、注入する量で注射器をロードする。それは多くの場合、ピペットパラフィルムの一部わたし注入されるボリュームに便利です。これにより、シリンジへの液の取り込みを明確に可視化することができます。
- ウィー視力のトランスは、簡単に新生児における浅側頭静脈、または顔面静脈、(図2A)を可視化するために使用されます。注射の前に、サージカルテープを使用してトランスに新生児を確保する。ガーゼは、動物の皮膚を損傷からテープを防ぐために、新生児とテープの間に配置する必要があります。テープは、呼吸を妨げないようにすること、その側のトランスに動物を固定します。新生児の首をやさしく顔面静脈が簡単に表示されるようにする必要があり、鼻は頭部を安定させるためにテープで固定してください。
- 簡単に可視化を可能にするために2.25Xヘッドバンドの拡大鏡を使用して、徐々に静脈に針を挿入する。針が皮膚の下に表示したままにするので、静脈は非常に表面的です。
- ゆっくり静脈内に溶液の体積を吹き込む。緑色の染料は、注入の容易な視覚化することができます。
- 完全にシリンジと極めて狭い針の穴のために残りの溶液の追放のプランジャーを押す間にタイムラグがあるので針を外す前に15秒を待ちます。
- 針を除去した後、出血が停止するまで注射部位に圧力を適用するためにガーゼを使用してください。
- 苦痛の徴候のための新生児を監視します。適切な注入後は、明白な苦痛は認めてはならない。新生児は、それがケージに戻される前に回復するために約5分間を与えられるべきである。
- 針で血液がすぐに小口径のためにそれを目詰まりするので注射の間にPBSで針/注射器ユニットをフラッシュします。
3。代表的な結果:
ICV注入:脳は様々な時点注射後に収穫し、成功した注入技術を実証するために視覚化することができます。染料を注射液に添加されていない場合、それはでの精度をチェックすることは困難ですjection。心室のいずれかの適切な注入は、脳の注入側にトリパンブルーの配布が可能になります約10-15分のポスト噴射( 図1B)。右と左大脳半球および嗅球の両方でトリパンブルーの均一な分布は、約60分の注射後( 図1C)表示されます。これは、隣接する心室に青色色素の普及を許可する脳室の接続によるものです。正確な注射はまた、約12時間注入後( 図1D)内の吻側、中央脊柱管に青い色素の分散可視化することができる。不正確な注射は、大脳半球の青色の欠如によって区別することができます。このケースでは、針の深さは十分ではなかったとされた注射液は、おそらく皮膚の下で配布されている。別の可能性は針、それによって心室と解決策が脳室の下に空に越えて渡して、脳にあまりにも深く浸透していることです。
IV注入:正確で効率的な時間的/顔面静脈注射は、注射の直後に視覚化することができます。解決策が注入されるように、緑色の色素が入ると顔面静脈( 図2A)を流れる液の可視化が可能になります。さらに、マウスの改変された肌の色は、注射後に観察されます。新生児の正常なピンクの色は、注射液( 図2B)における緑色食品色素の存在のために緑、に変換されます。新生児において観察された緑色の色の変化の程度は、使用する色素の濃度に依存している。注射のと練習期間中の単純な可視化のため、50倍希釈を推奨します。しかし、劇的に変化した肌のトーンは多くの場合、母親によって拒否される、したがって、染料または大幅に減少濃度の除去は、実験手順中に考慮すべき子犬をもたらす。不正確な注射は、注射の部位の皮膚の下に緑色の色素の蓄積になります。針の開口部が完全に静脈内に挿入されていない場合に発生する不完全な注射は、、いくつかのソリューションは、静脈を流れるときに見られると、一部は皮膚の下に蓄積されています。これが認められる場合は、針が血管にさらに挿入される必要があります。
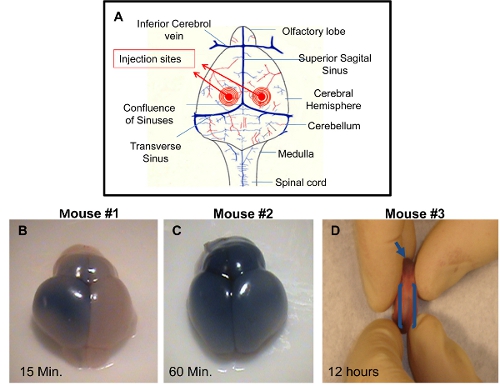
図 PDN2マウスで成功したICV注射1。デモンストレーション。)心室にICV注射で利用される注射部位の模式図。ICVからの脳が左心室にPBSでトリパンブルーの仔注入B)、写真は15分にポスト噴射を撮影。C ICVから)脳は、左心室にPBSでトリパンブルーで子犬を注入、撮影した写真は、60分の注射後。D)吻側、中央脊柱管がICVに示されているが、左心室にPBSでトリパンブルーで子犬を注入、12時間注入後に撮影した写真。

子犬が非注入同腹と比較してPBSで緑の色素でIVを注入図 IV注射のために利用さ顔面静脈の2。PDN2マウスで成功したIV注射のデモンストレーション。)回路図は。B)、写真はすぐにポスト噴射を取ら。
ディスカッション
病気のマウスモデルを用いた研究は多くの場合、新生児に薬物または他の物質の投与を必要とします。このビデオでは、我々はステップバイCNSを標的とするために使用できる注射戦略の2つのタイプに関連するステップの手順を示す:脳室内(ICV)注射を利用したCNSに)直接注入を1;時間/をターゲット)、または2のIV注入顔面静脈。これらの注射のタイミングは非常に重要です。 ICV注射はフ?...
開示事項
利害の衝突は宣言されません。
謝辞
著者は、このプロジェクトの初期段階での技術支援のため専門家畜産と博士マルコA. Passini用ジョンマーストンに感謝します。この作品は、CLLの国立衛生研究所(; R01HD054413 R01NS41584)からの助成金によって賄われていた。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
|---|---|---|---|
| 緑の食用色素 | マコーミック | N / A | フィルタ処理する必要があります |
| ハミルトンガラスシリンジ(100μL) | シグマAldrick | 20702 | |
| LuerMxFスレッドスタイルホワイトナイロン | 小さなパーツ、(株) | VPLF - LC78 - 1 - 25 | |
| ファインゲージの注射針 | ポッパー | 7111 | サイズ:33(SWG)× ¼"(6.35 MM) |
| ウィー視力のトランス | レスピロニクス | 1017920 | |
| 2.25Xヘッドバンド拡大鏡 | MagEyes | モデル第5号 | 個々の好みに合わせて倍率を選択します。 |
参考文献
- Blanchette, M., Fortin, D. Blood-brain barrier disruption in the treatment of brain tumors. Methods Mol. Biol. 686, 447-463 (2011).
- Foust, K. D., Kaspar, B. K. Over the barrier and through the blood: to CNS delivery we go. Cell Cycle. 24, 4017-4018 (2009).
- Snyder, E. Y., Taylor, R. M., Wolfe, J. H. Neural progenitor cell engraftment corrects lysosomal storage throughout the MPS VII mouse brain. Nature. 374, 367-370 (1995).
- Passini, M. A., Wolfe, J. H. Widespread gene delivery and structure-specific patterns of expression in the brain after intraventricular injections of neonatal mice with an adeno-associated virus vector. J. Virol. 24, 12382-12392 (2001).
- Kienstra, K. A., Freysdottir, D., Gonzales, N. M., Hirschi, K. K. Murine neonatal intravascular injections: modeling newborn disease. J. Am. Assoc. Lab. Anim. Sci. 46, 50-54 (2007).
- Sands, M. S., Barker, J. E. Percutaneous intravenous injection in neonatal mice. Lab. Anim. Sci. 49, 328-330 (1999).
- Foust, K. D. Rescue of the spinal muscular atrophy phenotype in a mouse model by early postnatal delivery of SMN. Nat. Biotechnol. 28, 271-274 (2010).
- Foust, K. D. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat. Biotechnol. 27, 59-65 (2009).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene delivery to the mouse brain with adeno-associated virus. Methods Mol. Biol. 246, 225-236 (2004).
- Coady, T. H., Lorson, C. L. Trans-splicing-mediated improvement in a severe mouse model of spinal muscular atrophy. J. Neurosci. 30, 126-130 (2010).
- Baughan, T. D., Dickson, A., Osman, E. Y., Lorson, C. L. Delivery of bifunctional RNAs that target an intronic repressor and increase SMN levels in an animal model of spinal muscular atrophy. Hum. Mol. Genet. 18, 1600-1611 (2009).
- Coady, T. H., Baughan, T. D., Shababi, M., Passini, M. A., Lorson, C. L. Development of a single vector system that enhances trans-splicing of SMN2 transcripts. PLoS One. 3, e3468-e3468 (2008).
- Dickson, A., Osman, E., Lorson, C. A. Negatively-Acting Bifunctional RNA Increases Survival Motor Neuron in vitro and in vivo. Hum. Gene. Ther. 19, 1307-1315 .
- Mattis, V. B., Ebert, A. D., Fosso, M. Y., Chang, C. W., Lorson, C. L. Delivery of a read-through inducing compound, TC007, lessens the severity of a spinal muscular atrophy animal model. Hum. Mol. Genet. 18, 3906-3913 (2009).
- Williams, J. H. Oligonucleotide-mediated survival of motor neuron protein expression in CNS improves phenotype in a mouse model of spinal muscular atrophy. J. Neurosci. 29, 7633-7638 (2009).
- Passini, M. A. CNS-targeted gene therapy improves survival and motor function in a mouse model of spinal muscular atrophy. J. Clin. Invest. 120, 1253-1264 (2010).
- Shababi, M., Glascock, J., Lorson, C. L. Combination of SMN Trans-Splicing and a Neurotrophic Factor Increases the Life Span and Body Mass in a Severe Model of Spinal Muscular Atrophy. Hum. Gene. Ther. 22, 1-10 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved