È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Consegna di agenti terapeutici attraverso intracerebroventricolare (ICV) e per via endovenosa (ev) nei topi
In questo articolo
Riepilogo
Questo articolo viene illustrato due metodi molto diversi di iniezione: 1) nel cervello (intracerebroventricolare) e 2) sistemica (endovenosa) per introdurre gli agenti terapeutici nel sistema nervoso centrale di topi neonati.
Abstract
Nonostante il ruolo protettivo che la barriera sanguigna del cervello gioca nella protezione del cervello, che limita l'accesso al sistema nervoso centrale (SNC), che il più delle volte si traduce in mancanza di terapie potenziali previsti per le malattie neurodegenerative 1,2. Malattie neurodegenerative come l'atrofia muscolare spinale (SMA), in cui i neuroni motori inferiori sono interessati, possono trarre grandi vantaggi di introdurre gli agenti terapeutici nel sistema nervoso centrale. Lo scopo di questo video è quello di dimostrare due paradigmi diversi di iniezione per fornire materiali terapeutici in topo neonato subito dopo la nascita. Uno di questi metodi è l'iniezione direttamente nel cervello ventricoli laterali (intracerebroventricolare) che si traduce in consegna dei materiali nel sistema nervoso centrale attraverso il fluido cerebrospinale 3,4. Il secondo metodo è una iniezione vena temporale (per via endovenosa) che possono introdurre terapie diverse nel sistema circolatorio, con conseguente consegna sistemiche tra cui il sistema nervoso centrale 5. Trasduzione diffusa del sistema nervoso centrale è realizzabile se un vettore virale appropriato e sierotipo virale viene utilizzato. Visualizzazione e l'utilizzo della vena temporale per l'iniezione è possibile fino al giorno dopo la nascita 6. Tuttavia, se il materiale consegnato è destinato a raggiungere il sistema nervoso centrale, queste iniezioni dovrebbero avvenire mentre la barriera emato-encefalica è più permeabile per il suo status immaturi, preferibilmente prima del giorno post-natale 2. La pienamente sviluppato barriera emato-encefalica limita fortemente l'efficacia della consegna per via endovenosa. Entrambi i sistemi di consegna sono semplici ed efficaci, una volta l'attitudine chirurgica è raggiunto. Essi non richiedono dispositivi chirurgici ampio e può essere eseguita da una sola persona. Tuttavia, queste tecniche non sono senza sfide. Le piccole dimensioni dei post-natale giorno 2 cuccioli e le aree successive bersaglio di piccole dimensioni può rendere le iniezioni di difficile esecuzione e inizialmente difficili da replicare.
Protocollo
1. Iniezione intracerebroventricolare
- Il primo passo è la preparazione delle soluzioni madre l'iniezione; queste soluzioni sono vettore virale, DNA plasmidico, droghe, e deve essere iniettato in condizioni sterili.
- Mescolare un titolo desiderato di vettore virale (5-7 totale mL) con il 0,05% w / v in PBS tripano blu per la visualizzazione del sito di iniezione.
- Soluzione di DNA plasmidico (5 in totale l mL) contiene D-(+)-glucosio al 20% (w / v) (1 mL), trypan blu (0,05%) PBS (1 mL), il plasmide (~ 5 ~ g / L ~ ) (2 ~ L), e 2,5 kDa lineare PEI omopolimero (150 mm) (1 ~ L).
- Immobilizzare il PND 2 neonati tramite crio-anestesia per 1-2 minuti.
- L'ago utilizzato per questa iniezione è un micro-litro micropipetta tarata vetro sterilizzati che è collegato ad una siringa da 3 ml 3 ml Hamilton attraverso un lungo tubo.
- Rompere la punta dell'ago (con spatola) per regolare la penetrazione per 2 mm nel cranio. Posizionare l'ago in diagonale nella provetta contenente la soluzione di iniezione. Caricare la soluzione iniezione l'ago con attenzione tirando lo stantuffo della siringa.
- Dopo l'assorbimento della soluzione, dissociare la siringa dal tubo; tirare lo stantuffo fino ulteriormente e quindi collegare l'ago di nuovo.
- Tenere l'ago nella mano destra tra il pollice e le dita indice e posizionare la siringa tra il medio e l'anulare con lo stantuffo toccando il palmo della mano destra.
- Afferrare il topo immobilizzato con fermezza dalla pelle dietro la testa con la mano sinistra e posto su una fibra ottica la luce per illuminare le strutture anatomiche rilevanti che possono essere utilizzati come guida.
- Inserire le 2 mm di profondità dell'ago, perpendicolare alla superficie del cranio, in una località a circa 0,25 mm lateralmente alla sutura sagittale e 0,50-0,75 millimetri anteriore del neonatali sutura coronarica (Figura 1A). Quindi, spingere lo stantuffo con il palmo della mano destra molto lentamente e con attenzione. Monitor per le navi rottura o gonfiore del viso.
- Rimuovere l'ago 15 secondi dopo l'interruzione del movimento di stantuffo per impedire il riflusso.
- Per recuperare, mantenere i topi per 5-10 minuti in un contenitore riscaldato fino a quando il movimento e la reattività generale viene ripristinato.
2. L'iniezione endovenosa attraverso la vena temporale / viso
- La soluzione da iniettare deve essere preparata e integrata con filtrata colorante alimentare verde alla diluizione 1:100 e iniettato in condizioni sterili.
- Allegare un piccolo plastico luer alla fine di una siringa di vetro 100 microlitri Hamilton. Per il luer, collegare un manometro 33 ago ipodermico 0,25 pollici. Assicurarsi che tutte le parti siano saldamente collegati.
- Caricare la siringa con il volume da iniettare, assicurando che non ci sia aria nella siringa, come l'iniezione di aria nel vaso è letale. È spesso utile pipetta il volume da iniettare fino un pezzo di parafilm. Questo permette la visualizzazione chiara di assorbimento della soluzione nella siringa.
- Un Transilluminatore Sight Wee è usato per visualizzare facilmente la vena temporale superficiale, o vena facciale, nel neonato (Figura 2A). Prima dell'iniezione, fissare il neonato al transilluminatore con nastro chirurgico. Garza deve essere collocato tra il neonato e il nastro per evitare che il nastro di danneggiare la pelle dell'animale. Fissare l'animale al transilluminatore dalla sua parte, assicurando che il nastro non impedisce la respirazione. Collo del neonato deve essere delicatamente girato in modo che la vena facciale è facilmente visibile e il naso dovrebbe essere registrato per stabilizzare la testa.
- Utilizzando una lente d'ingrandimento 2.25X archetto per consentire la visualizzazione più semplice, inserire lentamente l'ago nella vena. La vena è molto superficiale modo che l'ago deve rimanere visibili sotto la pelle.
- Infondere lentamente il volume di soluzione nella vena. La tinta verde permette una facile visualizzazione di iniezione.
- Attendere 15 secondi prima di rimuovere l'ago in quanto vi è un ritardo tra completamente lo stantuffo della siringa e l'espulsione della soluzione rimanenti a causa del foro ago molto sottile.
- Dopo aver rimosso l'ago, usare una garza per applicare pressione sul sito di iniezione fino a quando il sanguinamento cessa.
- Monitorare il neonato per i segni di sofferenza. Dopo una iniezione appropriate, nessun disagio palese devono essere osservati. Il neonato deve essere somministrata circa 5 minuti per riprendersi prima di essere restituita alla gabbia.
- Sciacquare l'ago / siringa unità con PBS tra iniezioni di sangue in l'ago si intasano rapidamente a causa di foro di piccole dimensioni.
3. Rappresentante dei risultati:
ICV iniezione: Il cervello può essere raccolte in diversi punti in tempo post-iniezione e visualizzati per dimostrare la tecnica di iniezione di successo. Se il colorante non viene aggiunto alla soluzione da iniettare, sarà difficile per verificare l'accuratezza del aproiezione. Iniezione appropriate di uno dei ventricoli permetterà la distribuzione del trypan blu sul lato del cervello iniettato circa 10-15 minuti dopo l'iniezione (Figura 1B). Una distribuzione uniforme di blu tripano in entrambi gli emisferi destro e sinistro cerebrale e bulbi olfattivi saranno visibili circa 60 minuti dopo l'iniezione (figura 1C). Ciò è dovuto alla connettività dei ventricoli cerebrali che permetterà la diffusione del colorante blu per il ventricolo adiacenti. Iniezioni accurato può anche essere visualizzati dalla dispersione del colorante blu nel rostrale canale centrale spinale circa entro 12 ore dopo l'iniezione (Figura 1D). Iniezioni inesatte si distingue per la mancanza di colore blu in emisferi cerebrali. In questo caso, la profondità dell'ago non era sufficiente e la soluzione di iniezione è probabilmente distribuito sotto la pelle. Una possibilità alternativa è che l'ago penetra troppo in profondità nel cervello, passando così al di là del ventricolo e la soluzione è svuotato sotto i ventricoli cerebrali.
IV iniezione: accurata ed efficiente iniezione vena temporale / facciali possono essere visualizzati immediatamente dopo l'iniezione. Dato che la soluzione viene iniettata, il colorante verde permette la visualizzazione della soluzione che entrano e che fluisce attraverso la vena facciale (Figura 2A). Inoltre, il colore della pelle alterata del mouse sarà osservato dopo l'iniezione. Colore normale rosa del neonato è convertito al verde, a causa della presenza di colorante alimentare verde nella soluzione da iniettare (Figura 2B). L'entità del cambiamento di colore verde osservato nel neonato dipende dalla concentrazione di colorante usato. Per la semplice visualizzazione di iniezione e durante un periodo di pratica, una diluizione 1:50 è raccomandato. Tuttavia, il tono della pelle drammaticamente alterato provoca spesso il cucciolo di essere rifiutato dalla madre e, quindi, la rimozione del colorante o di una concentrazione significativamente ridotto dovrebbero essere presi in considerazione durante le procedure sperimentali. Un'iniezione imprecisi comporterà l'accumulo di colorante verde sotto la pelle al sito di iniezione. Iniezione incompleta, che si verifica quando l'apertura dell'ago non è completamente inserito all'interno della vena, si vede quando qualche soluzione fluisce nella vena e alcuni si accumula sotto la pelle. Se questa è osservato, l'ago deve essere inserito ulteriormente nel vaso.
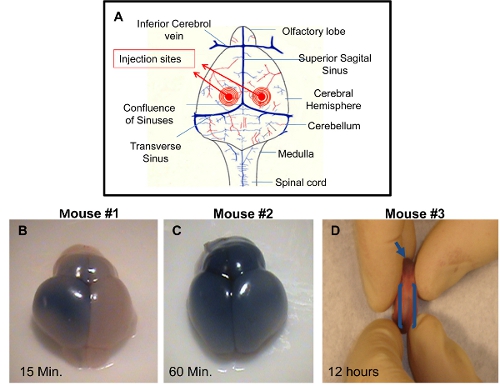
Figura 1. Dimostrazione del successo iniezioni ICV in PDN2 topi. A) Schema di iniezione utilizzati in iniezioni ICV nei ventricoli. B) Cervello da ICV iniettato Pup con tripano blu in PBS sul ventricolo sinistro, foto scattata 15 minuti dopo l'iniezione. C ) Cervello da ICV iniettato Pup con tripano blu in PBS a ventricolo sinistro, foto scattata 60 minuti dopo l'iniezione. D) viene mostrato rostrate centrale canale spinale in ICV iniettato cucciolo con tripano blu in PBS sul ventricolo sinistro, foto scattata 12 ore dopo l'iniezione.

Figura 2. Dimostrazione del successo iniezioni IV PDN2 topi. A) Schema di vena facciale utilizzata per iniezioni IV. B) Pup IV iniettato con colorante verde in PBS rispetto ai non-iniettati cucciolata, Foto scattata immediatamente dopo l'iniezione.
Discussione
La ricerca che utilizza modelli murini di malattie spesso richiede la somministrazione di farmaci o altre sostanze per neonati. In questo video, dimostriamo il passo per passo le procedure che coinvolgono due tipi di strategie di iniezione che possono essere utilizzati per indirizzare il sistema nervoso centrale: 1) iniezione diretta nel sistema nervoso centrale che utilizza intracerebroventricolare (ICV) di iniezione, oppure 2) intese a promuovere l'iniezione IV / temporali vena facciale. I tempi di queste iniezion...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare John Marston esperto per la zootecnia e il Dott. Marco A. Passini di assistenza tecnica nelle fasi iniziali di questo progetto. Questo lavoro è stato finanziato dalla sovvenzione da parte del National Institutes of Health a CLL (R01NS41584; R01HD054413).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
|---|---|---|---|
| Green Food Dye | McCormick | n / a | Devono essere filtrati |
| Hamilton siringa di vetro (100 mL) | Sigma Aldrick | 20702 | |
| LuerMxF filo di nylon Style Bianco | Parti piccole, Inc. | VPLF-LC78-1-25 | |
| Belle calibro aghi ipodermici | Bottone automatico | 7111 | Dimensioni: 33 (SWG) x ¼ "(6,35 mm) |
| Vista Transilluminatore Wee | Respironics | 1017920 | |
| 2.25X fascia Magnifier | MagEyes | Modello n. 5 | Seleziona ingrandimento per soddisfare le preferenze individuali |
Riferimenti
- Blanchette, M., Fortin, D. Blood-brain barrier disruption in the treatment of brain tumors. Methods Mol. Biol. 686, 447-463 (2011).
- Foust, K. D., Kaspar, B. K. Over the barrier and through the blood: to CNS delivery we go. Cell Cycle. 24, 4017-4018 (2009).
- Snyder, E. Y., Taylor, R. M., Wolfe, J. H. Neural progenitor cell engraftment corrects lysosomal storage throughout the MPS VII mouse brain. Nature. 374, 367-370 (1995).
- Passini, M. A., Wolfe, J. H. Widespread gene delivery and structure-specific patterns of expression in the brain after intraventricular injections of neonatal mice with an adeno-associated virus vector. J. Virol. 24, 12382-12392 (2001).
- Kienstra, K. A., Freysdottir, D., Gonzales, N. M., Hirschi, K. K. Murine neonatal intravascular injections: modeling newborn disease. J. Am. Assoc. Lab. Anim. Sci. 46, 50-54 (2007).
- Sands, M. S., Barker, J. E. Percutaneous intravenous injection in neonatal mice. Lab. Anim. Sci. 49, 328-330 (1999).
- Foust, K. D. Rescue of the spinal muscular atrophy phenotype in a mouse model by early postnatal delivery of SMN. Nat. Biotechnol. 28, 271-274 (2010).
- Foust, K. D. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat. Biotechnol. 27, 59-65 (2009).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene delivery to the mouse brain with adeno-associated virus. Methods Mol. Biol. 246, 225-236 (2004).
- Coady, T. H., Lorson, C. L. Trans-splicing-mediated improvement in a severe mouse model of spinal muscular atrophy. J. Neurosci. 30, 126-130 (2010).
- Baughan, T. D., Dickson, A., Osman, E. Y., Lorson, C. L. Delivery of bifunctional RNAs that target an intronic repressor and increase SMN levels in an animal model of spinal muscular atrophy. Hum. Mol. Genet. 18, 1600-1611 (2009).
- Coady, T. H., Baughan, T. D., Shababi, M., Passini, M. A., Lorson, C. L. Development of a single vector system that enhances trans-splicing of SMN2 transcripts. PLoS One. 3, e3468-e3468 (2008).
- Dickson, A., Osman, E., Lorson, C. A. Negatively-Acting Bifunctional RNA Increases Survival Motor Neuron in vitro and in vivo. Hum. Gene. Ther. 19, 1307-1315 .
- Mattis, V. B., Ebert, A. D., Fosso, M. Y., Chang, C. W., Lorson, C. L. Delivery of a read-through inducing compound, TC007, lessens the severity of a spinal muscular atrophy animal model. Hum. Mol. Genet. 18, 3906-3913 (2009).
- Williams, J. H. Oligonucleotide-mediated survival of motor neuron protein expression in CNS improves phenotype in a mouse model of spinal muscular atrophy. J. Neurosci. 29, 7633-7638 (2009).
- Passini, M. A. CNS-targeted gene therapy improves survival and motor function in a mouse model of spinal muscular atrophy. J. Clin. Invest. 120, 1253-1264 (2010).
- Shababi, M., Glascock, J., Lorson, C. L. Combination of SMN Trans-Splicing and a Neurotrophic Factor Increases the Life Span and Body Mass in a Severe Model of Spinal Muscular Atrophy. Hum. Gene. Ther. 22, 1-10 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon