Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Доставка терапевтических агентов Через Intracerebroventricular (ICV) и внутривенного (IV) инъекций у мышей
В этой статье
Резюме
В этой статье показано два совершенно разных методов инъекций: 1) в головном мозге (intracerebroventricular) и 2) системные (внутривенное) введение терапевтических агентов в центральной нервной системы у новорожденных мышей.
Аннотация
Несмотря на защитную роль, что гематоэнцефалический барьер играет в защитный головной мозг, это ограничивает доступ к центральной нервной системе (ЦНС), которое чаще всего приводит к отказу потенциальных терапии предназначен для нейродегенеративных 1,2 расстройств. Нейродегенеративных заболеваний, таких как спинальная мышечная атрофия (СМА), в которой нижние моторные нейроны влияют, могут извлечь большую пользу от введения терапевтических агентов в ЦНС. Цель этого видео, чтобы продемонстрировать две разные парадигмы инъекции для доставки терапевтических материалов в новорожденных мышей вскоре после рождения. Одним из таких методов является употребление инъекционных непосредственно в мозговой боковых желудочков (Intracerebroventricular), что приводит к доставке материалов в ЦНС через спинномозговую жидкость 3,4. Второй метод временные инъекции вену (внутривенно), которые могут вводить различные терапии в кровеносную систему, что приводит к системной доставки, включая ЦНС 5. Широкое трансдукции ЦНС достижимо, если соответствующие вирусный вектор и вирусных серотипа используется. Визуализация и использование временных вену для инъекции возможно до послеродового день 6. Однако, если поставленный материал предназначен для достижения ЦНС, эти инъекции должны проводиться в то время как гематоэнцефалический барьер более проницаемыми из-за его незрелые статус, предпочтительно до послеродового день 2. Полностью разработана гематоэнцефалический барьер значительно ограничивает эффективность внутривенной доставки. Оба систем доставки являются простыми и эффективными раз хирургических способностей достигается. Они не требуют обширных хирургических устройств и могут быть выполнены одним человеком. Однако эти методы не без проблем. Небольшой размер послеродовой день 2 щенков и последующих небольших участков целевой можете сделать инъекции трудно выполнить и поначалу сложно воспроизвести.
протокол
1. Intracerebroventricular инъекции
- Первым шагом является подготовка инъекционных растворов состава; эти решения являются вирусный вектор, плазмидной ДНК, наркотиков, и должны быть введены в стерильных условиях.
- Смешайте желаемый титр вирусного вектора (5-7 мкл общего числа) с 0,05% вес / трипанового синего в ФСБ для визуализации месте инъекции.
- Плазмиды решение ДНК (5 л мкл общего числа) содержит D-(+)-глюкоза 20% (м / о) (1 мкл), трипанового синего (0,05%) PBS (1 мкл), плазмиды (~ 5 ~ г / ~ L ) (2 ~ L), и 2,5 кДа линейной PEI гомополимер (150 мм) (1 ~ L).
- Остановите PND 2 новорожденных с помощью крио-анестезии в течение 1-2 минут.
- Иглы для этой инъекции микро-литровый калиброванный стерилизованные стеклянные микропипетки, который прилагается к 3 мл 3 мл шприца Hamilton через длинную трубку.
- Перерыв кончик иглы (с лопаточкой), чтобы настроить на 2 мм проникновения в череп. Место иглой по диагонали в микроцентрифужных пробирку, содержащую раствор для инъекций. Нагрузка раствор для инъекций в иглу, осторожно потянув поршень шприца.
- После поглощения раствора, дистанцироваться шприц из трубки; потянуть поршень вверх дальше и затем присоединить к игле снова.
- Держите иглу в правой руке между большим и указательным пальцами и поместить шприц между средним и безымянным пальцами с поршнем трогательные ладонь правой руки.
- Возьмитесь иммобилизованных мыши крепко кожи позади головки с помощью левой руки и положите на волоконно-оптический свет, чтобы осветить соответствующие анатомические структуры, которые можно использовать в качестве ориентира.
- Вставьте иглу 2 мм, перпендикулярно поверхности черепа, в месте, приблизительно 0,25 мм латеральнее сагиттального шва и 0.50-0.75 мм ростральнее новорожденных коронарного шва (рис. 1А). Затем нажмите на поршень использованием ладони Правая рука очень медленно и осторожно. Монитор для разрыва сосудов или отек лица.
- Удалите иглу через 15 секунд после прекращения движения плунжера для предотвращения обратного потока.
- Чтобы восстановить, сохранить мышей в течение 5-10 минут в нагретой до контейнера движения и общая чувствительность восстанавливается.
2. Внутривенное введение через временные / лицевой вены
- Решение для инъекций должна быть подготовлена и дополнена фильтруются зеленый пищевой краситель в разведении 1:100 и вводят в стерильных условиях.
- Прикрепите небольшие пластиковые Луер до конца 100 мкл стеклянный шприц Гамильтон. Для Луер, приложите на 33 калибр 0,25 дюйма шприц. Убедитесь, что все части надежно подключены.
- Нагрузка шприц с объемом, который будет введен, гарантируя, что нет воздуха в шприце, как введение воздуха в сосуд летально. Это часто бывает полезно пипетки объем, который будет введен к кусок парафильмом. Это позволяет ясно визуализации поглощение раствора в шприце.
- Ви Transilluminator Зрение легко использованы для визуализации поверхностной височной вены, или лицевой вены, у новорожденных (рис. 2А). Перед инъекцией, безопасные для новорожденных transilluminator помощью хирургического ленты. Марля должен находиться между новорожденным и лентой, чтобы предотвратить ленту от повреждения кожи животного. Безопасные животное transilluminator на его стороне, гарантируя, что лента не мешает дыханию. Шее новорожденного должна быть мягко повернут так, что лица вены хорошо видны и нос должны быть скреплены клейкой лентой, чтобы стабилизировать голову.
- Использование 2.25x лупа заставку для упрощения визуализации, медленно вставить иглу в вену. Вены очень поверхностна так игла должна оставаться видимым под кожей.
- Медленно влить объем раствора в вену. Зеленый краситель позволяет легко визуализировать инъекции.
- Подождите 15 секунд, прежде чем снимать иглу так как есть разрыв между полного нажатия на поршень шприца и изгнанию оставшийся раствор из-за чрезвычайно малого диаметра иглы.
- После удаления иглы, используйте марлю, чтобы оказать давление на месте инъекции, пока кровотечение прекращается.
- Монитор новорожденных на наличие признаков стресса. После надлежащего инъекции, не открытые бедствия должны быть соблюдены. Новорожденных должно быть дано приблизительно 5 минут, чтобы восстановиться, прежде чем вернулся в клетку.
- Флеш игл / шприцев блока с PBS между инъекциями, как кровь в иглу быстро забивают его из-за малого диаметра.
3. Представитель результаты:
ICV инъекций: мозг может быть собран в различных временных точках после инъекции и визуализированы, чтобы продемонстрировать успешный метод инъекции. Если краситель не добавляется в раствор для инъекций, это будет трудно для проверки точности впроекция. Правильное инъекции одного из желудочков позволит распределение трипанового синего на вводили сторона мозга примерно 10-15 минут после инъекции (рис. 1В). Равномерное распределение трипанового голубым в обоих правых и левых полушарий головного мозга и обонятельной луковицы будут видны примерно 60 минут после инъекции (рис. 1в). Это связано с связность желудочков головного мозга, которые позволят распространение синего красителя к соседнему желудочка. Точная инъекции могут быть визуализированы разгона синего красителя в ростральной центрального позвоночного канала примерно в течение 12 часов после инъекции (рис. 1D). Неточный инъекции можно отличить по отсутствию синего цвета в полушарий головного мозга. В этом случае глубина игла не была достаточной и раствор для инъекций, вероятно, распространяется по коже. Альтернативной возможностью является то, что игла проникла слишком глубоко в мозгу, тем самым передав за желудочка и решение опорожняется под желудочков головного мозга.
IV инъекций: Точная и эффективная временная / лицевой вены инъекции могут быть визуализированы сразу же после инъекции. Как решение вводится, зеленый краситель позволяет визуализировать решение ввода и протекающей через лицевой вены (рис. 2А). Кроме того, изменения цвета кожи мыши будет наблюдаться после инъекции. Нормальные розовый цвет новорожденного превращается в зеленый, из-за присутствия зеленый пищевой краситель в раствор для инъекций (рис. 2В). Степень изменения цвета зеленой наблюдаться у новорожденного зависит от концентрации красителя. Для простой визуализации инъекции и в течение периода тренировки, 1:50 разбавления рекомендуется. Тем не менее, резко изменила тон кожи часто приводит к щенку быть отвергнутым матерью и, следовательно, удаление красителя или значительно уменьшается концентрация должна быть рассмотрены в ходе экспериментальных процедур. Неточной инъекции приведет к накоплению зеленого красителя под кожу в месте инъекции. Неполное инъекции, которая происходит, когда открытия иглы не полностью вставлен в вену, это видно, когда какое-то решение потоков в вену, а некоторые скапливается под кожей. Если этого не наблюдается, игла должна быть вставлена в сосуд.
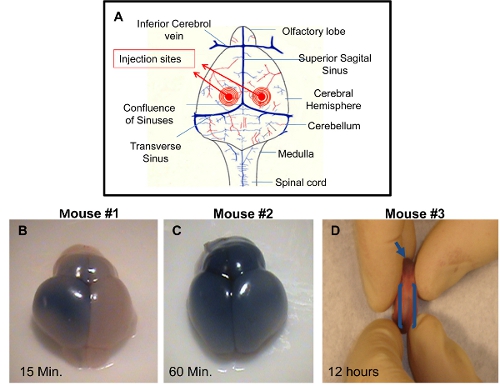
Рисунок 1. Демонстрация успешного инъекций ICV в PDN2 мышей.) Схема инъекций, используемых в инъекции ICV в желудочки. B) мозг от ICV вводят Pup с трипанового синего в ФСБ на левый желудочек, фото, сделанном 15 минут после инъекции. C ) мозг от ICV вводят Pup с трипанового синего в ФСБ на левый желудочек, фото, сделанном 60 минут после инъекции. D) Ростральные центрального позвоночного канала показан на ICV вводят щенка с трипанового синего в ФСБ на левый желудочек, фото, сделанном 12 часов после инъекции.

Рисунок 2. Демонстрация успешного инъекций IV в PDN2 мышей.) Схема лицевой вены используются для IV инъекций. B) Pup вводили IV с зеленым красителем в ФБР по сравнению с не-инъекции однопометница, Фотография, сделанная сразу после инъекции.
Обсуждение
Исследования с помощью мыши моделях болезни часто требует введения препаратов или других веществ новорожденных. В этом видео мы продемонстрируем шаг за шагом процедуры, связанные с двумя типами инъекции стратегий, которые могут быть использованы для целевой центральной нервной сист?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить Джон Марстон для экспертного животноводства и д-р Марко А. Пассини для оказания технической помощи на ранних этапах этого проекта. Эта работа финансировалась грантом Национального института здоровья в ХЛЛ (R01NS41584; R01HD054413).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (необязательно) |
|---|---|---|---|
| Зеленый пищевой краситель | Маккормик | н / | Должно быть отфильтрованы |
| Гамильтон стеклянный шприц (100 мкл) | Sigma Aldrick | 20702 | |
| LuerMxF тема Стиль Белый нейлон | Мелкие детали, Inc | VPLF-LC78-1-25 | |
| Изобразительное шприцы калибр | Стрелок | 7111 | Размер: 33 (СРГ) х ¼ "(6,35 мм) |
| Ви Transilluminator Зрение | Respironics | 1017920 | |
| 2.25x головная повязка лупы | MagEyes | Модель № 5 | Выберите увеличения с учетом индивидуальных предпочтений |
Ссылки
- Blanchette, M., Fortin, D. Blood-brain barrier disruption in the treatment of brain tumors. Methods Mol. Biol. 686, 447-463 (2011).
- Foust, K. D., Kaspar, B. K. Over the barrier and through the blood: to CNS delivery we go. Cell Cycle. 24, 4017-4018 (2009).
- Snyder, E. Y., Taylor, R. M., Wolfe, J. H. Neural progenitor cell engraftment corrects lysosomal storage throughout the MPS VII mouse brain. Nature. 374, 367-370 (1995).
- Passini, M. A., Wolfe, J. H. Widespread gene delivery and structure-specific patterns of expression in the brain after intraventricular injections of neonatal mice with an adeno-associated virus vector. J. Virol. 24, 12382-12392 (2001).
- Kienstra, K. A., Freysdottir, D., Gonzales, N. M., Hirschi, K. K. Murine neonatal intravascular injections: modeling newborn disease. J. Am. Assoc. Lab. Anim. Sci. 46, 50-54 (2007).
- Sands, M. S., Barker, J. E. Percutaneous intravenous injection in neonatal mice. Lab. Anim. Sci. 49, 328-330 (1999).
- Foust, K. D. Rescue of the spinal muscular atrophy phenotype in a mouse model by early postnatal delivery of SMN. Nat. Biotechnol. 28, 271-274 (2010).
- Foust, K. D. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat. Biotechnol. 27, 59-65 (2009).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene delivery to the mouse brain with adeno-associated virus. Methods Mol. Biol. 246, 225-236 (2004).
- Coady, T. H., Lorson, C. L. Trans-splicing-mediated improvement in a severe mouse model of spinal muscular atrophy. J. Neurosci. 30, 126-130 (2010).
- Baughan, T. D., Dickson, A., Osman, E. Y., Lorson, C. L. Delivery of bifunctional RNAs that target an intronic repressor and increase SMN levels in an animal model of spinal muscular atrophy. Hum. Mol. Genet. 18, 1600-1611 (2009).
- Coady, T. H., Baughan, T. D., Shababi, M., Passini, M. A., Lorson, C. L. Development of a single vector system that enhances trans-splicing of SMN2 transcripts. PLoS One. 3, e3468-e3468 (2008).
- Dickson, A., Osman, E., Lorson, C. A. Negatively-Acting Bifunctional RNA Increases Survival Motor Neuron in vitro and in vivo. Hum. Gene. Ther. 19, 1307-1315 .
- Mattis, V. B., Ebert, A. D., Fosso, M. Y., Chang, C. W., Lorson, C. L. Delivery of a read-through inducing compound, TC007, lessens the severity of a spinal muscular atrophy animal model. Hum. Mol. Genet. 18, 3906-3913 (2009).
- Williams, J. H. Oligonucleotide-mediated survival of motor neuron protein expression in CNS improves phenotype in a mouse model of spinal muscular atrophy. J. Neurosci. 29, 7633-7638 (2009).
- Passini, M. A. CNS-targeted gene therapy improves survival and motor function in a mouse model of spinal muscular atrophy. J. Clin. Invest. 120, 1253-1264 (2010).
- Shababi, M., Glascock, J., Lorson, C. L. Combination of SMN Trans-Splicing and a Neurotrophic Factor Increases the Life Span and Body Mass in a Severe Model of Spinal Muscular Atrophy. Hum. Gene. Ther. 22, 1-10 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены