Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La entrega de los agentes terapéuticos a través de intracerebroventricular (ICV) y la inyección intravenosa (IV) en ratones
En este artículo
Resumen
Este artículo muestra dos métodos muy diferentes de inyección: 1) en el cerebro (intracerebroventricular) y 2) sistémica (intravenosa) para introducir los agentes terapéuticos en el sistema nervioso central de ratones recién nacidos.
Resumen
A pesar de la función protectora de la barrera hematoencefálica juega en la protección del cerebro, limita el acceso al sistema nervioso central (SNC) que con mayor frecuencia resulta en el fracaso de la terapéutica potencial diseñado para 1,2 trastornos neurodegenerativos. Enfermedades neurodegenerativas como la atrofia muscular espinal (SMA), en el que las neuronas motoras inferiores se ven afectados, pueden beneficiarse enormemente de la introducción de los agentes terapéuticos en el SNC. El propósito de este video es para demostrar dos paradigmas diferentes de inyección para entregar los materiales terapéuticos en ratones recién nacidos poco después del nacimiento. Uno de estos métodos es la inyección directamente en los ventrículos laterales cerebrales (intracerebroventricular) que se traduce en la entrega de materiales en el sistema nervioso central a través del líquido cefalorraquídeo 3,4. El segundo método es una inyección en la vena temporal (intravenosa) que se pueden introducir diferentes terapias en el sistema circulatorio, dando lugar a la entrega sistémica incluyendo los 5 del SNC. Transducción generalizada del sistema nervioso central que se puede lograr si un vector apropiado viral y el serotipo viral se utiliza. La visualización y la utilización de la vena temporal para la inyección es posible hasta después del día 6. Sin embargo, si el material entregado está destinado a llegar al sistema nervioso central, estas inyecciones debe llevarse a cabo mientras la barrera hematoencefálica es más permeable, debido a su estado de inmadurez, de preferencia antes del día 2 después del parto. La barrera sanguínea del cerebro completamente desarrollado en gran medida limita la eficacia de la administración intravenosa. Ambos sistemas de entrega son simples y efectivas una vez que la capacidad quirúrgica se logra. No requieren ningún dispositivo quirúrgico extenso y se puede realizar por una sola persona. Sin embargo, estas técnicas no es una tarea sencilla. El pequeño tamaño de postnatal día 2 cachorros y las áreas posteriores objetivo pequeñas pueden hacer que las inyecciones difícil de realizar y en un principio difícil de replicar.
Protocolo
1. Inyección intracerebroventricular
- El primer paso es la preparación de las soluciones de inyección de valores, estas soluciones son vector viral, el ADN plásmido, las drogas, y debe ser inyectado bajo condiciones estériles.
- Mezcla de un título deseado de vector viral (total l 5-7) con un 0,05% w / v de azul tripan en PBS durante la visualización del sitio de la inyección.
- Solución de ADN plásmido (5 en total l l) contiene D-(+)-glucosa al 20% (w / v) (1 l), azul de tripano (0,05%) PBS (1 l), el plásmido (~ 5 ~ g / L ~ ) (2 ~ L), y 2,5 kDa homopolímero lineal PEI (150 mm) (1 ~ L).
- Inmovilizar el PND dos recién nacidos a través de la crio-anestesia durante 1-2 minutos.
- La aguja utilizada para la inyección es un micro-litros calibrada micropipeta de vidrio esterilizado que se adjunta a una jeringa de 3 ml 3 ml Hamilton a través de un tubo largo.
- Romper la punta de la aguja (con una espátula) para ajustarse a la penetración de 2 mm en el cráneo. Colocar la aguja en diagonal en el tubo de microcentrífuga que contiene la solución inyectable. Cargue la solución de la inyección en la aguja con cuidado tirando del émbolo de la jeringa.
- Después de la absorción de la solución, desvincular la jeringa de la sonda, tire del émbolo hasta allá y luego se adhieren a la aguja de nuevo.
- Mantenga la aguja en la mano derecha entre el pulgar y los dedos índice y coloque la jeringa entre los dedos medio y anular con el émbolo tocando la palma de la mano derecha.
- Sujete firmemente el ratón inmovilizado por la piel detrás de la cabeza con la mano izquierda y colocar en una luz de fibra óptica para iluminar las estructuras anatómicas relevantes que se pueden utilizar como guía.
- Inserte la aguja de 2 mm de profundidad, perpendicular a la superficie del cráneo, en un lugar de aproximadamente 0,25 mm lateral a la sutura sagital y 0,50-0,75 mm rostral a la sutura coronaria neonatal (Figura 1). A continuación, empuje el émbolo con la palma de la la mano derecha muy despacio y con cuidado. Monitor de ruptura de vasos o hinchazón de la cara.
- Retire la aguja de 15 segundos después de la interrupción del movimiento del émbolo para evitar el reflujo.
- Para recuperar, mantener a los ratones durante 5-10 minutos en un recipiente calentado hasta que el movimiento y la respuesta general es restaurado.
2. La inyección intravenosa a través de la vena temporal / facial
- La solución a inyectar debe estar preparado y que será completada con el tinte filtra los alimentos verdes en dilución 1:100 y se inyecta bajo condiciones estériles.
- Adjuntar una pequeña de plástico luer hasta el final de una jeringa de vidrio de 100 L Hamilton. Para el luer, conectar un 33 calibre 0,25 pulgadas aguja hipodérmica. Asegúrese de que todas las piezas estén bien conectados.
- Cargue la jeringa con el volumen a inyectar, asegurando que no hay aire en la jeringa como la inyección de aire en el vaso es letal. A menudo es útil para pipeta el volumen que se inyecta a un trozo de parafilm. Esto permite la visualización clara de la absorción de la solución en la jeringa.
- A la vista Transiluminador Wee se utiliza para visualizar fácilmente la vena temporal superficial, o en la vena facial, en el neonato (Figura 2A). Antes de la inyección, seguro del recién nacido a la transiluminador con cinta quirúrgica. Gasa se debe colocar entre el recién nacido y la cinta para evitar que la cinta de dañar la piel del animal. Seguro que el animal el transiluminador de su lado, asegurando que la cinta no impide la respiración. El cuello del recién nacido debe ser agitado giró de forma que la vena facial es fácilmente visible y la nariz debe ser grabada para estabilizar la cabeza.
- Usando una lupa diadema 2,25 X para permitir una mejor visualización, introduzca lentamente la aguja en la vena. La vena es muy superficial por lo que la aguja debe permanecer visible debajo de la piel.
- Poco a poco infundir el volumen de la solución en la vena. El tinte verde permite una fácil visualización de la inyección.
- Espere 15 segundos antes de retirar la aguja, como hay un desfase entre completamente el émbolo de la jeringa y la expulsión de la solución restante debido a la perforación de aguja extremadamente estrecho.
- Después de retirar la aguja, usar una gasa para aplicar presión en el sitio de la inyección hasta que el sangrado se detiene.
- Monitorear el recién nacido en busca de signos de angustia. Después de una inyección adecuada, no angustia manifiesta deben ser observados. El recién nacido debe ser dado a unos 5 minutos para recuperarse antes de que sea devuelto a la jaula.
- Enjuague la unidad de la aguja / jeringa con PBS entre las inyecciones de la sangre en la aguja rápidamente se obstruyen debido al pequeño diámetro.
3. Los resultados representativos:
ICV inyección: El cerebro se puede cosechar en el momento de los diferentes puntos después de la inyección y se visualizan para demostrar la técnica de inyección de éxito. Si el medio no se agrega a la solución de inyección, que será difícil para verificar la exactitud de los deproyección. De inyección adecuada de uno de los ventrículos permite la distribución de los azules en el lado de tripan inyecta en el cerebro a unos 10-15 minutos después de la inyección (fig. 1B). Una distribución uniforme de azul tripán en ambos hemisferios cerebrales derecho e izquierdo y bulbos olfatorios será visible aproximadamente 60 minutos después de la inyección (fig. 1C). Esto se debe a la conectividad de los ventrículos cerebrales que permitan la difusión del colorante azul al ventrículo adyacente. Inyecciones de precisión también puede verse por la dispersión del colorante azul en el canal central de la columna rostral aproximadamente dentro de 12 horas después de la inyección (Figura 1D). Inyecciones incorrectas pueden ser distinguidos por la falta de color azul en los hemisferios cerebrales. En este caso, la profundidad de la aguja no fue suficiente y la solución de inyección probablemente ha distribuido bajo la piel. Una posibilidad alternativa es que la aguja penetra demasiado profundamente en el cerebro, lo que pasa más allá del ventrículo y la solución se vacía por debajo de los ventrículos cerebrales.
IV de inyección: inyección precisa y eficiente la vena temporal / facial puede ser visualizado inmediatamente después de la inyección. Como la solución se inyecta el tinte verde permite la visualización de la solución que entra y fluye a través de la vena facial (Figura 2A). Además, el color de la piel alterada del ratón se observó después de la inyección. El recién nacido es de color rosado normal se convierte en verde, debido a la presencia del colorante verde en la solución de la inyección (Figura 2B). La medida del cambio de color verde observada en el recién nacido depende de la concentración de colorante utilizado. Para la visualización simple de la inyección y durante un periodo de prácticas, una dilución 1:50 se recomienda. Sin embargo, el tono de la piel dramáticamente alterado con frecuencia resulta en el cachorro de ser rechazado por la madre y por lo tanto, la eliminación del colorante o una concentración significativa reducción se debe considerar en los procedimientos experimentales. Una inyección incorrecta dará lugar a la acumulación de colorante verde debajo de la piel en el sitio de la inyección. Inyección incompleta, lo que ocurre cuando la abertura de la aguja no está completamente insertada en la vena, se ve cuando los flujos de alguna solución en la vena y algunos se acumula bajo la piel. Si esto se detecta, la aguja debe insertarse aún más en el vaso.
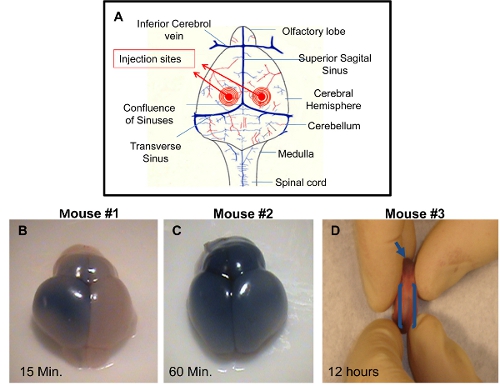
Figura 1. Demostración del éxito de las inyecciones de ICV en PDN2 ratones. Un esquema) de los sitios de inyección utilizado en las inyecciones ICV hacia los ventrículos. B) del cerebro de ICV inyecta Cachorro con azul tripán en PBS el ventrículo izquierdo, foto tomada 15 minutos después de la inyección. C ) del cerebro de ICV inyecta Cachorro con azul tripán en PBS en ventrículo izquierdo, foto tomada 60 minutos después de la inyección. D) se muestra el centro del canal espinal rostral de ICV inyecta cachorro con azul tripán en PBS el ventrículo izquierdo, foto tomada 12 horas después de la inyección.

Figura 2. Demostración del éxito de inyecciones intravenosas en PDN2 ratones. Esquema A) de la vena facial utilizada para inyecciones intravenosas. B) IV Cachorro inyectó un tinte verde en comparación con PBS sin inyección de la misma camada, foto tomada inmediatamente después de la inyección.
Discusión
Investigación utilizando modelos de ratón de la enfermedad a menudo requiere la administración de medicamentos u otras sustancias a los recién nacidos. En este video, se demuestra el paso a paso los procedimientos que participan dos tipos de estrategias de inyección que puede ser utilizada para combatir el SNC: 1) la inyección directa en el sistema nervioso central que utilizan intracerebroventricular (ICV) de la inyección, o 2) la inyección IV dirigidas a la / temporal vena facial. El calendario de estas inyecc...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a John Marston para el experto la cría de animales y el Dr. Marco A. Passini para la asistencia técnica en las primeras etapas de este proyecto. Este trabajo fue financiado por la beca de los Institutos Nacionales de Salud para la LLC (R01NS41584; R01HD054413).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| Verde colorantes en los alimentos | McCormick | n / a | Debe ser filtrada |
| Hamilton jeringa de vidrio (100 l) | Sigma Aldrick | 20702 | |
| Tema LuerMxF White Style Nylon | Piezas pequeñas, Inc. | VPLF-LC78-1-25 | |
| Finas agujas hipodérmicas calibre | Corchete | 7111 | Tamaño: 33 (SWG) x ¼ "(6,35 mm) |
| Transiluminador vista Wee | Respironics | 1017920 | |
| 2,25 X diadema Lupa | MagEyes | Modelo N º 5 | Seleccione ampliación para adaptarse a las preferencias individuales |
Referencias
- Blanchette, M., Fortin, D. Blood-brain barrier disruption in the treatment of brain tumors. Methods Mol. Biol. 686, 447-463 (2011).
- Foust, K. D., Kaspar, B. K. Over the barrier and through the blood: to CNS delivery we go. Cell Cycle. 24, 4017-4018 (2009).
- Snyder, E. Y., Taylor, R. M., Wolfe, J. H. Neural progenitor cell engraftment corrects lysosomal storage throughout the MPS VII mouse brain. Nature. 374, 367-370 (1995).
- Passini, M. A., Wolfe, J. H. Widespread gene delivery and structure-specific patterns of expression in the brain after intraventricular injections of neonatal mice with an adeno-associated virus vector. J. Virol. 24, 12382-12392 (2001).
- Kienstra, K. A., Freysdottir, D., Gonzales, N. M., Hirschi, K. K. Murine neonatal intravascular injections: modeling newborn disease. J. Am. Assoc. Lab. Anim. Sci. 46, 50-54 (2007).
- Sands, M. S., Barker, J. E. Percutaneous intravenous injection in neonatal mice. Lab. Anim. Sci. 49, 328-330 (1999).
- Foust, K. D. Rescue of the spinal muscular atrophy phenotype in a mouse model by early postnatal delivery of SMN. Nat. Biotechnol. 28, 271-274 (2010).
- Foust, K. D. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat. Biotechnol. 27, 59-65 (2009).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene delivery to the mouse brain with adeno-associated virus. Methods Mol. Biol. 246, 225-236 (2004).
- Coady, T. H., Lorson, C. L. Trans-splicing-mediated improvement in a severe mouse model of spinal muscular atrophy. J. Neurosci. 30, 126-130 (2010).
- Baughan, T. D., Dickson, A., Osman, E. Y., Lorson, C. L. Delivery of bifunctional RNAs that target an intronic repressor and increase SMN levels in an animal model of spinal muscular atrophy. Hum. Mol. Genet. 18, 1600-1611 (2009).
- Coady, T. H., Baughan, T. D., Shababi, M., Passini, M. A., Lorson, C. L. Development of a single vector system that enhances trans-splicing of SMN2 transcripts. PLoS One. 3, e3468-e3468 (2008).
- Dickson, A., Osman, E., Lorson, C. A. Negatively-Acting Bifunctional RNA Increases Survival Motor Neuron in vitro and in vivo. Hum. Gene. Ther. 19, 1307-1315 .
- Mattis, V. B., Ebert, A. D., Fosso, M. Y., Chang, C. W., Lorson, C. L. Delivery of a read-through inducing compound, TC007, lessens the severity of a spinal muscular atrophy animal model. Hum. Mol. Genet. 18, 3906-3913 (2009).
- Williams, J. H. Oligonucleotide-mediated survival of motor neuron protein expression in CNS improves phenotype in a mouse model of spinal muscular atrophy. J. Neurosci. 29, 7633-7638 (2009).
- Passini, M. A. CNS-targeted gene therapy improves survival and motor function in a mouse model of spinal muscular atrophy. J. Clin. Invest. 120, 1253-1264 (2010).
- Shababi, M., Glascock, J., Lorson, C. L. Combination of SMN Trans-Splicing and a Neurotrophic Factor Increases the Life Span and Body Mass in a Severe Model of Spinal Muscular Atrophy. Hum. Gene. Ther. 22, 1-10 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados