JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마우스에 Intracerebroventricular을 통해 치료 대리점 납품 (ICV)과 정맥 (IV) 사출
요약
신생아 생쥐의 중추 신경계에 치료 요원들을 소개하는 뇌 (intracerebroventricular)와 (정맥 주사) 2) 체계로 : 1)이 문서 분사의 두 가지 방법을 보여줍니다.
초록
혈액 뇌 장벽은 두뇌를 차폐에서 활약하는 보호 역할에도 불구하고, 그것은 중추 신경계 (CNS)에 대한 액세스를 제한하는 neurodegenerative 장애 1,2을위한 잠재적인 치료제의 실패에서 가장 자주 발생합니다. 이러한 척수 근육질 위축 (SMA)로 Neurodegenerative 질병은 낮은 모터 뉴런이 영향을하는, CNS에 치료 에이전트를 도입에서 크게 혜택을 누릴 수 있습니다. 이 비디오의 목적은 출생 직후 신생아 생쥐에 치료 물질을 전달하기 위해 두 개의 서로 다른 사출 패러다임을 설명하는 것입니다. 이러한 방법 중 하나는 뇌척수 3,4 통해 CNS에 자료의 전송 결과 뇌성 측면 심실 (Intracerebroventricular)에 직접 주입합니다. 두 번째 방법은 CNS 5 포함한 체계적인 납품에 이르는, 순환 시스템에 다른 치료제를 소개할 수있는 시간적 정맥 주입 (정맥 주사)입니다. 적절한 바이러스 벡터 및 바이러스 혈청형가 활용되는 경우 CNS의 광범위한 도입이 달성됩니다. 시각화 및 주입을위한 정맥의 시간적 활용도가 출생 후의 일 6 가능합니다. 제공된 자료가 CNS에 도달하기위한 것일 뿐이므로 이러한 경우에는 혈액 뇌 장벽 때문에 그 미숙 상태로 더 투과하는 동안 그러나, 이러한 주사는 가급적 사전에 출생 후의 일 2, 장소 정도 소요됩니다. 완벽하게 개발된 혈액 뇌 장벽은 크게 정맥 전달의 효과를 제한합니다. 수술 적성이 달성되면 전달 시스템 모두 간단하고 효과적입니다. 그들은 광범위한 수술 장치를 필요로하지 않으며 한 사람에 의해 수행할 수 있습니다. 그러나 이러한 기술은 도전없이는되지 않습니다. 출생 후의 일 2 새끼와 후속 작은 대상 영역의 작은 크기는 주사가 수행하기 어려운 및 복제 처음 도전 할 수 있습니다.
프로토콜
1. Intracerebroventricular 주사
- 첫 번째 단계는 사출 재고 솔루션의 준비이며 이러한 솔루션은 바이러스 벡터, 플라스미드 DNA, 마약, 그리고 무균 조건 하에서 주입해야합니다.
- 0.05 % 사출 사이트의 시각화를 위해 PBS에 W / V trypan 파랑과 바이러스성 벡터 (5-7 μL 총)의 원하는 titer를 섞습니다.
- 플라스미드 DNA 용액 (오리터 μL 총) D - (+) - 포도당 20% (W / V) (1 μL), trypan 파랑 (0.05 %) PBS (1 μL), 플라스미드 (~ 5 ~ G / ~ L을 포함 ) (2 ~ L) 및 2.5 kDa 선형 PEI 단일 중합체 (150 ㎜) (1 ~ L).
- 1~2분에 대한 cryo - 마취를 통해 쿨러 2 neonates를 무력화.
- 이 주사에 사용되는 바늘은 긴 튜브를 통하여 3ml 3 ML 해밀턴 주사기에 연결된 마이크로 리터 보정 소독 유리 micropipette입니다.
- 두개골에 2mm의 침투에 대한 조정 바늘 (주걱 포함)의 팁을 휴식. 사출 솔루션을 포함하고있는 microcentrifuge 관에서 대각선 바늘을 놓으십시오. 조심스럽게 주사기의 플런저를 당겨 바늘로 주사 솔루션을로드합니다.
- 솔루션의 이해 후, 튜브에서 주사기를 끊을, 추가로 플런저를 끌어 다음 다시 바늘에 첨부합니다.
- 엄지와 검지 손가락 사이의 오른쪽에있는 바늘을 잡고 오른쪽 손바닥을 감동 플런저와 함께 중간 및 링 손가락 사이에 주사기를 놓습니다.
- 단단히 가이드로 사용할 수있는 관련 해부 구조를 조명 광섬유 조명에 왼쪽과 장소를 사용하여 머리 뒤쪽 피부로 고정 마우스를 파악.
- 위치 화살 치료 측면 약 0.25 mm와 신생아 관상 봉합 (그림 1A)에 주동이의 0.50-0.75 mm에서 두개골 표면에 직각으로, 깊은 바늘 2mm를 넣습니다. 그런 다음 손바닥을 사용하여 플런저를 밀어 오른손 아주 천천히 그리고 신중하게. 파열 혈관이나 얼굴의 부기에 대한 모니터링합니다.
- 역류를 방지하기 위해 플런저 운동 중지 후 바늘 15 초 정도 제거합니다.
- , 복구 움직임과 일반적인 대응이 복구 될때까지 따뜻하게 용기에 5-10분에 대한 생쥐를 유지합니다.
2. 시간적 / 안면 정맥을 통해 정맥 주사
- 주입되는 솔루션은 준비 및 필터링 녹색 식용 색소를 보충 1:100 희석 시에 무균 조건 하에서 주입해야합니다.
- 100 μL 유리 해밀턴 주사기 끝에 luer 작은 플라스틱을 첨부합니다. luer하려면 33 게이지 0.25 인치 피하 바늘을 첨부합니다. 모든 부품이 안전하게 연결되어 있는지 확보.
- 공기 그릇에 공기 주입으로 주사기에 없다는 것을 보장, 주입으로 볼륨과 주사기를로드하면 치명적입니다. 그것은 종종 pipet parafilm의 일부 이니라 주입하는 볼륨에 도움이됩니다. 이것은 주사기로 솔루션의 이해의 명확 시각화 수 있도록합니다.
- 위 사이트의 Transilluminator 쉽게 neonate의 표면 시간적 정맥, 또는 얼굴 정맥, (그림 2A)를 시각화하는 데 사용됩니다. 주입하기 전에 수술 테이프를 사용하여 transilluminator로 neonate을 확보. 거즈는 동물의 피부를 손상에서 테이프를 방지하기 위해 neonate과 테이프 사이에 위치해야합니다. 테이프가 호흡을 방지하지 않는다는 보장, 그 측면에 transilluminator로 동물을 고정합니다. neonate의 목을 부드럽게 얼굴 정맥을 쉽게 볼 수 있도록 설정되어 있어야하며 코는 머리를 고정 녹화해야합니다.
- 쉽게 시각화 수 있도록 2.25X 밴드의 확대경을 사용하여 천천히 정맥에 바늘을 삽입합니다. 바늘이 피부 아래에 보이는 남아 있어야하므로 정맥은 매우 피상적이다.
- 천천히 정맥에 솔루션의 볼륨을 달이다. 녹색 염료는 사출 쉽게 시각화를위한 수 있습니다.
- 완전히 주사기와 매우 좁은 바늘 구멍으로 인해 남아있는 솔루션의 퇴학의 플런저를 우울 사이에 지연이로 바늘을 제거하기 전에 15 초 정도 기다리십시오.
- 바늘을 제거한 후 출혈이 멈추면 때까지 주입 사이트에 압력을 적용하기 위해 거즈를 사용합니다.
- 고통의 흔적에 대한 neonate를 모니터링합니다. 적절한 주사 후, 더 명백한 고통은 관찰되지 않을 것입니다. neonate 그것은 케이지에 반환되기 전에 복구하는 약 5 분 정도 실시한다.
- 주사 바늘에 혈액이 빠르게 인해 작은 구멍으로 방해할되므로 주사 사이에 PBS로 바늘 / 주사기 장치를 플러시.
3. 대표 결과 :
ICV 주사 : 두뇌가 서로 다른 시간 포인트 사후 분사에 수확하고 성공적인 사출 기술을 보여주는 시각하실 수 있습니다. 염료가 주입 솔루션에 추가되지 않은 경우, 그것은에의 정확성을 확인하기 어려울 것입니다jection. 심실 중 하나의 적절한 주입은 두뇌의 주입 측면에 trypan 파란색의 배포를 허용합니다 약 10-15분 포스트 사출 (그림 1B). 좌우 대뇌 반구와 후각 구근 모두 trypan 파랑의 균일한 분포가 약 60 분 게시 주입 (그림 1C) 표시됩니다. 이것은 인접한 뇌실에 청색 색소의 보급을 허용합니다 대뇌 심실의 연결에 의한 것입니다. 정확한 주사는 약 12시간 포스트 사출 (그림 1D)에서 주동이의 중앙 척추 운하에있는 청색 색소의 분산에 의해 시각하실 수 있습니다. 부정 확한 주사는 뇌성 반구에있는 파란색의 부족에 의해 구별 수 있습니다. 이 경우 바늘의 깊이가 충분하지되었고 사출 솔루션은 아마도 피부 아래에 배포했다. 다른 가능성은 바늘이이를 뇌실과 솔루션 대뇌 심실 아래납니다 넘어 통과, 두뇌에 너무 깊이 침투한다는 것입니다.
IV 주입 : 정확하고 효율적인 시간적 / 안면 정맥 주사는 주사 바로 다음 시각하실 수 있습니다. 솔루션이 주입되면서 녹색 염료 입력하고 얼굴 정맥 (그림 2A)를 통해 흐르는 솔루션의 시각화를위한 수 있습니다. 또한, 마우스의 조작 스킨 색상은 다음과 같은 주사를 관찰합니다. neonate의 정상적인 핑크색 색상 때문에 사출 솔루션에 녹색 식품 색소 (그림 2B)의 존재로, 녹색으로 변환됩니다. neonate에서 관찰 녹색 색깔 변화의 정도는 사용되는 염료의 농도에 의존적일 수 밖에 없습니다. 분사와 연습 기간 동안 간단한 시각화 들어, 1시 50분 희석 권장합니다. 그러나 극적으로 변경 피부 색조는 종종 강아지의 어머니에 의해 거부되고 따라서, 염료 또는 크게 감소 농도의 제거가 실험 과정 중에 고려되어야 결과. 부정 확한 주사는 주사의 사이트에있는 피부 아래에 녹색 색소의 축적의 결과 것입니다. 바늘의 개통 완전히 정맥 내에 삽입되지 않은 경우 발생하는 불완전 주입은, 일부 솔루션은 정맥에 흐르는 때 볼 수 있으며 일부는 피부 아래 축적되어있다. 이것이 관찰되면, 주사 바늘이 혈관에 더 삽입해야합니다.
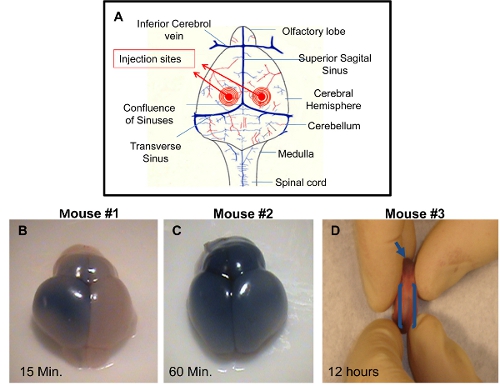
그림 1. PDN2 쥐를 성공적으로 ICV 주사의 데모. 심실로 ICV 주사에 이용 사출 사이트) 도식은. B) 좌심실에 PBS에 trypan 블루와 강아지 주입 ICV의 브레인, 사진 15 분 게시 주사를 촬영. C ICV에서) 브레인 좌심실에 PBS에 trypan 블루와 강아지 주입, 촬영한 사진은 60 분 게시 주입. D) 주동이의 중앙 척추 운하는 ICV에 표시됩니다이 좌심실에 PBS에 trypan 블루와 강아지 주입 12 시간 게시 주사를 찍은 사진.

그림 2. PDN2 생쥐에서 성공 IV 주사의 데모가. IV 주사에 대한 활용 안면 정맥의) 도식은. B) PBS에 녹색 색소와 강아지 주입 IV가 취소 주입 littermate에 비해, 사진은 즉시 게시 주사를 촬영.
토론
질병의 마우스 모델을 사용하는 연구는 종종 neonates에 약물이나 기타 물질의 관리를 필요로합니다. 이 비디오에서는, 우리는 입증 단계별로 CNS를 대상으로하는 데 사용할 수있는 분사 전략의 두 가지 유형의 포함하는 단계 절차 : 직접 분사가 intracerebroventricular (ICV) 주사를 이용한 CNS에 1), 또는 시간적 /를 대상으로 2) IV 주입 얼굴 정맥. 이 주사의 타이밍은 매우 중요합니다. ICV 주사는 프리핸드 때...
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
저자는이 프로젝트의 초기 단계에서 기술 지원 전문가 축산학 박사 마르코 A. Passini에 대한 존 말스톤양은 감사하고 싶습니다. 이 작품은 CLL로 국립 보건원 (; R01HD054413 R01NS41584)에서 부여에 의해 투자되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 (옵션) |
|---|---|---|---|
| 그린 식품 염료 | 맥코믹 | N / A | 필터링해야합니다 |
| 해밀턴 유리 주사기 (100 μL) | 시그마 Aldrick | 20,702 | |
| LuerMxF 스레드 스타일 화이트 나일론 | 소형 부품, 주식 회사 | VPLF - LC78 - 1-25 | |
| 파인 게이지 피하 니들 | Popper | 7111 | 크기 : 33 (SWG) × ¼ "(6.35 MM) |
| 위 시야 Transilluminator | Respironics | 1,017,920 | |
| 2.25X 머리띠 돋보기 | MagEyes | 모델 5 호 | 개별 환경에 맞게 확대를 선택합니다 |
참고문헌
- Blanchette, M., Fortin, D. Blood-brain barrier disruption in the treatment of brain tumors. Methods Mol. Biol. 686, 447-463 (2011).
- Foust, K. D., Kaspar, B. K. Over the barrier and through the blood: to CNS delivery we go. Cell Cycle. 24, 4017-4018 (2009).
- Snyder, E. Y., Taylor, R. M., Wolfe, J. H. Neural progenitor cell engraftment corrects lysosomal storage throughout the MPS VII mouse brain. Nature. 374, 367-370 (1995).
- Passini, M. A., Wolfe, J. H. Widespread gene delivery and structure-specific patterns of expression in the brain after intraventricular injections of neonatal mice with an adeno-associated virus vector. J. Virol. 24, 12382-12392 (2001).
- Kienstra, K. A., Freysdottir, D., Gonzales, N. M., Hirschi, K. K. Murine neonatal intravascular injections: modeling newborn disease. J. Am. Assoc. Lab. Anim. Sci. 46, 50-54 (2007).
- Sands, M. S., Barker, J. E. Percutaneous intravenous injection in neonatal mice. Lab. Anim. Sci. 49, 328-330 (1999).
- Foust, K. D. Rescue of the spinal muscular atrophy phenotype in a mouse model by early postnatal delivery of SMN. Nat. Biotechnol. 28, 271-274 (2010).
- Foust, K. D. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat. Biotechnol. 27, 59-65 (2009).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene delivery to the mouse brain with adeno-associated virus. Methods Mol. Biol. 246, 225-236 (2004).
- Coady, T. H., Lorson, C. L. Trans-splicing-mediated improvement in a severe mouse model of spinal muscular atrophy. J. Neurosci. 30, 126-130 (2010).
- Baughan, T. D., Dickson, A., Osman, E. Y., Lorson, C. L. Delivery of bifunctional RNAs that target an intronic repressor and increase SMN levels in an animal model of spinal muscular atrophy. Hum. Mol. Genet. 18, 1600-1611 (2009).
- Coady, T. H., Baughan, T. D., Shababi, M., Passini, M. A., Lorson, C. L. Development of a single vector system that enhances trans-splicing of SMN2 transcripts. PLoS One. 3, e3468-e3468 (2008).
- Dickson, A., Osman, E., Lorson, C. A. Negatively-Acting Bifunctional RNA Increases Survival Motor Neuron in vitro and in vivo. Hum. Gene. Ther. 19, 1307-1315 .
- Mattis, V. B., Ebert, A. D., Fosso, M. Y., Chang, C. W., Lorson, C. L. Delivery of a read-through inducing compound, TC007, lessens the severity of a spinal muscular atrophy animal model. Hum. Mol. Genet. 18, 3906-3913 (2009).
- Williams, J. H. Oligonucleotide-mediated survival of motor neuron protein expression in CNS improves phenotype in a mouse model of spinal muscular atrophy. J. Neurosci. 29, 7633-7638 (2009).
- Passini, M. A. CNS-targeted gene therapy improves survival and motor function in a mouse model of spinal muscular atrophy. J. Clin. Invest. 120, 1253-1264 (2010).
- Shababi, M., Glascock, J., Lorson, C. L. Combination of SMN Trans-Splicing and a Neurotrophic Factor Increases the Life Span and Body Mass in a Severe Model of Spinal Muscular Atrophy. Hum. Gene. Ther. 22, 1-10 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유