Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fare intraserebroventriküler sayesinde Terapötik Ajanlar teslimi (ICV) ve intravenöz (IV) Enjeksiyon
Bu Makalede
Özet
Merkezi sinir sistemi içine yenidoğan farelerin beyin (intraserebroventriküler) ve (intravenöz) 2) sistemik tedavi ajanları tanıtmak içine 1): Bu makale, enjeksiyon iki çok farklı yöntemler göstermektedir.
Özet
Kan-beyin bariyeri beyni koruyucu oynadığı koruyucu bir role rağmen, santral sinir sistemi (MSS) erişimi sınırlar, nörodejeneratif hastalıklar için tasarlanmış 1,2 potansiyel terapötikler çoğu kez sonuç başarısızlık . Spinal Müsküler Atrofi (SMA) gibi nörodejeneratif hastalıklar, alt motor nöronlar etkilendiği, merkezi sinir sistemi içine terapötik ajanlar tanıtan büyük fayda edebilir. Bu videonun amacı, yenidoğan farelerin doğumdan kısa süre sonra tedavi malzemeleri teslim etmek için iki farklı enjeksiyon paradigmalar göstermektir. Bu yöntemlerden biri, beyin omurilik sıvısı 3,4 yoluyla CNS içine malzeme teslim sonuçlar serebral lateral ventriküller (intraserebroventriküler) içine doğrudan enjekte İkinci yöntem, merkezi sinir sistemi de dahil olmak üzere 5 sistemik teslim giden, dolaşım sistemi içine farklı terapötikler tanıtmak temporal ven enjeksiyonu (intravenöz) . Uygun bir viral vektör ve viral serotip kullanılmaktadır MSS yaygın transdüksiyon ulaşılabilir. Görselleştirme ve enjeksiyon için temporal ven kullanımı, doğum sonrası gün 6 uygulanabilir. Ancak, teslim edilen malzeme, MSS ulaşmak için amaçlanan ise kan-beyin bariyeri nedeniyle olgunlaşmamış durumu daha geçirgen ise, bu enjeksiyonları, tercihen önce doğum sonrası gün 2 yer almalıdır. Tam gelişmiş kan-beyin bariyeri intravenöz teslim etkinliğini büyük ölçüde sınırlar. Her iki dağıtım sistemleri, cerrahi yetenek sağlandıktan sonra, basit ve etkili. Herhangi bir geniş cerrahi cihazlar gerek yoktur ve tek bir kişi tarafından yapılabilir. Ancak, bu teknikler zorlukları olmadan değildir. Postnatal 2. günde yavrular ve küçük bir sonraki hedef alanları küçük boyutlu enjeksiyonları gerçekleştirmek için çoğaltmak için başlangıçta zor ve zorlu yapabilirsiniz.
Protokol
1. Intraserebroventriküler enjeksiyon
- İlk adım enjeksiyon stok çözümler hazırlanması; bu çözümler viral vektör, plazmid DNA, uyuşturucu ve steril koşullar altında enjekte edilmelidir.
- Istenen bir viral vektör (5-7 mcL toplam) titresi 0.05% w / v tripan mavi enjeksiyon görünüm için PBS ile karıştırın.
- Plazmid DNA solüsyonu (5 l mcL toplam) D-(+)-glikoz oranı% 20 (w / v) (1 mcL), tripan mavisi (% 0.05), PBS (1 mcL), plazmid (~ 5 ~ g / ~ L içerir. ) (2 ~ L) ve 2.5 kDa doğrusal PEI homopolimer (150 mM) (1 ~ L).
- PND 2 yenidoğanlarda cryo anestezi ile 1-2 dakika boyunca hareketsiz.
- Bu enjeksiyon için kullanılan iğne, uzun bir tüp aracılığıyla 3ml 3 mL Hamilton şırınga takılı bir mikro-litre kalibre steril cam mikropipet.
- Kafatasının içine 2 mm penetrasyon için ayarlamak için (spatula ile) iğne ucu kırın. Enjeksiyon çözeltisi içeren mikrosantrifüj tüp çapraz iğne yerleştirin. Şırınganın pistonu dikkatlice çekerek iğne içine enjeksiyon çözüm yükleyin.
- Çözüm alındıktan sonra, tüpten şırınga ilişkisini; piston daha yukarı çekin ve sonra tekrar iğne eklemek.
- Sağ el başparmak ve işaret parmakları arasında Hold iğne ve şırınga pistonu dokunmadan sağ elin avuç içi ile orta ve yüzük parmakları arasında yerleştirin.
- Immobilize fare ilgili anatomik yapıların bir kılavuz olarak kullanılabilir aydınlatmak için sol eliyle yer ve bir fiber-optik ışık kullanarak deri başın arkasında sıkıca kavrayın.
- Bir konuma yaklaşık 0,25 mm lateral sagital sütür ve yenidoğan koroner dikiş (Şekil 1A) 0,50-0,75 mm rostral, kafatası yüzeye dik, derin iğne 2 mm yerleştirin. Sonra avuç kullanarak piston itme sağ eli çok yavaş ve dikkatli bir şekilde. Rüptüre damarlar ya da yüzde şişme izleyin.
- Geri akışı önlemek için piston hareketi kesildikten sonra iğne 15 saniye kaldırın.
- Kurtarma hareketi ve genel tepki restore kadar ısıtılmış bir kapta 5-10 dakika süreyle fareler tutmak için.
2. Intravenöz enjeksiyon yoluyla temporal / facialis'ten
- Enjekte edilebilir bir çözüm hazırlanmış ve süzülmüş yeşil gıda boyası ile desteklenmiş 1:100 dilüsyon ve steril koşullar altında enjekte edilmelidir.
- 100 mcL cam Hamilton şırınga sonuna kadar döner küçük bir plastik takın. Döner, 33 gauge 0,25 inç derialtı iğne takın. Bütün parçaları sıkıca bağlı olduğundan emin sigortalayın.
- Sağlanması, hava, damar içine hava enjeksiyon şeklinde şırınga olduğunu şırınga enjekte edilecek hacim yükleyin ölümcül. Genellikle pipetlemeyin parafilm bir parça şöyle enjekte edilecek hacim yardımcı olur. Bu açık bir görünüm için şırıngaya çözüm alımını sağlar.
- Wee Sight transilluminator'de kolayca yenidoğanda temporal ven veya yüz damar, (Şekil 2A) görselleştirmek için kullanılır. Enjeksiyondan önce, cerrahi bant kullanarak transilluminator'de yenidoğan güvenli. Tül hayvan derisine zarar bandı önlemek için yenidoğan ve teyp arasında yer almalıdır. Bant solunum engellemez sağlanması, hayvan yan transilluminator'de sabitleyin. Yenidoğan boyun hafifçe facialis'ten kolayca görünür olduğunu açık olmalı ve burun baş stabilize etmek için bantlanmış olmalıdır.
- Kolay görünüm için izin 2.25X bir kafa bandı büyüteç kullanarak, yavaş yavaş damar içine iğne takın. Iğne deri altında görünür kalmalıdır, böylece damar çok yüzeysel.
- Çözelti hacmi, damar içine yavaşça demleyiniz. Yeşil boya enjeksiyon kolay görüntülenmesini sağlar.
- Iğne, şırınga ve son derece dar bir iğne deliği nedeniyle kalan çözüm sürülmesi tamamen Medyumu arasında bir gecikme var gibi çıkarmadan önce 15 saniye bekleyin.
- Iğneyi çıkardıktan sonra, enjeksiyon yerinde kanama geçene kadar baskı uygulamak için gazlı bez kullanın.
- Sıkıntı belirtileri yenidoğan izleyin. Uygun bir enjeksiyondan sonra, hiçbir belirgin sıkıntı dikkat edilmelidir. Yenidoğan kafesine döndü önce kurtarmak için yaklaşık 5 dakika verilmelidir.
- Iğne kan hızlı bir şekilde küçük bir delik nedeniyle bu yapışmasına neden olarak, PBS ile enjeksiyonlar arasında iğne / şırınga birimi yıkayın.
3. Temsilcisi sonuçları:
ICV enjeksiyon: beynin farklı zaman noktalarında enjeksiyon sonrası hasat edilen ve başarılı bir enjeksiyon tekniği göstermek için görüntülenebilmekte. Boya enjeksiyon çözüm değilse, o, doğruluğunu kontrol etmek için zor olacakEnjeksiyon. Ventriküller biri doğru enjeksiyon beyin enjekte edilen tarafta tripan mavi dağılımını sağlayacaktır yaklaşık 10-15 dakika sonrası enjeksiyon (Şekil 1B). Sağ ve sol serebral hemisferlerin ve koku ampuller tripan mavi tekdüze dağılım yaklaşık 60 dakika enjeksiyon (Şekil 1C) görülebilir. Bu mavi boya komşu ventrikül yayılmasına izin verecek serebral ventriküllerin bağlantısı nedeniyle. Doğru enjeksiyonları da yaklaşık 12 saat sonrası enjeksiyon (Şekil 1D) içinde rostral santral spinal kanal mavi boya dağılma tarafından görüntülenmiştir olabilir. Yanlış enjeksiyonları hemisferlerin eksikliği mavi renk ile ayırt edilebilir. Bu durumda, iğne derinliği yeterli değildi ve enjeksiyon çözüm muhtemelen deri altında dağıttı. Alternatif bir olasılık iğne böylece ventrikül ve çözüm serebral ventriküllerin altında boşaltılır ötesine geçen, beynin çok derin nüfuz ettiğini.
IV enjeksiyon: Doğru ve verimli temporal / facialis'ten enjeksiyon enjeksiyonu takiben hemen görüntülendi olabilir. Çözüm enjekte edilir, yeşil boya görselleştirme giren ve yüz ven (Şekil 2A) akan bir çözüm sağlar. Ayrıca, fare değişmiş ten rengi aşağıdaki enjeksiyon görülecektir. Yenidoğan normal pembe renk enjeksiyon çözüm yeşil gıda boyası (Şekil 2B) varlığı nedeniyle, yeşil dönüştürülür. Yenidoğan döneminde gözlenen yeşil renk değişimi ölçüde kullanılan boya konsantrasyonu bağlıdır. Enjeksiyon ve basit bir uygulama döneminde görselleştirme, 1:50 seyreltme tavsiye edilir. Bununla birlikte, dramatik bir şekilde değişmiş cilt tonu genellikle yavru annesi tarafından reddedilen ve bu nedenle deneysel işlemleri sırasında, boya veya önemli ölçüde azaltılmış bir konsantrasyon kaldırılması düşünülmelidir. Bir yanlış enjeksiyon, enjeksiyon yerinde deri altında yeşil boya birikimine neden olur. Iğne açılış tam damar içinde takılı değilken oluşur Eksik enjeksiyon, bazı çözüm damar akar ve bazı cilt altında birikir. Bu görülürse damar içine iğne daha takılı olmalıdır.
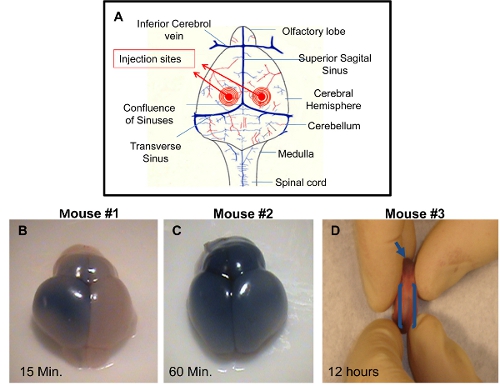
Şekil 1 PDN2 farelerde başarılı ICV enjeksiyonları gösterilmesi A) ventriküller içine ICV enjeksiyonları kullanılan enjeksiyon siteleri şematik B) PBS tripan mavisi ile sol ventrikül Pup enjekte ICV Beyin, fotoğraf 15 dakika enjeksiyon alınan C ICV gelen) Beyin PBS içinde tripan mavisi ile sol ventrikül Pup enjekte, alınan fotoğraf 60 dakika enjeksiyon. D) Rostral merkezi spinal kanal ICV gösterilir sol ventrikül PBS tripan mavisi ile yavru enjekte, 12 saat sonrası enjeksiyon alınan fotoğraf.

Şekil 2 PDN2 farelerde başarılı IV enjeksiyonlar gösterilmesi A) IV enjeksiyon için kullanılan facialis'ten şematik B) PBS içinde yeşil boya ile Pup enjekte IV un enjekte littermate göre, Foto hemen sonrası enjeksiyon alınır.
Tartışmalar
Araştırma hastalık fare modelleri kullanarak sık sık yenidoğanlarda ilaçlar ya da diğer maddelerin uygulanmasını gerektirir. Bu video gösteren adım adım MSS hedef için kullanılabilir iki tür enjeksiyon stratejileri içeren prosedürler: direkt enjeksiyon, intraserebroventriküler (ICV) enjeksiyonu kullanan MSS 1) veya temporal / hedef 2) IV enjeksiyon facialis'ten. Bu enjeksiyonların zamanlaması büyük önem taşıyor. ICV enjeksiyonları freehand olduğundan, kafatası nispeten uysal olmalıdır....
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar, bu projenin erken aşamalarında teknik yardım için uzman hayvancılık ve Dr. Marco A. Passini John Marston teşekkür etmek istiyorum. Bu çalışma, KLL için Ulusal Sağlık Enstitüleri (R01HD054413 R01NS41584) hibesi ile finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifin Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
|---|---|---|---|
| Yeşil Gıda Boyası | McCormick | n / a | Filtre edilmesi gerekir |
| Hamilton Cam Şırınga (100 mcL) | Sigma Aldrick | 20702 | |
| LuerMxF Konu Stil Beyaz Naylon | Küçük Parçalar, Inc. | VPLF-LC78-1-25 | |
| Güzel göstergesi Hipodermik İğneler | Çıtçıt | 7111 | Boyut: 33 (SWG) x ¼ "(6,35 MM) |
| Wee Sight transilluminator'de | Respironics | 1017920 | |
| 2.25X Headband Büyütücü | MagEyes | Model No: 5 | Bireysel tercihlerinize uygun büyütme |
Referanslar
- Blanchette, M., Fortin, D. Blood-brain barrier disruption in the treatment of brain tumors. Methods Mol. Biol. 686, 447-463 (2011).
- Foust, K. D., Kaspar, B. K. Over the barrier and through the blood: to CNS delivery we go. Cell Cycle. 24, 4017-4018 (2009).
- Snyder, E. Y., Taylor, R. M., Wolfe, J. H. Neural progenitor cell engraftment corrects lysosomal storage throughout the MPS VII mouse brain. Nature. 374, 367-370 (1995).
- Passini, M. A., Wolfe, J. H. Widespread gene delivery and structure-specific patterns of expression in the brain after intraventricular injections of neonatal mice with an adeno-associated virus vector. J. Virol. 24, 12382-12392 (2001).
- Kienstra, K. A., Freysdottir, D., Gonzales, N. M., Hirschi, K. K. Murine neonatal intravascular injections: modeling newborn disease. J. Am. Assoc. Lab. Anim. Sci. 46, 50-54 (2007).
- Sands, M. S., Barker, J. E. Percutaneous intravenous injection in neonatal mice. Lab. Anim. Sci. 49, 328-330 (1999).
- Foust, K. D. Rescue of the spinal muscular atrophy phenotype in a mouse model by early postnatal delivery of SMN. Nat. Biotechnol. 28, 271-274 (2010).
- Foust, K. D. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat. Biotechnol. 27, 59-65 (2009).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene delivery to the mouse brain with adeno-associated virus. Methods Mol. Biol. 246, 225-236 (2004).
- Coady, T. H., Lorson, C. L. Trans-splicing-mediated improvement in a severe mouse model of spinal muscular atrophy. J. Neurosci. 30, 126-130 (2010).
- Baughan, T. D., Dickson, A., Osman, E. Y., Lorson, C. L. Delivery of bifunctional RNAs that target an intronic repressor and increase SMN levels in an animal model of spinal muscular atrophy. Hum. Mol. Genet. 18, 1600-1611 (2009).
- Coady, T. H., Baughan, T. D., Shababi, M., Passini, M. A., Lorson, C. L. Development of a single vector system that enhances trans-splicing of SMN2 transcripts. PLoS One. 3, e3468-e3468 (2008).
- Dickson, A., Osman, E., Lorson, C. A. Negatively-Acting Bifunctional RNA Increases Survival Motor Neuron in vitro and in vivo. Hum. Gene. Ther. 19, 1307-1315 .
- Mattis, V. B., Ebert, A. D., Fosso, M. Y., Chang, C. W., Lorson, C. L. Delivery of a read-through inducing compound, TC007, lessens the severity of a spinal muscular atrophy animal model. Hum. Mol. Genet. 18, 3906-3913 (2009).
- Williams, J. H. Oligonucleotide-mediated survival of motor neuron protein expression in CNS improves phenotype in a mouse model of spinal muscular atrophy. J. Neurosci. 29, 7633-7638 (2009).
- Passini, M. A. CNS-targeted gene therapy improves survival and motor function in a mouse model of spinal muscular atrophy. J. Clin. Invest. 120, 1253-1264 (2010).
- Shababi, M., Glascock, J., Lorson, C. L. Combination of SMN Trans-Splicing and a Neurotrophic Factor Increases the Life Span and Body Mass in a Severe Model of Spinal Muscular Atrophy. Hum. Gene. Ther. 22, 1-10 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır