Method Article
一个实时,同步成像的TCR和其相关的信号转导蛋白的TIRF显微镜技术
摘要
条块分割,无论是在细胞膜或蛋白质进入细胞内的位置是一个监管机制,可以极大地影响信号的成果;因此,了解信号,重要的是要学习的时间和空间的行为,所涉及的蛋白质。我们描述1 TIRF显微镜为基础的系统研究在T细胞信号转导在这里的,而且是广泛适用的。
摘要
它是由从事势必由主要组织相容性复合体(住房抵押贷款公司)表面抗原提呈细胞(APC)蛋白表达的抗原肽片段时,信号是通过T细胞受体(TCR)发起。 T细胞受体复合物由配体结合TCRαβ异,联营公司的非共价键与CD3二聚体(εδ和εγ异和ζζ二聚体)1。受体接触后,为CD3ζ链磷酸化Src家族激酶,LCK。这将导致Syk的家族激酶,ZAP70,然后将其磷酸化和激活由LCK招聘。在此之后,ZAP70磷酸化接头蛋白LAT和SLP76,开始形成近端信令复杂,含有大量的不同的信号分子2。
在这个复杂的最终结果形成钙和依赖的Ras-TRAnscription因子激活和由此引发的一系列复杂的基因表达程序,引起T细胞分化2。 T细胞受体信号(和分化状态)是由许多其他因素,包括抗原与co-stimulatory/co-inhibitory的效力和串扰,趋化因子,细胞因子受体3-4调制。因此,学习的时间和空间的各种刺激条件下的近端信号复杂的组织,是了解TCR信号通路以及其他信号通路调控的关键。
一个非常有用的模型系统研究的TCR信号在T细胞的细胞膜发起玻璃支持的脂双层,以前5-6。他们可以利用抗原复合物的住房抵押贷款公司,附着力,共刺激分子,T为细胞人工装甲运兵车服务。由成像与T细胞相互作用利用全内反射荧光显微镜(TIRFM)脂双层,我们可以限制激励100纳米的玻璃和细胞表面的7-8之间的空间内。这使我们的图像,主要信令事件发生在细胞膜。正如我们在成像感兴趣的信号蛋白的TCR复杂的招聘,我们描述了两个摄像头TIRF成像系统,其中H57的抗体标记的TCR,荧光灯厂(片段抗原结合)的片段(纯化杂交瘤细胞的H57-597 ATCC,ATCC编号:HB-218),这是具体的TCRβ,信号蛋白与GFP标签,可同时成像和实时。这一战略是必要的,由于双方的T细胞和信号事件是发生在TCR高度的动态性。这种成像方式,使研究人员9-11图像的单配体激活受体信号分子以及招聘是一个很好的系统研究原位 12-16生物化学。
研究方案
实验步骤:
1。转用Amaxa小鼠T细胞Nucleofector套件
我们在这里描述转任天真或在体外激活原代T细胞表达质粒编码绿色荧光蛋白标记的信号分子,使用的Amaxa小鼠T细胞Nucleofector套件。在体外激活T细胞肽装脾装甲运兵车进行前7。在我们的研究中使用的所有T细胞表达和TCR识别冶肽MHC分子即 K(88-103)约束。染是开展基本上是根据制造商的建议,但是,我们提出了一些建议,促进T细胞转染后的生存能力。可行性和转染效率远远高于幼稚细胞在体外激活T细胞。
- 在开始之前,准备2毫升辅以T细胞的培养基中加入20μL两个中等组件和B,每个转100μL胎牛血清(5%)进行。平衡介质,在12孔板在培养箱37℃,5% 二氧化碳培养箱至少一个小时。另外,辅以5%的血清和组件一个可编制和存储冻结中等等分。如果是这样的情况下,解冻所需数量的等分,加入B组分,并进行平衡。
- 中期预平衡是非常重要的,因为细胞死亡会导致重新悬浮细胞转染后在培养基,要么是感冒或有其他pH值大于7.2。
- 下一步,准备转染混合物。结合18μL补编2和5μg质粒DNA(浓度不低于0.5微克/微升),82μL小鼠T细胞Nucleofector解决方案。调匀攻管或微量移液器使用。
-重要的是要执行每个结构,可用于转染的细胞固定数量的质粒剂量滴定。对于一些较大的结构,可能需要更多的DNA。 DNA应该是免费的内毒素。
- 5至10万个细胞转移至15 mL离心管。在600转离心5分钟,在室温下。取出真空抽吸尽可能多的上清。
- 制造商建议纺纱在小于90XĞ的细胞;在我们的例子中,这个速度相当于75XĞ。选定的相对离心力(RCF)获得一个细胞沉淀也许是最关键的变量,在低离心力离心排除细胞膜的损害。
- 重新暂停转染混合物轻轻的细胞沉淀,慢慢地pipeting细胞沉淀,直到有剩余的细胞没有大的团块。这通常可以通过完全吸细胞ţhrough的枪头不超过3-4倍。
- 使用吸管,小心地转移到认证Amaxa试管悬挂,确保有出席无气泡。例试管。
- 选择Nucleofector程序X-001 Nucleofector设备。插入的的Nucleofector试管架试管和应用选定的方案。
- 电穿孔的细胞后,最好是立即将它们传输到预平衡的培养基。制造商建议的细胞保持在不超过15分钟nucleofector介质。
- 带来,引擎盖试管和预平衡的,充分的补充培养基。使用提供的塑料吸管,加入约500μL培养基试管和板一滴一滴在传输介质的细胞悬液。
- 在37℃孵育4小时前成像细胞。幼稚细胞是incubat海关在30°C取代37°C。这有助于保持其对抗原的反应。
- 三四个小时的潜伏期一般为T细胞,足以detectably表达绿色荧光蛋白标记的蛋白质。我们选择在这个时间点图像细胞由于表达水平低,应尽量减少过度表达的产物。然而,如果需要一种特定的蛋白质过度表达,T细胞应该被删除4个小时后从Amaxa介质。这是通过在低离心力再次pelletting细胞重新悬浮在预平衡的T细胞培养介质密度在2万细胞/ mL与50的U / mL的白细胞介素2(IL-2)补充。
2。 TIRF显微镜
的TIRF显微镜的描述:
- 围绕奥林巴斯IX71荧光显微镜,最初是与奥林巴斯的TIRF模块配备常规配置:光学元件。一声低喝scovered色效果在此模块中的一个单一的调整状态时,并没有实现对不同波长的激光线重合的准直。这个模块,因此,不会允许使用不同的激发波长为同步的TIRF成像,我们开始着手构建一个自定义的TIRF仪器系统,最大限度地减少色差的影响,因为我们在下面的章节详细讨论。这里介绍的方法为150×放大倍率,1.45数值孔径(NA)TIRFM目标(奥林巴斯),但一样为60×放大倍率,1.45适用版本。宽视场照明,显微镜连接到金属卤化物λ-XL光源和一个装有激发滤光片激发滤光片轮(萨特仪器)。对于自动定位与尊重客观样品阶段,在显微镜配备了机动XY翻译,压电控制Z轴(ASI)的。拍摄的图像使用两个相同的曲antEM电子倍增(EM)的CCD相机(Photometrics)。这些相机的像素大小150×的TIRF目标提供倍率匹配很好,给了每个像素的0.1微米的最终解决。 EMCCD相机还提供了可视化表达水平低的绿色荧光蛋白转染的敏感性。
- 激光器:有关的TIRF照明系统共提供了6个激光线(405,440,488,514,561和640纳米)的5激光器耦合到单模光纤(Solamere技术)。氩激光和561 nm的二极管泵浦固态(DPSS)激光器(488线,514和561)路由通过声光可调谐光纤强度控制(AOTF的),而二极管激光器的强度(405,440和640 nm)的控制,通过调节其电源电压。 AOTF的二极管激光器电源上的电压控制,通过数据采集卡(DAC)的董事会(测量计算)使用MetaMorph软件(MolecuLAR设备)。二极管激光器的耦合效率为30%,而氩气和DPSS激光器由于其较小的光束直径约60%。
- 的TIRF模块:为了同时图像TCR和其相关的信号分子,如前面所述,这是必须要有的TIRF照明色纠正,并不会要求调整或重新定位时,获得不同波长的荧光排放。 TIRFM被使用过的目标照明,17日之前所述。提供激光显微镜的光缆固定到同一个XY纤维支架安装驱动的Z调整(Thorlabs)一微米的光轨之上装有光纤发射。要实现的TIRF照明,激光束聚焦在客观焦平面使用两个镜头系统(L1(准直 透镜)和L2(聚焦透镜)在图1),这样的bEAM出现平行的目标。这将确保所有目标的光射线会与样品平面有相同的角度。光纤的尖端定位于准直透镜的焦点。由光学准直透镜(Z方向)铁路沿千分尺,它是可以调整光束的焦点,在X和Y使用XY调整旋钮的位置和移动梁。由于非常小的回光圈的150×目标,我们发现,要实现的TIRF,小回焦平面在激光光斑大小。为了达到必要的重点,以生产小斑点,短焦距的镜头是必要的(凯尔·纽曼,个人通讯);因此,我们用了大约108毫米的焦距,被放置在分色立方体聚焦透镜直接前的目标。接近放置在TI带来的分光镜准直透镜射频照明。为了最大限度地减少不必要的色效果,我们用抗反射涂层消色差双峰(色校正镜头融合两个镜头的不同折射率的材料制成的元素)的准直和聚焦透镜(JML的光)。可以验证的重点检查,准直光束出现的目标时,在后面的光圈的中心定位,并应成为房间的天花板上紧点。聚焦点的位置,然后走向光圈(在Y轴方向),这使梁在大角度的图像平面上收敛的边缘,并最终实现内部全反射的临界角。使用这些光学元件,我们实现了从442到640 nm的所有波长在同一路线的同时准直。因此,一个单一的光学对准使我们能够同时执行多个波长的TIRFM。
- 双摄像头表观atus:从两个不同的荧光产生明显的荧光发射同时收购实现建立一个双相机系统分成两个波长范围内,通过分色镜的使用( 图2)的排放。发出的光反射出右侧端口显微镜的目标。由于大多数的目标是无限校正(在无穷形成的图像),管镜头聚焦影像。同时操纵两个发射波长,右侧端口管镜头被删除。含C-安装线程(萨特仪器)连接定制的适配器和连接到分色镜人(埃德蒙光学)。分色镜分开使用有机染料标记的TCR(Alexa546,Alexa647等),GFP的发射被安装在这个支架。其次是该模块在两个光路管透镜支架,排放过滤器支架和延长管。 “管镜片(TL1和TL2( 图2))有一个焦距为180毫米。免受杂散光的相机,用黑纸覆盖在延长管,导致EM CCD相机的差距。为了让两个通道对齐,摄像机被安装在两个自定义XYZ翻译看台(Holmarc产品)。
下面,我们描述了如何使两个通道同时成像显微镜。涉及的步骤调整的TIRF照明,激光功率的调整,以及调整使用分辨率子微球的两个输出图像。
- 开始之前,所有元件的显微镜。计算机和软件,然后开始,并确保所有的硬件组件由软件确认。
- 作为合作本地化标准的使用,到2毫升的PBS稀释1μL分(0.2微米)Fluoresbrite多荧光微球,并加入0.25毫升的微暂停以及每一个Lab-Tek的II 8腔的玻璃罩系统(NUNC)。将上述目标平台上的室幻灯片制度。被吸附到玻璃珠,然后带进焦点。
- 使用Y调整XYZ光纤发射激光束的位置转移到客观的回光圈的中心。做到这一点是很重要的目标是在玻璃平面位置,重点是。如果梁不平行,Z轴千分尺调整,以达到充分的准直。单独进行测试,在实验中使用的所有激光线准直。在这个阶段,每行的激光功率测量激光功率计和调整,以20-30μW,在每个通道。
-T细胞是极为敏感的激光辐射,照明有限共50μW。
- 珠图像采集使用的TIRF illuminat在现场模式的离子。使光束开始从天花板上移动,直到其尊重客观的光轴接近90度的角度打开光纤发射的Y对齐微米。最终,当达到临界角的TIR,激光灯将不再退出的目标。集中了通过玻璃罩平面和向下的TIRF对齐,然后判断。如果溶液中漂浮的珠可能是可视化,然后与尊重客观的正常需要的光束的角度将进一步增加。在正确的TIRF对齐,只有一个光架飞机将成为市场关注焦点(即,只有珠被吸附到盖玻片)。可以实现一个更好的TIRF对齐测试时成像的T细胞表面传播,表面上的染料染色。 (见3.4)。
- 已取得的TIRF照明后,两个通道可以对齐到另一个方面。专注于珠和比较,我的位置图像dentifiable功能产生两个通道。 X和Y微米螺丝使用一台摄像机的立场,把尽可能靠近珠的相对位置。从两个通道保存图像。这些图像将被用来作为一个合作的本地化标准对齐的两个通道。
- 该相机还需要对齐,使他们与另外一个方面齐焦。这是通过收购一组图像分在Z轴方向,从彼此分开的100纳米的决议珠。如果珠的最大强度像素在于在同一平面上的两个摄像机,那么他们是齐焦。
3。成像
一旦成立后,在显微镜下一个任务是准备流室,含玻璃支持呈现抗原和粘附分子的脂质双层如前所述6和T与相互作用转染细胞,然后执行TIRFM基板上。随后公布的双层协议5-6除外,脂质体流室组装后孵育20分钟的玻璃罩发表。相反,哈佛商学院-BSA的缓冲流在流动细胞后立即组装。
- 组装与平面脂质双层玻璃盖含镍NTA血脂的滑移形成的流动腔。粘附分子ICAM-1(100分子/ 2微米),和肽-MHC复合物,中冶装即 K(5-10分子/ 2微米),通过他们的组氨酸标签的双层纳入。共刺激分子CD80的添加使用GPI锚定(100分子/ 2微米)。
- 放在显微镜阶段的流动细胞和稳定。附加的制造商提供加热流动池的元素,以控制其温度。放置在一个双层的目标和集中带来的双层飞机。启用加热的目的和流细胞室的温度稳定在37°C。
- 转染的T细胞是颗粒速度80X g和4小时的潜伏期后重新悬浮在哈佛商学院-BSA的缓冲和补充10微克/毫升的H57厂或20微克/毫升的H57单链可变区片段(抗体)标记的TCR。在流动细胞的细胞,然后注入。成像的Fab抗体,由于他们的高解离常数的持续存在。他们在中期并不显着增加的TIRF领域是非常薄的背景。
- 成像条件的设立,使双通道实时采集,显示实时预览,有助于在转染细胞的TCR和GFP渠道。重点玻璃平面,任何侧膜染色检测证实的TIRF照明。如果侧膜不重点的TIRF对齐然后是好的。转染细胞,然后一次成像或图像序列中产生VIDEOS。
4。图像处理和数据分析
软件在一个单一的框架从两个摄像头的图像输出。每个摄像头的输出是512 x 512像素,因此,输出图像为1024×512像素大小。首先需要分割成单个帧对应的两个摄像头的图像。决议子珠从两个通道的图像叠加和校准参数的确定。具体到我们的系统的一个功能是其他方面的一个通道1度旋转( 见图3)。这个旋转的最可能的来源是相机的立场。进一步相对X和Y的线性变换,这种旋转后需要进行相互尊重,完全配合珠。珠的图片,在每一个实验,以确定精确的参数调整两个通道。这些线性和旋转变换,然后应用到所有的图像和分割算法和共定位分析,他们是受。
5。代表结果
这里描述的系统,可适应任何受体信号的下游,在细胞膜研究。这是特别是在信息研究TCR信号,因为信号在光学解决集群的TCR microclusters或发生在内涵体作为最近描述了18。如果信令子受体的决议集群或在联合国聚集受体发生更多的实验来解释数据,就必须做。如前面提到的TCR复杂的CD3链进行Src家族激酶的磷酸化,LCK后的TCR肽-MHC复合物的参与。磷酸化CD3ζ链,然后招募阻滞家庭激酶ZAP70。可视化杂招聘P70报告CD3ζ链的磷酸化状态。 TCR刺激的强度可以改变使用的TCR接触残留突变肽。这些肽被称为改变肽配体(杀伤人员地雷)。一个有代表性的实验激动剂肽有力招募ZAP70到受体microclusters而效价降低肽T102L未能以招募ZAP70到受体microclusters,表明CD3ζ链不磷酸化,在这种情况下,在图4所示。我们可以得出这样的结论,因为我们只是观察ZAP70招聘TIRFM很容易被检测到的TCR集群。一个自动分割算法被用来计算ZAP70个microclusters细胞的数目。同时TCR和ZAP70相关荧光成像也显示,在补充电影。注意动态lamelipodium性质。
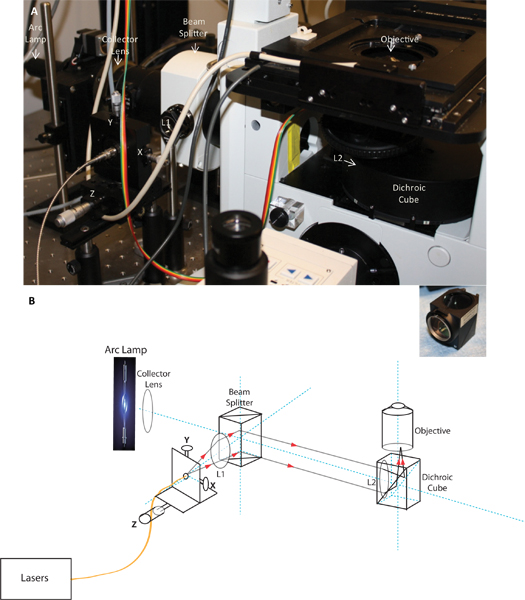
图1。图像和定制的TIRF推出的示意图。小组A显示了安装在显微镜上的TIRF推出的照片,B组的TIRF发射演示光路示意图。原理图和图像显示收集透镜,分光镜,光纤推出分色立方体的TIRF目标在安装X,Y和Z的调整,准直透镜L1和聚焦透镜L2的位置。插图显示了聚焦透镜安装在分色立方体。
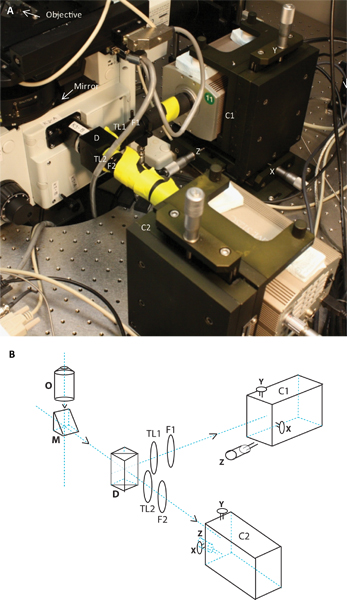
图2。图像和两个摄像系统原理图。 A组的两个摄像系统连接到显微镜的照片,B组是相同的原理。原理图和图像显示的目标位置,镜,分色,管镜片TL1和TL2,排放过滤器F1和F2,C1和C2两个摄像头对T继承人代表与各自的X,Y和Z的调整。
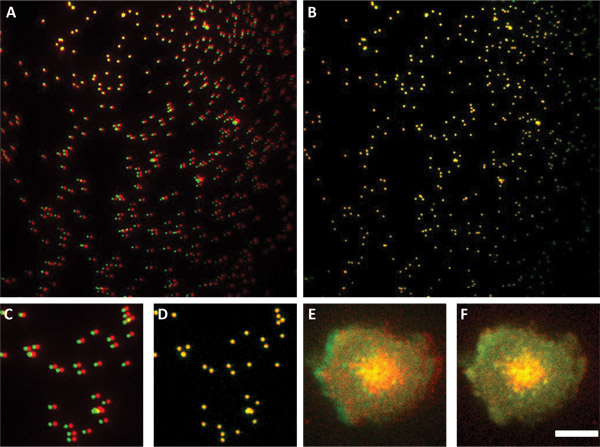
图3。使用分决议珠,对齐两个通道。面板和分决议珠的B显示覆盖前(A组),后(B组)对齐。 A组的渠道之一是与其他旋转。板C和D是一个图像的子节在A和B.面板E显示了两个通道的叠加图像,未经处理的细胞。面板D使用的对齐参数被应用到从两个渠道lamelipodium完美面板中的F和不对齐面板E.比例尺4微米所有的面板如何在面板号公告中显示的图像。
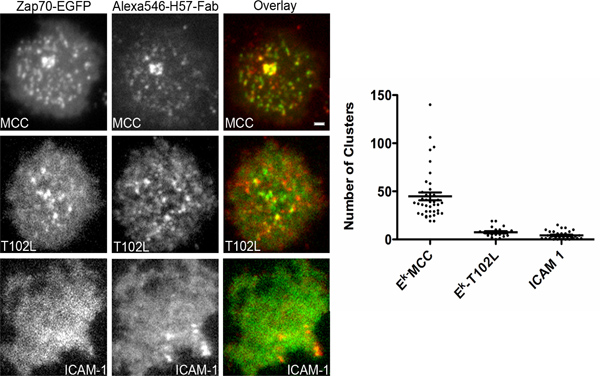
图4。ZAP70招聘在响应不同的杀伤人员地雷到受体microclusters。 在体外激活和T细胞转染质粒编码绿色荧光蛋白融合ZAP70和玻璃支持双层镍NTA包含6个分子/ 2微米肽孵育装载了他的标签, 即 K,100分子/微米的Alexa647结合他的标签2细胞ICAM- 1和100分子/ 2微米的GPI锚定CD80的。加载肽插图表示。 ICAM-1的是细胞双层包含100个分子/μm的网站-647结合他的标记细胞ICAM-1 2。双通道同步采集TIRF显微镜进行持续存在的Alexa546结合H57的Fab片段(非阻塞)染色的TCR。细胞成像一小时后,初次接触的双层。 ZAP70细胞簇的数字进行了分析,使用一个自动化的集群计算软件。每个案例进行了分析,至少有40个细胞。比例尺为2微米的所有图像。
92/3892fig5.jpg“/>
图5。两个相机系统,使用两个不同类型的相机对准。此面板显示了使用两个摄像系统,两个摄像头的地方有不同的像素大小(绿色:6.45微米像素尺寸2x2的分级和红成像:在没有分级成像16微米的像素尺寸)“分决议珠的排列叠加成像。插图显示了在该领域的中心方框的放大视图。比例尺5微米。
补充电影。ZAP70招聘受体激动剂肽microclusters。在体外激活和T细胞转染质粒编码绿色荧光蛋白融合ZAP70和玻璃支持双层镍NTA包含6个分子/ 2微米肽孵育加载他的标签, 即 K,100个分子/微米的Alexa647 2结合他的标签ICAM-1和100分子GPI锚定CD80分子/微米2。双通道同步A在持续存在Alexa546结合H57的Fab片段(非阻塞)染色的TCR cquisition TIRF显微镜。曾多次用了10秒每帧的时间分辨率成像领域的转染细胞的40倍。比例尺2微米。 点击这里查看补充电影 。
讨论
我们在这里描述TIRFM和玻璃支持的脂质双层人工装甲运兵车使用的抗原特异性的主要小鼠T细胞信号系统的研究。该技术依赖于成功地在这些细胞中表达绿色荧光蛋白标记蛋白。转染T细胞始终是一个具有挑战性的任务。通常情况下,电或使用逆转录病毒或慢病毒基因传递。一种方法是不是比其他优越,同时也有其局限性和优势。我们发现,电,具有以下优点:1)它是不需要的细胞积极除以逆转录病毒,但不慢病毒,和2)的表达水平,可以通过不同的细胞成像前孵育时间控制。最大的缺点是,我们很难表达的蛋白质,是在原代细胞的大小大。我们已经提出了一个方法,给我们电非常良好的细胞活力。因此,它是applicab勒到用它来实现的siRNA介导的基因沉默。
我们还描述了在这里定制的两个通道同步采集的TIRF显微镜色纠正,不需要单独调整不同波长。这些功能;然而,市场上可以买到。我们的系统是基于TIRF显微镜发表在该领域的专家和较便宜的商业选择的原则。我们设计的一个可能的批评是,我们正在使用的发病率相同的角度,不同的激发波长。这将导致在不同的TIRF穿透深度不同的激发波长。我们认为,这些影响很小,因为渐逝波是一个指数衰减的领域和深度的TIRF领域是波长的线性函数。靠近玻璃表面的荧光会遇到两种波长的激光强度之间没有差异。对于附近的PE荧光netration深度,强度差,将是两个两个波长488和561 nm的波长488和640 nm和1.15倍1.3倍。在同一系统可用于超分辨率技术的结合,使使用的TIRF照明。
我们还介绍了两个摄像系统是定制的。 TIRF系统一样,类似的器具,也市售。我们的系统提供了灵活性,允许其使用不同波长的组合,以改变过滤器和dichroics。我们的系统的缺点是需要调整两个图像的旋转度。解决这个问题可以通过使用摄像头是压电驱动,并提供旋转,对齐度看台。我们还成功地实施这种显微镜上两个摄像系统,在该相机是不同的,有不同的像素大小。像这样的系统将是有益的,如果需要在一个通道的灵敏度和一个大型的DY在另一个NAMIC范围内,这两者是相同的相机很少提供。我们使用2x2的分级Photometrics HQ-2摄像头,给我们的有效像素,12.9微米的Photometrics QUANT-EM的摄像头,其中有一个16微米的像素尺寸大小。一个180毫米焦距镜头用于管QUANT-EM的HQ-2摄像头和145毫米焦距管镜头使用。 HQ-2使用MetaMorph软件和QUANT-EM的控制是通过微观管理软件在单独的计算机外部触发模式控制。外部触发提供了QUANT-EM的相机使用数字输出的测量计算DAC板,这是作为一个额外的的Metamorph配置照明设置快门实施。管镜头的焦距比有效像素大小的比例匹配。一个有代表性的对齐, 如图5所示。
披露声明
在无特定病原体的环境,并保持在这些实验中使用的所有动物的实验,由国家研究院健康的动物护理和使用委员会批准。
致谢
这项研究是支持的国立过敏和传染病,国立卫生研究院院内研究司。我们非常感谢为我们提供的H57在这些研究中使用的抗体约翰内斯Huppa和马克·戴维斯。房车想感谢凯尔·纽曼在这项技术的发展有益的讨论。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| 小鼠T细胞amaxa Nucleofector套件 | 龙沙公司 | VPA-1006 | |
| PureLink HiPure质粒Midiprep套件 | 生命科技 | K2100-05 | 内毒素的DNA PREPS |
| amaxa Nucleofector设备 | 龙沙公司 | 反倾销协定,1001 | |
| 重组小鼠IL-2 | PeproTech公司公司 | 212-12 | |
| fluoresbrite Multifluorescent微0.20μm | polysciences,公司 | 24050-5 | |
| 实验室TEK二8腔玻璃罩 | Thermo Scientific的,NUNC | 155409 |
参考文献
- Call, M. E., Wucherpfennig, K. W. The T cell receptor: critical role of the membrane environment in receptor assembly and function. Annu. Rev. Immunol. 23, 101-125 (2005).
- Smith-Garvin, J. E., Koretzky, G. A., Jordan, M. S.T cell activation. Annu. Rev. Immunol. 27, 591-619 (2009).
- Bezbradica, J. S., Medzhitov, R. Integration of cytokine and heterologous receptor signaling pathways. Nat. Immunol. 10, 333-339 (2009).
- Fraser, I. D., Germain, R. N. Navigating the network: signaling cross-talk in hematopoietic cells. Nat. Immunol. 10, 327-331 (2009).
- Dustin, M. L., Starr, T., Varma, R., Thomas, V. K. Supported planar bilayers for study of the immunological synapse. Curr. Protoc. Immunol. Chapter 18, 13-13 (2007).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. (19), e947-e947 (2008).
- Varma, R., Campi, G., Yokosuka, T., Saito, T., Dustin, M. L. T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster. Immunity. 25, 117-127 (2006).
- Yokosuka, T. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat. Immunol. 6, 1253-1262 (2005).
- Huppa, J. B. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463, 963-967 (2010).
- Tolar, P., Pierce, S. K. A conformation-induced oligomerization model for B cell receptor microclustering and signaling. Curr. Top. Microbiol. Immunol. 340, 155-169 (2010).
- Treanor, B. The membrane skeleton controls diffusion dynamics and signaling through the B cell receptor. Immunity. 32, 187-199 (2010).
- Treanor, B., Batista, F. D. Mechanistic insight into lymphocyte activation through quantitative imaging and theoretical modelling. Curr. Opin. Immunol. 19, 476-483 (2007).
- Sylvain, N. R., Nguyen, K., Bunnell, S. C. Vav1-mediated scaffolding interactions stabilize SLP-76 microclusters and contribute to antigen-dependent T cell responses. Sci. Signal. 4, ra14-ra14 (2011).
- Purbhoo, M. A. Dynamics of subsynaptic vesicles and surface microclusters at the immunological synapse. Sci. Signal. 3, ra36-ra36 (2010).
- Lasserre, R. Ezrin tunes T-cell activation by controlling Dlg1 and microtubule positioning at the immunological synapse. EMBO. J. 29, 2301-2314 (2010).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat. Rev. Immunol. 11, 21-33 (2011).
- Axelrod, D. Chapter 7: Total internal reflection fluorescence microscopy. Methods Cell. Biol. 89, 169-221 (2008).
- Williamson, D. J. Pre-existing clusters of the adaptor Lat do not participate in early T cell signaling events. Nat. Immunol. 12, 655-662 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。