Method Article
실시간, TCR의 동시 이미징 및 관련 신호 전달 단백질에 대한 TIRF 현미경 기법
요약
따라서, 그것이 관여 단백질의 공간적 및 시간적 행위를 파악하는 것이 중요 신호 전달 이해하기 위해, 플라즈마 막 내에서 또는 세포 내 위치에 두 단백질의 compartmentalization 크게 신호 결과에 영향을 미칠 수있는 규제 메커니즘입니다. 우리는 여기서 T 세포의 신호 전달을 연구하는 TIRF 현미경 기반 시스템을 설명하지만, 광범위하게 적용됩니다.
초록
그것이 주요 Histocompatibility 컴플렉스 (pMHC) 항원 제시 세포 (APCs)의 표면에 표현 단백질에 의해 구속 antigenic의 펩타이드 조각으로 종사하는 경우 신호는 T 세포 수용체 (TCR)를 통해 시작됩니다. TCR 복합은 리간드 바인딩 TCRαβ의 heterodimer로 구성되어 있으며 그 동료 인 경우에는 3 번 CD dimers (εδ 및 εγ heterodimers 및 ζζ homodimer) 1 비 covalently. 수용체의 교전시 인 경우에는 3 번 CD의 ζ 체인은 Lck, SRC 가족 키나제에 의해 phosphorylated된다. 이것은 그때 Lck 의해 phosphorylated 및 활성화 Syk 가족 키나제, Zap70의 채용으로 연결됩니다. 그 후, Zap70 다른 신호 분자 2의 다수를 포함하는 근위 신호 단지의 형성을 시작, 어댑터 단백질 LAT와 SLP76을 phosphorylates.
칼슘과 RAS 종속 tra이 복잡한 결국 결과의 형성nscription 요소 활성화 및 T 세포 분화 2 야기할 유전자 발현 프로그램의 복잡한 일련의 논리상 필연의 개시. TCR 신호 (및 분화의 결과 상태)는 항원 힘 및 누화 co-stimulatory/co-inhibitory와 케모카인 및 3-4 시토킨 수용체를 포함한 기타 여러 요인에 의해 변조된 있습니다. 다양한 자극 조건에서 근위 신호 복합 공간과 시간적 조직을 공부한다는 것은 따라서, TCR 신호 경로뿐만 아니라 다른 신호 전달 경로에 의해 그 규정을 이해하는 열쇠입니다.
T 세포의 플라즈마 막에서 TCR에 의해 시작 신호를 공부하는 한 매우 유용한 모델 시스템은 이전에 설명한 5-6 유리 지원 지질 bilayers입니다. 그들은 인공 APCs으로 T 세포 자찬에 antigenic의 pMHC 단지, 접착 및 공동 stimulatory 분자를 제시 활용할 수 있습니다. 영상으로 T 세포와 상호 작용총 내부 반사 형광 현미경 (TIRFM)를 사용하여 지질 이중층, 우리는 7-8 유리와 세포 표면 사이의 공간을 100 nm의 범위까지 여기를 제한할 수 있습니다. 이것은 우리가 이미지에 주로 신호 이벤트 플라즈마 막에서 발생하실 수 있습니다. 우리 이미징에서 TCR은 복합 단백질 신호의 채용에 관심이있다, 우리는 두 카메라 TIRF 이미징 시스템을 설명하는 어떤 점에서 H57 항체의 형광 팹으로 표시 TCR은 (단편 항원 결합) 조각 (하이 브리 도마 H57-597에서 정화 , ATCC, ATCC 번호 : GFP 태그가 TCRβ에 대한 구체적인 HB-218), 그리고 신호 전달 단백질은, 동시에 실시간으로 몇 군데있을 수 있습니다. 이 전략은 T 세포 모두와 TCR에서 발생하는 신호 이벤트의 높은 동적 특성으로 인해 필요합니다. 이 영상 양상 이미지 단일 리간드 9-11뿐만 아니라 활성화된 수용체에 분자를 신호 모집과 연구자를 허용하고있다12-16 원위치에서 생화학을 공부하는 훌륭한 시스템입니다.
프로토콜
실험 절차 :
1. Amaxa 마우스 T 세포 Nucleofector 키트를 사용하여 Transfection
우리는 여기서 Amaxa 마우스 T 세포 Nucleofector 키트를 사용하여 GFP하여 태그가 지정된 신호 전달 분자를 인코딩 표현 plasmids와 순진 또는-체외 활성화 기본 T 세포 중의 transfection에 대해 설명합니다. 펩타이드 - 로드된 지라 APCs를 사용하여 T 세포의 인 체외 정품 인증과 같은 일곱 전에 설명 수행됩니다. 우리의 연구에 사용된 모든 T 세포는 MHC 분자 IE K에 바인딩 펩타이드 고객 센터 (88-103)를 인식 및 TCR을 표현. Transfection은 제조 업체의 권고에 따라 본질적으로 실시되지만, 우리는 transfection 후 T 세포의 생존을 촉진 몇 가지 팁을 제시. 생존과 transfection 효율을 모두 순진 세포에 비해 인 - 체외 활성화된 T 세포에서 훨씬 높다.
- 시작하기 전에, 20 μL를 추가하여 보충 T 세포 매체 2 ML 준비각 transfection을위한 두 매체 구성 요소 A와 B 및 태아 소 혈청 100 μL (5 %)을 수행할 수 있습니다. humidified 37에서 12 잘 판에 매체를 평형 ° C에서 5 % 이상의 시간 동안 CO 2 배양기. 또는 매체의 aliquots 5 %의 혈청 및 구성 요소들이 준비하고 냉동 보관되어있을 수도 보충. 이 경우, aliquots의 필요한 번호를 녹여 부품 B를 추가하고 평균을 수행합니다.
- 세포 죽음이 어느 추운이거나 7.2 이외의 산도를 가지고 중간에 transfection 후 세포의 재 정학 인해하므로 매체의 사전 평균은 매우 중요합니다.
- 다음으로 transfection 혼합물을 준비합니다. 플라스미드 DNA의 18 보충 2 μL 및 5μg (농도없이 낮은 0.5 이상 μg / μl)로 마우스 T 세포 Nucleofector 솔루션의 82 μL을 결합. 튜브를 도청하거나 마이크로 피펫의 사용과 완전히 섞는다.
-그것은 transfection에 사용할 수 있도록 각 구문에 대한 세포의 고정 번호 플라스미드 투여량의 적정을 수행하는 것이 중요합니다. 어떤 큰 구조의 경우 더 많은 DNA가 필요할 수 있습니다. DNA는 endotoxins 무료 여야합니다.
- 15 ML의 원심 관에 5-10000000 세포를 전송합니다. 상온에서 5 분간 600 rpm으로 원심 분리기. 진공 흡인기 가능한 뜨는의만큼을 제거합니다.
- 제조 업체 미만 90x g에서 세포를 회전하는 것이 좋습니다, 우리 같은 경우에는,이 속도는 75x g에 해당합니다. 선택한 상대 원심력 (RCF)은 세포막의 손상 걸로 낮은 RCF에서 원심 분리로 펠렛은, 아마도 가장 중요한 변수이다 세포를 구하십시오.
- 부드럽게하여 transfection 혼합물로 세포 펠렛를 다시 중지하고 남은 세포의 더 큰 대단히 짧은 시간이 없을 때까지 천천히 세포 펠렛을 pipeting. 이것은 보통 완전히 세포에게 T를 aspirating하여 수행할 수 있습니다hrough 피펫 팁 3-4 회 이상 안돼.
- 피펫 사용하여, 현재에는 거품이 없다는 것을 보장, 인증 Amaxa cuvette으로 정학을주의 깊게을 전송. cuvette를 쏠.
- Nucleofector 장치 Nucleofector 프로그램 X-001을 선택합니다. Nucleofector Cuvette 홀더로 cuvette을 넣고 선택된 프로그램을 적용할 수 있습니다.
- 세포를 electroporating 후 즉시 사전 equilibrated 문화 매체로 전송하는 것이 가장 좋습니다. 제조 업체들은 셀이 15 분 이상 더 이상의 nucleofector 매체에 보관하는 것이 좋습니다.
- 후드에 cuvette와 사전 equilibrated, 완벽한 보충 배지 와요. 제공된 플라스틱 피펫 사용 cuvette에 매체의 약 500 μL를 추가하고 드롭에 의한 판 드롭에 매체에 세포 현탁액을 전송.
- 이미징 전에 4 시간 동안 37 ° C에서 세포를 품어. 나이브 세포 incubat 있습니다에드 30시 ° C ~ 대신 37 ° C. 이것은 항원에 대한 그들의 반응을 유지하는 데 도움이됩니다.
- 부화 세 시간 내지 네 시간이 detectably GFP 태그가 단백질을 표현하는 T 세포에 대한 일반적으로 충분합니다. 표현의 수준이 낮은 이상 - 표현의 유물을 최소화해야하기 때문에 우리는이 시점에서 이미지 세포에 선택했습니다. 특정 단백질의 과잉 표현을 원하는 경우 단, T 세포는 4 시간 이후 Amaxa 매체에서 제거되어야합니다. 이것은 다시 낮은 RCF에서 세포를 pelletting하고 2,000,000 세포 / ML의 밀도에서 인터루킨 2의 50 U / ML (IL-2)와 보충 예비 equilibrated T의 세포 배양 매체에서 resuspending에 의해 수행됩니다.
2. TIRF 현미경
TIRF 현미경에 대한 설명
- 일반 구성 : 광학 부품은 원래 올림푸스 TIRF 모듈이 장착된되었다 올림푸스 IX71 형광 현미경을 중심으로했다. 우리는 곧 디scovered 색채 효과는이 모듈에 하나의 정렬 상태는 서로 다른 파장의 레이저 라인에 일치하는 콜리 메이션을 달성 않았을 때. 이 모듈은 그러므로 다른 여기 파장을 사용하여 동시 TIRF 이미징을 허용하지 않았 겠죠, 그리고 우리는 다음 절에서 자세히 논의로서, 시스템에 색채 효과를 최소화 정의 TIRF 장치를 구성하기 위해 밖으로 설정합니다. 여기서 설명한 방법은 150 X 확대를 위해 개발되었습니다, 1.45 수치 조리개 (NA) TIRFM 목표 (올림푸스) 그러나이 60 X 배율, 1.45 NA 버전을 위해 단지뿐만 아니라 작동합니다. 넓은 필드 조명의 경우 현미경은 금속 할로겐화물 람다-XL 광원과 여기 필터를 들으며 여기 필터 휠 (셔터 인 스트 루먼트)에 연결됩니다. 목표와 관련 샘플 단계의 자동 위치 결정은 현미경 동력 XY 번역, 압전 제어 Z 스테이지 (ASI)를 갖추고 있습니다. 이미지는 두 동일한 숨어를 사용하여 캡처되어antEM 전자 곱한 (EM) CCD 카메라 (Photometrics). 이 카메라의 픽셀 크기는 픽셀 당 0.1 μm의의 최종 결의안을주는 150 X TIRF 목표에서 제공하는 배율과 매우 잘 일치합니다. EMCCD 카메라는 또한 낮은 표현 수준을 가진 GFP의 transfectants을 시각화하기위한 감도를 제공합니다.
- 레이저 : TIRF 조명, 6 레이저 라인 (405, 440, 488, 514, 561 및 640 nm의)의 합계를 제공하는 5 레이저의 시스템은 단일 모드 광섬유 (Solamere 기술)에 결합됩니다. 아르곤 레이저와 561 nm의 다이오드 레이저 (라인 488, 514 및 561)가 강도 제어를위한 음향 광학 조정할 광섬유 (AOTF)를 통해 라우트됩니다 고체 (DPSS)를 펌핑하는 동안 다이오드 레이저의 강도 (405, 440 및 640 NM)은 자신의 전원 공급 장치의 modulating 전압에 의해 제어됩니다. AOTF와 다이오드 레이저의 전원 공급 장치의 전압은 데이터 수집 카드 (DAC) MetaMorph 소프트웨어 (Molecu를 사용하는 보드 (측정 컴퓨팅)를 통해 제어됩니다고맙다 장치). 아르곤 및 DPSS 레이저의 사람들이 작은 빔 지름으로 인해 약 60 %의 동안 다이오드 레이저의 결합 효율은 30 %입니다.
- TIRF 모듈 위해서는 동시에 이미지 TCR과 같이 앞에서 설명한 관련 신호 전달 분자가, 그것 chromatically 수정되었고 다른 파장의 형광 방출을 취득했을 때 발령이나주의를 환기 시켰을 뿐일세가 필요없는거야, 그렇지 TIRF 조명을하는 것이 중요했습니다. TIRFM가 아니라 17 전에 설명을 통해 - 더 - 객관적인 조명을 사용하여 달성되었다. 현미경에 레이저 빛을 제공하는 광섬유 케이블은 Z 조정 (Thorlabs)에 대한 마이크로 미터 기반의 광학 레일 위에 장착된 XY 섬유 보유자를 들으며 섬유 발사로 확보했다. TIRF 조명을 달성하기 위해, 레이저 광선은 두 렌즈 시스템 (L1 (collimating 렌즈)와 그림 1의 L2 (초점 렌즈))를 사용하여 목표의 뒤쪽 초점 평면에 중점을두고 있습니다 그래서 Beam는 객관적 밖 collimated 나온다. 이것은 목적에서 나오는 빛의 모든 광선이 샘플 비행기와 관련하여 동일한 각도를 가질 것이라고 보장합니다. 광섬유의 끝은 collimating 렌즈의 초점에 위치하고 있습니다. collimating 렌즈 (Z 방향)와 관련 광학 레일을 따라 마이크로 미터를 이동하면 그것은 광선의 초점을 조정하고 XY 조정 단자를 사용하여 X와 Y 위치에 빔을 이동이 가능합니다. 을 긋는 150 X 목표의 아주 작은 백 개구로, 우리는 TIRF, 작은 있어야만 다시 초점 평면에서 레이저 스폿의 크기를 달성하는 것으로 나타났습니다. 작은 자리를 생산하는 데 필요한 포커스를 달성하기 위해, 짧은 초점 거리의 렌즈 (Keir 노이만, 개인 통신) 어쩔 수 없었; 따라서, 우리는 직접 앞의 이색성 큐브에 배치되었다 약 108mm의 초점 거리와 초점 렌즈를 사용 객관적. collimating 렌즈는 가까이 TI에서 가져온 빔 스플리터에 배치되었다RF 조명. 원치 않는 색채 효과를 최소화하기 위해, 우리는 collimating와 렌즈 (JML 광)을 중심으로 모두에 반사 코팅과 함께 (다른 굴절 인덱스의 소재로 만든 융합이 렌즈 요소에 의해 만들어진 chromatically 수정 렌즈) 수색 성의 doublets를 사용했습니다. 초점은 광선이 다시 조리개의 중앙에 위치했을 때 객관적 밖 collimated 나온다과 방 천정에 단단히 자리를 형성해야한다는 선택하여 확인하실 수 있습니다. 집중 지점의 위치는 다음 빔 큰 각도에서 이미지를 평면을 추적하게됩니다 조리개 (Y 방향)의 가장자리쪽으로 이동하고 있으며, 결국 총 내부 반사에 대한 비판적 시각이 이루어진다. 이러한 광학 구성 요소를 사용하여, 우리는 같은 배열에서 442-640 nm의 모든 파장에 대해 동시 콜리 메이션을 달성했습니다. 하나 광학 정렬 그러므로 우리는 여러 파장에 걸쳐 동시에 TIRFM을 수행할 수있었습니다.
- 듀얼 카메라 apparatus : 두 개의 다른 fluorophores에서 발생하는 서로 다른 형광 방출의 동시 획득이 이색성 거울의 사용 (그림 2)를 통해 두 파장 범위에 방출을 분리 듀얼 카메라 시스템을 구축함으로써 달성되었다. 방출되는 빛이 현미경의 오른쪽 포트의 아웃 객관적으로 반영됩니다. 대부분의 목표는 무한대가 튜브 렌즈 이미지를 집중해야합니다 (무한에서 형성된 이미지) 수정.있는 바와 같이 동시에이 방출 파장을 조작하려면, 오른쪽 포트에 튜브 렌즈가 제거되었습니다. C-마운트 스레드 (셔터 인 스트 루먼트)가 포함된 사용자 정의 어댑터가 첨부와 이색성 거울 홀더 (에드먼드 광학)에 연결되었습니다. TCR을 (Alexa546, Alexa647 등) 레이블을 지정하는 데 사용되는 유기 염료의에서 GFP 방출을 구분 이색성 거울이 홀더에 설치되었다. 이 모듈은 튜브 렌즈 홀더, 배기 필터 홀더 및 확장 튜브에 의해 빛의 경로 모두에 따라되었습니다.튜브 렌즈 (TL1과 TL2 (그림 2)) 180 mm의 초점 길이 있습니다. EM CCD 카메라로 이어지는 확장 튜브의 격차는 길 잃은 빛으로부터 카메라를 보호하기 위해 검은 종이로 덮여 있었다. 두 채널의 정렬을 허용하기 위해 카메라는 두 사용자 정의 XYZ 번역 스탠드 (Holmarc 제품)에 탑재되었다.
다음은 두 채널 동시 이미징을위한 현미경을 정렬하는 방법을 설명합니다. 참여 단계, TIRF 조명을 정렬 레이저 전원을 조정하고, 하위 해상도 microbeads를 사용하여 두 개의 출력 이미지를 정렬합니다.
- 시작하기 전에 현미경의 모든 구성 요소에 공급하고 있습니다. 컴퓨터 및 소프트웨어는 다음 시작되고 그것은 모든 하드웨어 구성 요소를 소프트웨어에 의해 인식되도록 보장한다.
- 공동 현지화 표준으로 사용하는 경우, PBS 2 ML로 하위 해상도 (0.2 μm의) Fluoresbrite 멀티 형광 Microspheres 1 μL를 희석하고 microsphere의 0.25 ML 추가실험실 - 테크 II 8-잘 chambered coverglass 시스템 (Nunc) 각각 잘으로 정지. 객관적 위의 플랫폼에 챔버 슬라이드 시스템을 배치합니다. 유리에 adsorbed되는 비즈 그런 다음 포커스로 이동됩니다.
- XYZ 섬유 출시 Y 정렬을 사용하여 레이저 빔의 위치를 객관적 뒷면 조리개의 중심으로 이동됩니다. 목적 유리 비행기에 초점에 위치에있을 때 그것은이 작업을 수행하는 것이 중요합니다. 빔이 collimated되지 않은 경우 Z 마이크로 미터는 전체 콜리 메이션을 달성하도록 조정됩니다. 콜리 메이션이 실험에서 사용되는 모든 레이저 라인을 위해 개별적으로 테스트됩니다. 이 단계에서는 각 라인을위한 레이저의 파워는 레이저 파워 미터를 사용하여 측정되며 각 채널의 20-30 μW으로 조정됩니다.
-T 세포가 레이저 방사에 극도로 민감하고, 조명은 50 μW의 합계로 제한됩니다.
- 구슬의 이미지 TIRF illuminat를 사용하여 인수하고라이브 모드에서 이온. 그래서 광선이 목표의 광학 축 접근 방법 90도에 관하여 그 각도까지 천정으로부터 멀어 시작되는 섬유 개시에 와이 정렬 마이크로 미터를 켜십시오. 결국 사격을위한 중요한 각도에 도달하면 레이저 불빛은 더 이상 목표를 종료하지 않습니다. TIRF 정렬 그런 다음 coverglass의 비행기 통해 아래까지 초점을 맞춤으로써 판단된다. 용액에 부유하는 구슬은 시각이 될 수있다면, 객관적 정상적인 요구와 관련하여 광선의 각도가 더욱 증가해야합니다. 올바른 TIRF 정렬에서 단 하나 광학 비행기는 (즉, coverslip에 adsorbed 경우에만 비즈) 초점이 될 것입니다. 이미징 T 세포 표면에 확산 표면의 염료를 물들일 때 TIRF 정렬의 미세한 시험 구현할 수 있습니다. (포인트 3.4를 참조).
- TIRF 조명이 달성되면, 두 개의 채널이 서로에 대하여 정렬됩니다. 비즈에 집중하며 전의 위치를 비교이미지 dentifiable 특징은 양쪽 채널에서 생산. 한 카메라 스탠드에 X와 Y 마이크로 미터 나사를 사용하여 가능한 한 근접 등으로 구슬의 상대적 위치를 가져. 양쪽 채널에서 이미지를 저장합니다. 이러한 이미지는 두 채널을 정렬하기 위해 공동 현지화 표준으로 사용됩니다.
- 카메라는 또한 다른 한쪽에 관하여 parfocal가되도록 정렬해야합니다. 이것은 100 nm의로 Z 방향으로 서로 구분되는 하위 해상도 구슬의 이미지 집합을 인수함으로써 이루어진다. 구슬의 최대 강도 픽셀 카메라 모두에 대해 동일한 비행기에있다면 그들은 parfocal 있습니다.
3. 이미징
현미경이 설정되면 그 다음 작업은 이전에 6을 설명하고 상호 작용 transfected T 세포의 TIRFM를 수행 항원과 접착 분자를 제시 유리 지원 지질 bilayers를 포함하는 흐름 챔버를 준비하는 것입니다기판. 출판 이중층 프로토콜 5-6은 흐름 챔버가 조립 후 liposomes가 coverglass 20 분 동안 incubated되지 않은 것을 제외하고는 출판으로 이어했다. 대신, HBS-BSA 버퍼 즉시 조립 후 흐름 세포 성장을 거듭했다.
- 니켈-NTA의 lipids를 포함하는 유리 덮개 조각에서 형성된 평면 지질 bilayers과 흐름 챔버를 조립. 유착 분자는 ICAM-1 (100 분자 / μm의 2), 그리고 펩타이드-MHC 단지, 고객 센터 로드된 IE K는 (5-10 분자 / μm의 2), 그들의 히스티딘 태그 통해 이중층에 통합됩니다. costimulatory 분자 CD80는 GPI 앵커 (100 분자 / μm의 2)를 사용하여 추가됩니다.
- 현미경의 무대에 흐름 전지를 삽입하고 안정화. 의 온도를 제어하는 흐름 세포에 요소를 가열 제공된 제조 업체를 연결합니다. 이중층에 목적을 배치하고 집중하기의 이중층 비행기를 가지고. 목적의 가열과 흐름을 활성화37시 챔버의 온도를 안정화하기 위해 세포 ° C.
- Transfected T 세포는 80x G와의 속도로 배양 4 시간 후 pelleted 있습니다 HBS-BSA 버퍼에 다시 정지 및 10 μg / H57 팹의 ML 또는 20 μg / H57 단일 사슬 변수 조각 (scFv)까지 ML과 보충 TCR 라벨을 달고. 세포 후 흐름 세포에 주입하고 있습니다. 이미징들은 높은 분해 상수로 인해 팹 또는 scFv의 지속적인 존재로 이루어집니다. TIRF 필드는 매우 얇은 그대로 매체에 그들의 존재는 상당히 배경을 증가시키지 않습니다.
- 그 듀얼 채널 라이브 인수 transfected 세포를 찾고 도움 TCR 및 GFP 채널의 라이브 프리뷰를 표시하도록 이미징 조건이 설정되었습니다. TIRF 조명은 어떤 측면 멤브레인 염색법을 감지 유리 비행기를 집중하여 확인합니다. 측면 세포막 초점에 오지 않으면 다음 TIRF 정렬이 좋다. Transfected 세포는 다음 화상을 생산하기 위해 한 이미지 시퀀스의 몇 군데있다EOS.
4. 이미지 처리 및 데이터 분석
소프트웨어는 단일 프레임에 두 개의 카메라에서 이미지를 출력합니다. 각 카메라의 출력은 512 X 512 픽셀입니다; 따라서, 출력 이미지의 크기는 1024 X 512 픽셀입니다. 이미지는 먼저 두 개의 카메라에 대응하는 개별 프레임으로 분할해야합니다. 두 채널의 하위 해상도 구슬의 이미지가 겹쳐 있고 정렬 매개 변수가 결정됩니다. Google 시스템은 특정 기능은 서로에 대한 존중과 하나가 채널의 1도 회전이다 (그림 3 참조). 이 회전의 가장 큰 원천은 카메라 스탠드입니다. 이 회전하면 X와 Y에 대한 상대적인 선형 변환은 완벽하게 서로 관련하여 비즈를 정렬하기 위해 수행해야합니다. 구슬의 이미지는 두 채널을 정렬하기 위해 정확한 매개 변수를 결정하는 모든 실험에서 얻을 수있다. 이러한 선형 및 회전 변환 그러면 모든에 적용됩니다다음 이미지와 그들이 세분화 알고리즘과 공동 현지화 분석이 적용됩니다.
5. 대표 결과
여기에서 설명한 시스템은 플라즈마 막 언제 수용체의 신호 스트림을 공부하고 적용할 수 있습니다. 신호는 TCR microclusters 불리는 광학 해결 클러스터에서 또는 최근 18 설명되어 endosomes에서 발생하기 때문에 그것은 TCR 신호 전달을 연구 특히 유익한 것입니다. 신호가 수용체의 하위 해상도 클러스터 또는 취소 클러스터 수용체에서 발생하는 경우 추가적인 실험 데이터를 해석 할 수 밖에 없었다. 위에서 말했듯, TCR 복합 인 경우에는 3 번 CD 체인 펩타이드-MHC 단지 의한 TCR의 교전시 Lck SRC 가족 키나제에 의해 인산화을 받고있다. phosphorylated CD3ζ 체인 다음 Syk 가족 키나제 Zap70을 신병. ZA의 채용을 떠올리p70 따라서 CD3ζ 체인의 인산화 상태를보고합니다. TCR의 자극 강도는 TCR 연락처 잔류물에서 변이된 펩티드을 사용하여 변경할 수 있습니다. 이러한 펩티드가 조작된 펩타이드 리간드 (APLs)이라고합니다. 대표적인 실험은 낮은 힘 펩타이드 T102L이 CD3ζ 체인이 경우에 phosphorylated되지 않았음을 입증, TCR microclusters에 Zap70을 모집하는 데 실패하면서 작용제의 펩티드가 robustly TCR의 microclusters에 Zap70을 신병 그림 4에 표시됩니다. 우리가 그냥 쉽게 TIRFM에 의해 발견되었다 TCR 클러스터에 Zap70의 모집을 관찰해야했기 때문에 우리는이 결론을 그릴 수 있습니다. 자동 분할 알고리즘은 셀 당 Zap70 microclusters의 개수를 계산하는 데 사용되었다. 또한 TCR과 Zap70 관련 형광 동시 이미징은 보조 영화에 나와. lamelipodium의 동적 특성을 확인합니다.
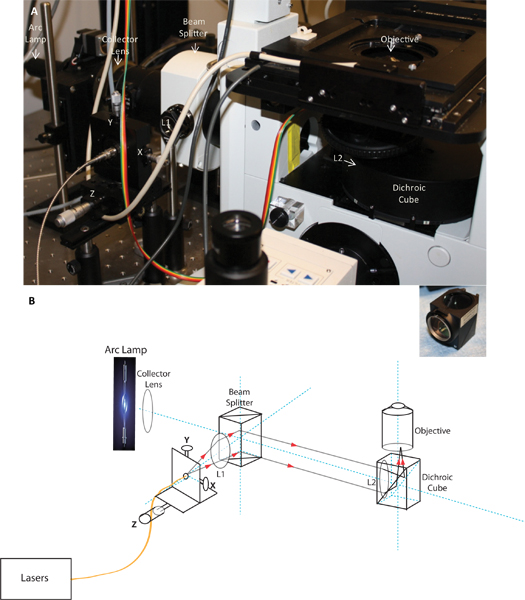
그림 1. 이미지 및 사용자 정의 TIRF 출시의 개략도. 패널은이 현미경에 설치된대로 TIRF 출시의 사진을 표시하고, 패널 B는 빛의 경로를 보여주는 TIRF 출시의 구조도이다. 약도와 컬렉터 렌즈, 빔 스플리터, 이색성 큐브와 TIRF 목표에 설치된 X, Y 및 Z 조정, collimating 렌즈 L1, 그리고 초점 렌즈 L2와 섬유 발사의 위치를 보여주는 이미지입니다. 삽입된 페이지는 이색성 큐브에 설치 초점 렌즈를 보여줍니다.
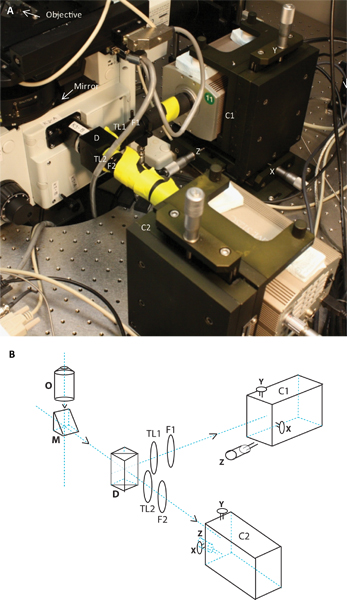
그림 2. 이미지 및 두 개의 카메라 시스템의 개략도. 패널은이 현미경에 부착된으로 두 카메라 시스템의 사진을 보여줍니다, 그리고 패널 B는 동일의 구조도이다. 약도와 이미지는 목표의 위치, 거울, 이색성, 튜브 렌즈의 TL1과 TL2, 방사 필터 F1과 F2, T에있는 두 개의 카메라 C1과 C2를 보여후계자는 해당 X, Y 및 Z 조정과 함께 선다.
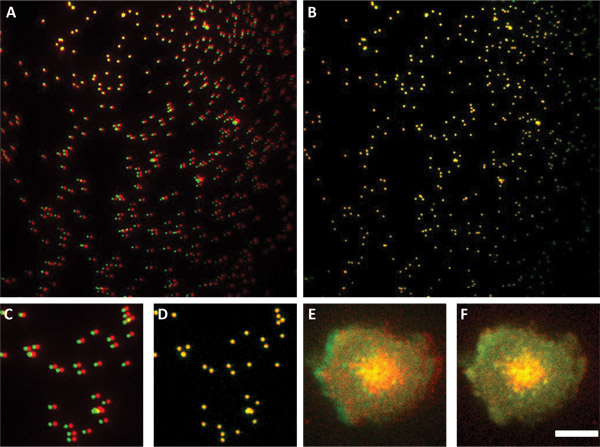
그림 3. 두 개 채널을 정렬하기 위해 하위 해상도의 구슬 사용합니다. 패널과 전 서브 해상도의 구슬 B 쇼 오버레이 (패널)과 후 (패널 B)를 정렬. 패널은이 채널 중 하나가 다른와 관련해서 회전을 알게됩니다. 패널 C와 D는에있는 이미지의 하위 섹션에있는 A와 B 패널 E는 처리없이 세포의 두 채널 오버레이 이미지를 보여줍니다. 패널 D에 사용되는 정렬 매개 변수는 두 채널의 lamelipodium 완벽하게 패널 F와 모든 패널 패널 E. 스케일 바 4 μm의에서 정렬되는 방식 패널 F. 통지서에 표시된 이미지에 적용되었다.
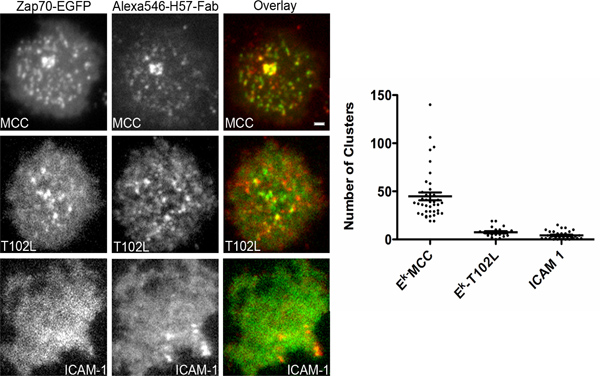
그림 4. 다른 APLs에 대응 Zap70 모집 TCR microclusters 있습니다. 인 체외 활성과 T 세포가 GFP에 융합 플라스미드 인코딩 Zap70로 transfected되었다 6 분자 / μm의 펩타이드 2를 포함하는 유리를 지원 니켈-NTA의 bilayers에 incubated되었다 그분-태그를 IE K, 100 분자 / Alexa647 복합 그의 태그가 추가된 중 μm의 두 ICAM을로드 1과 100 분자 / GPI-고정 CD80의 μm의 2. 로드 펩티드가 삽입된 페이지에 표시됩니다. ICAM-1이 100 분자 / μm의 알렉사-647 복합 그 .. 태그가 ICAM-1의 2를 포함하는 bilayers에있는 세포를 말합니다. 듀얼 채널 동시 취득 TIRF 현미경은 TCR을 착색하기 위해 Alexa546 복합 H57 팹 조각 (비 차단)의 지속적인 존재에서 수행되었다. 전지 이중층과 최초 접촉 후 1 시간까지 몇 군데 있었다. 셀 당 Zap70 클러스터 번호는 자동 클러스터 계산 소프트웨어를 사용하여 분석되었다. 최소한 40 세포는 각 경우에 분석되었다. 모든 이미지에 대한 크기 조정 막대 2 μm의.
92/3892fig5.jpg "/>
그림 5. 카메라의 두 가지 종류를 사용하여 두 개의 카메라 시스템의 정렬. 이 패널은 하위 해상도 구슬의 정렬 오버레이는 두 카메라가 다른 픽셀 크기 (2x2 binning과 레드에서 몇 군데 6.45 μm의 화소 크기 : 없음 binning에 몇 군데 16 μm의 화소 크기 녹색)가 두 개의 카메라 시스템을 사용하여 몇 군데 보여줍니다. 삽입된 페이지는 필드의 중앙에 사각형 상자의 확대보기를 표시합니다. 스케일 바 5 μm의.
부가 영화. 작용제의 펩타이드에 대응 Zap70 모집 TCR의 microclusters 있습니다. 인 시험 관내 활성과 T 세포가 GFP에 융합 플라스미드 인코딩 Zap70로 transfected되었다 6 분자 / μm의 펩타이드 2를 포함하는 유리를 지원 니켈-NTA의 bilayers에 incubated되었다 그분-태그를 IE K, 100 분자 / μm의 Alexa647 중 2로드 복합 GPI-고정 CD80의 ICAM-1 및 100 분자 / μm의 2 그의 -이 태그로 지정했습니다. 듀얼 채널 동시cquisition TIRF 현미경은 TCR을 착색하기 위해 Alexa546 복합 H57 팹 조각 (비 차단)의 지속적인 존재에서 수행되었다. transfected 세포의 필드가 반복적으로 프레임 당 10 초의 시간 해상도로 40 번정도 몇 군데했습니다. 스케일 바 2 μm의가. 보충 동영상을 보려면 여기를 클릭하십시오 .
토론
우리는 여기서 TIRFM과 인조 APCs과 같은 유리를 지원 지질 bilayers를 사용하여 항원에 특정한 기본 마우스 T 세포에 신호를 공부하는 시스템을 설명합니다. 기술은 성공적으로 이들 세포에 GFP 태그가 단백질을 표현에 의존합니다. T 세포를 Transfecting 것은 언제나 어려운 작업입니다. 일반적으로 retroviruses 또는 lentiviruses을 사용하여 electroporation이나 유전자 전달이 사용됩니다. 한 기술은 다른여 우수하지 않으며 모두 자신의 한계와 장점이 있습니다. 1) 이는 retroviruses 아니지만 lentiviruses 필요로 세포가 활발히 분열하는 것이 필요하지 않습니다, 그리고 2) 표현 수준이 세포 이미징 전에 incubated되는 시간을 변화하여 제어할 수 있습니다 : 우리는 electroporation은 다음과 같은 장점이있다 찾습니다. 가장 큰 단점은 우리가 매우 어려운 일차 세포의 크기가 큰 단백질을 표현하는 것입니다. 우리는 electroporation 이후 우리에게 아주 좋은 세포 생존 능력을 제공 방법을 제시했습니다. 결과적으로 그것은 applicab입니다siRNA의 중재 유전자 입을를 달성하기 위하여 그것을 사용 르.
우리는 또한 여기서 chromatically 수정하고 다른 파장에 대해 별도의 정렬이 필요없는 맞춤형 두 채널 동시 수집 TIRF 현미경을 설명합니다. 이러한 기능은 있지만 상업적으로 사용할 수 있습니다. 저희 시스템은 TIRF 현미경 분야의 전문가에 의해 출판 및 상업 대안보다 저렴의 원리에 근거한다. 우리 디자인의 한 가지 비판은 우리가 다른 여기 파장에 대한 발생률의 동일한 각도를 사용하고있다는 것입니다. 이것은 다른 여기 파장에 대해 다른 TIRF의 침투 깊이가 나타날 수 있습니다. 우리는 지극히 미미한 파도가 기하 급수적으로 부패 분야이며 TIRF 필드의 깊이가 파장의 선형 함수이기 때문에 이러한 효과가 작기 생각합니다. 유리 표면에 가까운 Fluorophores는 두 파장 사이의 레이저 농도에는 차이가 발생할하지 않습니다. PE 근처 fluorophores위한netration 깊이는 강도 차이는 두 파장 488 및 561 nm의를위한 두 파장 488 및 640 nm의 및 1.15 배위한 1.3 배 될 것입니다. 동일한 시스템 TIRF 조명을 사용하게 수퍼 해상도 기술과 함께 사용될 수 있습니다.
우리는 또한 사용자 정의 내장입니다 두 카메라의 시스템을 설명했습니다. TIRF 시스템과 마찬가지로 유사한 apparatuses 또한 상업적으로 사용할 수 있습니다. Google 시스템은 파장의 서로 다른 조합과의 사용할 수 있도록 필터와 dichroics을 변경하는 유연성을 제공합니다. 시스템의 단점은 두 이미지를 정렬하는데 필요한 회전 한 정도입니다. 이 문제는 압전 구동과 정렬의 회전 정도를 제공하고 있습니다 카메라 스탠드를 사용하여 해결할 수 있습니다. 우리는 또한 성공적으로 카메라는 다른 서로 다른 픽셀 크기를 가지고있는이 현미경에 두 개의 카메라 시스템을 구축했습니다. 하나 하나의 채널에서 민감도와 대형 다이 필요한 경우이 같은 시스템이 있으면 좋을 텐데또 다른 namic 범위는, 둘 다 같은 카메라에 거의 사용할 수 없습니다. 우리는 16 μm의의 픽셀 크기를 가지고 Photometrics 양의-EM 카메라와 12.9 μm의의 효과적인 픽셀 크기를 제공 2x2 binning에 Photometrics HQ-2 카메라를 사용했습니다. 180mm 초점 거리 튜브 렌즈는 양의-EM에 사용되었으며, 145mm 초점 거리 튜브 렌즈는 HQ-2 카메라 사용되었다. HQ-2 Metamorph 소프트웨어와 양의-EM은 외부 트리거 모드에서 별도의 컴퓨터에 마이크로 매니저 소프트웨어를 통해 제어습니다을 사용하여 통제되었다. 외부 트리거는 Metamorph의 구성 조명 설정에서 추가로 셔터로 구현된 측정 컴퓨팅 DAC 보드의 디지털 출력을 사용하여 양의-EM 카메라에 제공되었다. 튜브 렌즈의 초점 길이의 비율은 유효 픽셀 크기의 비율과 일치합니다. 대표 정렬은 그림 5에 표시됩니다.
공개
이 실험에 사용된 모든 동물들은 무균 환경에서 유지되었으며, 실험은 보건 동물 관리 및 사용위원회의 국립 연구소에 의해 승인되었다.
감사의 말
이 연구는 알레르기 및 감염성 질병, 건강의 국립 연구소의 국립 연구소의 교내 연구 부문에 의해 지원되었다. 우리는이 연구에서 사용 H57의 scFv으로 우리를 제공하는 요하네스 Huppa과 마크 데이비스에게 감사합니다. RV가이 기술의 개발시 유용한 논의 Keir 노이만 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
| 마우스 T 세포에 대한 Amaxa Nucleofector 키트 | Lonza 주식 회사 | VPA-1006 | |
| PureLink HiPure 플라스미드 Midiprep 키트 | 생명 기술 | K2100-05 | 내독소 무료 디엔에이 preps위한 |
| Amaxa Nucleofector 장치 | Lonza 주식 회사 | AAD-1001 | |
| 재조합 Murine IL-2 | Peprotech 주식 회사 | 212-12 | |
| Fluoresbrite Multifluorescent Microspheres 0.20μm | Polysciences 주식 회사 | 24050-5 | |
| 실험실 - 테크 II 8-잘 chambered coverglass | 써모 과학, Nunc | 155,409 |
참고문헌
- Call, M. E., Wucherpfennig, K. W. The T cell receptor: critical role of the membrane environment in receptor assembly and function. Annu. Rev. Immunol. 23, 101-125 (2005).
- Smith-Garvin, J. E., Koretzky, G. A., Jordan, M. S.T cell activation. Annu. Rev. Immunol. 27, 591-619 (2009).
- Bezbradica, J. S., Medzhitov, R. Integration of cytokine and heterologous receptor signaling pathways. Nat. Immunol. 10, 333-339 (2009).
- Fraser, I. D., Germain, R. N. Navigating the network: signaling cross-talk in hematopoietic cells. Nat. Immunol. 10, 327-331 (2009).
- Dustin, M. L., Starr, T., Varma, R., Thomas, V. K. Supported planar bilayers for study of the immunological synapse. Curr. Protoc. Immunol. Chapter 18, 13-13 (2007).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. (19), e947-e947 (2008).
- Varma, R., Campi, G., Yokosuka, T., Saito, T., Dustin, M. L. T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster. Immunity. 25, 117-127 (2006).
- Yokosuka, T. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat. Immunol. 6, 1253-1262 (2005).
- Huppa, J. B. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463, 963-967 (2010).
- Tolar, P., Pierce, S. K. A conformation-induced oligomerization model for B cell receptor microclustering and signaling. Curr. Top. Microbiol. Immunol. 340, 155-169 (2010).
- Treanor, B. The membrane skeleton controls diffusion dynamics and signaling through the B cell receptor. Immunity. 32, 187-199 (2010).
- Treanor, B., Batista, F. D. Mechanistic insight into lymphocyte activation through quantitative imaging and theoretical modelling. Curr. Opin. Immunol. 19, 476-483 (2007).
- Sylvain, N. R., Nguyen, K., Bunnell, S. C. Vav1-mediated scaffolding interactions stabilize SLP-76 microclusters and contribute to antigen-dependent T cell responses. Sci. Signal. 4, ra14-ra14 (2011).
- Purbhoo, M. A. Dynamics of subsynaptic vesicles and surface microclusters at the immunological synapse. Sci. Signal. 3, ra36-ra36 (2010).
- Lasserre, R. Ezrin tunes T-cell activation by controlling Dlg1 and microtubule positioning at the immunological synapse. EMBO. J. 29, 2301-2314 (2010).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat. Rev. Immunol. 11, 21-33 (2011).
- Axelrod, D. Chapter 7: Total internal reflection fluorescence microscopy. Methods Cell. Biol. 89, 169-221 (2008).
- Williamson, D. J. Pre-existing clusters of the adaptor Lat do not participate in early T cell signaling events. Nat. Immunol. 12, 655-662 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유