Method Article
TCRとそれに関連するシグナル伝達タンパク質のリアルタイムの同時イメージングのための全反射顕微鏡法
要約
それゆえ、それが関与するタンパク質の空間的および時間的挙動を調べることが重要であるシグナリングを理解するために、細胞膜内や細胞内の場所にどちらかのタンパク質の棲み分けが大幅にシグナル伝達の結果に影響を与えることができる1調節機構である。ここではT細胞のシグナル伝達を研究するための全反射顕微鏡ベースのシステムを説明しますが、広く適用可能である。
要約
それは主要組織適合遺伝子複合体(pMHC)抗原提示細胞(APC)の表面に発現したタンパク質によって結合した抗原ペプチド断片によって従事しているときにシグナルがT細胞受容体(TCR)を介して開始されます。 TCR複合体はCD3二量体(εδとεγヘテロとホモ二量体ζζ1)を関連付ける非共有結合的にそのリガンド結合TCRαβヘテロで構成されています。受容体の関与すると、CD3ζ鎖はLckは、Srcファミリーキナーゼによってリン酸化されています。そして、これはLckがによってリン酸化と活性化されるSykの家族キナーゼ、ZAP70の採用につながります。その後、ZAP70は、さまざまなシグナル伝達分子が多数の2を含む近位シグナル伝達複合体の形成を開始し、アダプタータンパク質LATとSLP76をリン酸化する。
カルシウムは、この複雑な最終的に結果の形成とRas依存TRAnscription因子の活性化とT細胞の分化2に上昇を与える遺伝子発現プログラムの複雑な一連の結果開始。 TCR信号(および分化の結果の状態)は、抗原の効力とクロストークco-stimulatory/co-inhibitoryと、ケモカイン、および3-4のサイトカイン受容体を含む他の多くの要因によって変調されています。さまざまな刺激条件下での近位シグナル伝達複合体の空間的および時間的な組織を研究することは、従って、TCRシグナル伝達経路だけでなく、他のシグナル伝達経路によるその調節を理解する鍵となります。
以前は5-6を説明したようにT細胞の細胞膜でTCRによって開始されたシグナル伝達を研究するための一つの非常に有用なモデルシステムは、ガラスでサポートされている脂質二重層である。彼らは人工的なAPCのようにT-サービングセルに抗原pMHC複合体、接着性、共刺激分子を提示するために利用することができる。撮像することによってT細胞と相互作用する内部全反射蛍光顕微鏡(TIRFM)を使用して、脂質二重層は、我々は7-8ガラスと細胞表面との間の空間の中では100nmに励起を制限することができます。これは、私たちは主に画像細胞膜で起こるシグナル伝達イベントをすることができます。我々はイメージングにTCR複合体にシグナル伝達タンパク質の募集に興味を持っているように、我々はH57抗体の蛍光灯のFab(フラグメントの抗原結合)断片(ハイブリドーマから精製されたH57-597で標識された、前記TCR 2つのカメラTIRFイメージングシステムを記述する、ATCC、ATCC番号:HB-218)TCRβのために固有のものであり、GFPでタグ付けシグナル伝達タンパク質は、同時に、リアルタイムでイメージングすることができます。この戦略は、T細胞の両方とTCRで行われているシグナル伝達事象の非常に動的な性質のために必要である。この画像診断法は、画像、単一のリガンド9月11日と同様に活性化受容体へのシグナル伝達分子の募集に研究を許可していると12月16日 in-situで生化学を勉強するための優れたシステムです。
プロトコル
実験の手順:
1。 AmaxaマウスT細胞のNucleofectorキットを使用してトランスフェクション
ここではAmaxaマウスT細胞のNucleofectorキットを使用して、GFPでタグ付けされたシグナル分子をコードする発現プラスミドを使用して、プライマリT細胞を活性化ナイーブまたはインビトロのいずれかのトランスフェクションを記述します。 7の前に説明したようにペプチドにロードされた脾臓のAPCを使ってT細胞のin vitro活性化が実行されます。我々の研究で使用されているすべてのT細胞はMHC分子IE kに結合したMCCペプチド(88から103)を認識し、TCRを発現する。トランスフェクションを、製造業者の推奨に従って、本質的に実施されていますが、我々は、トランスフェクション後のT細胞の生存を促進するいくつかのヒントを提示します。生存率およびトランスフェクション効率の両方がナイーブ細胞より試験管内活性化T細胞で非常に高くなります。
- 開始する前に、20μLを加えることによって補わT細胞培地2 mLを準備する実行される各トランスフェクション用培地成分Bおよびウシ胎児血清100μL(5%)の両方。加湿37℃、少なくとも1時間、5%CO 2インキュベーター内で12ウェルプレートに培地を平衡化する。また、培地のアリコートは、5%血清とコンポーネントを調製し、凍結保存することができると補足した。このような場合は、アリコートの必要数を解凍コンポーネントBを追加し、平衡化を実行します。
- 細胞死のいずれか冷たいですまたは7.2以外のpHを有する培地でのトランスフェクション後の細胞の再懸濁液からなりますように培地のプレ平衡は、非常に重要です。
- 次に、トランスフェクション混合物を準備します。 18補足2μLとプラスミドDNAの5μgの(濃度も低くμg/μLの0.5以上)を持つマウスT細胞のNucleofectorソリューションの82μLを兼ね備えています。チューブをタッピングしたり、マイクロピペットの使用と混和します。
-トランスフェクションに使用する各コンストラクトの細胞が一定数のプラスミド投与量の滴定を行うことが重要である。一部の大規模構造物については、より多くのDNAが必要な場合があります。 DNAは、エンドトキシンフリーである必要があります。
- 15 mLの遠心チューブに5から10000000までのセルを転送します。室温で5分間600rpmで遠心します。真空吸引で可能な限り上清の程度を削除します。
- メーカーは以下の90X gで細胞を回転お勧めします。我々のケースでは、この速度は、75X gに対応しています。細胞ペレットを得るために選択された相対遠心力(RCF)は、低RCFの遠心分離は、細胞膜へのダメージを排除するとして、おそらく最も重要な変数です。
- 残りの細胞の大規模な塊がなくなるまで静かにゆっくりと細胞ペレットをピペッティングによりトランスフェクション混合物中の細胞ペレットを再懸濁する。これは通常、細胞を完全トンを吸引することによって達成することができますhroughピペットチップに3-4回以上ありません。
- ピペットを用いて、慎重に存在する気泡が存在しないことを確認し、認定Amaxaキュベットに懸濁液を移す。キュベットに上限を設ける。
- のNucleofectorデバイス上のNucleofectorプログラムX-001を選択します。のNucleofectorキュベットホルダにキュベットを挿入し、選択したプログラムを適用します。
- 細胞をelectroporatingした後、直ちにあらかじめ平衡化した培地にそれらを転送することをお勧めします。メーカーは、細胞が15分を超えないためのNucleofector媒体に保持されることをお勧めします。
- フードにキュベットと予め平衡化し、完全に添加培養培地を持参してください。提供するプラスチック製のピペットを用いて、キュベットに培地を約500μLを追加し、ドロップによるプレートのドロップで培地に細胞懸濁液を転送します。
- イメージングの前に4時間、37℃で細胞をインキュベートします。ナイーブ細胞がincubatです。ED 30℃代わりに37℃のこれは、抗原への反応性を維持するのに役立ちます。
- インキュベーションの3〜4時間で検出可能なGFPタグ融合タンパク質を表現するT細胞の一般的に十分である。発現レベルが低く、過剰発現のアーティファクトを最小限に抑える必要があるので、我々はこの時点で画像セルを選択しました。特定のタンパク質の過剰発現が必要な場合は、しかし、T細胞は4時間後にAmaxa媒体から削除する必要があります。これは再び低RCFでセルをpelletting 200万細胞/ mLの密度でインターロイキン2の50 U / mLの(IL-2)を添加したプレ平衡化したT細胞の培養培地に再懸濁することによって達成される。
2。全反射顕微鏡
全反射顕微鏡の説明:
- 一般的な構成:光学部品は、もともとオリンパスTIRFモジュールを搭載したオリンパスIX71蛍光顕微鏡を中心に構築されました。我々はすぐにディscovered色収差の影響は、このモジュール内の単一の配向状態は、異なる波長のレーザーラインの一致するコリメーションを達成しなかったとき。このモジュールは、したがって、異なる励起波長を使用して同時TIRFイメージングのために許可しない、と我々は次のセクションで詳細に議論するように、システム内の色収差の影響を最小限に抑えカスタムTIRF装置を構成するために設定してください。ここで説明するメソッドは、150 X倍率用に開発された、1.45の開口数(NA)TIRFM目標(オリンパス)は、60 X倍率、1.45 NAのバージョンでも同様に動作します。広い視野照明では、顕微鏡は、金属ハロゲン化物ラムダ-XL光源と励起フィルターを装備励起フィルターホイール(サッター·インスツルメンツ)に接続されている。目的に関して、試料ステージの自動位置決めのために、顕微鏡は電動XY翻訳、ピエゾ制御されたZステージ(ASI)が装備されています。画像は、2つの同一QUを使用して取得されアンテム電子乗算(EM)のCCDカメラ(Photometrics)。これらのカメラの画素サイズはピクセル当たり0.1μmの最終的な解決を与えて、150 X TIRF目的で提供される倍率と非常によく一致しています。 EMCCDカメラは、低発現レベルを有するGFPのトランスフェクタントを視覚化するための感度を提供します。
- レーザー:TIRF照明、6レーザーライン(405、440、488、514、561および640 nm)の合計を提供する5レーザーのシステムの場合は、シングルモードファイバ(Solamereテクノロジー)に結合される。アルゴンレーザーと561 nmのダイオードは、レーザー(行488、514、561)はダイオードレーザー(405、440と640の強度ながら、強度制御のための音響光学チューナブルファイバー(AOTF)を介してルーティングされる固体(DPSS)を励起nm)は、その電源装置の変調電圧によって制御されます。 AOTFとダイオードレーザーの電源の電圧は、データ集録カード(DAC)MetaMorphソフトウェア(Molecuを使用してボード(計測·コンピューティング)を介して制御されLARデバイス)。アルゴンおよびDPSSレーザーのものが彼らの小さいビーム径に起因する約60%でありながら、ダイオードレーザの結合効率は30%です。
- TIRFモジュール:ために同時に画像TCRとそれに関連するシグナル伝達分子には、前述したように、それが色収差補正された全反射照明が不可欠であり、異なる波長の蛍光量を取得するときには、再編やリフォーカスを必要としないでしょう。 17前述のようにTIRFMは、照明-レンズを通して使用して達成された。顕微鏡にレーザー光を実現します光ファイバケーブルは、Z調整(Thorlabs)のマイクロメータ駆動型光学レール上にマウントされたXYのファイバホルダを装備繊維の打ち上げに確保した。 TIRF照明を達成するために、レーザビームは、2つのレンズのシステム(L1(コリメータレンズ)と図1のL2(合焦レンズ))を使用して目的の後焦点面に集束されるように、BEAMは、目的外に平行現れる。これは客観から出てくる光のすべての光線が試料面に対して同じ角度を持っていることが保証されます。光ファイバの先端がコリメートレンズの焦点に配置されます。コリメートレンズ(Z方向)に対する光レールに沿ってマイクロメーターを動かすことによって、それはビームの焦点を調整し、XY調整ノブを使用して、XとYの位置にビームを移動させることが可能です。 150 Xの目的の非常に小さな背面開口部のおかげで、我々は全反射、小さくするために必要な後焦点面でのレーザスポットサイズを達成することがわかった。小さなスポットを生成するのに必要なフォーカスを実現するために、短い焦点距離のレンズは(キアノイマン、私信)が必要であった、したがって、我々が直接前のダイクロイックキューブに置かれた約108ミリメートルの焦点距離と焦点レンズを使用し目的。コリメートレンズは、近くにTIをもたらした光ビームスプリッタに置かれたRF照明。不要な色収差の影響を最小限に抑えるために、我々は、コリメートおよび集光レンズ(JML光)の両方に反射防止コーティングで色消しダブレット(異なる屈折率の材料から作られた融合2つのレンズの要素によって行われた色収差補正レンズ)を使用しました。フォーカスは、ビームが戻って開口部の中央に配置するときの目的外に平行と部屋の天井にタイトなスポットを形成する必要が出てくるかどうかを確認することによって確認できます。焦点スポットの位置は、ビームが大きな角度で像面に収束させる開口部(Y方向)の端に向かって移動され、最終的には、全反射の臨界角が達成されます。これらの光学部品を使用して、我々は同じ配置で442から640 nmの全波長同時視準を達成しました。単一の光学アライメントは、したがって、私たちは複数の波長で同時にTIRFMを実行することができました。
- デュアルカメラapparatus:2つの異なる蛍光色素から生じる異なる蛍光発光の同時取得は、ダイクロイックミラーを使用する( 図2)を介して2つの波長範囲に発光を分割し、デュアルカメラシステムを構築することによって達成された。放出された光は顕微鏡の右側のポートのうち、客観的に反映されます。ほとんどの目的は、(無限に形成されたイメージを持つ)を修正無限大であるので、チューブレンズは、イメージを集中する必要があります。同時に二つの発光波長を操作するには、右側のポート上のチューブレンズは削除されました。 Cマウントのスレッド(サッター·インスツルメンツ)を含むカスタマイズされたアダプタが接続されたダイクロイックミラーホルダー(エドモンド·オプティクス)にリンクされました。 TCRを(Alexa546、Alexa647など)をラベルに使用される有機色素のそれからGFPの発光を分離するダイクロイックミラーは、このホルダーにインストールされていました。このモジュールは、チューブレンズホルダー、エミッションフィルターホルダーと延長チューブにより、両方の光路に続いた。ザチューブレンズ(TL1とTL2( 図2))は、180ミリメートルの焦点距離を持っています。 EM CCDカメラに至る延長チューブ間のギャップが迷光からカメラを保護するために黒い紙で覆われていた。つのチャネルのアラインメントを可能にするために、カメラ(Holmarc製品)の略つのカスタムXYZ翻訳にマウントされた。
以下我々は2つのチャンネル同時イメージングのための顕微鏡を整列する方法について説明します。手順は、全反射照明を合わせてレーザーパワーを調整し、サブ解像度のマイクロビーズを使用して、2つの出力画像を整列されています。
- 開始する前に、顕微鏡のすべてのコンポーネントの電源がオンにされています。コンピュータとソフトウェアが起動されており、それはすべてのハードウェアコンポーネントがソフトウェアによって認識されることが保証される。
- 共局在の標準として使用するために、PBS 2 mlのサブ分解能(0.2μm)をFluoresbriteマルチ蛍光マイクロスフェアの1μLを希釈し、マイクロスフェアの0.25 mLを加えラボ·テックII 8ウェルチャンバーカバーガラスシステム(Nunc社製)の各ウェルに停止。客観的な上記のプラットフォームにチャンバースライドシステムを配置します。ガラスに吸着されているビーズは、フォーカスに持ち込まれています。
- XYZ繊維の打ち上げのY整列を使用して、レーザビームの位置が目的の背面開口部の中央に移動されます。目的は、ガラス面にフォーカスがある位置にあるとき、これを行うことが重要です。ビームはコリメートされていない場合は、Zマイクロメータは、完全なコリメーションを達成するために調整されます。コリメーションは実験で使用するすべてのレーザ·ラインを個別にテストされています。この段階で、各ラインのレーザーパワーはレーザーパワーメータを使用して測定され、各チャンネル20〜30μWに調整されます。
-T細胞は、レーザ放射に非常に敏感であり、照明は50μWの合計に制限されています。
- ビーズの画像は、TIRF illuminatを使用して取得されますライブモードでのイオン。ビームが目標の光軸に対するその角度が90度に達するまで天井から遠ざかって起動するように繊維の起動時にY-アライメントマイクロメータをオンにします。最終的には、TIRの臨界角に達したときに、レーザー光は、もはや目的を終了しません。 TIRFアライメントその後、カバーガラス面を上下に着目して判断される。溶液中に浮遊しているビーズが可視化される可能性がある場合、その客観的な通常のニーズに対するビームの角度がさらに増加することができます。正しいTIRFアライメントでは、1つの光学面(すなわち、カバースリップに吸着されている唯一のビーズ)フォーカスになります。イメージングT細胞は表面に広がっている表面の染料で染色したときに全反射配置の細かいテストを実装することができます。 (ポイント3.4を参照)。
- TIRF照明が達成された後、2チャンネルは、互いに対して整列させることができる。ビーズに焦点を当て、私の位置を比較する画像内のdentifiable機能は、両方のチャンネルで生産。一台のカメラスタンドにXとYのマイクロネジを使用して、可能な限り近接したビーズの相対的な位置をもたらす。両方のチャンネルから画像を保存します。これらの画像は、2つのチャネルを揃えるために共局在標準として使用されます。
- カメラはまた、彼らはもう一つに関して同焦点になるように整列する必要があります。これは、100nm以下でZ方向に互いに分離されているサブ解像度ビーズのイメージのセットを取得することにより達成される。ビーズの最大強度のピクセルが両方のカメラに対して同一平面にある場合、それらは同焦点です。
3。イメージング
顕微鏡のセットアップが完了したら、次のタスクは、前述のように6抗原と接着分子を提示するガラスサポート脂質二重層を含むフローチャンバーを準備し、と相互作用するトランスフェクトされたT細胞のTIRFMを実行することです基板。フローチャンバーを組み立てた後、リポソームはカバーガラス上で20分間インキュベートされていないことを除いて公開された公開二重層プロトコル5-6に従った。代わりに、HBS-BSAバッファはすぐに組み立てた後、フローセルに流した。
- のNi-NTA脂質を含有するガラスカバースリップ上に形成された平面脂質二重膜とフローチャンバーを組み立てる。接着分子ICAM-1(100分子/μmの2)、ペプチド-MHC複合体は、MCCロードされたIE のk(5-10分子/μmの2)は 、それらのヒスチジンタグを介した二重層に組み込まれています。共刺激分子CD80はGPIアンカー(100分子/μmの2)を使用して追加されます。
- 顕微鏡のステージ上でフローセルを配置し、それを安定させます。その温度を制御するためのフローセル上の要素を加熱して供給するメーカーを添付してください。二重層に目的を置き、集中することで二重面をもたらす。目標と流れの加熱を可能にする37室の温度を安定させるための細胞℃、
- トランスフェクトされたT細胞は、80X gの速度でのインキュベーションの4時間後にペレット化しており、HBS-BSAバッファーで再懸濁させ、H57 FabまたはH57単鎖可変断片の20μg/ mLの(scFv)をへの10μg/ mLのを補充したTCRにラベルを付けます。次に、細胞をフローセルに注入されています。イメージングは、高い解離定数に起因するFabまたはscFvの連続的な存在下で行われます。 TIRFフィールドは非常に薄いように培地中の彼らの存在は、かなりのバックグラウンドを増加させることはありません。
- そのデュアルチャンネルライブ買収は、トランスフェクションした細胞を検索するのに役立ちますTCRとGFPのチャンネルのライブプレビューが表示されますので、撮影条件が設定されています。 TIRF照明は、任意の横方向の膜染色を検出するためにガラス面を焦点によって確認されています。横方向の膜にフォーカスが来ない場合は、全反射のアライメントは良好である。トランスフェクトした細胞は、その後のVIDを生成するために一回またはイメージシーケンスで撮像されるEOS。
4。画像処理とデータ解析
ソフトウェアは、単一のフレームに2つのカメラからの画像を出力します。各カメラの出力は512×512ピクセルであり、従って、出力イメージのサイズは1024×512ピクセルです。画像は最初の2つのカメラに対応する個々のフレームに分割する必要があります。 2つのチャネルからサブ解像度のビーズのイメージがオーバーレイされるとアライメントパラメータが決定されます。私たちのシステムに固有の機能は、他に対して1チャネルの1度の回転である( 図3を参照)。この回転の最もありそうなソースは、カメラスタンドです。この回転後のXとYの一層の相対的な線形変換は完全に互いにビーズを整列するために実行する必要があります。ビーズの画像は、2つのチャネルを配置する正確なパラメータを決定するためにすべての実験で得られた。これらのリニアと回転変換は、すべてに適用されます。イメージと、彼らはセグメンテーションアルゴリズムと共局在解析の対象となります。
5。代表的な結果
ここで説明するシステムは、細胞膜に任意の受容体の下流シグナル伝達を研究するために適応させることができます。シグナリングはTCRマ イクロクラスターと呼ばれる光学的に解決するクラスタで、または、最近18を説明するエンドソームで起こるので、それはTCRシグナル伝達を研究する上で特に有益です。シグナリングは、受容体のサブ解像度のクラスタで、または非クラスタ化された受容体で発生した場合は追加の実験データを解釈するために行われる必要があります。前述したように、TCR複合体のCD3鎖は、ペプチド-MHC複合体によるTCRの関与に応じてLckをSrcファミリーキナーゼによるリン酸化を受けています。リンCD3ζ鎖は、その後のSykファミリーキナーゼZAP70を募集しています。ザの募集を可視化するP70は、このようにCD3ζ鎖のリン酸化状態を報告します。 TCR刺激の強さはTCR接触残基に変異ペプチドを使用して変更することができます。このようなペプチドは、改変ペプチドリガンド(APLs)と呼ばれています。代表的な実験は、低価ペプチドT102Lは、CD3ζチェーンがこのケースではリン酸化されていないことを実証し、TCRマ イクロクラスターにZAP70を募集して失敗しながら、アゴニストペプチドは確実にTCRマ イクロクラスターにZAP70を募集して図4に示します。我々だけで簡単にTIRFMによって検出されたTCRクラスタにZAP70の募集を観察しなければならなかったので、私たちはこの結論を出すことができます。自動セグメンテーションアルゴリズムは、セル当たりZAP70マイクロクラスターの数を数えるために使用されていました。また、補足ムービーに示すように、TCRとZAP70関連した蛍光の同時イメージングです。 lamelipodiumの動的な性質に注意してください。
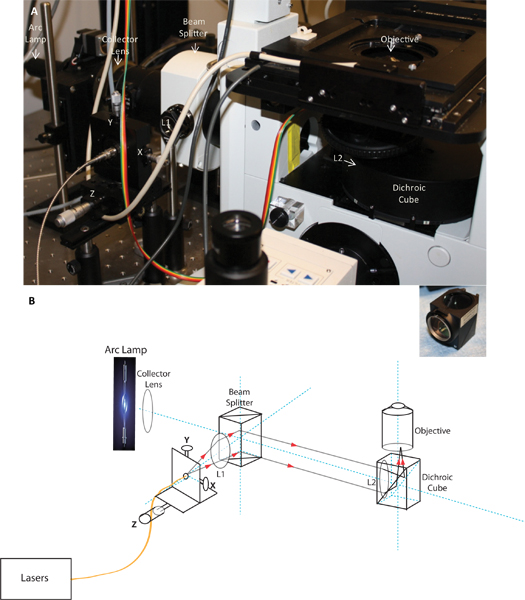
図1。イメージとカスタムTIRF発射の模式図。パネルには、顕微鏡にインストールされTIRFの打ち上げの写真を示し、パネルBは、光路を示すTIRFの打ち上げの概略図である。回路図とコレクタレンズ、ビームスプリッター、ダイクロイックキューブとTIRF目的にインストールされているX、Y、およびZの調整、コリメートレンズL1と、集束レンズL2と光ファイバ打ち上げの位置を示す画像。挿入図は、ダイクロイックキューブにインストールされている集光レンズを示しています。
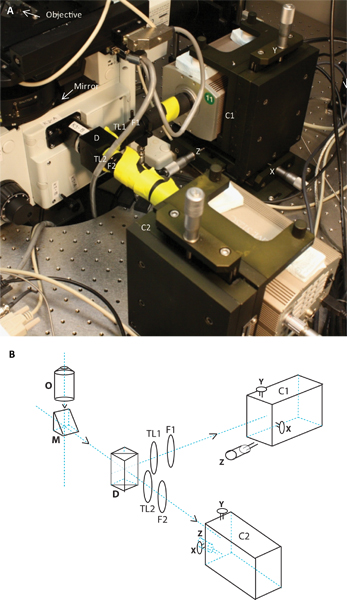
図2画像と2つのカメラシステムの概略図。パネルには、顕微鏡に接続されているように、2つのカメラシステムの写真を示し、パネルBは、同一の概略図である。回路図と画像が目的の位置、ミラー、ダイクロイック、チューブレンズTL1とTL2、エミッションフィルタF1とF2は、tの2つのカメラがC1とC2を表示相続人は、それぞれのX、Y、Zの調整を意味します。
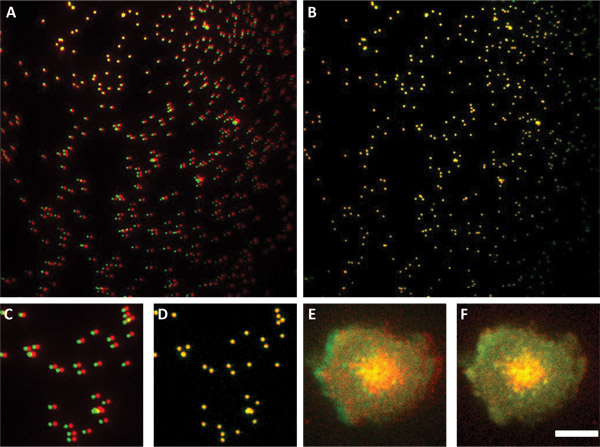
図3つのチャネルを整列するサブ解像度ビーズの使用。サブ分解能ビーズのBショーオーバーレイの前に(パネルA)と(パネルB)アライメント後のパネル。パネルには、チャネルの1つが他に対して回転であることを示しています。パネルCおよびDはAとBのパネルの画像のサブセクションであるEは、処理を行わずに細胞の2つのチャネルのオーバーレイイメージを示しています。パネルDで使用されているアライメントパラメータは、2つのチャネルからlamelipodiumは完全にパネルFでなく、すべてのパネルのパネルE.スケールバーは4μmでどのように配置されるかをパネルF.通知に示す画像に適用した。
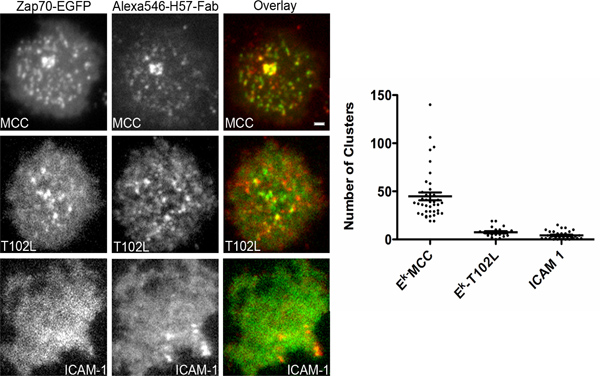
図4異なるAPLsに応答して、ZAP70募集TCRマ イクロクラスターへ。 インビトロ活性化とT細胞は、プラスミドのエンコーディングZAP70 GFPに融合し、Hisタグ-IE kをロードされたペプチドの6分子/μmの2を含むガラスサポートをNi-NTA脂質二重層でインキュベートしたとAlexa647コンジュゲートしたHisタグ- 100分子/μm2でトランスフェクトしたICAMをGPIアンカー型CD80の1〜100分子/μm2で 。ロードされたペプチドは、挿入図に示されています。 ICAM-1は、100分子/μmのアレクサ-647共役HisタグICAM-1の2を含む二重層の細胞を指します。デュアルチャンネル同時取得TIRF顕微鏡は、TCRを染色するためにAlexa546コンジュゲートH57 Fabフラグメント(非ブロッキング)の連続的な存在下で行われた。細胞は脂質二重層との最初の接触後1時間まで撮像した。セル当たりZAP70クラスタの番号は自動化されたクラスタカウントソフトウェアを用いて分析した。少なくとも40細胞は、それぞれのケースで分析した。すべてのイメージのスケールバーは2μm。
92/3892fig5.jpg "/>
図5:カメラの2つの異なるタイプを使用して、2つのカメラシステムのアライメント。このパネルは、サブ解像度のビーズの整列オーバーレイ2台のカメラが異なるピクセルサイズ(:2x2ビニングと赤で撮影さ6.45μmのピクセルサイズ:なしビニングで撮影さ16μmのピクセルサイズグリーン)持つ2つのカメラシステムを用いて画像化を示しています。挿入図はフィールドの中央にある四角形のボックスの拡大図を示しています。スケールバーは5μm。
補足ムービー。アゴニストペプチドに応答して、TCRマ イクロクラスターにZAP70採用。試験管内活性化とT細胞がコードするプラスミドZAP70 GFPに融合されたとAlexa647のHisタグ-IE K、100分子/μm2でのロードされたペプチドの6分子/μmの2を含むガラスサポートをNi-NTA脂質二重層でインキュベートしたトランスフェクションした共役GPIアンカー型CD80のICAM-1と100分子/μm2での Hisタグ。デュアルチャンネル同時cquisition TIRF顕微鏡は、TCRを染色するためにAlexa546コンジュゲートH57 Fabフラグメント(非ブロッキング)の連続的な存在下で行われた。トランスフェクトした細胞のフィールドは、繰り返してフレームあたり10秒の時間分解能で40回をイメージしました。スケールバーは2μm。 補足ムービーを表示するには、ここをクリック 。
ディスカッション
ここではTIRFMと人工APCのようなガラスサポート脂質二重層を用いた抗原特異的なマウスの主要T細胞のシグナル伝達を勉強するようにシステムを説明します。技術は、正常にこれらの細胞でGFPタグ融合タンパク質を発現しているに依存しています。 T細胞をトランスフェクションは、常に困難な作業です。一般的に、レトロウイルスやレンチウイルスを用いたエレクトロポレーション、または遺伝子送達が使用されています。一つの技術は他よりも優れたではありません。両方がそれらの限界と利点を持っています。 1)それは、レトロではなくレンチウイルスのために要求されるように細胞が活発に分裂することを要求されない、2)の発現レベルは細胞がイメージングの前にインキュベートされる時間を変えることによって制御することができます:我々は、エレクトロポレーションは、次のような利点があります見つける。最大の欠点は、我々はそれが非常に困難な初代培養細胞のサイズが大きいタンパク質を発現することを見つけることです。我々は、エレクトロポレーション後、私達に非常に優れた細胞の生存を与える方法を提案した。結果としてそれがapplicabです。siRNAを介した遺伝子サイレンシングを達成するためにそれを使用するル。
また、ここで色収差補正されており、異なる波長ごとに個別のアライメントを必要としないカスタマイズされた2チャンネル同時取得TIRF顕微鏡を説明します。これらの機能はあるが、市販されている。私たちのシステムは、全反射顕微鏡分野の専門家によって発行され、商業の選択肢よりも安価であるの原則に基づいています。私たちのデザインの一つの可能な批判は、我々は、異なる励起波長の入射角度と同じを使用していることです。これは、異なる励起波長の異なる全反射侵入深さをもたらすでしょう。我々は、エバネッセント波は指数関数的に減衰するフィールドであり、全反射、被写界深度は、波長の線形関数であるため、これらの影響は小さいと考えています。ガラス表面に近い蛍光体は、2つの波長間でのレーザー強度の差を体験しません。 PEの近くに蛍光体のためにnetrationの深さは、強度の違いは、2つの波長488と640nmの1.3倍、二つの波長488と561 nmの1.15倍となります。同じシステムは、全反射照明を利用して超解像技術と組み合わせて使用することができます。
また、カスタム構築されている二つのカメラシステムを記載している。 TIRFシステムと同様に、類似した装置も市販されている。我々のシステムは、波長の異なる組み合わせでの使用を許可し、フィルタとdichroicsを変更する柔軟性を提供します。我々のシステムの欠点は、2つの画像を整列するために必要な回転の1程度である。この問題は、ピエゾ駆動アライメントの回転度を提供しているカメラスタンドを使用することで解決できます。我々はまた、成功したカメラが異なっていて、別のピクセルサイズを持っているでは、この顕微鏡に2つのカメラシステムを導入しています。一つ一つのチャネルの感度と大きなdyを必要に応じてこのようなシステムが有用であろう別のnamic範囲は、どちらも同じカメラではほとんど利用できません。私たちは私たち16μmのピクセルサイズを持つPhotometricsクワント-EMのカメラで12.9μmの有効画素サイズを与える2x2ビニングでPhotometrics HQ-2カメラを使用していました。 180ミリメートルの焦点距離チューブレンズはクワント-EMに使用されたと145ミリメートルの焦点距離チューブレンズはHQ-2カメラを使用しました。 HQ-2はMetamorphソフトウェアを使用して制御されたとクワント-EMは、外部トリガ·モードで別のコンピュータにマイクロ·マネージャー·ソフトウェアを介して制御されていました。外部トリガは、Metamorphのconfigure照明の設定で追加のシャッターとして実装された測定·コンピューティングのDACボードのデジタル出力を使用してクワント-EMカメラに提供されていました。チューブレンズの焦点距離の比は、有効画素サイズの比率と一致しています。代表的なアラインメントを図5に示します。
開示事項
これらの実験で使用されているすべての動物は特定病原体フリーの環境で維持され、実験は、健康動物のケアおよび使用委員会の国民の協会によって承認されました。
謝辞
本研究では、アレルギー感染症研究所、国立衛生研究所の学内研究部門によってサポートされていました。我々は、これらの研究で使用されているH57のscFvをご提供するためのヨハネスHuppa、マーク·デイビスに感謝しています。 RVは、この手法の開発中に有用な議論のためのキア·ノイマンに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| マウスT細胞のAmaxaのNucleofectorキット | ロンザ社 | VPA-1006 | |
| PureLink HiPureプラスミドミディプレップキット | ライフテクノロジーズ | K2100-05 | エンドトキシンフリーのDNAプレップ用 |
| AmaxaのNucleofectorデバイス | ロンザ社 | AAD-1001 | |
| 組換えマウスIL-2 | ぺプロテック株式会社 | 212から12 | |
| Fluoresbrite Multifluorescentミクロスフェア0.20μm | ポリサイエン株式会社 | 24050から5 | |
| ラボ·テックII 8ウェルチャンバーカバーガラス | サーモフィッシャーサイエンティフィック、ヌンク | 155409 |
参考文献
- Call, M. E., Wucherpfennig, K. W. The T cell receptor: critical role of the membrane environment in receptor assembly and function. Annu. Rev. Immunol. 23, 101-125 (2005).
- Smith-Garvin, J. E., Koretzky, G. A., Jordan, M. S.T cell activation. Annu. Rev. Immunol. 27, 591-619 (2009).
- Bezbradica, J. S., Medzhitov, R. Integration of cytokine and heterologous receptor signaling pathways. Nat. Immunol. 10, 333-339 (2009).
- Fraser, I. D., Germain, R. N. Navigating the network: signaling cross-talk in hematopoietic cells. Nat. Immunol. 10, 327-331 (2009).
- Dustin, M. L., Starr, T., Varma, R., Thomas, V. K. Supported planar bilayers for study of the immunological synapse. Curr. Protoc. Immunol. Chapter 18, 13-13 (2007).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. (19), e947-e947 (2008).
- Varma, R., Campi, G., Yokosuka, T., Saito, T., Dustin, M. L. T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster. Immunity. 25, 117-127 (2006).
- Yokosuka, T. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat. Immunol. 6, 1253-1262 (2005).
- Huppa, J. B. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463, 963-967 (2010).
- Tolar, P., Pierce, S. K. A conformation-induced oligomerization model for B cell receptor microclustering and signaling. Curr. Top. Microbiol. Immunol. 340, 155-169 (2010).
- Treanor, B. The membrane skeleton controls diffusion dynamics and signaling through the B cell receptor. Immunity. 32, 187-199 (2010).
- Treanor, B., Batista, F. D. Mechanistic insight into lymphocyte activation through quantitative imaging and theoretical modelling. Curr. Opin. Immunol. 19, 476-483 (2007).
- Sylvain, N. R., Nguyen, K., Bunnell, S. C. Vav1-mediated scaffolding interactions stabilize SLP-76 microclusters and contribute to antigen-dependent T cell responses. Sci. Signal. 4, ra14-ra14 (2011).
- Purbhoo, M. A. Dynamics of subsynaptic vesicles and surface microclusters at the immunological synapse. Sci. Signal. 3, ra36-ra36 (2010).
- Lasserre, R. Ezrin tunes T-cell activation by controlling Dlg1 and microtubule positioning at the immunological synapse. EMBO. J. 29, 2301-2314 (2010).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat. Rev. Immunol. 11, 21-33 (2011).
- Axelrod, D. Chapter 7: Total internal reflection fluorescence microscopy. Methods Cell. Biol. 89, 169-221 (2008).
- Williamson, D. J. Pre-existing clusters of the adaptor Lat do not participate in early T cell signaling events. Nat. Immunol. 12, 655-662 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved