Method Article
Ein TIRF Mikroskopie-Technik für Echtzeit-, Einzigartige Bilder aus dem TCR und der damit verbundenen Signalproteine
In diesem Artikel
Zusammenfassung
Die Aufspaltung der Proteine entweder innerhalb der Plasmamembran oder in intrazellulären Orten eines Regulierungsmechanismus, stark beeinflussen können Signalisierung Ergebnisse, daher zu verstehen Signalisierung ist es wichtig, die räumliche und zeitliche Verhalten der beteiligten Proteine zu untersuchen. Wir beschreiben hier eine TIRF-Mikroskopie basierendes System zur Signaltransduktion in T-Zellen zu studieren, aber ist breit anwendbar.
Zusammenfassung
Diese Signalisierung wird durch den T-Zell-Rezeptor (TCR) ausgelöst wird, wenn es durch antigene Peptidfragmente von Haupthistokompatibilitätskomplex (pMHC) Proteine auf der Oberfläche von Antigen präsentierenden Zellen (APC) gebunden zu eingreift. Der TCR-Komplex der Ligandenbindung TCRαβ Heterodimer besteht, das nicht-kovalent assoziierten mit CD3-Dimere (die εδ und εγ Heterodimere und die ζζ Homodimer) 1. Beim Eingriff des Rezeptors, werden die CD3 ζ-Ketten der Src-Familie-Kinase phosphoryliert, Lck. Dies führt zur Rekrutierung der Syk-Familie-Kinase, ZAP70, der dann phosphoryliert wird und durch Lck aktiviert. Danach phosphoryliert ZAP70 den Adapter Proteine LAT und SLP76, initiiert die Bildung des proximalen Signalkomplex, die eine große Anzahl verschiedener Signalmoleküle 2.
Die Bildung dieses Komplexes führt schließlich zu Kalzium-und Ras-abhängige transcription Faktor Aktivierung und die daraus folgende Einleitung einer komplexen Reihe von Genexpression, die Anlass zu T-Zell-Differenzierung 2. TCR-Signale (und die daraus resultierende Zustand der Differenzierung) moduliert werden von vielen anderen Faktoren ab, einschließlich Antigen Potenz und Übersprechen mit co-stimulatory/co-inhibitory, Chemokin-und Zytokin-Rezeptoren 3-4. Die Untersuchung der räumlichen und zeitlichen Organisation des proximalen Signalkomplex unter verschiedenen Bedingungen Stimulation ist somit Schlüssel zum Verständnis der TCR-Signalwegs sowie deren Regulation durch andere Signalwege.
Ein sehr nützliches Modell zu untersuchenden System Signalisierung von der TCR an der Plasmamembran in T-Zellen initiiert ist Glas-Lipiddoppelschichten, wie zuvor beschrieben 5-6. Sie können verwendet werden, um antigene pMHC Komplexen, Adhäsion und co-stimulatorische Moleküle an T-Zellen-APC, die als künstliche präsentieren. Durch die Abbildung die T-Zellen der Interaktion mit demLipid-Doppelschicht mit innerer Totalreflexion (TIRFM), können wir die Erregung zu beschränken innerhalb von 100 nm von dem Raum zwischen dem Glas und der Zelloberfläche 7-8. Dies erlaubt uns, in erster Linie die Bild Signalisierung Ereignisse an der Plasmamembran. Wie wir in der Abbildung der Einstellung von Signalproteinen an den TCR-Komplex interessiert sind, beschreiben wir ein Zwei-Kamera-TIRF Abbildungssystem, wobei das TCR, mit fluoreszierenden markierten Fab (Fragment antigen-binding) Fragmente des H57-Antikörper (aufgereinigt aus Hybridom H57-597 , ATCC, ATCC Nummer: kann HB-218), die spezifisch für TCRβ ist, und Signalproteine, markiert mit GFP, gleichzeitig und in Echtzeit abgebildet werden. Diese Strategie ist notwendig aufgrund der hohen Dynamik sowohl der T-Zellen und der Signalwege, die an der TCR auftreten werden. Diese bildgebenden Verfahren hat die Forscher einzelne Bild 9-11 Liganden sowie Rekrutierung von Signalmolekülen an aktivierten Rezeptoren und erlaubtist ein ausgezeichnetes System für Biochemie in-situ 12-16 studieren.
Protokoll
Versuchsdurchführung:
1. Transfektion unter Verwendung Amaxa Maus T-Zell-Nucleofector Kit
Wir beschreiben hier die Transfektion von entweder naiv oder In-vitro-aktivierte primäre T-Zellen mit Plasmiden Ausdruck Signalmoleküle durch GFP markiert, mit dem Maus-T-Zell-Amaxa Nucleofector Kit. In-vitro-Aktivierung von T-Zellen unter Verwendung von Peptid-beladenen Milz-APCs erfolgt wie vor 7 beschrieben. Alle T-Zellen in unseren Studien verwendet ausdrücken und TCR, die MCC-Peptid (88-103), gebunden an den MHC-Molekül IE k erkennt. Die Transfektion wird im wesentlichen nach den Empfehlungen des Herstellers durchgeführt, jedoch stellen wir einige Hinweise, die die Lebensfähigkeit der T-Zellen nach Transfektion zu präsentieren. Sowohl Lebensfähigkeit und Transfektionseffizienz ist viel höher in der In-vitro-aktivierten T-Zellen als in naiven Zellen.
- Bevor Sie beginnen, bereiten 2 ml ergänzt T-Zell-Medium durch Zugabe von 20 ulbeide Medium Komponenten A und B und 100 ul fötales Rinderserum (5%) für jede Transfektion durchgeführt werden. I. Das Medium in einer 12-Well-Platte in einem befeuchteten 37 ° C, 5% CO 2-Inkubator für mindestens eine Stunde. Alternativ Aliquots Medium mit 5% Serum und Komponente A, hergestellt werden und gefroren gelagert ergänzt. Wenn dies der Fall ist, Auftauen der gewünschten Anzahl an Aliquots, Komponente B, und führen die Äquilibrierung.
- Vor Einstellung des Gleichgewichts des Mediums ist sehr wichtig, wie Zelltod von der Resuspension von Zellen nach Transfektion in Medium, das entweder kalt ist oder einen pH-Wert anderen als 7,2 führt.
- Als nächstes bereiten die Transfektionsansatz. Kombinieren Sie 82 ul der Maus T-Zell-Nucleofector Lösung mit 18 uL Beiblatt 2 und 5μg von Plasmid-DNA (Konzentration nicht kleiner als 0,5 ug / ul). Gründlich mischen, indem Sie auf das Rohr oder mit der Verwendung von Mikro-Pipette.
-Es ist wichtig, um eine Titration von Plasmid Dosis für eine bestimmte Anzahl von Zellen für jedes Konstrukt für die Transfektion verwendet werden durchzuführen. Bei einigen größeren Konstrukten kann mehr DNA benötigt werden. DNA sollte frei von Endotoxinen.
- Übertragen von 5 bis 10.000.000 Zellen in ein 15 ml-Zentrifugenröhrchen. Zentrifuge bei 600 UpM für 5 Minuten bei Raumtemperatur. Entfernen Sie so viel wie möglich der Überstand mit einer Vakuum-Saugvorrichtung.
- Die Hersteller empfehlen das Drehen der Zellen mit weniger als 90x g; in unserem Fall entspricht diese Geschwindigkeit zu 75x g. Die gewählte relative Zentrifugalbeschleunigung (RCF), um ein Zellpellet ist vielleicht die entscheidende Variable, wie Zentrifugation bei niedriger RCF schließt Schäden an der Zellmembran.
- Resuspendieren Sie das Zellpellet im Transfektionsgemisch durch Pipettieren vorsichtig und langsam das Zellpellet bis es keine großen Klumpen von Zellen mehr vorhanden sind. Dies kann in der Regel durch Absaugen vollständig den Zellen t erreicht werdenurch die Pipettenspitze nicht mehr als 3-4 mal.
- Mit Hilfe einer Pipette vorsichtig die Suspension in einem zertifizierten Amaxa Küvette, so dass sich keine Luftblasen vorhanden. Verschließen Sie die Küvette.
- Wählen Nucleofector Programm X-001 auf dem Nucleofector Gerät. Setzen Sie die Küvette in den Küvettenhalter Nucleofector und wenden Sie das ausgewählte Programm.
- Nach der Elektroporation der Zellen, ist es am besten sofort übergeben sie an die voräquilibriert Kulturmedium. Die Hersteller empfehlen, dass die Zellen in der Nucleofector Medium nicht länger als 15 Minuten gehalten werden.
- Bringen Sie die Küvette und die voräquilibriert, voll ergänzt Kulturmedium auf der Motorhaube. Mit Hilfe der mitgelieferten Kunststoff-Pipette je ca. 500 ul des Mediums in die Küvette und übertragen Sie die Zellsuspension auf das Medium in der Platte Tropfen für Tropfen.
- Inkubieren der Zellen bei 37 ° C für 4 Stunden vor der Bildgebung. Naive Zellen sind INCUBATED bei 30 ° C statt 37 ° C Dies hilft bei der Erhaltung ihrer Reaktivität auf Antigen.
- Drei bis vier Stunden der Inkubation sind in der Regel ausreichend für T-Zellen nachweisbar exprimieren das GFP-markierten Proteine. Wir entschieden uns, Bildzellen zu diesem Zeitpunkt, da die Höhe der Expression ist gering und Artefakte der Überexpression sollte minimiert werden. Wenn Überexpression eines bestimmten Proteins gewünscht ist, sollte jedoch T-Zellen aus dem Medium Amaxa nach 4 Stunden entfernt werden. Dies wird durch wieder Pelletpresse die Zellen bei niedrigen RCF und Resuspendieren in voräquilibriert T-Zell-Kultur-Medium mit 50 U / ml Interleukin 2 (IL-2) bei einer Dichte von 2 Millionen Zellen / ml ergänzt erreicht.
2. TIRF-Mikroskopie
Beschreibung des TIRF-Mikroskop:
- Allgemeine Konfiguration: Optische Komponenten wurden rund einem Olympus IX71 Fluoreszenzmikroskop, das ursprünglich mit einer Olympus TIRF-Modul ausgestattet wurde gebaut. Wir haben schnell discovered chromatische Effekte in diesem Modul, wenn ein einzelner Ausrichtungszustand nicht erreicht zusammenfällt Kollimation Laserlinien unterschiedlicher Wellenlängen. Dieses Modul würde daher nicht für die gleichzeitige TIRF Bildgebung mit verschiedenen Anregungswellenlängen erlauben, und wir brachen auf, um eine benutzerdefinierte TIRF Apparat, chromatische Effekte minimiert im System, wie wir besprechen im Detail in den folgenden Abschnitten zu bauen. Das hier beschriebene Verfahren für die 150-facher Vergrößerung wurde entwickelt, funktioniert 1,45 numerischen Apertur (NA) TIRFM Ziel (Olympus), aber ebenso gut für das 60-fache Vergrößerung, 1,45 NA-Versionen. Für Weitfeldbeleuchtung ist das Mikroskop eine Metallhalogenid Lambda-XL Lichtquelle und einem Anregungsfilter Rad (Sutter Instruments) mit Anregungsfilter eingebaut ist. Für die automatische Positionierung der Probe Stufe mit Bezug auf das Ziel, wird das Mikroskop mit einem motorisierten XY-Übersetzung, piezogesteuerten Z-Stufe (ASI) ausgestattet. Bilder erfasst werden unter Verwendung von zwei identischen QuAntem Elektron Multiplizieren (EM) CCD-Kameras (LVK). Die Pixelgröße von diesen Kameras passt sehr gut mit der Vergrößerung durch die 150 X TIRF Ziel angeboten, was eine endgültige Auflösung von 0,1 mu m pro Pixel. Die EMCCD-Kameras bieten auch die Empfindlichkeit gegenüber GFP-Transfektanten mit niedrigen Expressionsniveau zu visualisieren.
- Laser: für TIRF Beleuchtung, ein System von 5 Laser mit einer Gesamtleistung von 6 Laserlinien (405, 440, 488, 514, 561 und 640 nm) in eine Single-Mode-Faser (Solamere Technologies) gekoppelt ist. Die Argon-Laser und 561 nm-Dioden-gepumpten Festkörperlaser (DPSS) Laser (Linien 488, 514 und 561) durch einen akusto-optischen Faser (AOTF) zum Intensitätsregelung geleitet werden, während die Intensität der Diodenlaser (405, 440 und 640 nm) durch Modulieren der Spannung der Stromversorgung gesteuert. Die Spannung auf der AOTF und den Netzteilen der Diodenlaser wird über eine Messkarte (DAC) Board (Measurement Computing) mit MetaMorph Software (Molekulare gesteuertlar Devices). Die Kopplungseffizienz für Diodenlaser ist 30%, während jene der Argon und DPSS-Lasern ca. 60% aufgrund ihres geringeren Strahldurchmesser sind.
- TIRF-Modul: Um gleichzeitig das Bild TCR und die damit verbundenen Signalmoleküle, wie oben beschrieben, war es unerlässlich, TIRF-Beleuchtung, die chromatisch korrigiert wurde und das wäre nicht erforderlich, Neuausrichtung oder Neuausrichtung beim Erwerb von Fluoreszenz-Emissionen verschiedener Wellenlängen haben. TIRFM wurde unter Verwendung von durch-die-Ziel Beleuchtung, wie vor 17 beschrieben. Das faseroptische Kabel, die Laserlicht liefert nach dem Mikroskop wurde zu einer Faser mit einem XY-Start Faserhalter auf einem Mikrometer angetriebenen optischen Bahn für Z-Verstellung (Thorlabs) montiert ausgestattet befestigt. Um TIRF-Beleuchtung zu erreichen, wird der Laserstrahl an der hinteren Brennebene des Objektivs konzentriert unter Verwendung eines Systems aus zwei Linsen (L1 (Kollimationslinse) und L2 (Fokussierlinse) in 1), so dass die beam taucht aus dem Ziel gebündelt. Dies gewährleistet, dass alle Lichtstrahlen, die aus dem Ziel wird den gleichen Winkel mit Bezug auf die Probe Ebene haben. Die Spitze der optischen Faser wird im Brennpunkt der Kollimatorlinse angeordnet ist. Durch Bewegen des Mikrometer entlang der optischen Bahn in Bezug auf die Kollimatorlinse (Z-Richtung) ist es möglich, den Fokus des Strahls einzustellen und zu bewegen den Strahl in X und Y-Position unter Verwendung der XY Einstellknöpfe. Aufgrund der sehr kleinen hinteren Öffnung des Ziels 150 X, fanden wir, dass die TIRF, die Größe des Laserpunkts an der hinteren Brennebene benötigt wird, um klein zu erreichen. Um den Fokus notwendig, den kleinen Ort produzieren zu erreichen, wurden Linsen von kurzer Brennweite erforderlich (Keir Neumann, persönliche Mitteilung), daher verwendeten wir eine fokussierende Linse mit einer Brennweite von ca. 108 mm, die in den dichroitischen Würfel platziert wurde unmittelbar vor das Ziel. Die Kollimationslinse näher an den Strahlteiler, der in der TI gebracht platziertHF-Beleuchtung. Um unerwünschte Effekte zu minimieren chromatische verwendeten wir achromatischen Dublett (chromatisch korrigiert Linse durch Verschmelzen von zwei Linsen aus Werkstoffen unterschiedlicher Brechungsindizes made) mit Antireflexschichten sowohl für die kollimierende und fokussierende Linsen (JML Optical). Der Fokus kann durch Überprüfen, dass der Strahl ist, ergibt sich das Ziel kollimiert, wenn sie in der Mitte der Rückapertur positioniert und sollte einen festen Punkt auf der Decke des Raumes bilden verifiziert werden. Die Position des fokussierten Punkt wird dann auf den Rand der Öffnung (in Y-Richtung), die der Strahl auf der Bildebene bei großen Winkeln konvergieren bewirkt bewegt wird, und schließlich der kritische Winkel für Totalreflexion erreicht wird. Mit Hilfe dieser optischen Komponenten erzielten wir simultanen Kollimation für alle Wellenlängen von 442 bis 640 nm bei gleicher Ausrichtung. Eine einzige optische Ausrichtung, daher konnten wir TIRFM gleichzeitig auszuführen über mehrere Wellenlängen.
- Dual-Kamera ApparATUS: Gleichzeitige Erfassung der verschiedenen Fluoreszenzemission aus zwei unterschiedlichen Fluorophoren wurde, indem ein Dual Kamera-System, die die Emission teilt sich in zwei Wellenlängenbereichen durch die Verwendung von dichroitischen Spiegeln (2) erreicht. Emittierte Licht wird von dem Ziel aus der rechten Seite des Mikroskops reflektiert. Da die meisten Ziele sind unendlich korrigiert (mit Bildern im Unendlichen gebildet), eine Tubuslinse erforderlich ist, um das Bild zu fokussieren. Um zwei Emissionswellenlängen gleichzeitig zu bearbeiten, wurde das Röhrchen Linse auf der rechten Seite Port entfernt. Eine angepasste Adapter mit C-Mount-Gewinde (Sutter Instruments) befestigt war und in Verbindung mit einem dichroitischen Spiegel Halter (Edmund Optics). Dichroitische Spiegel, die das GFP-Emission getrennt von der organischen Farbstoffe verwendet, um den TCR (Alexa546, Alexa647, etc.) beschriften wurden in dieser Halterung installiert. Dieses Modul wurde in beiden Lichtwege durch ein Rohr Linsenhalter, einer Emission Filterhalter und Verlängerungsrohre gefolgt. DieTubuslinsen (TL1 und TL2 (2)) eine Brennweite von 180 mm. Lücken in den Verlängerungsrohre, die zu den EM CCD-Kameras wurden mit schwarzem Papier abgedeckt, um die Kameras von Streulicht abzuschirmen. Um für die Ausrichtung der beiden Kanäle ermöglichen, wurden die Kameras auf zwei individuelle XYZ-Ständer (Holmarc Produkte) angebracht ist.
Nachfolgend beschreiben wir, wie das Mikroskop für die Zwei-Kanal gleichzeitige Abbildung ausrichten. Die Schritte erforderlich sind Ausrichten des TIRF-Beleuchtung, Einstellen der Laserleistung und das Ausrichten der zwei Ausgabebilder mit unter der Auflösung Mikrokügelchen.
- Vor dem Start werden alle Komponenten des Mikroskops eingeschaltet. Der Computer und Software gestartet, und es wird sichergestellt, dass alle Hardware-Komponenten von der Software erkannt werden.
- Für den Einsatz als Co-Lokalisation Standard, verdünnter 1 ul Sub-Auflösung (0,2 um) Fluoresbrite Multi-fluoreszierende Mikrosphären in 2 mL PBS und fügen 0,25 ml der MikrosphäreSuspension, um jede Vertiefung einer Lab-Tek II 8-Well-Kammer-System Deckglas (Nunc). Legen Sie die Chamber Slide System auf die Plattform über dem Ziel. Perlen, die auf das Glas adsorbiert sind, werden dann in den Mittelpunkt gerückt.
- Den Y Ausrichtung der XYZ Fasereinkoppelsystemen, wird die Position des Laserstrahls auf die Mitte der Rückapertur des Objektivs verschoben. Es ist wichtig, dies zu tun, wenn das Ziel in der Position, wo die Glasscheibe im Fokus ist. Wenn der Strahl nicht kollimiert wird, wird die Z-Mikrometer, eingestellt auf volle Kollimation zu erreichen. Kollimation wird individuell für alle Laserlinien in dem Experiment verwendet werden getestet. In diesem Stadium wird die Laserleistung für jede Zeile unter Verwendung eines Lasers Leistungsmesser und wird auf 20-30 mW in jedem Kanal eingestellt.
-T-Zellen sind sehr empfindlich gegen Laserstrahlung, und die Beleuchtung auf insgesamt 50 mW beschränkt.
- Bilder der Kügelchen werden unter Verwendung TIRF illuminatIon im Live-Modus. Drehen des Y-Ausrichtung Mikrometer auf der Faser Start so dass der Strahl weg von der Decke bis zum Winkel in Bezug auf das Ziel der optischen Achse Ansätze 90 Grad beginnt. Schließlich, wenn der kritische Winkel für TIR erreicht ist, wird das Laserlicht nicht mehr verlassen das Ziel. TIRF Ausrichtung wird dann durch die sich nach oben und unten durch die Ebene des Deckglases beurteilt. Wenn Kügelchen, die in Lösung schweben kann visualisiert werden, dann ist der Winkel des Strahls in Bezug auf den objektiven normale Bedarf weiter erhöht werden. Bei der richtigen Ausrichtung TIRF, wird nur einer optischen Ebene kurz gefasst sein (dh nur die Perlen, die auf das Deckglas adsorbiert werden). Eine feinere Test TIRF Ausrichtung kann implementiert werden, wenn T-Zellen angefärbt Bildgebung mit einer Oberfläche Farbstoff, der auf einer Oberfläche ausgebreitet haben werden. (Siehe Punkt 3.4).
- Nach TIRF-Beleuchtung erreicht worden ist, können die zwei Kanälen in Bezug zueinander ausgerichtet werden. Konzentrieren Sie sich auf die Perlen und vergleichen Sie die Position des identifiable Merkmale in den Bildern erzeugt in beiden Kanälen. Mit dem X und Y Mikrometerschrauben auf einem Stativ, bringen die relative Position der Perlen in so nah beieinander wie möglich. Speichern Sie die Bilder aus beiden Kanälen. Diese Bilder werden als Co-Lokalisation Standard verwendet werden, um die beiden Kanäle ausrichten.
- Die Kameras müssen auch so ausgerichtet sein, dass sie Abgleichlänge in Bezug auf eine andere sind. Dies wird durch Erfassen eines Satzes von Bildern der unter der Auflösung Perlen, die voneinander in der Z-Richtung um 100 nm getrennt erreicht. Wenn die maximale Intensität der Pixel für Granulats liegt in der gleichen Ebene für beide Kameras, dann sind sie Abgleichlänge.
3. Imaging
Sobald das Mikroskop eingerichtet ist, besteht die nächste Aufgabe zu fließen Kammern mit Glas unterstützten Lipiddoppelschichten Antigen präsentieren und Adhäsionsmoleküle wie zuvor 6 beschrieben und führen Sie dann TIRFM transfizierter T-Zellen interagieren mit der VorbereitungSubstrat. Die veröffentlichte Doppelschicht-Protokoll 5-6 wurde veröffentlicht als der Ausnahme, dass die Liposomen wurden für 20 Minuten auf dem Deckglas inkubiert, nachdem die Strömungskammer zusammengebaut gefolgt. Stattdessen wurde HBS-BSA-Puffer in der Flußzelle fließt sofort nach der Montage.
- Zusammenstellen eines Strömungskammer mit planaren Lipiddoppelschichten auf der Deckglas mit Ni-NTA-Lipiden. Adhäsionsmoleküle, sind ICAM-1 (100 Moleküle / um 2), Peptid-MHC-Komplexe, MCC geladenen bzw. k (5-10 Molekülen / um 2), in der Doppelschicht über ihre Histidin-Tags aufgenommen. Das kostimulatorische Molekül CD80 wird hinzugefügt mit einem GPI-Anker (100 Moleküle / mu m 2).
- Legen Sie die Messzelle auf der Bühne des Mikroskops und zu stabilisieren. Befestigen vom Hersteller gelieferte Heizelement auf der Durchflusszelle, um seine Temperatur zu steuern. Positionieren Sie das Ziel auf einer Doppelschicht und bringen das Flugzeug in Doppelschicht zu konzentrieren. Aktivieren Erwärmung des objektiven und des DurchflussesZelle, um die Temperatur der Kammer bei 37 ° C zu stabilisieren
- Transfizierte T-Zellen werden pelletiert nach 4 Stunden Inkubation bei einer Geschwindigkeit von 80x g und in HBS-BSA-Puffer resuspendiert und mit 10 ug / ml H57 Fab oder 20 ug / ml H57 single chain variable fragment (scFv), um beschriften Sie die TCR. Die Zellen werden dann in den Durchfluss-Zellen injiziert. Die Bebilderung wird, in ständiger Anwesenheit des Fab oder scFv aufgrund ihrer hohen Dissoziationskonstante durchgeführt. Ihre Präsenz im Medium nicht wesentlich erhöht den Hintergrund wie die TIRF-Feld ist sehr dünn.
- Die Aufnahmebedingungen sind so eingerichtet, dass Dual-Channel-Live-Akquisition zeigt eine Live-Vorschau der TCR-und GFP-Kanäle, die bei der Suche nach transfizierten Zellen hilft gesetzt. TIRF-Beleuchtung wird durch die Fokussierung auf das Glas Flugzeug ein seitliches Membranfärbung erkennen bestätigt. Wenn seitlichen Membranen nicht in den Blick kommen müssen dann die TIRF Ausrichtung ist gut. Die transfizierten Zellen werden dann einmal oder in einer Bildsequenz zu erzeugen vid abgebildetEOS.
4. Bildverarbeitung und Datenanalyse
Die Software gibt Bilder von den beiden Kameras in einem einzigen Frame. Der Ausgang jedes Kamera 512 x 512 Pixel, so daß nur das ausgegebene Bild 1024 x 512 Pixel in der Größe. Die Abbildungen müssen zunächst in einzelne Bilder entsprechend den zwei Kameras aufgeteilt werden. Die Abbildungen der unter der Auflösung Kügelchen aus den beiden Kanälen sind überlagert und Ausrichtung Parameter bestimmt. Ein Merkmal spezifisch für unser System ist ein 1-Grad-Drehung eines Kanals in Bezug auf das andere (siehe Abbildung 3). Die wahrscheinlichste Quelle dieser Rotation ist die Kamera steht. Nach dieser Drehung weitere relative lineare Transformationen in X und Y müssen durchgeführt werden, um perfekt ausrichten, die Perlen mit Bezug zueinander. Bilder von Kügelchen werden in jedem Experiment, um die genauen Parameter zu bestimmen, um die zwei Kanäle richten erhalten. Diese linearen und rotatorischen Transformationen werden dann an alle die angelegteBilder und dann unterliegen sie Segmentierungsalgorithmen und Co-Lokalisation Analyse.
5. Repräsentative Ergebnisse
Das hier beschriebene System kann ausgelegt ist, stromabwärts von Signalisierung jeden Rezeptor an der Plasmamembran zu untersuchen. Es ist besonders informativ in das Studium TCR-Signal, weil Signalisierung erfolgt in optisch aufgelöst Cluster genannt TCR Mikrocluster oder in Endosomen als kürzlich 18 beschrieben. Wenn Signalisierung in Sub-Cluster Auflösung von Rezeptoren oder in un-Cluster-Rezeptoren aufgetreten zusätzliche Experimente müsste getan werden, um die Daten zu interpretieren sein. Wie bereits erwähnt, unterliegen die CD3-Ketten des TCR-Komplexes Phosphorylierung von Lck-Kinase der Src-Familie bei einem Eingriff des TCR durch Peptid-MHC-Komplexe. Das phosphorylierte CD3ζ Kette dann rekrutiert die Syk-Kinase-Familie ZAP70. Visualisierung der Rekrutierung von Zap70 so berichtet über die Phosphorylierung von CD3ζ Kette. Die Stärke der TCR-Stimulation kann durch Verwendung von Peptiden an den TCR Kontakt Resten mutiert geändert werden. Solche Peptide werden als Peptid verändert Liganden (APL). Ein repräsentatives Experiment ist in Abbildung 4, wo die Agonist Peptide robust rekrutiert ZAP70 zu TCR Mikrocluster während der untere Potenz Peptid T102L nicht ZAP70 zu TCR Mikrocluster rekrutieren, die belegen, dass die Kette nicht CD3ζ wird in diesem Fall phosphoryliert gezeigt. Wir könnten diesen Schluss zu ziehen, weil wir gerade beobachten, die Rekrutierung von ZAP70 zu TCR-Cluster, die leicht von TIRFM nachgewiesen hatte. Eine automatische Segmentierung Algorithmus verwendet, um die Anzahl der ZAP70 Mikrokügelchen pro Zelle zu zählen. Auch in der ergänzenden Film gezeigt, ist die gleichzeitige Darstellung von TCR und ZAP70 assoziierten Fluoreszenz. Beachten Sie die dynamische Natur der lamelipodium.
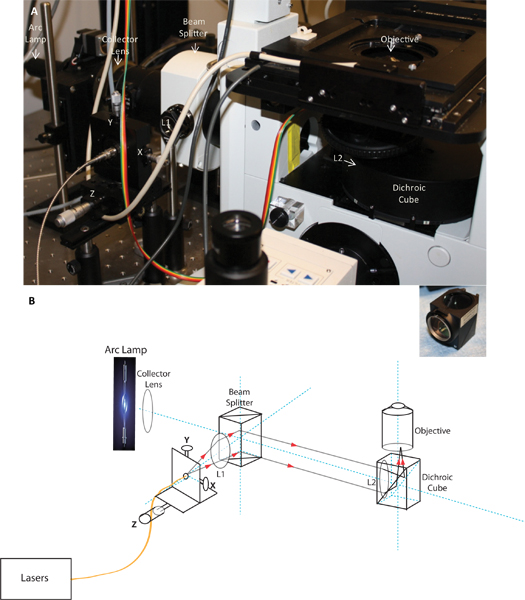
Abbildung 1. Bild und schematische Darstellung des benutzerdefinierten TIRF Start. Abbildung A zeigt das Foto des TIRF-Start als am Mikroskop installiert, und Tafel B ist eine schematische Darstellung des TIRF Markteinführung zeigt den Lichtweg. Der Schaltplan und Bild, das die Position der Sammellinse, wobei der Strahlteiler, der Fasereinkoppelsystemen mit X, Y und Z Einstellungen, die Kollimationslinse L1 und L2 der Fokussierlinse in dem dichroitischen Würfel und TIRF Ziel installiert. Der Einschub zeigt die fokussierende Linse in dem dichroitischen Würfel installiert.
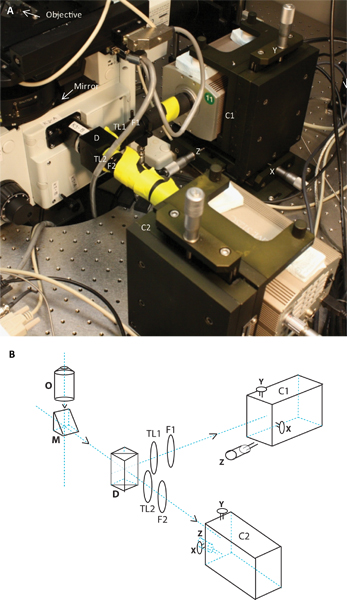
Abbildung 2. Das Bild und schematische Darstellung der beiden Kamera-System. Tafel A zeigt das Foto der beiden Kamerasystem nach dem Mikroskop befestigt ist, und Tafel B ist eine schematische Darstellung derselben. Das schematische Bild und zeigen die Position des Ziels, Spiegel, dichroitische, Tubuslinsen TL1 und TL2-, Emissions-Filter F1 und F2, die beiden Kameras C1 und C2 auf tErben steht mit ihren jeweiligen X-, Y und Z Einstellungen.
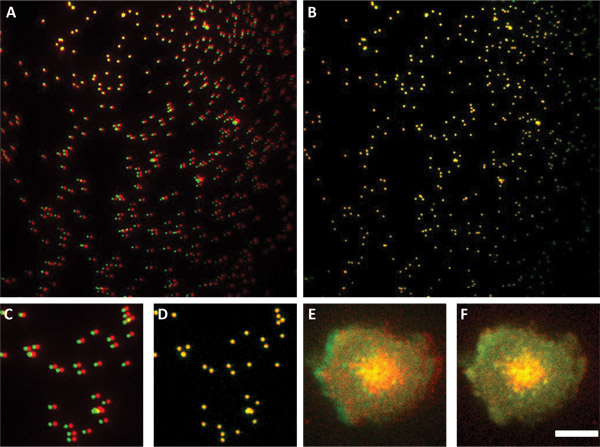
Abbildung 3. Von Sub-Auflösung Perlen verwenden, um die beiden Kanäle ausrichten. Felder A und B zeigen Überlagerungen von Sub-Auflösung Perlen vor (Panel A) und nach (Feld B) Ausrichtung. Abbildung A zeigt, dass einer der Kanäle gedreht wird in Bezug auf die andere ist. Felder C und D sind ein Unterbereich der Bilder in A und B Tafel E zeigt eine Zwei-Kanal-Overlay-Bild von Zellen ohne Verarbeitung. Alignment-Parameter im Panel D verwendet wurden, um das Bild in Panel F. Beachten Sie, wie die lamelipodium aus den beiden Kanälen ist perfekt in F-Panel und Panel nicht in E. Maßstabsbalken 4 um für all die Platten ausgerichtet gezeigt angewendet.
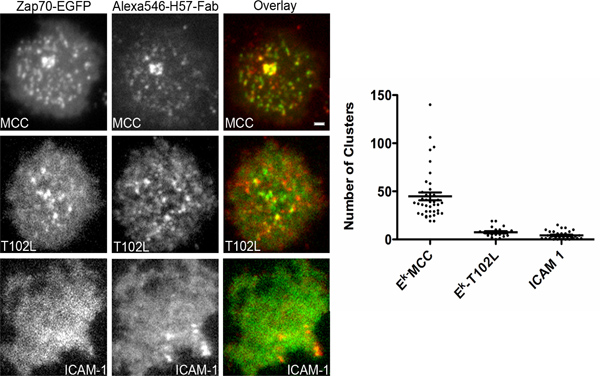
4. ZAP70 Einstellung auf die TCR-Mikrokügelchen in Reaktion auf unterschiedliche APL. In-vitro-aktivierten T UND Zellen wurden mit einem Plasmid ZAP70 von GFP transfiziert und wurden auf Glas-unterstützten Ni-NTA-Doppelschichten mit 6 Molekülen / um 2 von Peptid inkubiert geladen His-Tag-IE k, 100 Moleküle / um 2 von Alexa647 konjugierten His-Tag-ICAM- 1 und 100 Moleküle / &mgr; m 2 von GPI-verankerten CD80. Die Peptide geladen werden in der Einfügung dargestellt. ICAM-1 bezieht sich auf Zellen, die 100 Doppelschichten Moleküle / um 2 von Alexa-647 konjugierten His-Tag-ICAM-1. Dual-Channel gleichzeitige Erfassung TIRF-Mikroskopie wurde in der kontinuierlichen Präsenz von Alexa546 konjugierte H57 Fab-Fragment (non-blocking), um den TCR Fleck durchgeführt. Die Zellen wurden bis zu einer Stunde nach dem ersten Kontakt mit der Doppelschicht abgebildet. Die Zahl der ZAP70 Cluster pro Zelle wurden mit Hilfe eines automatisierten Cluster Counting Software. Mindestens 40-Zellen wurden in jeweils analysiert. Maßstab 2 um für alle Bilder.
92/3892fig5.jpg "/>
Bild 5. Ausrichtung der beiden Kamerasystem mit zwei verschiedenen Arten von Kameras. Diese Tafel zeigt die ausgerichtet Überlagerung von Sub-Auflösung Perlen abgebildet mit den beiden Kamera-System, wo die beiden Kameras haben verschiedene Pixelgrößen (Grün: 6,45 mu m Pixelgröße bei 2x2 Binning und Red abgebildet: 16 um Pixelgröße ohne Binning abgebildet). Einschub zeigt die vergrößerte Ansicht des viereckigen Kasten in der Mitte des Feldes. Maßstabsbalken 5 um.
Ergänzende Movie. ZAP70 Anwerbung für den TCR Mikrocluster als Reaktion auf Agonisten Peptid. In-vitro-aktivierten T-Zellen und wurden mit einem Plasmid ZAP70 von GFP transfiziert und wurden auf Glas-unterstützten Ni-NTA-Doppelschichten mit 6 Molekülen / um 2 von Peptid inkubiert geladen His-Tag-IE k, 100 Moleküle / um 2 von Alexa647 konjugierten ICAM-1 und 100 Moleküle / &mgr; m 2 von GPI-verankerten CD80 mit His-Tag. Dual-Kanal simultan einÜ bernahme TIRF-Mikroskopie wurde in der kontinuierlichen Präsenz von Alexa546 konjugierte H57 Fab-Fragment (non-blocking), um den TCR Fleck durchgeführt. Ein Feld von transfizierten Zellen wurde 40 Mal wiederholt mit einer zeitlichen Auflösung von 10 Sekunden pro Frame abgebildet werden. Maßstab 2 um. Klicken Sie hier um ergänzende Film anzusehen .
Diskussion
Wir beschreiben hier ein System zu studieren Signalisierung in Antigen-spezifischen T-Zellen, primäre Maustaste mit TIRFM und Glas unterstützten Lipiddoppelschichten als künstliche APCs. Die Technik beruht auf erfolgreich exprimieren GFP-markierten Proteine in diesen Zellen. Transfektion von T-Zellen ist immer eine anspruchsvolle Aufgabe. Typischerweise werden Elektroporation oder Gentransfer mit Retroviren oder Lentiviren verwendet. Eine Technik ist nicht überlegen über das andere, beide haben ihre Grenzen und Vorteile. Wir finden, dass die Elektroporation hat folgende Vorteile: 1) Es ist nicht erforderlich, dass die Zellen aktiv werden Unterteilen wie Retroviren, aber nicht Lentiviren erforderlich ist, und 2) Die Expression kann durch Variieren der Zeit wurden die Zellen vor der Bebilderung inkubiert werden, gesteuert werden. Der größte Nachteil ist, dass wir es sehr schwierig, Proteine, die große Abmessungen in primären Zellen auszudrücken. Wir haben eine Methode, die uns sehr gut die Lebensfähigkeit der Zellen nach der Elektroporation vorgestellt. Als ein Ergebnis ist es geltenden Gesundheitsschutzmaßnahmenle zu benutzen, um siRNA-vermittelten Gen-Silencing zu erreichen.
Wir beschreiben hier eine maßgeschneiderte Zwei-Kanal gleichzeitige Erfassung TIRF Mikroskop, das chromatisch korrigiert wird, und erfordert keine separate Ausrichtung für verschiedene Wellenlängen. Diese Funktionen, jedoch sind im Handel erhältlich. Unser System basiert auf den Prinzipien der TIRF-Mikroskopie veröffentlicht von Experten auf diesem Gebiet und ist billiger als kommerzielle Alternativen basieren. Eine mögliche Kritik an unserem Design ist, dass wir mit dem gleichen Einfallswinkel für die verschiedenen Anregungswellenlängen. Dies würde in einer anderen TIRF Eindringtiefe für verschiedene Anregungswellenlängen führen. Wir glauben, dass diese Effekte gering sind, da die evaneszente Welle ist eine exponentiell abklingende Feld und die Tiefe der TIRF Feld ist eine lineare Funktion der Wellenlänge. Fluorophore nahe der Glasoberfläche erleben keinen Unterschied in der Intensitäten zwischen den beiden Wellenlängen. Für Fluorophore in der Nähe des PEnetration Tiefe wird die Intensitätsunterscheidung 1,3-fachen für die beiden Wellenlängen 488 und 640 nm und 1,15-fachen für die beiden Wellenlängen 488 und 561 nm sein. Das gleiche System kann in Verbindung mit Super-Resolution-Techniken, die Verwendung von TIRF-Beleuchtung machen eingesetzt werden.
Wir haben auch ein zwei Kamera-System, das speziell angefertigten ist beschrieben. Wie die TIRF-System, sind ähnliche Apparate auch kommerziell erhältlich. Unser System bietet Flexibilität, um die Filter und dichroics zu ändern, was ihre Anwendung bei verschiedenen Kombinationen von Wellenlängen. Der Nachteil des eigenen Systems ist der Grad der Drehung um die beiden Bilder auszurichten. Dieses Problem kann durch die Verwendung Kamera steht, die Piezo angetrieben werden und bieten rotatorischen Ausrichtung gelöst werden. Wir haben auch erfolgreich ein Zwei-Kamera-System auf diesem Mikroskop durchgeführt, in dem die Kameras verschieden sind und unterschiedliche Punktgrößen. Ein solches System wäre nützlich, wenn man brauchte Empfindlichkeit in einen Kanal und einen großen dyDynamikbereich in einem anderen, sind die beide nur selten in der gleichen Kamera zur Verfügung. Wir nutzten die Photometrics HQ-2-Kamera bei 2x2 Binning gibt uns eine effektive Pixelgröße von 12,9 um mit dem Photometrics Quant-EM-Kamera, die eine Pixelgröße von 16 mu m aufweist. Ein 180 mm Brennweite Tubuslinse wurde für die Quant-EM eingesetzt und ein 145 mm Brennweite Tubuslinse wurde für die HQ-2-Kamera verwendet. Der HQ-2 wurde unter Verwendung Metamorph-Software und die Quant-EM wurde über Mikro-Manager-Software auf einem separaten Computer in externe Trigger-Modus gesteuert. Der externe Trigger wurde der Quant-EM-Kamera mit einem digitalen Ausgang des DAC Messung Computing Platine, die als zusätzliche Blende in der configure Beleuchtungseinstellungen Metamorph umgesetzt wurde bereitgestellt. Das Verhältnis der Brennweiten der Tubuslinsen entspricht dem Verhältnis der effektiven Pixelgrößen. Eine repräsentative Ausrichtung in 5 gezeigt.
Offenlegungen
Alle Tiere in diesen Experimenten verwendet wurden in einem spezifischen Pathogen-freien Umgebung gehalten, und die Experimente wurden von den National Institutes of Health Animal Care und Use Committee gebilligt.
Danksagungen
Diese Arbeit wurde von der Abteilung für Interne Forschung des National Institute for Allergy and Infectious Diseases, National Institutes of Health unterstützt. Wir danken Johannes Huppa und Mark Davis, der uns mit dem scFv von H57 in diesen Studien verwendet. RV möchte Keir Neumann für hilfreiche Diskussionen bedanken bei der Entwicklung dieser Technik.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Amaxa Nucleofector Kit für Maus-T-Zellen | Lonza Inc. | VPA-1006 | |
| PureLink HiPure Plasmid Midiprep Kit | Life Technologies | K2100-05 | Für Endotoxin freie DNA PREPS |
| Amaxa Nucleofector- | Lonza Inc. | AAD-1001 | |
| Rekombinantes Mäuse-IL-2 | Peprotech Inc. | 212-12 | |
| Fluoresbrite Multifluorescent Microspheres 0.20μm | Polysciences, Inc. | 24050-5 | |
| Lab-Tek II 8-Well-Kammer-Deckglas | Thermo Scientific, Nunc | 155409 |
Referenzen
- Call, M. E., Wucherpfennig, K. W. The T cell receptor: critical role of the membrane environment in receptor assembly and function. Annu. Rev. Immunol. 23, 101-125 (2005).
- Smith-Garvin, J. E., Koretzky, G. A., Jordan, M. S.T cell activation. Annu. Rev. Immunol. 27, 591-619 (2009).
- Bezbradica, J. S., Medzhitov, R. Integration of cytokine and heterologous receptor signaling pathways. Nat. Immunol. 10, 333-339 (2009).
- Fraser, I. D., Germain, R. N. Navigating the network: signaling cross-talk in hematopoietic cells. Nat. Immunol. 10, 327-331 (2009).
- Dustin, M. L., Starr, T., Varma, R., Thomas, V. K. Supported planar bilayers for study of the immunological synapse. Curr. Protoc. Immunol. Chapter 18, 13-13 (2007).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. (19), e947-e947 (2008).
- Varma, R., Campi, G., Yokosuka, T., Saito, T., Dustin, M. L. T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster. Immunity. 25, 117-127 (2006).
- Yokosuka, T. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat. Immunol. 6, 1253-1262 (2005).
- Huppa, J. B. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463, 963-967 (2010).
- Tolar, P., Pierce, S. K. A conformation-induced oligomerization model for B cell receptor microclustering and signaling. Curr. Top. Microbiol. Immunol. 340, 155-169 (2010).
- Treanor, B. The membrane skeleton controls diffusion dynamics and signaling through the B cell receptor. Immunity. 32, 187-199 (2010).
- Treanor, B., Batista, F. D. Mechanistic insight into lymphocyte activation through quantitative imaging and theoretical modelling. Curr. Opin. Immunol. 19, 476-483 (2007).
- Sylvain, N. R., Nguyen, K., Bunnell, S. C. Vav1-mediated scaffolding interactions stabilize SLP-76 microclusters and contribute to antigen-dependent T cell responses. Sci. Signal. 4, ra14-ra14 (2011).
- Purbhoo, M. A. Dynamics of subsynaptic vesicles and surface microclusters at the immunological synapse. Sci. Signal. 3, ra36-ra36 (2010).
- Lasserre, R. Ezrin tunes T-cell activation by controlling Dlg1 and microtubule positioning at the immunological synapse. EMBO. J. 29, 2301-2314 (2010).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat. Rev. Immunol. 11, 21-33 (2011).
- Axelrod, D. Chapter 7: Total internal reflection fluorescence microscopy. Methods Cell. Biol. 89, 169-221 (2008).
- Williamson, D. J. Pre-existing clusters of the adaptor Lat do not participate in early T cell signaling events. Nat. Immunol. 12, 655-662 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten