Method Article
Техника для TIRF микроскопии в реальном времени, одновременная съемка TCR и его ассоциированных сигнальных белков
В этой статье
Резюме
Фрагментации белков либо в мембране или в местах внутриклеточного является одним регулирующим механизмом, который может существенно влиять сигнализации результаты, поэтому, чтобы понять, сигнализация важно для изучения пространственных и временных поведение белков, участвующих. Мы описываем здесь TIRF микроскопии система для изучения передачи сигнала в Т-клетках, но широкого применения.
Аннотация
Signaling is initiated through the T Cell Receptor (TCR) when it is engaged by antigenic peptide fragments bound by Major Histocompatibility Complex (pMHC) proteins expressed on the surface of antigen presenting cells (APCs). The TCR complex is composed of the ligand binding TCRαβ heterodimer that associates non-covalently with CD3 dimers (the εδ and εγ heterodimers and the ζζ homodimer)1. Upon engagement of the receptor, the CD3 ζ chains are phosphorylated by the Src family kinase, Lck. This leads to the recruitment of the Syk family kinase, Zap70, which is then phosphorylated and activated by Lck. After that, Zap70 phosphorylates the adapter proteins LAT and SLP76, initiating the formation of the proximal signaling complex containing a large number of different signaling molecules2.
The formation of this complex eventually results in calcium and Ras-dependent transcription factor activation and the consequent initiation of a complex series of gene expression programs that give rise to T cell differentiation2. TCR signals (and the resulting state of differentiation) are modulated by many other factors, including antigen potency and crosstalk with co-stimulatory/co-inhibitory, chemokine, and cytokine receptors 3-4. Studying the spatial and temporal organization of the proximal signaling complex under various stimulation conditions is, therefore, key to understanding the TCR signaling pathway as well as its regulation by other signaling pathways.
One very useful model system to study signaling initiated by the TCR at the plasma membrane in T cells is glass-supported lipid bilayers, as described previously5-6. They can be utilized to present antigenic pMHC complexes, adhesion, and co-stimulatory molecules to T cells-serving as artificial APCs. By imaging the T cells interacting with the lipid bilayer using total internal reflection fluorescence microscopy (TIRFM), we can restrict the excitation to within 100 nm of the space between the glass and the cell surface 7-8. This allows us to image primarily the signaling events occurring at the plasma membrane. As we are interested in imaging the recruitment of signaling proteins to the TCR complex, we describe a two-camera TIRF imaging system wherein the TCR, labeled with fluorescent Fab (fragment antigen binding) fragments of the H57 antibody (purified from hybridoma H57-597, ATCC, ATCC Number:HB-218) which is specific for TCRβ, and signaling proteins, tagged with GFP, may be imaged simultaneously and in real time. This strategy is necessary due to the highly dynamic nature of both the T cells and of the signaling events that are occurring at the TCR. This imaging modality has allowed researchers to image single ligands 9-11 as well as recruitment of signaling molecules to activated receptors and is an excellent system to study biochemistry in-situ12-16.
протокол
Экспериментальные процедуры:
1. Трансфекция использованием Amaxa мыши Т-клеток Nucleofector Kit
Мы описываем здесь трансфекции либо наивным, либо в лабораторных условиях активировать Т-клетки первичной с выражением плазмиды кодирования сигнальных молекул, помеченных GFP, используя мышь Amaxa Т-клеток Nucleofector Kit. В лабораторных активации Т-клеток с помощью пептидных загруженных селезенки БТР осуществляется, как описано выше 7. Все Т-клетки, используемые в наших исследованиях выразить и TCR, которая признает MCC пептид (88-103), связанного с молекулой MHC IE к. Трансфекция осуществляется по существу в соответствии с рекомендациями производителя, однако, мы приводим несколько советов, которые способствуют жизнеспособности Т-клеток после трансфекции. И жизнеспособность и эффективность трансфекции значительно выше в в пробирке активированных Т-клеток, чем в наивных клеток.
- Перед началом подготовки 2 мл дополнены T средней ячейки, добавив 20 мкли средних компонентов А и В и 100 мкл эмбриональной телячьей сыворотки (5%) для каждого трансфекции должны быть выполнены. Равновесие среды, в 12-луночный планшет в увлажненной 37 ° C, 5% СО 2 инкубатора, по крайней мере час. Кроме того, аликвоты среде с 5% сыворотки крови и компонентов могут быть подготовлены и хранят в замороженном виде. Если это так, растопить необходимое количество порции, добавить компонент Б, а также выполнять равновесия.
- Предварительно уравновешивания среды очень важно, так как клетки смерть в результате повторного суспензию клеток после трансфекции в среду, либо холодно, либо имеет рН, кроме 7.2.
- Далее готовим трансфекции смеси. Комбинат 82 мкл мышь T Решение Nucleofector сотовый с 18 мкл дополнения 2 и 5 мкг плазмидной ДНК (концентрация не ниже 0,5 мкг / мкл). Тщательно перемешайте, нажав на трубе или с использованием микро-пипетки.
-Важно выполнять титрования дозы плазмиды на фиксированное количество ячеек для каждой конструкции, которые будут использоваться для трансфекции. Для некоторых крупных конструкций, больше ДНК, которые могут потребоваться. ДНК должна быть свободной от эндотоксинов.
- Передача от 5 до 10 миллионов клеток в 15 мл центрифужные пробирки. Центрифуга 600 оборотов в минуту в течение 5 минут при комнатной температуре. Удалить столько супернатант возможно с вакуумным аспиратором.
- Производители рекомендуют вращение клетки менее 90x г, в нашем случае, эта скорость соответствует 75x г. Выбранная относительная центробежная сила (RCF), чтобы получить осадок клеток является, пожалуй, наиболее важные переменные, как центрифугирование при низких RCF исключает повреждение клеточной мембраны.
- Повторно приостанавливать осадок клеток в трансфекции смесь, осторожно и медленно пипетировать осадок клеток, пока нет большого скопления клеток остается. Обычно это может быть достигнуто путем полного аспирационных Т-клетокhrough кончиком пипетки не более 3-4 раз.
- С помощью пипетки, аккуратно передавать суспензии в сертифицированных Amaxa кювет, гарантируя, что нет пузырей настоящее время. Закройте кювету.
- Выберите Nucleofector программа X-001 на Nucleofector устройства. Вставьте кювету в держатель кювет Nucleofector и применять выбранную программу.
- После electroporating клеток, то лучше сразу перевести их на предварительно уравновешенную питательную среду. Производители рекомендуют, чтобы клетки хранятся в nucleofector среднего не более чем на 15 минут.
- Принесите кювет и предварительно уравновешенную, полностью дополнена питательной среде с капюшоном. С помощью прилагаемого пластиковые пипетки, добавьте 500 мкл среды в кювет и передачи клеточной суспензии в среду в пластинке капля за каплей.
- Инкубируйте клетки при 37 ° C за 4 часа до съемки. Наивные клетки incubatред на 30 ° C вместо 37 ° C. Это помогает поддерживать их реактивность на антиген.
- Три-четыре часа инкубации, как правило, достаточным для Т-клеток детектирования выразить GFP меченных белков. Мы выбрали изображение клетки в это время точка, потому что уровень экспрессии низка и артефакты за выражение должно быть сведено к минимуму. Если на выражение того или иного белка требуется, однако, Т-клетки должны быть удалены из среды Amaxa через 4 часа. Это достигается за счет вновь гранулирования клеток при низких RCF и ресуспендирования в предварительно уравновешенную Т-клеточной культуре среде, дополненной 50 Ед / мл интерлейкин 2 (IL-2) при плотности 2 млн. кл / мл.
2. TIRF микроскопии
Описание микроскоп TIRF:
- Общая конфигурация: Оптические компоненты были построены вокруг Olympus IX71 флуоресцентного микроскопа, который был первоначально оснащен модулем Olympus TIRF. Мы скоро диscovered цветовые эффекты в этом модуле, когда одно государство выравнивание не достигли совпадает коллимации для лазерных линий с различными длинами волн. Этот модуль, следовательно, не позволяют одновременно изображение TIRF с использованием различных длин волн возбуждения, и мы намерены построить пользовательский аппарат TIRF, что сводит к минимуму хроматические эффекты в системе, как мы подробно обсудим в следующем разделе. Описанный здесь метод был разработан для 150 X увеличения, 1,45 числовой апертурой (NA) TIRFM цель (Olympus), но работает так же хорошо для 60-кратное увеличение, 1,45 NA версии. Для широкого освещения поле микроскопа связан с галогенными лямбда-XL источником света и колесо возбуждении фильтра (Sutter Instruments) оснащены фильтрами возбуждения. Для автоматического позиционирования образца стадии по отношению к цели, микроскоп снабжен моторизованным перевод XY, пьезо-контролируемых Z этапе (ASI). Изображения получены с помощью двух одинаковых QuANTEM электронного умножения (EM) ПЗС-камеры (Фотометрические). Размер пикселя из этих камер соответствует очень хорошо с увеличением предлагаемых 150 X TIRF цели, предоставляя окончательное решение 0,1 мкм на пиксель. EMCCD камер также предлагают чувствительность к себе GFP трансфектантов с низким уровнем экспрессии.
- Лазеры: Для TIRF освещение, система из 5 лазеров доставки в общей сложности 6 лазерных линий (405, 440, 488, 514, 561 и 640 нм) вводится в одномодового волокна (Solamere технологий). Аргонового лазера и 561 нм с диодной накачкой твердого тела (DPSS) лазер (строки 488, 514 и 561) проходят через акустооптических перестраиваемых волокна (AOTF) для управления интенсивностью, а интенсивность диодные лазеры (405, 440 и 640 нм) находится под контролем модуляции напряжения их питания. Напряжение на AOTF и источники питания диодных лазеров контролируется с помощью карты сбора данных (DAC) доски (измерение вычислительной) с использованием программного обеспечения метаморфизма (молекулярногоLAR устройства). Связь эффективности диодных лазеров составляет 30%, тогда как у аргона и DPSS лазеры являются около 60% за счет их меньшего диаметра пучка.
- TIRF модуля: Для того, чтобы изображение одновременно TCR и связанные с молекулами сигнализации, как было описано ранее, это было важно иметь TIRF освещения, которая была исправлена и хроматически, что не потребует перестройки и переориентации при приобретении флуоресценции выбросов различных длин волн. TIRFM была достигнута с помощью сквозной целью освещения, как описано выше 17. Волоконно-оптического кабеля, который обеспечивает лазерный свет в микроскоп был обеспечен в волокно запуска оснащен держателем XY волокон установлен на вершине микрометра управляемые оптические шины для регулировки Z (Thorlabs). Для достижения TIRF освещенности, лазерный луч фокусируется на задней фокальной плоскости объектива с помощью системы из двух линз (L1 (коллиматорный объектив) и L2 (фокусирующей линзы) на рисунке 1), так что бEAM возникает коллимированный из цели. Это гарантирует, что все лучи света, выходящие из целей будет иметь тот же угол по отношению к плоскости образца. Кончик оптического волокна находится в фокусе коллимирующей линзы. Перемещая микрометр вдоль оптической железнодорожных отношению к объективу коллиматорный (направление Z) можно настроить фокус пучка и перемещения луча в X и Y позиции с помощью ручки регулировки XY. В связи с очень маленькой апертурой назад из 150 цели X, мы обнаружили, что для достижения TIRF, размер лазерного пятна в задней фокальной плоскости должна быть небольшой. Чтобы добиться внимания необходимо, чтобы произвести небольшие пятна, линзы короткое фокусное расстояние было необходимо (Кейр Неймана, личное сообщение), поэтому мы использовали фокусирующей линзы с фокусным расстоянием около 108 мм, который был помещен в дихроичных куб непосредственно предшествующий цели. Коллимирующей линзой был помещен ближе к светоделитель, который принес в TIРФ освещения. Чтобы свести к минимуму нежелательные цветовые эффекты, мы использовали ахроматических дублетов (хроматически исправлены линзы сделаны синтезе два линзы изготовлены из материалов, различных показателей преломления) с антибликовым покрытием для коллимации и фокусировки объектива (JML оптический). В центре можно проверить, проверяя, что пучок выходит коллимированный из целей, когда положение в центре задней диафрагмы и должно стать плотное пятно на потолке комнаты. Положение сосредоточены пятно затем направился к краю отверстия (в направлении Y), который вызывает луча сходятся на плоскости изображения при больших углах, и в конце концов, критический угол полного внутреннего отражения достигается. Используя эти оптические компоненты, мы достигли одновременной коллимации для всех длин волн от 442 до 640 нм, в то же выравнивание. Одного оптического выравнивания, таким образом, позволило нам выполнить TIRFM одновременно на нескольких длинах волн.
- Двойная камера видимомуАТУС: одновременное приобретение различных флуоресценции, вытекающих из двух флуорофоров была достигнута за счет создания двойной системы камера, которая разделяет излучение на два диапазона длин волн с помощью дихроичных зеркал (рис. 2). Излучаемого света, отраженного от цели из правого борта микроскопа. Как и большинство цели бесконечности исправлены (с изображениями формируются на бесконечности), объектив трубы необходимо сосредоточиться на изображении. Чтобы работать с двумя длинами волн излучения одновременно, трубки линзы на правый борт был удален. Настроенный адаптер содержащих C-Mount потоков (Sutter Instruments) был присоединен и связанных с дихроичным держатель зеркала (Эдмунд оптики). Дихроичных зеркал, которые отделяют GFP выбросов от органических красителей, используемых для обозначения TCR (Alexa546, Alexa647 и др.) были установлены в держатель. Этот модуль был следовать в оба пути света от держателя трубки объектива, держатель фильтра выбросов и расширения труб.трубы линз (TL1 и TL2 (рис. 2)) имеют фокусное расстояние 180 мм. Пробелы в расширение трубы, ведущие к EM ПЗС-камеры были покрыты черной бумаги, чтобы защитить камеры от постороннего света. Для обеспечения выравнивания из двух каналов, камеры были установлены на двух пользовательских перевод стенды XYZ (Holmarc продукты).
Ниже мы опишем, как выровнять микроскоп для двух каналов одновременной визуализации. Шаги, вовлеченные выравнивание освещения TIRF, регулировка мощности лазера, а также выравнивание два выходных изображений с помощью суб-разрешение микрошарики.
- Перед началом работы все компоненты микроскоп включены. Компьютеры и программное обеспечение, затем начал и он заверил, что все аппаратные компоненты признаны программного обеспечения.
- Для использования в качестве со-локализация стандарт, развести 1 мкл суб-разрешение (0,2 мкм) Fluoresbrite Multi-флуоресцентные микросферы в 2 мл ФСБ и добавить 0,25 мл микросферПодвеска в каждую лунку Lab-Tek II 8-и камерные системы покровного стекла (Nunc). Установите систему камеры слайд на платформу выше цели. Бисер, которые адсорбируются на стекло, затем в центре внимания.
- С помощью Y выравнивания волокно XYZ, положение лазерного луча перемещается к центру задней диафрагмы объектива. Важно сделать это, когда цель находится в положении, когда стекло самолета находится в фокусе. Если луч не коллимированный, микрометр Z регулируется для достижения полной коллимации. Коллимации проверяется индивидуально для всех лазерных линий, которые будут использоваться в эксперименте. На этом этапе мощность лазера для каждой линии измеряется с помощью измерителя мощности лазерного излучения и доводят до 20-30 мВт на каждый канал.
-Т-клетки крайне чувствительны к лазерному излучению, и освещение ограничен всего 50 мкВт.
- Изображения бисер, приобретенный с помощью TIRF illuminatионов в режиме реального времени. Поверните Y выравнивания микрометр на волокно запуска так, чтобы луч начинает двигаться от потолка до его угол по отношению к оптической оси цель Подходы 90 градусов. В конце концов, когда критический угол МДП будет достигнуто, лазерное излучение не будет выходить из цели. TIRF выравнивание затем судить, сосредоточив внимание вверх и вниз по плоскости покровного стекла. Если шарики, которые плавают в растворе могут быть визуализированы, то угол луча по отношению к цели нормальной должна быть увеличена в дальнейшем. При правильном выравнивание TIRF только один оптический самолет будет в центре внимания (например, только шарики, которые адсорбируются на покровное). Тонкие тест выравнивания TIRF могут быть реализованы при визуализации Т-клетки окрашивали поверхность красителем, которые распространились на поверхность. (См. пункт 3.4).
- После освещения TIRF была достигнута, двух каналов могут быть выровнены по отношению друг к другу. Сосредоточьтесь на бусы и сравнить позиции яdentifiable функции изображения, полученные в обоих каналах. Использование X и Y винтов микрометров в одной камере стенда, приносят взаимное расположение бусин в качестве непосредственной близости, как это возможно. Сохранение изображений в обоих каналах. Эти снимки будут использоваться в качестве со-локализация стандартной для выравнивания двух каналов.
- Камеры должны быть расположены так, что они parfocal по отношению друг к другу. Это достигается за счет приобретения набора изображений под разрешение шарики, которые отделены друг от друга в направлении Z на 100 нм. Если максимальная интенсивность пикселя для бус лежит в одной плоскости, как для камеры, то они parfocal.
3. Изображений
После того, микроскоп установлен, следующей задачей является подготовка проточных камерах содержащие стекло поддерживается липидного бислоя представления антигена и молекул адгезии, как описано выше 6, а затем выполнять TIRFM трансфицированных Т-клетки взаимодействуют сподложки. Опубликовала протокол двухслойных 5-6 последовало, опубликованной исключением того, что липосомы не выдерживают в течение 20 минут после покровного стекла потоком камеры был собран. Вместо этого, HBS-BSA буфера текла потоком клетки сразу после сборки.
- Соберите проточную камеру с плоскими двухслойных липидных формируется на скольжение стеклянной крышкой содержащих Ni-NTA липидов. Молекул адгезии, ICAM-1 (100 молекул / мкм 2) и пептид-MHC комплексов, MCC загруженных т. е. К (5-10 молекул / мкм 2), включены в двухслойной через свои теги гистидин. Костимуляторных молекулы CD80 добавляется с помощью GPI якорь (100 молекул / мкм 2).
- Поместите проточной ячейки на стадии микроскоп и стабилизировать его. Прикрепите поставляемый производителем нагревательного элемента в проточной ячейке контролировать его температуру. Установите цель на двухслойных и вывести самолет в двухслойной сосредоточиться. Включение отопления цели и потокклетка для стабилизации температуры в камере при температуре 37 ° C.
- Трансфицированных Т-клетки осаждали после 4 часов инкубации на скорости 80x г и вновь приостановлен в HBS-BSA буфере с добавлением 10 мкг / мл H57 Fab или 20 мкг / мл H57 одного фрагмента переменная цепи (ScFv), чтобы маркировать TCR. Затем клетки вводили в потоке клеток. Изображения осуществляется в постоянном присутствии Fab или ScFv из-за их высокой константа диссоциации. Их присутствие в среду не значительно увеличить фон, как поле TIRF очень тонкий.
- Изображениями условия настроены так, что двухканальный живой приобретение показывает предварительный просмотр и GFP TCR каналы, которые помогают в поиске трансфицированных клеток. TIRF освещения подтверждается внимание на стеклянные плоскости для обнаружения бокового окрашивания мембраны. Если боковой мембраны не приходят в фокусе, то выравнивание TIRF хорошо. Трансфицированных клеток, затем один или отображаемого в последовательность изображений для получения VIDEOS.
4. Обработка изображений и анализ данных
Программа выводит изображения с двух камер в одном кадре. Выход каждой камеры составляет 512 х 512 пикселей, следовательно, выходного изображения составляет 1024 х 512 пикселей. Изображения в первую очередь необходимо разбить на отдельные кадры, соответствующие двум камерам. Изображения под разрешение бусы из двух каналов накладываются и согласование параметров определяются. Функция, специфичные для нашей системы на 1 градус вращения одного канала по отношению к другой (см. Рисунок 3). Наиболее вероятным источником этого вращения камеры стендов. После этого вращения дальнейшего относительного линейного преобразования в X и Y должны быть выполнены, чтобы полностью выровнять бисером по отношению друг к другу. Изображения бисер, полученных в каждом эксперименте, чтобы определить точные параметры для выравнивания двух каналов. Эти линейные и вращательные преобразования затем применяется ко всемизображения, а затем они могут быть алгоритмы сегментации и сотрудничества локализации анализа.
5. Представитель Результаты
Система, описанная здесь, может быть адаптирована для изучения сигнализации на выходе любой рецепторов на мембране. Особенно информативны при изучении TCR сигнализации, потому что сигнализация происходит в оптически решить кластеры называется TCR микрокластеров или в эндосомы как недавно описал 18. Если сигнализация произошло к югу разрешения скопления рецепторов или в не-кластерных рецепторов дополнительных экспериментов должно быть сделано, чтобы интерпретировать эти данные. Как упоминалось ранее, CD3 цепи TCR комплекс пройти фосфорилирования киназ Src Lck на участие TCR на пептид-MHC комплексов. Фосфорилированных цепи CD3ζ После связывания антитело мобилизует киназы Syk семьи Zap70. Визуализация набора Zap70 таким образом сообщает о фосфорилирования статус цепь CD3ζ. Сила стимуляции TCR может быть изменен с помощью пептидов мутировал в остатках ТКС контакт. Такие пептиды, называемые пептидные лиганды изменены (ППМ). Представитель эксперимента приведена на рисунке 4, где агонист пептидов решительно набирает Zap70 к TCR микрокластеров в то время как снижение потенции пептид T102L не удается привлечь к Zap70 TCR микрокластеров, демонстрируя, что CD3ζ цепь не фосфорилируется в этом случае. Мы можем сделать такой вывод, потому что мы просто наблюдаем набор Zap70 к TCR кластеров, которые легко обнаружить TIRFM. Автоматизированный алгоритм сегментации были использованы для подсчета количества Zap70 микрокластеров на ячейку. Кроме того, показано в дополнительном фильм одновременные снимки TCR и Zap70 связанных флуоресценции. Обратите внимание на динамичный характер lamelipodium.
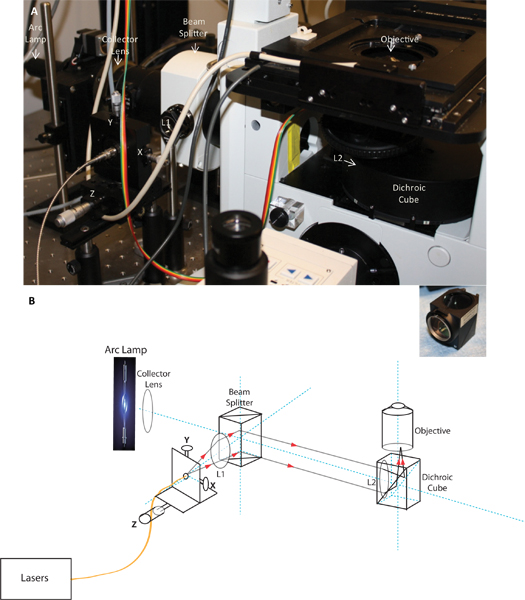 <бр /> Рисунок 1. Изображение и схема запуска пользовательских TIRF. Группа показывает фотографию запуска TIRF как установленной на микроскопе, а группа B является схема запуска TIRF демонстрируют легкий путь. Схема и изображение, показывающее позицию коллектора объектива, светоделитель, волокно с запуском X, Y и Z корректировки, коллиматорные линзы L1 и L2 фокусирующей линзы устанавливаются в дихроичных куба и цель TIRF. На вставке показана фокусирующей линзы устанавливаются в дихроичных куб.
<бр /> Рисунок 1. Изображение и схема запуска пользовательских TIRF. Группа показывает фотографию запуска TIRF как установленной на микроскопе, а группа B является схема запуска TIRF демонстрируют легкий путь. Схема и изображение, показывающее позицию коллектора объектива, светоделитель, волокно с запуском X, Y и Z корректировки, коллиматорные линзы L1 и L2 фокусирующей линзы устанавливаются в дихроичных куба и цель TIRF. На вставке показана фокусирующей линзы устанавливаются в дихроичных куб.
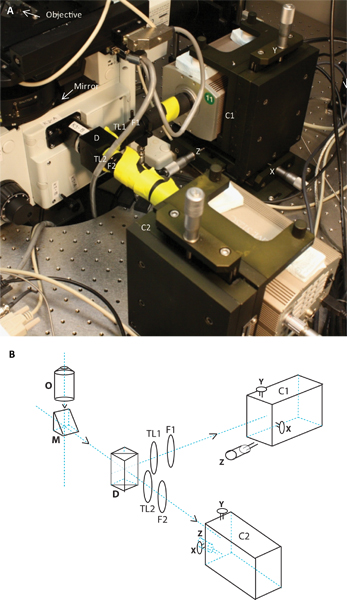
Рисунок 2. Изображение и схема из двух камер. Группа показывает фотографии двух камер системы прикреплены к микроскопу, и группа B является схема то же самое. Схематическое изображение и показывают положение объектива, зеркало, дихроичных, трубки линзы TL1 и TL2, излучение фильтры F1 и F2, две камеры, С1 и С2 на тНаследник стенды с их X, Y и Z изменения.
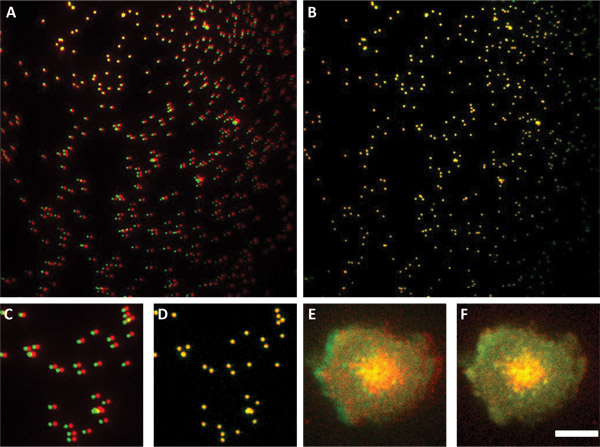
Рисунок 3. Использование суб-разрешение бисер для выравнивания двух каналов. Панели и B показывать пометки к югу разрешения бисер перед (группа А) и после (группа B) выравнивание. Группа показывает, что одним из каналов вращается по отношению к другим. Панели C и D, подраздел изображений в А и В. Группы E показывает два изображения наложение каналов клеток без обработки. Согласование параметров, используемых в панели D были применены к изображению показано на панели F. Обратите внимание, как lamelipodium из двух каналов идеально ровные на панель F, а не в панели E. Масштаб бар 4 мкм для всех панелей.
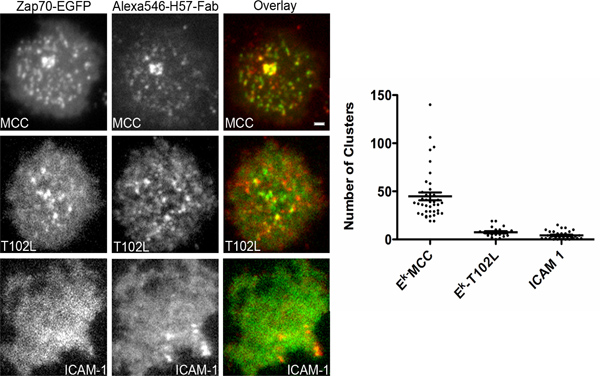
Рисунок 4. Zap70 вербовки TCR микрокластеров в ответ на различные противопехотных мин. В лабораторных активированных Т И Клетки трансфекции плазмидой, кодирующей Zap70 слит с GFP и инкубировали на стекле поддерживает Ni-NTA бислоев, содержащих 6 молекул / мкм 2 пептида загружены Его с метками-IE к, 100 молекул / мкм 2 Alexa647 сопряженных его тегами ICAM- 1 и 100 молекул / мкм 2 GPI-якорь CD80. Пептиды загружены показаны на вставке. ICAM-1 относится к клеткам на бислоев, содержащих 100 молекул / мкм 2 Alexa-647 Его сопряженных с метками ICAM-1. Двухканальная одновременного приобретения TIRF микроскопии была выполнена в постоянном присутствии Alexa546 сопряженных H57 Fab фрагментов (без блокировки) для окрашивания TCR. Клетки были обследованы до одного часа после первого контакта с бислоя. Количество Zap70 кластеров в камере были проанализированы с помощью автоматизированного программного обеспечения подсчета кластера. По меньшей мере 40 клеток были проанализированы в каждом конкретном случае. Шкала бар 2 мкм для всех изображений.
92/3892fig5.jpg "/>
Рисунок 5. Выравнивание двух камер системы с использованием двух различных типов камер. Эта панель показывает соответствие наложения под разрешение бисером отображаемого с помощью двух камер системы, в которой две камеры имеют различные размеры пикселей (Зеленый: 6.45 мкм размер пикселя отображаемого на 2x2 биннинга и красный: 16 мкм, размер пикселя отображаемого на нет биннинга). Врезка показывает увеличенное изображение квадрат в центре поля. Шкала бар 5 мкм.
Дополнительные кино. Zap70 вербовки TCR микрокластеров в ответ на агонист пептида. В лабораторных и активированные Т-клетки трансфицированных плазмидой, кодирующей Zap70 слит с GFP и инкубировали на стекле поддерживает Ni-NTA бислоев, содержащих 6 молекул / мкм 2 пептида загружены Его с метками-IE к, 100 молекул / мкм 2 Alexa647 Его сопряженных с метками ICAM-1 и 100 молекул / мкм 2 GPI-якорь CD80. Двухканальная одновременнойcquisition TIRF микроскопии была выполнена в постоянном присутствии Alexa546 сопряженных H57 Fab фрагментов (без блокировки) для окрашивания TCR. Поле трансфицированных клеток неоднократно отображаемого в 40 раз с временным разрешением 10 секунд на кадр. Шкала бар 2 мкм. Щелкните здесь для просмотра дополнительных кино .
Обсуждение
Здесь мы опишем систему для изучения сигналов в антиген-специфические первичные Т-клеток мыши использованием TIRFM и стекла поддерживают липидного бислоя как искусственные БТР. Эта технология основана на успешно выразить GFP меченных белков в этих клетках. Трансфекции Т-клеток, это всегда сложная задача. Как правило, электропорации или доставки генов использованием ретровирусов или лентивирусов используются. Один из методов не превосходство над другими, оба имеют свои ограничения и преимущества. Мы считаем, что электропорации имеет следующие преимущества: 1) не требуется, что клетки активно деления, как это требуется для ретровирусов, но не лентивирусов, и 2) уровень экспрессии можно управлять, варьируя время клетки инкубируют до визуализации. Самым большим недостатком является то, что мы очень трудно выразить белков, которые имеют большие размеры в первичных ячейках. Мы представили метод, который дает нам очень хорошую жизнеспособность клеток после электропорации. В результате это applicabле, чтобы использовать его для достижения миРНК опосредованного генов.
Мы также опишем здесь настроенные двухканальная одновременная микроскоп TIRF приобретение, которое хроматически исправлены и не требует отдельного согласования для разных длин волн. Эти возможности, однако, имеются в продаже. Наша система основана на принципах TIRF микроскопии опубликованные экспертами в этой области и дешевле, чем коммерческие альтернативы. Одним из возможных критику нашего проекта является то, что мы используем тот же угол падения на различных длинах волн возбуждения. Это приведет к проникновению различных TIRF глубины для разных длин волн возбуждения. Мы считаем, что эти эффекты малы, так как затухающих волн экспоненциально затухающие поля и глубина поля TIRF является линейной функцией длины волны. Флуорофоров близко к поверхности стекла будут испытывать никакой разницы в интенсивности лазерного двух длинах волн. Для флуорофоров у рnetration глубине, интенсивности разница будет 1,3 раза для двух длин волн 488 и 640 нм и 1,15 раза на двух длинах волн 488 и 561 нм. Та же система может быть использована в сочетании с супер методов разрешения, которые делают использование освещения TIRF.
Мы также описаны две камеры системы, которая на заказ. Как система TIRF, подобные аппараты также на коммерческой основе. Наша система предоставляет возможность изменить фильтры и dichroics, что позволяет его использование с различными комбинациями длин волн. Недостатком нашей системы на один градус вращения необходима для выравнивания двух изображений. Эта проблема может быть решена с помощью камеры стенды, которые пьезо приводом и предлагать вращательных степеней выравнивания. Кроме того, мы успешно реализовали две камеры системы на этот микроскоп, в котором камеры разные и имеют разные размеры пикселя. Системы, как это было бы полезно, если необходимо чувствительность в одном канале и большой дудинамический диапазон в другой, оба из которых редко имеются в наличии в той же камере. Мы использовали Фотометрические HQ-2 камеры на 2x2 биннинга дает нам эффективный размер пикселя составляет 12,9 мкм с Фотометрические Квант-ЕМ камера, которая имеет размер пикселя 16 мкм. 180 мм фокусным длина трубы была использована для Квант-ЕМ и 145 мм фокусным длина трубы была использована для HQ-2 камеры. HQ-2 управляется с помощью программного обеспечения и Метаморф Квант-ЕМ было управлять с помощью микро-менеджер программного обеспечения на отдельном компьютере в режиме внешнего триггера. Внешний запуск был представлен Квант-ЕМ камеру с помощью цифровой выход ЦАП измерения вычислительной борту, который был реализован в качестве дополнительной выдержки в конфигурации настройки освещения Метаморф. Отношение фокусного расстояния трубки линзы соответствует отношение эффективного размера пикселя. Представитель выравнивание показано на рисунке 5.
Раскрытие информации
Все животные, используемые в этих экспериментах, были сохранены в конкретных патогенов окружающей среды, а также эксперименты были одобрены Национальным институтом здравоохранения и использованию животного комитета.
Благодарности
Работа выполнена при поддержке со стороны Отдела Внутренние исследований Национального института аллергии и инфекционных заболеваний, Национальные институты здравоохранения. Мы благодарны Йоханнес Huppa и Марк Дэвис за предоставление нам ScFv из H57, используемые в этих исследованиях. RV хотел бы поблагодарить Кейр Неймана за полезные обсуждения в ходе развития этой техники.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Amaxa Nucleofector набор для Т-клеток мыши | Lonza Инк | VPA-1006 | |
| PureLink HiPure плазмиды Midiprep Kit | Life Technologies | K2100-05 | Для эндотоксин бесплатно Preps ДНК |
| Amaxa Nucleofector устройств | Lonza Инк | AAD-1001 | |
| Рекомбинантных мышей ИЛ-2 | Peprotech Инк | 212-12 | |
| Fluoresbrite Multifluorescent микросфер 0.20μm | Polysciences, Inc | 24050-5 | |
| Лаборатория-Tek II 8-и камерные покровного стекла | Thermo Scientific, Nunc | 155409 |
Ссылки
- Call, M. E., Wucherpfennig, K. W. The T cell receptor: critical role of the membrane environment in receptor assembly and function. Annu. Rev. Immunol. 23, 101-125 (2005).
- Smith-Garvin, J. E., Koretzky, G. A., Jordan, M. S.T cell activation. Annu. Rev. Immunol. 27, 591-619 (2009).
- Bezbradica, J. S., Medzhitov, R. Integration of cytokine and heterologous receptor signaling pathways. Nat. Immunol. 10, 333-339 (2009).
- Fraser, I. D., Germain, R. N. Navigating the network: signaling cross-talk in hematopoietic cells. Nat. Immunol. 10, 327-331 (2009).
- Dustin, M. L., Starr, T., Varma, R., Thomas, V. K. Supported planar bilayers for study of the immunological synapse. Curr. Protoc. Immunol. Chapter 18, 13-13 (2007).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. (19), e947-e947 (2008).
- Varma, R., Campi, G., Yokosuka, T., Saito, T., Dustin, M. L. T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster. Immunity. 25, 117-127 (2006).
- Yokosuka, T. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat. Immunol. 6, 1253-1262 (2005).
- Huppa, J. B. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463, 963-967 (2010).
- Tolar, P., Pierce, S. K. A conformation-induced oligomerization model for B cell receptor microclustering and signaling. Curr. Top. Microbiol. Immunol. 340, 155-169 (2010).
- Treanor, B. The membrane skeleton controls diffusion dynamics and signaling through the B cell receptor. Immunity. 32, 187-199 (2010).
- Treanor, B., Batista, F. D. Mechanistic insight into lymphocyte activation through quantitative imaging and theoretical modelling. Curr. Opin. Immunol. 19, 476-483 (2007).
- Sylvain, N. R., Nguyen, K., Bunnell, S. C. Vav1-mediated scaffolding interactions stabilize SLP-76 microclusters and contribute to antigen-dependent T cell responses. Sci. Signal. 4, ra14-ra14 (2011).
- Purbhoo, M. A. Dynamics of subsynaptic vesicles and surface microclusters at the immunological synapse. Sci. Signal. 3, ra36-ra36 (2010).
- Lasserre, R. Ezrin tunes T-cell activation by controlling Dlg1 and microtubule positioning at the immunological synapse. EMBO. J. 29, 2301-2314 (2010).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat. Rev. Immunol. 11, 21-33 (2011).
- Axelrod, D. Chapter 7: Total internal reflection fluorescence microscopy. Methods Cell. Biol. 89, 169-221 (2008).
- Williamson, D. J. Pre-existing clusters of the adaptor Lat do not participate in early T cell signaling events. Nat. Immunol. 12, 655-662 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены