需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
工程双层凝胶控制升序分化
摘要
该协议着重于利用干细胞的固有能力,其周围的细胞外基质的线索,被诱导分化成多个表型。这种方法手稿延伸我们描述一个利用双层水凝胶的模型,PEG-纤维蛋白和胶原蛋白的组成和特性,同时脂肪干细胞分化 1。
摘要
多年来的天然聚合物获得了更多,因为它们的宿主的生物相容性和交互能力与细胞在体外和体内的重要性,认为在再生医学中的承诺的一个研究领域,是新型生物材料和干细胞的组合使用。在组织工程领域的一个基本战略是指导细胞的功能,使用三维支架(如脱细胞外基质,水凝胶,微/纳米颗粒)。这项技术已经从发现,细胞需要一个基板后,他们能够坚持,增殖,并表达他们分化 的细胞表型和功能2-3。最近,它也已被确定,细胞不仅使用这些基板的坚持,但也互动,并采取从矩阵基板(例如,细胞外基质,细胞外基质)的线索。因此,细胞和支架有一个相互连接,为控制组织发展,组织,和最终功能。脂肪干细胞(ASCs)是间质,非造血干细胞存在于脂肪组织,可以表现出多谱系分化的细胞现成的源(即前血管内皮细胞和周细胞)作为。我们的假设是,脂肪干细胞可以向简单的合作,培养他们的不同表型,同时在双层矩阵1。我们的实验室专注于皮肤伤口愈合。为此,我们建立了从天然生物材料的复合材料基体,纤维蛋白,胶原蛋白,壳聚糖,可以模仿特定皮肤伤口愈合的ECM环境的特点和功能。
研究方案
1。分离脂肪干细胞(ASCs)1,5
注:所有的程序,在室温下进行,除非另有说明。
- 分离大鼠肾周和附睾脂肪用无菌汉克的缓冲盐溶液,含1%胎牛血清(FBS),(5先前所描述的HBSS中)。这项研究已进行符合动物福利法“,实施动物福利条例,并按照实验动物护理和使用指南”的原则。
- 百果组织和转移到1-2克25毫升含有500克50毫升管和离心机在室温为8分钟到1%胎牛血清的HBSS。
- 收集的自由浮动的脂肪层转移到125毫升三角瓶和治疗胶原酶II型(200单位/毫升)25毫升37°轨道摇床(125转)在45分钟的HBSSÇ。
- 仔细由pipeting删除的液体部分(油和脂肪层以下)和过滤器,它通过一个100顺序 - 微米和70 - 微米尼龙网过滤器。在500克,在常温下为10分钟,离心滤液,吸上清,用25毫升的HBSS沉淀两次。
- 悬浮细胞沉淀在50毫升的培养基中补充MesenPRO RS生长补充,抗生素,抗霉菌(100 U / ml的青霉素G,100微克/毫升的硫酸链霉素,两性霉素0.25微克/毫升(MesenPRO RS基础培养基) B)和2毫米的L-谷氨酰胺和移液器细胞分为两个的T75瓶(25毫升/瓶)。
- 文化在5%CO 2培养箱孵化ASC在37°C间(通过2-4 ASCs的所有实验中使用的)。
2。制备壳聚糖微球(CSMS)
注:所有的程序,在室温下进行,除非另有说明。
- CSMS准备由水油乳化过程中,随着离子的凝聚技术,用我们以前的协议5。乳化油相混合组成的大豆油,正辛醇(1:2 V / V)和5在100毫升的壳聚糖水溶液(6毫升3%W / V壳聚糖醋酸在0.5中号) %山梨醇单油酸酯(跨度80)乳化剂,同时使用方向相反的开销(1700 RPM)和磁力搅拌(1000转)。这种混合确保年初之前,在交联形成的胶束可以留在溶液中,并没有解决的底部双方法。此外,磁力搅拌棒的艾滋病在聚合过程中胶束的形成和刚化壳聚糖。
- 连续搅拌混合搅拌约1小时,直到获得一个稳定的中水乳化油。启动离子交联除了为4小时(共24毫升)1.5毫升1%W / V正辛醇,每15分钟的氢氧化钾 交联反应,慢慢倒出油相的混合物含有的CSM完成后,立即加入100毫升的丙酮,该解决方案将变得混浊,由于渣油。 5分钟后,倒出,加入100毫升的丙酮和在室温下孵育过夜。次日,再与丙酮洗五分钟的珠子。在执行这些串行洗涤溶液应转清,如果不继续冲洗被删除,直到所有的石油和丙酮的解决方案是明确的。
- 在真空干燥器的干燥回收领域,没有进一步的处理和分析。你可以决定CSM的平均颗粒大小,每毫克的表面积,使用粒度分析仪和单位立方体体积。
- 对于随后的实验中,用无菌水冲洗CSM的三倍,以除去残留的盐和隔夜5毫升无水乙醇洗涤消毒。
3。确定在CSMS游离氨基酸组数
注:所有的程序,在室温下进行,除非另有说明。
- 确定后离子交叉连接使用硝基苯磺酸(三硝基苯磺酸)酸法的Bubnis和Ofner 6 CSMS目前的氨基酸组的数量。用1 mL 0.5%三硝基苯磺酸溶液50毫升的玻璃试管中4小时在40°C孵育5毫克的微球和水解与另外3毫升6N盐酸在60°2小时。
- 样品冷却至室温,加入5毫升的去离子水和10毫升乙醚提取自由硝基苯磺酸。
- 温暖的水相的5 mL等分40°C的水浴蒸发冷却至室温,任何残余的乙醚,15分钟和15毫升水稀释。
- 与壳聚糖不使用三硝基苯磺酸溶液分光光度计测量吸光度作为空白和壳聚糖为CSM带够,在345 nm处确定氨基酸组总数的赔偿。估计CSM的相对壳聚糖的游离氨基酸组的数量。
4。在CSM加载升序
注:所有的程序,在室温下进行,除非另有说明。
- 平衡消毒CSMS在一夜之间无菌的HBSS 2.5节从5毫克,并添加到一个8 - 微米孔径的膜培养板插入(24孔板)。
- CSMS已落户到膜后,小心吸的HBSS,并添加300μL培养基中的生长介质的插入和700微升内插入外。
- 重悬的ASCs在适当的浓度(1×10 4 4×10 4)200μL生长介质和种子在培养板内插入的CSM。 ,播种后,内插入的文化语言的最终体积为500μL。
- incub吃了24小时的ASC上CSMS种子在5%CO 2培养箱孵化器在37°C。
5。 ASC的装载和细胞活力的百分比确定在CSMS
注:所有的程序,在室温下进行,除非另有说明。
- 经过孵化,在无菌的1.5 ml离心管吸管ASC加载,而不会干扰细胞已迁移到插入膜的CSM。
- 去除残留的培养基,并添加250μL新鲜生长培养基管。
- 每管中,加入25μLMTT法[3 - (4,5 - dimethylthiozole -2 -基)-2,5 -二苯基溴化铵溶液(5毫克/毫升)和5%CO 2培养箱中孵育4小时孵化器在37°C。
- 孵化后,取出介质,添加250μL二甲基亚砜,涡2-5分钟,以溶解甲臜的复杂混合物。
- CSM的离心2700Ğ5分钟,关闭上清吸管,并确定使用标准酶标仪在570 nm和630 nm的波长的吸光度,根据MTT法制造商的规格。
- 确定细胞数量与培养制定一个标准曲线从定义升序号码所得的值相对CSMS。
6。嵌入式PEG - 纤维蛋白凝胶的ASC-CSM的制备和表征
注:所有的程序,在室温下进行,除非另有说明。
- 萨格斯等制备了聚乙二醇(PEG)纤维蛋白凝胶(PEG-纤维素)溶解的琥珀戊二酸改性聚乙二醇PEG(3400大)7。使用4毫升Tris缓冲生理盐水公司(TBS,pH值7.8)和过滤消毒与刚刚在实验开始前的0.22微米的过滤器。溶解PEG是只有在此应用程序的第3-4小时有效。
- 混合500万亩;纤维蛋白原股票升(40毫克/毫升在TBS,pH值7.8)和250μlPEG的股票在6孔板,孵育20分钟,在5%CO 2培养箱孵化文化在37°C。这种混合物构成的摩尔浓度比是1:10,SG-PEG-SG的:纤维蛋白原。
- 采取的ASC-CSM 250μL,浓度5毫克的CSM(≈2×10 4细胞)和聚乙二醇化纤维蛋白原的解决方案组合。
- 立即加入1毫升的,凝血酶股票(25U/mL)和快速磨碎移液器一次或两次。与PEG-纤维蛋白原,凝血酶混合后,立即将在12孔板细胞凝胶的混合物,在37°C在5%CO 2培养箱培养箱孵育10分钟,以便为完整的凝胶。由于凝胶时间快,不尝试按住超过5秒内枪头凝胶溶液。聚乙二醇化纤维蛋白原,凝血酶切割,形成了聚乙二醇的纤维蛋白凝胶。由于这样,THé最终凝胶产品被称为PEG-纤维。
- 洗两次PEG-纤维蛋白凝胶的HBSS和孵化最小的重要媒体阿尔法(α-MEM)的补充5%CO 2培养箱孵化器在37与10%FBS°C。
- 观察从CSM的细胞迁移到凝胶超过11天,期间使用标准光学显微镜技术。
7。胶原凝胶中的嵌入式的ASC-CSM的制备和表征
注:所有的程序,在室温下进行,除非另有说明。
- 组合的ASC-CSM(含5毫克≈2×10 4细胞),与1型胶原根据8伯恩斯坦和fibrillate后调节pH至6.8使用2N氢氧化钠的方法,从鼠尾肌腱中提取(7.5毫克/毫升)。
- 纤胶原蛋白ASC-CSM的混合物加入到12孔板,孵育30分钟,在5%的CO 2 humidi田间孵化器在37°C
- 完成后房颤,在5%CO 2培养箱孵化至11天孵化,在37°C胶原蛋白ASC-CSM的凝胶
- 观察从CSM的细胞迁移到凝胶超过11天,期间使用标准的显微镜技术。
8。双层聚乙二醇,纤维蛋白(ASC-CSM)的胶原蛋白凝胶构造的发展
注:所有的程序,在室温下进行,除非另有说明。
- 开发的双层构造,准备的胶原蛋白和聚乙二醇纤维蛋白凝胶如上所述,稍作修改。简单地说,研究一个单一来源的干细胞,使用两个bioscaffolds候鸟和共同诱导的性质,“三明治”的ASC-CSMS之间的胶原蛋白和聚乙二醇纤维支架使用的四步过程:1)负载升序到CSM的,2)投在山坳纤胶原凝胶层的ASC-CSM珠演员拉根凝胶,3)PEG-纤维素凝胶以上的ASC-CSM-Ⅰ型胶原凝胶和凝胶固化,4)增加中等和插入来研究细胞在体外或删除从插入体内应用( 见图1 )。
- 准备1胶原蛋白的混合物,如上所述,无需添加的ASC-CSM的混合物,在7.1(7.5毫克/毫升)1毫升的类型。将在6孔组织培养插入(8微米孔径)的混合物,并在37°C 30分钟在5%CO 2培养箱孵化器的孵化
- 经过完整的颤动,多一层表面的胶原蛋白5毫克的ASC-CSM(10,000细胞/毫克)文化传媒(200μL)暂停。已落户在凝胶微球后,准备如6.0节所述的聚乙二醇纤维蛋白胶,无添加的ASC-CSM的混合物,并层以上的ASC-CSM胶原层的聚乙二醇化纤维蛋白原/凝血酶溶液。当准备PEG - 纤维蛋白胶,使用地方的T细胞培养液中加入250μl他250μL含有细胞的媒介。
- 一旦完成,5%CO 2培养箱培养箱中培养30分钟的结构,实现喂奶前用培养基构造完整的凝胶。
- 完成后的凝胶,地点1毫升的中型以上的下腔的构造和3毫升培养基上腔。
9。使库存解决方案
注:所有的程序,在室温下进行,除非另有说明。
- 氯化钙股票(40毫米):使用氯化钙2 .2 H 2 O 100毫升去离子水溶解588.4毫克氯化钙2·2H 2 O。消毒用0.22微米的过滤器。
- 聚乙二醇 PEG是高度与氧气反应,并可以成为室内空气接触氧化。因此,PEG应存放在氮气(N2)气氛 。命中率urately权衡,直到准备使用32毫克2毫升离心管(与N 2,使用前务必清除管)和存储于-80°C间。溶于4毫升TBS的解决方案之前,使用32毫克的聚乙二醇。
以下解决方案必须每次实验前新鲜。 - TBS的解决方案:(7.75-7.77 pH值在25°C,pH值在25°C是非常重要的)。要准备的TBS溶液15毫升,仔细溶解过滤灭菌去离子水的缓冲片,并调整到所需的pH值。不存储解决方案,准备新鲜每次股票。
- 纤维蛋白原的解决方案:(40毫克/毫升)。在TBS溶解纤维蛋白原粉使纤维蛋白原浓度40毫克/毫升。一夜之间解散它使用磁力搅拌器在4°C。这是比较容易溶解所需金额的TBS整个1-G数量。翌日,从4℃(通常是阴天)纤维蛋白原,并允许它地暖水浴,直到得到一个同质的解决方案。最后,过滤消毒使用0.45微米的过滤器的纤维蛋白原。
- 凝血酶溶液(25单位/毫升):为了使凝血酶溶液,称出所需的金额和化解的准备40毫米氯化钙2 .2 H 2 O它总是一个很好的做法,使用凝血酶整个小瓶,使股票。例如:200毫米氯化钙2·2H 2 O,分装和储存在-20°C溶解一瓶5 KU凝血酶
10。代表结果
这里介绍的是该技术的总体目标,证明将作为运载工具使用多个表型的CSM矩阵驱动的同时ASC的分化潜力。我们证明在体外战略提供CSMS干细胞成双层的聚乙二醇胶原纤维支架。嵌入式这个脚手架reveale内ASC的表征ð同时ASC装CSMS“夹心阶层”之间的胶原蛋白和PEG-纤维层和差异来自外环境的提示下茁壮成长的新情况。首先,我们的特点模型系统的能力,以维持细胞活力和迁徙能力。胶原蛋白的ASCs的支持能力,以维持他们的“干”,被证明STRO-1的表达和成纤维样形态( 图2D和2F)。相比之下,PEG-纤维蛋白诱导的ASCs分化对血管型,为的是证明他们的筒状结构形态,其内皮细胞特异性表达von Willebrand因子( 图2E,2G),和周细胞特异性表达NG2的和血小板衍生生长因子受体β(PDGFRβ)(数据未显示)。此外,这些观察到的表型出现初发生在文化和维持超过11天,是DEM图3 onstrated在。
表格和图表
双层福利建设:
- 无细胞支架单独作为一种生物活性支架可以执行。
- PEG-纤维蛋白可诱导干细胞分化生长因子除了没有。
- 胶原蛋白能协助维持干细胞表型的ASCs的。
- 一个双层结构可以用来作为其他类型的细胞迁移和增殖(如内皮细胞,成纤维细胞,角质细胞,平滑肌细胞,周细胞)的活性基底。
- 它可以用来与羟基磷灰石或脱钙骨等硬组织工程支架的硬软组织再生。
- 它可以用来发展一个多层次,多样化的组织工程的结构(如皮肤血管,血管上皮细胞,真皮血管,皮下等)。
- 它使用一种单细胞的来源,同时发展多细胞车厢。
- 它有可能与宿主组织的整合,因为它是天然来源。
- 内的凝胶结构CSM提供了一个平台,为细胞迁移。
- 壳聚糖,用于准备CSM的,是一个众所周知的活跃的化学引诱剂。
- 在这个“矩阵驱动的干细胞分化”的协议,适用于整体概念可以应用到其它的干细胞类型。然而,进一步的调查是必要的,确定的矩阵驱动分化的可行性。双层凝胶支架可以作为水库细胞在持续的和可控的方式提供。
- 重建后,凝胶仍然可以被分离成单个组件。
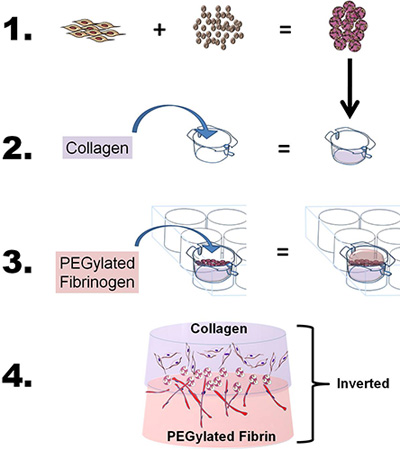
图1。示意图描绘的总体目标和过程的技术。 1)脂肪干细胞(ASCs)劳交锋到壳聚糖微球。 2)胶原蛋白,然后倒入6孔插入,调整以fibrillate胶原蛋白的pH值,并放置到6孔板室插入。在胶原蛋白ASC装的CSM球然后分层。 3)聚乙二醇化纤维蛋白原,然后倒在胶原蛋白(ASC - CSM)和凝血酶此外胶凝。 4)最后的双层结构可以从插入的文化,并在体外或体内分析。
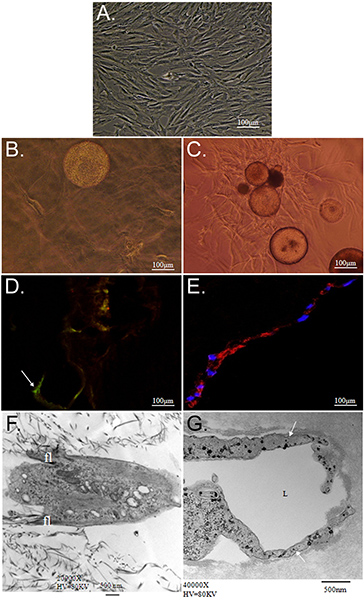
图2。表征的ASC内的胶原蛋白和PEG-纤维蛋白的三维矩阵的培养。一个隔离升序)相衬显微照片传代并保持使用常规二维细胞培养技术。显微B,D和F描绘的ASC-CSM在三维胶原凝胶中培养的,而C,E和G秀的ASC-CSM在3维PEG纤维蛋白胶,既培养第1天2。在B和C),ASCs的迁移从CSM的领域中的两个支架类型。 ASCs的出现有一个扁平的,纺锤状的胶原蛋白的形态(乙),同时保持其表达干细胞标记STRO-1(D组;箭头)。当聚乙二醇 - 纤维素的ASCs培养表现出更多的筒状结构和诱导表达血管内皮细胞标记物,如血管性血友病因子(E)。透射电子显微镜描绘了典型的形态,通过在每个支架的ASCs证明。在胶原蛋白凝胶的ASCs出现有小的丝状伪足(FL)从体细胞(F)的延长,而通常的ASCs形成食管腔结构(L),(G组;箭头)。
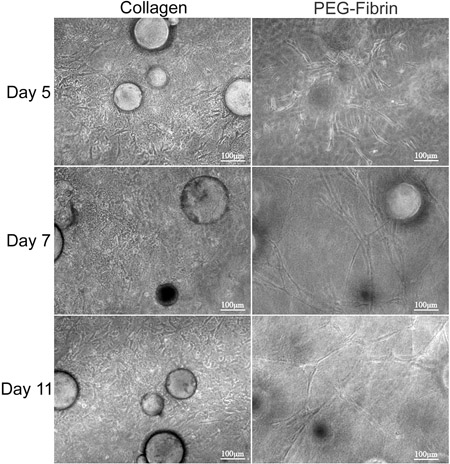
图3。之间的胶原蛋白和PEG-纤维素凝胶的双层ASC-CSMS形态分析。 ASC-CSMS“夹心阶层”之间的胶原蛋白和聚乙二醇纤维蛋白凝胶和文化保持11天。左colu百万描绘ASCs的迁移和增殖,胶原基质内出现主轴样形态。右列描述的ASCs迁移远离了CSMS,形成整个PEG - 纤维蛋白胶的筒状结构。
讨论
ASCs的是众所周知的,他们易于隔离和向多种细胞类型分化的能力。在这个手稿中描述的技术,我们能够利用这些细胞暴露多个biomatrices同时ASCs的可塑性。细胞迁移远离他们的CSM基地,并进入其周围的细胞外环境,细胞采取从断头台上的提示,并可以保持“干细胞”(胶原蛋白),或向血管和血管支持细胞类型(纤维蛋白)被诱导分化。由于我们的实验室是在皮肤及软组织伤口愈合的兴趣,我们?...
披露声明
没有竞争的金融利益存在。
免责声明
所载的意见或主张是作者的私人意见,是不被理解为官方或反映国防部或美国政府部门的意见。作者是美国政府的雇员,以及作为其执行公务的一部分准备工作。所有的工作是由美国陆军医学研究和装备司令部的支持。这项研究是由美国陆军医学研究和装备司令部机构审查委员会,并按照批准的协议的审查和批准了一项协议下进行的。
致谢
支持博士后奖学金资助从匹兹堡组织工程倡议的SN。 DOZ的日内瓦基金会颁发的赠款支持。
材料
| Name | Company | Catalog Number | Comments |
| 试剂/设备名称 | 公司 | 目录编号 | 评论 |
| 汉克斯平衡盐溶液(HBSS中) | Gibco公司 | 14175 | 耗材 |
| 胎牛血清 | 胎牛血清 | SH30071.03 | 耗材 |
| 二型胶原酶 | Sigma-Aldrich公司 | C6685 | 耗材 |
| 70微米尼龙网过滤器 | BD公司 | 352350 | 耗材 |
| 100μm的尼龙网过滤器 | BD公司 | 352360 | 耗材 |
| MesenPRO生长介质系统 | Invitrogen公司 | 12746-012 | 耗材 |
| L-谷氨酰胺 | Gibco公司 | 25030 | 耗材 |
| 氯化钙2·2H 2 O | 西格玛 | C8106 | 耗材 |
| 的T75组织培养瓶 | BD公司 | 137787 | 耗材 |
| 壳聚糖 | Sigma-Aldrich公司 | 448869 | 耗材 |
| 醋酸 | Sigma-Aldrich公司 | 320099 | 耗材 |
| 正辛醇 | Acros Organics公司 | 150630025 | 耗材 |
| 山梨醇单声道,油酸 | Sigma-Aldrich公司 | S6760 | 耗材 |
| 氢氧化钾 | Sigma-Aldrich公司 | P1767 | 耗材 |
| 丙酮 | Fisher Scientific则 | L - 4859 | 耗材 |
| 乙醇 | Sigma-Aldrich公司 | 270741 | 耗材 |
| 硝基苯酸 | Sigma-Aldrich公司 | P2297 | 耗材 |
| 盐酸 | Sigma-Aldrich公司 | 320331 | 耗材 |
| 乙醚 | Sigma-Aldrich公司 | 472-484 | 耗材 |
| 8微米的细胞培养板插入 | BD公司 | 353097 | 耗材 |
| 1.5毫升离心管 | 费舍尔 | 05-408-129 | 耗材 |
| MTT法试剂 | Invitrogen公司 | M6494 | 耗材 |
| 二甲基亚砜 | Sigma-Aldrich公司 | D8779 | 耗材 |
| qtracker细胞标记试剂盒(问跟踪655) | 分子探针 | Q2502PMP | 耗材 |
| 1型胶原 | travigen | 3447-020-01 | 耗材 |
| 氢氧化钠 | Sigma-Aldrich公司 | S8045 | 耗材 |
| 12孔细胞培养板 | BD公司 | 353043 | 耗材 |
| 纤维蛋白原 | 西格玛 | F3879 | 耗材 |
| 凝血酶 | 西格玛 | T6884 | 耗材 |
| benztriazole衍生的聚乙烯 | sunbio | DE-034GS | 耗材 |
| 平板Tris缓冲(pH值7.6) | 西格玛 | T5030 | 耗材 |
| 离心分离 | Eppendorf公司 | 5417R | 马巴贝西pment |
| 轨道摇床 | 新不伦瑞克省Scienctific | C24的 | 设备 |
| 湿润的孵化器与空气,5%的CO 2 | Thermo Scientific的 | 370型 | 设备 |
| 架空搅拌器 | 伊嘉 | visc6000 | 设备 |
| 磁力搅拌器 | 康宁 | PC-210 | 设备 |
| 真空干燥器 | - | - | 设备 |
| 粒度分析仪 | 马尔文 | STP2000 Spraytec | 设备 |
| 水浴 | Fisher Scientific则 | isotemp210 | 设备 |
| 分光光度计 | 贝克曼 | 贝克曼DU 800UV/Visible分光光度计 | 设备 |
| 涡旋 | diagger | 3030A | 设备 |
| 酶标仪 | 分子器件 | SpectraMax M2的 | 设备 |
| 光/荧光显微镜 | 奥林巴斯 | IX71 | 设备 |
| 共聚焦显微镜 | 奥林巴斯 | FV-500激光共聚焦显微镜 | 设备 |
| 扫描电子显微镜 | 卡尔蔡司显微成像 | 狮子座435副总裁 | 设备 |
| 透射电子显微镜 | JEOL | JEOL 1230 | 设备 |
参考文献
- Natesan, S. A bilayer construct controls adipose-derived stem cell differentiation into endothelial cells and pericytes without growth factor stimulation. Tissue Eng. Part A. 17, 941-953 (2011).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J Biomed Mater Res A. 81, 259-268 (2007).
- Willerth, S. M., Sakiyama-Elbert, S. E. Combining stem cells and biomaterial scaffolds for constructing tissues and cell delivery. , (2008).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, M. C. The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Zhang, G. A PEGylated fibrin patch for mesenchymal stem cell delivery. Tissue Eng. 12, 9-19 (2006).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Zhang, G. Vascular differentiation of bone marrow stem cells is directed by a tunable three-dimensional matrix. Acta Biomater. 6, 3395-3403 (2010).
- Rochon, M. H. Normal human epithelial cells regulate the size and morphology of tissue-engineered capillaries. Tissue Eng. Part A. 16, 1457-1468 (2010).
- Liu, H., Collins, S. F., Suggs, L. J. Three-dimensional culture for expansion and differentiation of mouse embryonic stem cells. Biomaterials. 27, 6004-6014 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。