Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Ingeniería de un hidrogel de dos capas para el control de la diferenciación ASC
En este artículo
Resumen
Este protocolo se centra en la utilización de la capacidad inherente de las células madre para tomar el ejemplo de su matriz extracelular circundante y ser inducidas a diferenciarse en múltiples fenotipos. Este manuscrito métodos extiende nuestra descripción y caracterización de un modelo utilizando un hidrogel bicapa, compuesto de PEG-fibrina y colágeno, a la vez co-diferenciar derivadas de tejido adiposo células madre 1.
Resumen
Polímeros naturales en los últimos años han adquirido mayor importancia debido a su biocompatibilidad anfitrión y capacidad de interactuar con las células in vitro e in vivo. Un área de investigación que promete en medicina regenerativa es el uso combinatorio de biomateriales novedosos y células madre. Una estrategia fundamental en el campo de la ingeniería de tejidos es el uso de andamios tridimensionales (por ejemplo, descelularizados matriz extracelular, hidrogeles, micro / nano partículas) de la dirección de la función celular. Esta tecnología ha evolucionado desde el descubrimiento de que las células necesitan un sustrato sobre el que se pueden adherir, proliferan, y expresar su fenotipo diferenciado y función celular 2-3. Más recientemente, se ha determinado también que las células no sólo utilizar estos sustratos para la adherencia, sino también interactuar y tener señales de la matriz de sustrato (por ejemplo, la matriz extracelular, ECM) 4. Por lo tanto, las células y andamios tienen una conexión recíproca quesirve para controlar el desarrollo del tejido, la organización y función última. Derivadas de tejido adiposo células madre (ASC) son mesenquimal, no las células madre hematopoyéticas presentes en el tejido adiposo que puede exhibir múltiples linaje diferenciación y sirven como una fuente disponible de células (es decir, pre-endotelio vascular y pericitos). Nuestra hipótesis es que derivadas de tejido adiposo células madre pueden ser dirigidos hacia diferentes fenotipos de forma simultánea simplemente co-cultivo en matrices de doble capa 1. Nuestro laboratorio está centrado en la curación de heridas dérmicas. Para este fin, se creó una matriz compuesta única de los biomateriales naturales, fibrina, el colágeno, y quitosano que puede imitar las características y funciones de un dermo-específica curación ambiente de la herida de ECM.
Protocolo
1. Aislar derivadas de tejido adiposo células madre (ASC) 1, 5
Nota: Todos los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario.
- Aislar adiposo perirrenal rata y epididimal y se lava con solución estéril de Hank sal tamponada (HBSS) que contenía 1% de suero fetal bovino (SFB) como se ha descrito previamente 5. Este estudio ha sido llevado a cabo en cumplimiento de la Ley de Bienestar Animal, el Reglamento de ejecución de Bienestar Animal y de conformidad con los principios de la Guía para el Cuidado y Uso de Animales de Laboratorio.
- Picar el tejido y transferir 1-2 g en 25 ml de HBSS conteniendo FBS al 1% en un tubo de 50 ml y se centrifuga a 500 g durante 8 minutos a temperatura ambiente.
- Recoger la capa adiposa de libre flotación del tejido y la transferencia de 125-ml matraz Erlenmeyer y se trata con 25 ml de colagenasa tipo II (200 U / ml) en HBSS durante 45 min a 37 ° C en un agitador orbital (125 rpm).
- Retire con cuidado la fracción líquida (por debajo del petróleo y la capa de tejido adiposo) por pipetear y filtrar de forma secuencial a través de un 100 - y 70 micras - filtro de malla de nylon m. Centrifugar el filtrado a 500 g durante 10 min a temperatura ambiente, aspirar el sobrenadante, y lavar el precipitado dos veces con 25 ml de HBSS.
- Resuspender el sedimento celular en 50 ml de medio de crecimiento (Medio MesenPRO RS basal), complementado con Suplemento MesenPRO Crecimiento RS, antibiótico-antimicótico (100 U / ml de penicilina G, 100 ug / ml de sulfato de estreptomicina, y 0,25 g / ml de anfotericina B), y 2 mM de L-glutamina y células de pipeta en dos matraces T75 (25 ml / matraz).
- Cultura de la ASC en un 5% de CO 2 humidificado incubadora a 37 ° C (paso 2-4 ASC se utilizan para todos los experimentos).
2. Preparación de microesferas de quitosano (CSM)
Nota: Todos los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario.
- MCS se preparan mediante un proceso de agua en aceite emulsificación junto con una técnica de coacervación iónico utilizando nuestra anterior protocolo 5. Emulsionar una solución acuosa de quitosano (6 ml de w / v 3% de quitosano en 0,5 M de ácido acético) en un 100 ml de una mezcla en fase de aceite consistente en aceite de soja, el n-octanol (1:2 v / v) y 5 % sorbitan mono-oleato (Span 80) emulsionante, utilizando sobrecarga (1700 rpm) y agitación magnética (1000 rpm) simultáneamente en direcciones opuestas. Este método dual de la mezcla que se asegura de micelas formadas desde el principio antes de la reticulación se puede permanecer en la solución y no se deposite en el fondo. Además, la barra magnética agitadora ayudas en DE-agregación de quitosano durante la formación de micelas y la rigidización.
- Se agita la mezcla se agita continuamente durante aproximadamente 1 hora hasta una estable de agua-en-aceite que se obtiene. Iniciar transversal iónico une con la adición de 1,5 ml de w / v de hidróxido potásico al 1% en n-octanol cada 15 minutos durante 4 horas (24 ml en total)
- Después de la terminación de la reacción de reticulación, lentamente decantar la fase oleosa de la mezcla que contiene CSM y añadir inmediatamente el 100 ml de acetona, la solución se volverá turbia, debido al residuo de aceite. Después de 5 minutos, se decanta, añadir un adicional de 100 ml de acetona y se incuba durante la noche a temperatura ambiente. Al día siguiente, de re-lavar las perlas con acetona durante cinco minutos. Después de realizar estas serie lava la solución debería haber girado claro, si no continuar el lavado hasta que todo el aceite se elimina y la solución de acetona es clara.
- Secar los campos recuperados en un desecador de vacío y analizar sin más trámite. Se puede determinar el tamaño de partícula medio CSM, área de superficie por miligramo, y la unidad de volumen cúbico utilizando un analizador de tamaño de partícula.
- Para los experimentos posteriores, se lavan los CSM tres veces con agua estéril para eliminar las sales residuales y esterilizar por lavado durante la noche con 5 ml de etanol absoluto.
3. La determinación deel número de grupos amino libres en los CSM
Nota: Todos los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario.
- Determinar el número de grupos amino libres presentes en MCS después de cruz iónico une mediante el bencenosulfónico trinitro (TNBS) ensayo del ácido de Bubnis y Ofner 6. Incubar 5 mg de microesferas con 1 ml de solución al 0,5% TNBS en un tubo de vidrio de 50 ml durante 4 horas a 40 ° C y hidrolizar con la adición de 3 ml de HCl 6N a 60 ° C durante 2 h.
- Enfriar las muestras a temperatura ambiente y extraer los TNBS libres mediante la adición de 5 ml de agua desionizada y 10 ml de éter etílico.
- Calentar una parte alícuota de 5 ml de la fase acuosa a 40 ° C en un baño de agua durante 15 minutos para evaporar cualquier éter residual, enfriar a temperatura ambiente, y se diluye con 15 ml de agua.
- Medir la absorbancia a 345 nm con un espectrofotómetro utilizando la solución de TNBS sin quitosano y quitosano como blanco de la utilizada para CSM preparación para determinar el número total de grupos amino. Estimación del número de grupos amino libres de la CSM en relación con quitosano.
4. Cargando ASC en CSM
Nota: Todos los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario.
- Equilibrar 5 mg de MCS esterilizados de la sección 2.5 en HBSS estériles durante la noche y agregar a un niño de 8 - tamaño de micras de poro la cultura Plate de Inserción (placa de 24 pocillos).
- Después de los MCS se han asentado sobre la membrana, cuidadosamente aspire el HBSS y añadir 300 l de medio de crecimiento hacia el interior del inserto y 700 l de medio de crecimiento hacia el exterior del inserto.
- Volver a suspender las ASC en la concentración adecuada (1 × 10 4 4 × 10 4) en 200 ul de medio de cultivo y de semillas en el interior de la inserción CSM placa de cultivo. El volumen final de medio de cultivo dentro de la inserción, después de la siembra, es de 500 l.
- Incubse comió la cabeza de serie ASC en los CSM durante 24 horas en un 5% de CO 2 humidificado incubadora a 37 ° C.
5. La determinación del porcentaje de carga ASC y la viabilidad celular en los CSM
Nota: Todos los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario.
- Después de la incubación, la pipeta CSM ASC-cargada en un tubo de microcentrífuga estériles 1,5-ml sin alterar las células que han migrado a la membrana de inserción.
- Eliminar el medio residual y añadir 250 l de medio de cultivo fresco al tubo.
- A cada tubo, se añaden 25 l de MTT [3 - (4,5-dimethylthiozole-2-il) -2,5-difeniltetrazolio] solución (5 mg / ml) e incubar durante 4 h en un 5% de CO 2 humidificado incubadora a 37 ° C.
- Después de la incubación, se elimina el medio, añadir 250 l de dimetilsulfóxido, y vórtice de la mezcla durante 2-5 minutos para solubilizar el complejo formazano.
- Centrifugar el CSM en 2700 gdurante 5 min, pipeta el sobrenadante y determinar su longitud de onda de absorbancia a 570 nm y 630 nm utilizando un lector de placas estándar, de acuerdo con las especificaciones del fabricante MTT.
- Determinar el número de células asociada con los MCS en relación con los valores obtenidos a partir de números definidos ASC cultivadas para desarrollar una curva estándar.
6. Preparación y caracterización de ASC-CSM incrustada en PEG-geles de fibrina
Nota: Todos los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario.
- Polietileno glicol (PEG) de fibrina (PEG-fibrina) hidrogel preparado por Suggs et al 7 por disolución del glutarato succinimidilo modificada con polietilenglicol (PEG; 3400 Da). Usando 4 ml de Tris-solución salina tamponada (TBS, pH 7,8) y el filtro de esterilizar con un filtro de 0,22 micras-justo antes de iniciar el experimento. PEG disuelto sólo es eficaz en esta solicitud para las primeras 3-4 horas.
- Mezclar 500 ymu; l de caldo de fibrinógeno (40 mg / ml en TBS, pH 7,8) y 250μl de stock de PEG en un pocillo de cultivo de una placa de 6 pocillos y se incuba durante 20 minutos en un 5% de CO 2 incubador humidificado a 37 ° C. Esta mezcla constituye una relación de concentración molar de 1:10, SG-PEG-SG: fibrinógeno.
- Tomar 250 l de ASC-CSM a una concentración de 5 mg de CSM, (≈ 2 x 10 4 células) y se mezcla con la solución de fibrinógeno PEGilado.
- Inmediatamente después, añadir 1 ml de trombina stock (25U/mL) y rápidamente se tritura una o dos veces con la pipeta. Después de mezclar la trombina con el PEG-fibrinógeno, inmediatamente colocar la mezcla de células-gel en una placa de 12 pocillos y se incubaron en un 5% de CO 2 incubador humidificado a 37 ° C durante 10 min para permitir la gelificación completa. Desde el tiempo de gelificación es rápida, no tratar de mantener la solución de gel dentro de la punta de la pipeta durante más de 5 segundos. El fibrinógeno PEGilado es escindido por la trombina y forma un hidrogel de fibrina PEGilado. Como tales ª,producto e gel final que se conoce como PEG-fibrina.
- Lavar los geles de PEG-fibrina dos veces con HBSS y se incuba con medio esencial mínimo alfa (α-MEM) suplementado con FBS al 10% en un 5% de CO 2 incubador humidificado a 37 ° C.
- Tenga en cuenta la migración de las células de CSM en el gel durante un período de 11 días utilizando técnicas de microscopía de luz.
7. Preparación y caracterización de ASC-CSM incrustada en geles de colágeno
Nota: Todos los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario.
- Mezcla ASC-CSM (5 mg contiene ≈ 2 x 10 4 células) con colágeno tipo 1 (7,5 mg / ml) se extrajo a partir de tendones de cola de rata según el método de Bornstein 8 y fibrilar después de ajustar el pH a 6,8 utilizando NaOH 2N.
- Agregue el fibrilada colágeno-ASC-CSM mezcla a una placa de 12 pocillos y se incuba durante 30 minutos en un 5% de CO 2 humedadescado incubadora a 37 ° C.
- Después de la fibrilación completa, incubar los geles de colágeno-ASC-CSM para un máximo de 11 días en un 5% de CO 2 humidificado incubadora a 37 ° C.
- Tenga en cuenta la migración de las células de CSM en el gel durante un período de 11 días utilizando técnicas convencionales de microscopía.
8. Desarrollo de la bicapa PEG-fibrina (ASC-CSM) Las construcciones de gel de colágeno-
Nota: Todos los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario.
- Para desarrollar la bicapa de construir, preparar tanto el colágeno y los geles de PEG-fibrina como se ha descrito anteriormente, con ligeras modificaciones. En pocas palabras, para estudiar las propiedades migratorias y de cooperación por inducción de una sola fuente de células madre utilizando dos matrices biodegradables, "sandwich" de la ASC-MCS, entre el colágeno y los andamios de PEG-fibrina mediante un proceso de cuatro pasos: 1) La carga ASC en CSM, 2) echó gel de colágeno fibrilada y la capa de las perlas de ASC-CSM sobre la collagen gel, 3) reparto de PEG-gel de fibrina sobre el gel ASC-CSM-colágeno y permitir gel a solidificar, y 4) se añade medio para insertar y así para estudiar células in vitro o eliminar de inserción para aplicaciones in vivo (véase la Figura 1 ).
- Preparar un tipo 1-1 ml de colágeno (7,5 mg / ml) mezcla como se describió anteriormente en 7,1, sin añadir ASC-CSM a la mezcla. Colocar la mezcla en un inserto de tejido 6-pocillos (8-micras de tamaño de poro) y se incuba durante 30 minutos en un 5% de CO 2 incubador humidificado a 37 ° C.
- Después de fibrilación completa capa, sobre la superficie de colágeno 5 mg de ASC-CSM (10, 000 células / mg) en suspensión en medios de cultivo (200 l). Después de las microesferas se han asentado sobre el gel, preparar el gel de fibrina-PEG como se describe en la sección 6.0, sin añadir ASC-CSM a la mezcla, y la capa PEGilado fibrinógeno / trombina solución sobre las capas ASC-CSM-colágeno. Al preparar el gel de fibrina-PEG, utilizar 250 l de medio de cultivo celular en lugar de tél 250 l de medio que contiene las células.
- Una vez completado, se incuban las construcciones de 30 minutos en un 5% de CO 2 humidificado incubadora para lograr la gelificación completa antes de alimentar a la construcción con el medio de cultivo.
- Después de la gelificación completa, coloque 1 mL de medio en la cámara alta sobre la construcción y 3 ml de medio en la cámara baja.
9. La materialización de soluciones de archivo
Nota: Todos los procedimientos se realizaron a temperatura ambiente a menos que se indique lo contrario.
- Acciones de cloruro de calcio (40 mM): Utilice sólo CaCl 2 .2 H 2 O. Disolver 588,4 mg de CaCl 2 .2 H 2 O con 100 ml de agua desionizada. Esterilizar utilizando un filtro de 0,22-micras.
- Polietilenglicol: PEG es altamente reactivo con el oxígeno y puede oxidarse cuando se exponen al aire ambiental. Como tal, el PEG se deben almacenar en atmósfera de nitrógeno (N 2) atmósfera. Accurately pesan 32 mg en un tubo de centrífuga de 2 ml (asegúrese de purgar los tubos con el N 2 antes de su uso) y almacenar a -80 ° C hasta que esté listo para su uso. Disolver 32 mg de PEG en 4 ml de solución de TBS antes de su uso.
Las siguientes soluciones deben ser fresca antes de cada experimento. - TBS solución: (pH 7.75-7.77 a 25 ° C; pH a 25 ° C es muy crítico). Para preparar 15 ml de solución de TBS, cuidadosamente disolver una tableta tampón en esterilizada por filtración de agua desionizada y ajustar el pH a requerida. No guarde la solución madre de preparar fresca cada vez.
- Solución de fibrinógeno: (40 mg / ml). Disolver polvo fibrinógeno en TBS para hacer la concentración de fibrinógeno de 40 mg / ml. Disolver que durante la noche utilizando un agitador magnético a 4 ° C. Es más fácil de disolver el entero 1-g cantidad con la cantidad requerida de TBS. El día siguiente, eliminar el fibrinógeno a partir de 4 ° C (generalmente turbia) y permitir quepara calentar en un baño de agua hasta una solución homogénea. Por último, filtrar esterilizar el fibrinógeno utilizando un filtro de 0,45-micras.
- Solución de trombina (25 unidades / ml): Para hacer la solución de trombina, pésese la cantidad requerida y se disuelven con la preparada 40 mM CaCl 2 .2 H 2 O. Siempre es una buena práctica utilizar el vial entero de la trombina para hacer el caldo. Ejemplo: Disolver una botella de 5 kU trombina con 200 mM de CaCl 2 .2 H 2 O, alícuota y almacenar a -20 ° C.
10. Los resultados representativos
El objetivo general de la técnica que aquí se presenta es demostrar el potencial de la matriz simultánea basada en la diferenciación de ASC en fenotipos múltiples usando CSM como vehículo de entrega. Se demuestra una estrategia in vitro para entregar las células madre de los CSM en una bicapa de colágeno-PEG-matrices de fibrina. Caracterización de ASC incrustado dentro de este reveale andamiod que ASC-cargados MCS puede ser "sandwich" entre una capa de colágeno y PEG-fibrina simultáneamente y diferencialmente tomar ejemplo de ambos ambientes extracelulares a prosperar bajo sus nuevas condiciones. En primer lugar, caracteriza la capacidad para el sistema modelo para mantener la viabilidad celular y la capacidad migratorias. El colágeno apoyó la capacidad de CSA para mantener su "troncalidad", como fue demostrado por su expresión de Stro-1 y su morfología similar a fibroblastos (Figura 2D y 2F). En contraste, el PEG-fibrina inducida los ASCs para diferenciar hacia un fenotipo vascular, como se demuestra por su morfología estructura similar a un tubo, su endotelial de células específicas de expresión del factor de von Willebrand (2E y 2G Figura), y pericitos expresión específica de factor de NG2 y plaquetas de crecimiento derivado del receptor beta (PDGFRβ) (datos no presentados). Además, estos fenotipos observados parecen ocurrir a principios de la cultura y se mantuvieron durante 11 días, como es demtrado en la Figura 3.
Tablas y Figuras
Beneficios de la bicapa de constructo:
- La sola andamio sin células pueden actuar como un andamio bioactivo.
- PEG-fibrina puede inducir a las células madre para diferenciar sin la adición de factores de crecimiento.
- El colágeno puede ayudar en el mantenimiento del fenotipo de células madre de la ASC.
- Un constructo bicapa puede ser utilizado como un sustrato activo para otros tipos de células a migrar y proliferar (por ejemplo, células endoteliales, fibroblastos, queratinocitos, células musculares lisas, pericitos).
- Se puede utilizar con andamios de ingeniería de los tejidos duros como los huesos hydroxyaptite o desmineralizada para regenerar el tejido duro y blando.
- Puede ser utilizado para desarrollar una de varias capas, diverso tejido modificado construcción (como dermo-vascular, vascular epitelial, dermo-hipodérmica vascular, etc.)
- Se utiliza una sola fuente de células para desarrollar simultáneamentecompartimentos multicelulares.
- Esto tiene el potencial para la integración con el tejido huésped, ya que es de origen natural.
- CSM dentro de la construcción de gel proporciona una plataforma para que las células migran de.
- El quitosano, utilizado para preparar CSM, es un bien conocido activa quimio-atrayente.
- El concepto general se aplica en este protocolo de "matriz impulsada por la diferenciación de células madre" se puede aplicar a otros tipos de células madre. Sin embargo, debe ampliarse la investigación para determinar la viabilidad de la matriz basada en la diferenciación. La bicapa andamio gel puede actuar como un depósito para entregar las células en una forma sostenida y controlada.
- Después de la reconstrucción, los geles todavía se puede separar en sus componentes individuales.
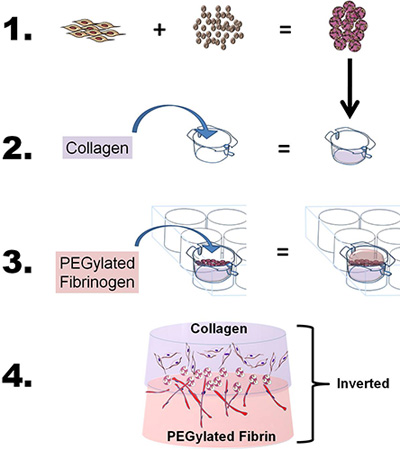
Figura 1. Esquemático que representa el objetivo general y el proceso de la técnica. 1) derivadas de tejido adiposo de células madre (ASC) se heADED en quitosano microesferas. 2) El colágeno se vierte entonces en un inserto 6-así, el pH se ajustó a fibrilar del colágeno, y el inserto se coloca en una cámara de placa de 6 pocillos. Las esferas CSM ASC-cargadas son entonces en capas sobre el colágeno. 3) El fibrinógeno PEGilada se vierte entonces sobre el colágeno (ASC-CSM) y gelifica mediante la adición de trombina. 4) El constructo bicapa final puede ser retirado de la inserción cultivo y se utiliza para in vitro o in vivo en el análisis.
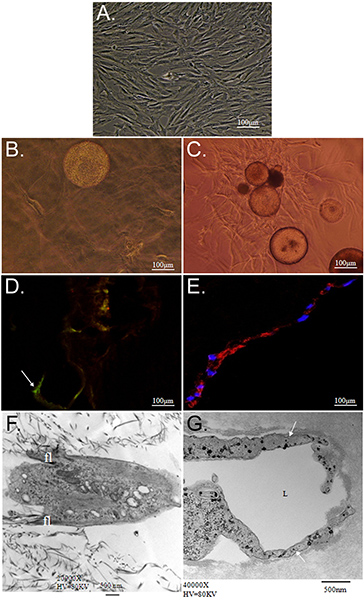
Caracterización de la Figura 2. De ASC cultivadas en colágeno y fibrina PEG-3D matrices. A) Fase de contraste de microfotografía de pasajes aislados ASC y mantenido mediante la rutina de 2 dimensiones técnicas de cultivo celular. Fotomicrografías B, D y F representan ASC-CSM cultivaron en un gel de colágeno 3-dimensional, mientras que C, E y G muestran ASC-CSM cultivaron en un 3-dimensional de PEG-gel de fibrina, tanto en el día 12. En B y C), ASC se muestran migrar fuera de la esfera CSM en ambos tipos de andamios. ASC parecen tener un aplanado, de tipo huso morfología en colágeno (B), manteniendo al mismo tiempo su expresión del marcador de células madre Stro-1 (D; flecha). Cuando se cultiva en PEG-fibrina ASCs exhiben más estructuras tubulares y son inducidos a expresar estos marcadores de células vasculares como factor von Willebrand (E). Microscopía electrónica de transmisión muestra la morfología típica demostrada por ASC dentro de cada andamio. ASC en gel de colágeno parecen tener menor filopodios (FL) que se extiende desde el cuerpo de la célula (F), mientras que ASCs forman típicamente lumenal (con la etiqueta L) estructuras (G; flecha).
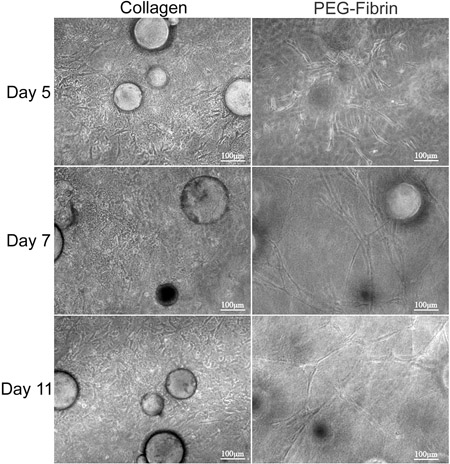
Figura 3. El análisis morfológico de ASC-MCS, entre las bicapas de colágeno y geles de PEG-fibrina. ASC-MCS, se "sándwich" entre el colágeno y los geles de PEG-fibrina y se mantienen en cultivo durante 11 días. La izquierda Column representa la migración y la proliferación de ASC dentro de la matriz de colágeno y parece tener una morfología de tipo huso. La columna de la derecha muestra ASC migran fuera de los MCS y la formación de estructuras tubulares en todo el gel de fibrina-PEG.
Discusión
ASCs son bien conocidos por su facilidad de aislamiento y la capacidad de diferenciar hacia diversos tipos de células. Con las técnicas descritas en este manuscrito, que son capaces de explotar la plasticidad de la ASC mediante la exposición de estas células para biomatrices múltiples simultáneamente. Como las células migran lejos de su base de CSM y entrar en su entorno extracelular, las células toman el ejemplo de la tarima y puede mantener la "troncalidad" (colágeno) o ser inducidas a diferenciarse...
Divulgaciones
No hay conflictos de intereses financieros existen.
Aviso legal
Las opiniones o afirmaciones contenidas en este documento son las opiniones particulares de los autores y no deben interpretarse como oficial o que refleja las opiniones del Departamento de Defensa o el Gobierno de los EE.UU.. Los autores son empleados del gobierno de EE.UU., y este trabajo fue preparado como parte de sus funciones oficiales. Todo el trabajo fue apoyado por el Ejército de los EE.UU. de Investigación Médica y el Comando de Material. Este estudio se llevó a cabo en virtud de un protocolo revisado y aprobado por la Investigación Médica del Ejército de EE.UU. y de la Junta de Revisión Institucional de Material de comandos y de acuerdo con el protocolo aprobado.
Agradecimientos
SN fue apoyado por una beca Postdoctoral Fellowship de la Iniciativa de Ingeniería de Tejidos de Pittsburgh. DOZ con el apoyo de una subvención concedida por La Fundación de Ginebra.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo / equipo | Empresa | Número de catálogo | Comentarios |
| Solución salina equilibrada de Hanks (HBSS) | Gibco | 14175 | Consumible |
| Suero Bovino Fetal | Hyclone | SH30071.03 | Consumible |
| La colagenasa tipo II | Sigma-Aldrich | C6685 | Consumible |
| 70-m Filtro de malla de nylon | BD Biosciences | 352350 | Consumible |
| 100-m nylon Filtro de malla | BD Biosciences | 352360 | Consumible |
| El crecimiento medio del sistema MesenPRO | Invitrogen | 12746-012 | Consumible |
| L-glutamina | Gibco | 25030 | Consumible |
| CaCl 2 .2 H 2 O | Sigma | C8106 | Consumible |
| T75 frasco de cultivo de tejidos | BD Biosciences | 137787 | Consumible |
| El quitosano | Sigma-Aldrich | 448869 | Consumible |
| Ácido Acético | Sigma-Aldrich | 320099 | Consumible |
| N-octanol | Acros Organics | 150630025 | Consumible |
| Sorbitan mono-oleato | Sigma-Aldrich | S6760 | Consumible |
| Hidróxido de potasio | Sigma-Aldrich | P1767 | Consumible |
| Acetona | Fisher Scientific | L-4859 | Consumible |
| Etanol | Sigma-Aldrich | 270741 | Consumible |
| Trinitro bencenosulfónico | Sigma-Aldrich | P2297 | Consumible |
| Ácido clorhídrico | Sigma-Aldrich | 320331 | Consumible |
| Éter etílico | Sigma-Aldrich | 472-484 | Consumible |
| 8 micras de tejido Inserta cultivo en placa | BD Biosciences | 353097 | Consumible |
| 1,5 ml Tubos de microcentrífuga | Pescador | 05-408-129 | Consumible |
| Reactivo MTT | Invitrogen | M6494 | Consumible |
| Dimetilsulfóxido | Sigma-Aldrich | D8779 | Consumible |
| Qtracker célula Etiquetado Kit (QRastreador de 655) | Sondas moleculares | Q2502PMP | Consumible |
| Colágeno tipo 1 | Travigen | 3447-020-01 | Consumible |
| Hidróxido de sodio | Sigma-Aldrich | S8045 | Consumible |
| 12 placas de cultivo tisular | BD Biosciences | 353043 | Consumible |
| El fibrinógeno | Sigma | F3879 | Consumible |
| La trombina | Sigma | T6884 | Consumible |
| Derivado benzotriazol de polietileno | Sunbio | DE-034GS | Consumible |
| Tampón Tris Tableta (pH 7,6) | Sigma | T5030 | Consumible |
| Centrifugar | Eppendorf | 5417R | Equillo |
| Agitador orbital | New Brunswick Scienctific | C24 | Equipo |
| Incubador humidificado con Air-5% de CO 2 | Thermo Scientific | Modelo 370 | Equipo |
| Agitador de varillas | IKA | Visc6000 | Equipo |
| Agitador magnético | Corning | PC-210 | Equipo |
| Desecador de vacío | - | - | Equipo |
| Analizador de Tamaño de Partículas | Malvern | STP2000 Spraytec | Equipo |
| Baño de agua | Fisher Scientific | Isotemp210 | Equipo |
| Espectrofotómetro | Beckman | Beckman Coulter DU Espectrofotómetro 800UV/Visible | Equipo |
| Vórtice | Diagger | 3030a | Equipo |
| Lector de microplacas | Molecular Devices | SpectraMax M2 | Equipo |
| Luz / microscopio de fluorescencia | Olimpo | IX71 | Equipo |
| Microscopio Confocal | Olimpo | FV-500 microscopio confocal de barrido láser | Equipo |
| Microscopio Electrónico de Barrido | Carl Zeiss MicroImaging | Leo 435 VP | Equipo |
| Microscopio Electrónico de Transmisión | JEOL | JEOL 1230 | Equipo |
Referencias
- Natesan, S. A bilayer construct controls adipose-derived stem cell differentiation into endothelial cells and pericytes without growth factor stimulation. Tissue Eng. Part A. 17, 941-953 (2011).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J Biomed Mater Res A. 81, 259-268 (2007).
- Willerth, S. M., Sakiyama-Elbert, S. E. Combining stem cells and biomaterial scaffolds for constructing tissues and cell delivery. , (2008).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, M. C. The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Zhang, G. A PEGylated fibrin patch for mesenchymal stem cell delivery. Tissue Eng. 12, 9-19 (2006).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Zhang, G. Vascular differentiation of bone marrow stem cells is directed by a tunable three-dimensional matrix. Acta Biomater. 6, 3395-3403 (2010).
- Rochon, M. H. Normal human epithelial cells regulate the size and morphology of tissue-engineered capillaries. Tissue Eng. Part A. 16, 1457-1468 (2010).
- Liu, H., Collins, S. F., Suggs, L. J. Three-dimensional culture for expansion and differentiation of mouse embryonic stem cells. Biomaterials. 27, 6004-6014 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados