Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Инжиниринг двухслойных гидрогель для управления ASC дифференциации
В этой статье
Резюме
Этот протокол фокусируется на использовании врожденной способности стволовых клеток брать пример с окружающих их внеклеточный матрикс и вызвать их дифференцировку в несколько фенотипов. Это методы рукопись расширяет наше описание и характеристика модели использования двухслойных гидрогель, состоящий из PEG-фибрин и коллаген, одновременно совместно дифференцировать жировой ткани стволовых клеток 1.
Аннотация
Природных полимеров на протяжении многих лет приобрели большее значение из-за их биосовместимостью хозяина и способность взаимодействовать с клетками, в пробирке и в естественных условиях. Область исследований, которая держит обещание в регенеративной медицине комбинаторной использование новых биоматериалов и стволовых клеток. Основная стратегия в области тканевой инженерии является использование трехмерных леса (например, decellularized внеклеточного матрикса, гидрогели, микро / нано частиц) для направления клеточной функции. Эта технология прошла путь от открытия, что клетки должны подложки, на которой они могут придерживаться, размножаться, и выражать свои дифференцированные клеточный фенотип и функции 2-3. Совсем недавно было также установлено, что клетки не только использовать эти субстраты для присоединения, а также взаимодействовать и принимать сигналы с матрицы подложки (например, внеклеточный матрикс, ECM) 4. Таким образом, клетки и леса имеют взаимные связи, чтослужит для контроля тканей развитию, организации и конечная функция. Жировая производные стволовые клетки (ИСС) являются мезенхимальные, не кроветворения стволовые клетки, присутствующие в жировой ткани, что может выставить несколько линия дифференциации и служить доступный источник клеток (т.е. предварительно сосудистой эндотелия и перицитов). Наша гипотеза состоит в том, что жировая стволовых клеток могут быть направлены на различные фенотипы одновременно просто совместного культивирования их в двухслойных матриц 1. Наша лаборатория ориентирована на кожный заживления ран. С этой целью мы создали один составной матрицы от природных биоматериалов, фибрин, коллаген и хитозан, которые могут имитировать характеристики и функции кожного конкретных раны окружающей среды исцеления ECM.
протокол
1. Изоляция жировой производные стволовые клетки (ИСС), 1, 5
Примечание: Все процедуры были выполнены при комнатной температуре, если не указано иное.
- Изолировать крысы паранефральная и придатка жировой и промыть буферной соли стерильной Хэнка решение (HBSS), содержащей 1% эмбриональной телячьей сыворотки (FBS), как описано выше 5. Это исследование было проведено в соответствии с Законом о животных, подзаконных актов животных и в соответствии с принципами руководства по уходу и использованию лабораторных животных.
- Фарш ткани и передавать 1-2 г на 25 мл HBSS, содержащим 1% FBS в 50 мл трубку и центрифуги в 500 г в течение 8 минут при комнатной температуре.
- Соберите свободно плавающего слоя жировой ткани и передачи 125-мл колбу и лечение с 25 мл коллагеназы тип II (200 ЕД / мл) в HBSS в течение 45 мин при 37 ° С на орбитальном шейкере (125 оборотов в минуту).
- Осторожно снимите жидкой фракции (ниже масла и жировой слой) на пипетировать и фильтровать его последовательно через 100 - мкм и 70 - мкм сетчатый фильтр из нейлона. Центрифуга фильтрата на 500 г в течение 10 мин при комнатной температуре, аспирации супернатант и осадок мыть дважды 25 мл HBSS.
- Ресуспендируют клеточный осадок в 50 мл среды роста (MesenPRO RS базальной среды) с добавлением MesenPRO RS роста дополнения, противогрибковых антибиотиков (100 ЕД / мл пенициллина G, 100 мкг / мл стрептомицина сульфата и 0,25 мкг / мл амфотерицина B), и 2 мМ L-глутамина и пипетки клетки на две колбы T75 (25 мл / колбы).
- Культура ASC в 5% CO 2-инкубаторе увлажненных при температуре 37 ° C (переход 2-4 ИСС используются для всех опытов).
2. Подготовка Хитозан микросфер (ЦСМС)
Примечание: Все процедуры были выполнены при комнатной температуре, если не указано иное.
- CSMS готовятся воды в масле эмульгирование процесс наряду с ионной техники коацервации используя наш предыдущий протокол 5. Эмульсию водный раствор хитозана (6 мл 3% вес / объем хитозана в 0,5 М уксусной кислоты) в 100 мл смеси масляная фаза, состоящая из соевого масла, октаноле (1:2 об / об) и 5 % сорбитан-моноолеат (диапазон 80) эмульгатор, с использованием накладных (1700 оборотов в минуту) и магнитной мешалкой (1000 оборотов в минуту), одновременно в противоположных направлениях. Этот двойной метод смешивания гарантирует, что мицеллы образуются на ранних стадиях до сшивания происходит, может оставаться в растворе и не осели на дно. Кроме того, магнитная мешалка средств в де-объединения хитозана в мицеллообразования и rigidization.
- Размешайте смесь непрерывно перемешивают в течение примерно 1 часа до стабильного водно-нефтяной эмульсии получается. Начать ионных сшивки с добавлением 1,5 мл 1% вес / объем гидроксида калия в октаноле каждые 15 мин в течение 4 ч (24 мл общего числа) После завершения реакции сшивания, медленно слейте масло фазы смеси, содержащей CSM и сразу же добавить 100 мл ацетона, решение будет облачно, из-за нефтяных остатков. Через 5 минут, слейте, добавьте еще 100 мл ацетона и инкубировать в течение ночи при комнатной температуре. На следующий день, вновь промыть бисер с ацетоном в течение пяти минут. После выполнения этих серийных моет решение должно превратились ясно, если не продолжать стиральная пока все масло удаляется, а ацетон раствор не станет прозрачным.
- Высушите восстановленные сферы в вакуум-эксикаторе и анализа без дополнительной обработки. Вы можете определить средний размер частиц CSM, площадью в миллиграммах, а блок кубический объем с помощью анализатора размера частиц.
- В последующих экспериментах, мыть CSM три раза стерильной водой для удаления остатков солей и стерилизовать стиральная ночь с 5 мл абсолютного этанола.
3. ОпределениеКоличество свободных аминогрупп в CSMS
Примечание: Все процедуры были выполнены при комнатной температуре, если не указано иное.
- Определить количество свободных аминогрупп в настоящее время ЦСМС после ионной сшивки с помощью тринитро бензолсульфоновая (TNBS) кислоты из анализа Bubnis и Ofner 6. Инкубировать 5 мг микросфер с 1 мл 0,5% раствора TNBS в 50 мл стеклянную трубку в течение 4 ч при 40 ° С и гидролиза с добавлением 3 мл 6N HCl при 60 ° С в течение 2 часов.
- Охладите образцы до комнатной температуры и извлечения свободным TNBS добавлением 5 мл дистиллированной воды и 10 мл этилового эфира.
- Теплый 5 мл аликвоты водной фазы до 40 ° С на водяной бане в течение 15 минут для испарения остаточной эфир, охладить до комнатной температуры и разбавляют 15 мл воды.
- Измерьте оптическую плотность при 345 нм с помощью спектрофотометра использованием TNBS решение без хитозана как пустые и хитозана для CSM рвозмещение ущерба, чтобы определить общее количество аминогрупп. Оцените количество свободных аминогрупп CSM относительно хитозана.
4. Загрузка ASC в CSM
Примечание: Все процедуры были выполнены при комнатной температуре, если не указано иное.
- Уравновешивать 5 мг стерилизовать CSMS из раздела 2.5 в стерильной HBSS в ночное время и добавить в 8 - мкм размер пор мембраны культуры пластины вставки (24-луночного планшета).
- После CSMS поселились на мембране, тщательно аспирации HBSS и добавить 300 мкл питательной среды для внутренней вставкой и 700 мкл питательной среды за пределы вставки.
- Ресуспендируйте ИСС в соответствующей концентрации (1 × 10 4 до 4 × 10 4) в 200 мкл среднего роста и семян на МКС внутри вставки пластины культуры. Окончательный объем среды в культуре вставки, после посева, составляет 500 мкл.
- Incubели ASC семенами на CSMS в течение 24 ч в 5% CO 2 увлажненном инкубаторе при температуре 37 ° C.
5. Определение Процент ASC Загрузка и жизнеспособность клеток в CSMS
Примечание: Все процедуры были выполнены при комнатной температуре, если не указано иное.
- После инкубации пипетки ASC-загруженным CSM в стерильном 1,5 мл микроцентрифужных трубы, не нарушая клетки, которые мигрировали в вставкой мембраны.
- Удаление остаточных средних и добавить 250 мкл свежей среды, рост к трубе.
- В каждую пробирку, добавляют 25 мкл МТТ [3 - (4,5-dimethylthiozole-2-ил) -2,5-diphenyltetrazolium метила] решение (5 мг / мл) и инкубировать в течение 4 ч в 5% CO 2 увлажненный инкубаторе при температуре 37 ° C.
- После инкубации удалить среды, добавить 250 мкл диметилсульфоксида, и вихрь смесь в течение 2-5 мин для растворения формазана комплекса.
- Центрифуга CSM в 2700 гв течение 5 мин, пипетка с супернатант и определить его длину волны поглощения при 570 нм и 630 нм с использованием стандартных планшетов, в соответствии со спецификацией производителя МТТ.
- Определить количество клеток связано с ЦСМС по отношению к значениям, полученным от определенных номеров ASC культивировали разработать стандартную кривую.
6. Подготовка и характеристика ASC-CSM встроенный в PEG-фибрин Гели
Примечание: Все процедуры были выполнены при комнатной температуре, если не указано иное.
- Полиэтиленгликоля (PEG) фибрина (PEG-фибрин) гидрогель подготовленный Саггс и др. 7, растворение сукцинимидил glutarate изменение полиэтиленгликоля (ПЭГ, 3400 Да). С помощью 4 мл трис-буферном растворе (TBS, рН 7.8) и фильтр стерилизовать с 0.22-мкм фильтр непосредственно перед началом эксперимента. Растворенный PEG действует только в этой заявке на первые 3-4 часа.
- Смешать 500 иму, л акции фибриноген (40 мг / мл в TBS, рН 7,8) и 250 мкл ПЭГ акции в культуре и 6-луночный планшет и инкубировать в течение 20 минут в 5% CO 2 увлажненном инкубаторе при температуре 37 ° C. Эта смесь является молярное отношение концентрации 1:10, SG-PEG-SG: фибриногена.
- Возьмите 250 мкл ASC-CSM в концентрации 5 мг CSM (≈ 2 × 10 4 клеток) и смешать с пегилированный решение фибриногена.
- Сразу добавляют 1 мл тромбина акций (25U/mL) и быстро растереть один или два раза с помощью пипетки. После смешивания тромбина с PEG-фибриногена, немедленно разместить клетки-гель смеси в 12-луночного планшета и инкубировали в 5% CO 2 увлажненном инкубаторе при температуре 37 ° С в течение 10 мин, чтобы обеспечить полную гелеобразования. Так как время гелеобразования быстро, не пытайтесь удерживать гель решение в пипетки более чем на 5 секунд. Пегилированный фибриноген расщепляется тромбином и образует гидрогель пегилированный фибрина. Таким образом, яэлектронной конечный продукт гель называется PEG-фибрина.
- Вымойте PEG-фибрин гели дважды HBSS и инкубировать с альфа минимальный необходимый носитель (α-MEM) с добавлением 10% FBS в 5% CO 2 увлажненном инкубаторе при температуре 37 ° C.
- Обратите внимание на миграцию клеток из CSM в гель в течение 11-дневного периода с использованием стандартных методов световой микроскопии.
7. Подготовка и характеристика ASC-CSM встроенный в коллагеновых гелях
Примечание: Все процедуры были выполнены при комнатной температуре, если не указано иное.
- Mix ASC-CSM (5 мг содержащих ≈ 2 × 10 4 клеток) с коллагена 1 типа (7,5 мг / мл), выделенных из сухожилий хвоста крысы в соответствии с методом Борнштейн 8 и фибриллировать после корректировки рН до 6,8 использовании 2N NaOH.
- Добавить фибриллированная коллагена ASC-CSM смесь на 12-луночного планшета и инкубировать в течение 30 мин в 5% CO 2 humidiFied инкубаторе при температуре 37 ° C.
- После полного аритмия, инкубировать коллагена ASC-CSM гели до 11 дней в 5% CO 2 увлажненном инкубаторе при температуре 37 ° C.
- Обратите внимание на миграцию клеток из CSM в гель в течение 11-дневного периода с использованием стандартных методов микроскопии.
8. Развитие двухслойных PEG-фибрин-(ASC-CSM) Коллаген гель Конструкции
Примечание: Все процедуры были выполнены при комнатной температуре, если не указано иное.
- Для разработки двухслойных построить, подготовить как коллаген и фибрин PEG-гели как описано выше, с небольшими изменениями. Короче говоря, для изучения миграционных и сотрудничества индукции свойства одного источника стволовых клеток с помощью двух bioscaffolds, "сэндвич" ASC-CSMS между коллагена и PEG-фибрин леса с помощью четырех шагов: 1) Нагрузка ASC на CSM, 2) бросить фибриллированная гель слой коллагена и ASC-CSM бисером на колЛаген гель, 3) литье PEG-фибринового геля на ASC-CSM-коллагеновый гель и позволяют закрепить гелем, и 4) добавить средне хорошо и вставить изучать клетки в пробирке или удалить из вставки в естественных приложений (см. Рисунок 1 ).
- Подготовить 1 мл коллагена типа 1 (7,5 мг / мл) смеси, как описано выше в п. 7.1, не добавляя ASC-CSM в смесь. Поместите смесь в 6-и культуре тканей вставки (8 мкм, размер пор) и инкубировать в течение 30 мин в 5% CO 2 увлажненном инкубаторе при температуре 37 ° C.
- После полного аритмия, слой над поверхностью коллагена 5 мг ASC-CSM (10 000 клеток / мг), взвешенных в культуре средств массовой информации (200 мкл). После того, микросферы осели в гель, подготовить PEG-фибринового геля, как описано в разделе 6.0, без добавления ASC-CSM в смеси, а слой пегилированный фибриногена / тромбина решение по ASC-CSM-коллагеновые слои. При подготовке PEG-фибринового геля, использовать 250 мкл клеточной среде культуры вместо тон 250 мл среды, содержащей клетки.
- После завершения инкубации конструкций в течение 30 мин в 5% CO 2 увлажненном инкубаторе для достижения полной геля перед подачей конструкция с питательной среде.
- После завершения гелеобразования, место 1 мл среды в верхней палате по конструкции и 3 мл среды в нижней палате.
9. Создание растворы
Примечание: Все процедуры были выполнены при комнатной температуре, если не указано иное.
- Кальций хлористый акции (40 мм): Используйте только CaCl 2 · 2H 2 O. Растворите 588,4 мг CaCl 2 · 2H 2 O с 100 мл дистиллированной воды. Стерилизовать использованием 0.22-мкм.
- Полиэтиленгликоль: PEG очень реагируют с кислородом и может стать окисленных при контакте с воздухом. Таким образом, PEG должны храниться в атмосфере азота (N 2) атмосферы. Точностьurately весом 32 мг в 2-мл центрифужные пробирки (не забудьте очистить трубы № 2 перед использованием) и хранить при температуре -80 ° C до готовности к использованию. Растворите 32 мг ПЭГ в 4 мл TBS раствор перед использованием.
Следующие решения должны быть свежими перед каждым экспериментом. - TBS решение: (рН 7.75-7.77 при 25 ° С, рН при 25 ° С имеет очень важное значение). Для подготовки 15 мл раствора TBS, тщательно растворите одну таблетку в буфер фильтр стерилизовать деионизированной воды и приспособиться к необходимой рН. Не храните маточного раствора, готовить свежую каждый раз.
- Фибриноген решение: (40 мг / мл). Растворите порошок в фибриногена TBS, чтобы концентрации фибриногена в дозе 40 мг / мл. Растворите в одночасье с использованием магнитной мешалки при температуре 4 ° C. Это проще распустить весь 1-г величина с необходимым количеством TBS. На следующий день, удалить фибриногена от 4 ° C (как правило, облачно) и дайте емунагреть на водяной бане до однородной раствор. Наконец, фильтр стерилизуют фибриногена использованием 0,45 мкм.
- Тромбин решение (25 ед / мл): Для того, чтобы решение тромбина, взвесить необходимое количество и растворяются с подготовленной 40 мМ CaCl 2 · 2H 2 O. Это всегда хорошая практика, чтобы использовать весь флакон тромбина, чтобы сделать запас. Пример: Растворите бутылку из 5-ку тромбина с 200 мМ CaCl 2 · 2H 2 O, аликвоты и хранят при температуре -20 ° C.
10. Представитель Результаты
Общая цель техники, представленные здесь, чтобы продемонстрировать возможности одновременного матрицы управляемой дифференциации АСК на несколько фенотипов использованием CSM, как средство доставки. Мы демонстрируем в пробирке стратегии доставить стволовые клетки из CSMS в двухслойных коллаген ПЭГ-фибрин эшафот. Характеристика ASC встроенный в эту леса revealeг, что ASC-загруженным CSMS может быть "зажата" между слой коллагена и PEG-фибрин одновременно и дифференцированно взять пример с внеклеточной среде и процветать под новые условия. Сначала характеризуется возможностью для модельной системы для поддержания жизнеспособности клеток и миграционных возможностей. Коллаген поддерживает возможность ИСС для поддержания их "stemness", как было продемонстрировано их выражение Стро-1 и их фибробластоподобных морфологии (рис. 2D и 2F). В отличие от PEG-фибрин индуцированные ИСС дифференцировать к сосудистой фенотип, о чем свидетельствует их ламповую структуру морфологии, их эндотелиальных клеток-конкретное выражение фактор фон Виллебранда (2E Рисунок и 2G) и перицитов конкретным выражением NG2 и тромбоцитарный рецептор фактора роста бета (PDGFRβ) (данные не представлены). Кроме того, эти наблюдаемых фенотипов появился происходят рано в культуре и сохранялись в течение 11 дней, как это демровал на рисунке 3.
Таблицы и рисунки
Преимущества двухслойной конструкции:
- Леса в одиночку, без клетки могут выступать в качестве биологически активных эшафот.
- PEG-фибрина может вызвать стволовых клеток дифференцироваться без добавления ростовых факторов.
- Коллаген может помочь в поддержании фенотипа стволовых клеток ИСС.
- Двухслойная конструкция может быть использована в качестве активного субстрата для других типов клеток мигрировать и размножаться (например, эндотелиальные клетки, фибробласты, кератиноциты, клетки гладкой мускулатуры, перицитов).
- Он может быть использован с жесткой тканевой инженерии леса как hydroxyaptite или деминерализованной кости для восстановления мягких и твердых тканей.
- Она может быть использована для создания многослойной, разнообразной тканевой инженерии конструкции (например, кожно-сосудистых, сосудисто-эпителиальные, кожно-сосудисто-гиподермальные и т.д.).
- Он использует одноклеточные источник одновременно развиватьмногоклеточных отсеков.
- У него есть потенциал для интеграции с тканями организма, поскольку он имеет естественное происхождение.
- CSM в гель конструкция обеспечивает платформу для клетки мигрируют из.
- Хитозан, используемых для подготовки CSM, это известные активные химио-приманки.
- Общая концепция применяется в этом протоколе «матрицы управляемой дифференциации стволовых клеток", может быть применена к другим типам стволовых клеток. Тем не менее, дальнейшее расследование является оправданным для определения целесообразности матрицы управляемой дифференциации. Двухслойных гель леса могут выступать в качестве резервуара для доставки клеток в устойчивых и контролируемым образом.
- После реконструкции, гели все еще может быть разделена на отдельные компоненты.
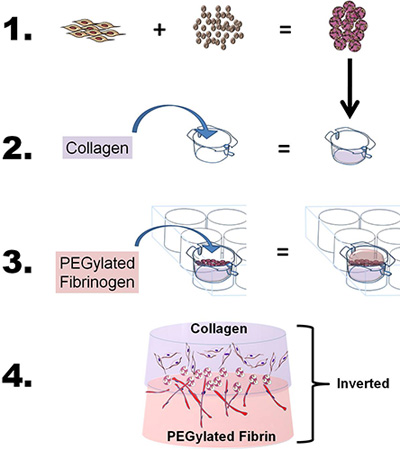
Рисунок 1. Схема изображающая общую цель и процесс техники. 1) Жировая производные стволовые клетки (ИСС) являются лоaded на хитозана микросферы. 2) Коллаген затем выливают в 6-и вставки, рН доводили до фибриллировать коллагена и вставки помещается в 6-луночный планшет камеры. ASC-загруженным сферах CSM затем накладываются коллагена. 3) пегилированный фибриногена затем облили коллагена (ASC-CSM) и гель при добавлении тромбина. 4) конечная конструкция бислоя могут быть удалены из культуры вставки и использоваться в пробирке или в естественных условиях анализа.
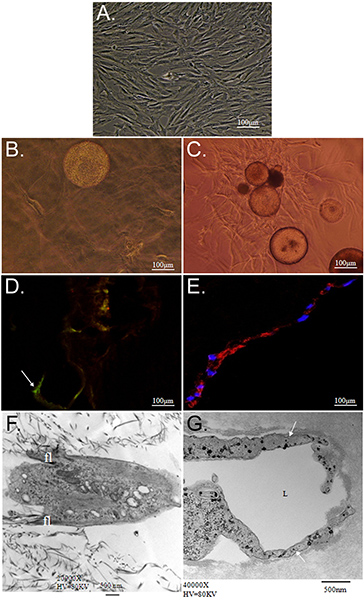
Рисунок 2. Характеристика ASC культивировали в течение коллагена и PEG-фибрин 3D-матрицы. А) фазового контраста Микрофотография изолированной ASC пассировать и поддерживается с помощью обычных 2-мерные методы клеточной культуре. Микрофотографии B, D, F и изображать ASC-CSM культивировали в течение 3-х мерного коллагеновый гель, в то время как C, E, G и шоу ASC-CSM культивировали в течение 3-х мерного PEG-фибринового геля, как на 1-й день2. В B и C), ИСС показаны мигрируют от CSM сферы в обоих типах леса. ИСС, как представляется, плоский, как веретено морфологии коллагена (B), при сохранении их экспрессии маркера стволовых клеток Стро-1 (D, стрелка). При культивировании в PEG-фибрин ИСС обладают более ламповую структур и вынуждены выражать такие сосудистые маркеры ячейки как фактор фон Виллебранда (E). Просвечивающей электронной микроскопии показана типичная морфология свидетельствует ИСС в каждой эшафот. ИСС в коллагеновый гель, кажется, есть меньше филоподии (П) простирается от тела клетки (F), в то время как ИСС обычно формируется lumenal (обозначение L) структур (G; стрелкой).
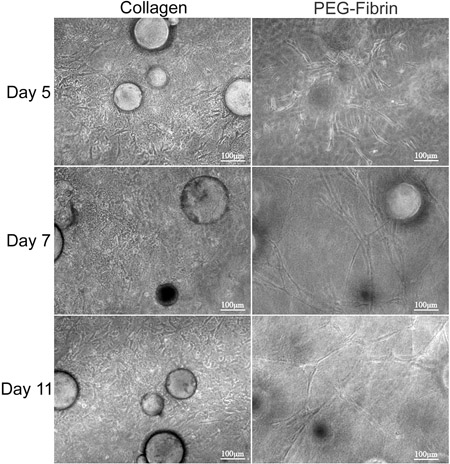
Рисунок 3. Морфологический анализ ASC-CSMS между бислоев коллагена и фибрина PEG-гели. ASC-ЦСМС были «зажаты» между коллагена и PEG-фибрин гели и поддерживаться в культуре в течение 11 дней. Левая coluмлн. изображает ИСС миграции и пролиферации в коллагеновой матрице и, кажется, взять на шпиндель, как морфология. В правой колонке показаны ИСС миграции от CSMS и формирования ламповую структур в PEG-фибринового геля.
Обсуждение
ИСС хорошо известны за их простоту изоляции и способность различать на различные типы клеток. С методами, описанными в этой рукописи, мы можем использовать пластичность ИСС, подвергая эти клетки на несколько biomatrices одновременно. Как клетки мигрируют от их CSM базу и ввести окружающих их ?...
Раскрытие информации
Нет конкурирующих финансовых интересов существуют.
Отказ от ответственности
Мнения или утверждения, содержащиеся в настоящем личные взгляды авторов и не должно истолковываться как официальная или отражает мнение министерства обороны или американского правительства. Авторами являются сотрудники правительства США, и эта работа была подготовлена в рамках своих служебных обязанностей. Все Работа выполнена при поддержке армии США медицинских исследований и материального командования. Данное исследование было проведено в рамках протокола рассматриваются и утверждаются в армии США медицинских исследований и материального командной Экспертный совет организации и в соответствии с утвержденным протоколом.
Благодарности
Н. была поддержана Грантом Докторантура стипендий от инженерной инициативы тканей Питтсбурге. ДОЗ поддерживается гранта от Фонда Женеве.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента / оборудование | Компания | Номер по каталогу | Комментарии |
| Хэнкс сбалансированный солевой раствор (HBSS) | Гибко | 14175 | Потребляемый |
| Эмбриональной телячьей сыворотки | Hyclone | SH30071.03 | Потребляемый |
| Коллагеназы II типа | Sigma-Aldrich | C6685 | Потребляемый |
| 70-мкм нейлоновая сетка фильтра | BD Biosciences | 352350 | Потребляемый |
| 100 мкм нейлоновая сетка фильтра | BD Biosciences | 352360 | Потребляемый |
| MesenPRO рост средней система | Invitrogen | 12746-012 | Потребляемый |
| L-Глютамин | Гибко | 25030 | Потребляемый |
| CaCl 2 · 2H 2 O | Сигма | C8106 | Потребляемый |
| T75 тканевой культуры колбу | BD Biosciences | 137787 | Потребляемый |
| Хитозан | Sigma-Aldrich | 448869 | Потребляемый |
| Уксусная кислота | Sigma-Aldrich | 320099 | Потребляемый |
| Октаноле | Acros Organics | 150630025 | Потребляемый |
| Сорбитан-моноолеат | Sigma-Aldrich | S6760 | Потребляемый |
| Гидроксид калия | Sigma-Aldrich | P1767 | Потребляемый |
| Ацетон | Fisher Scientific | L-4859 | Потребляемый |
| Этанол | Sigma-Aldrich | 270741 | Потребляемый |
| Тринитро бензолсульфокислота | Sigma-Aldrich | P2297 | Потребляемый |
| Соляная кислота | Sigma-Aldrich | 320331 | Потребляемый |
| Этиловый эфир | Sigma-Aldrich | 472-484 | Потребляемый |
| 8 мкм ткани Вставки культуры плиты | BD Biosciences | 353097 | Потребляемый |
| 1,5 мл Трубы Микроцентрифуга | Рыбак | 05-408-129 | Потребляемый |
| МТТ реагентов | Invitrogen | M6494 | Потребляемый |
| Диметилсульфоксида | Sigma-Aldrich | D8779 | Потребляемый |
| Qtracker мечения клеток Kit (QTracker 655) | Молекулярные зонды | Q2502PMP | Потребляемый |
| Коллаген типа 1 | Travigen | 3447-020-01 | Потребляемый |
| Едкий натр | Sigma-Aldrich | S8045 | Потребляемый |
| 12-луночных тканевой культуры | BD Biosciences | 353043 | Потребляемый |
| Фибриноген | Сигма | F3879 | Потребляемый |
| Тромбин | Сигма | T6884 | Потребляемый |
| Benztriazole Производная полиэтилена | Sunbio | DE-034GS | Потребляемый |
| Tris буфера Tablet (рН 7,6) | Сигма | T5030 | Потребляемый |
| Центрифугировать | Эппендорф | 5417R | Оборpment |
| Орбитальный Шейкер | Нью-Брансуик Scienctific | C24 | Оборудование |
| Увлажненном инкубаторе с воздушным 5% CO 2 | Thermo Scientific | Модель 370 | Оборудование |
| Накладные мешалки | IKA | Visc6000 | Оборудование |
| Магнитная мешалка | Гранулирование | PC-210 | Оборудование |
| Вакуум-эксикатор | - | - | Оборудование |
| Анализатор размеров частиц | Малверн | STP2000 Spraytec | Оборудование |
| Водяная баня | Fisher Scientific | Isotemp210 | Оборудование |
| Спектрофотометр | Beckman | Beckman Coulter DU 800UV/Visible спектрофотометр | Оборудование |
| Вихревой | Diagger | 3030a | Оборудование |
| Считыватель микропланшетов | Molecular Devices | SpectraMax M2 | Оборудование |
| Свет / флуоресцентный микроскоп | Олимп | IX71 | Оборудование |
| Конфокальной микроскопии | Олимп | FV-500 лазерный сканирующий конфокальный микроскоп | Оборудование |
| Сканирующий электронный микроскоп | Carl Zeiss MicroImaging | Лев 435 VP | Оборудование |
| Просвечивающего электронного микроскопа | JEOL | JEOL 1230 | Оборудование |
Ссылки
- Natesan, S. A bilayer construct controls adipose-derived stem cell differentiation into endothelial cells and pericytes without growth factor stimulation. Tissue Eng. Part A. 17, 941-953 (2011).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J Biomed Mater Res A. 81, 259-268 (2007).
- Willerth, S. M., Sakiyama-Elbert, S. E. Combining stem cells and biomaterial scaffolds for constructing tissues and cell delivery. , (2008).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, M. C. The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Zhang, G. A PEGylated fibrin patch for mesenchymal stem cell delivery. Tissue Eng. 12, 9-19 (2006).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Zhang, G. Vascular differentiation of bone marrow stem cells is directed by a tunable three-dimensional matrix. Acta Biomater. 6, 3395-3403 (2010).
- Rochon, M. H. Normal human epithelial cells regulate the size and morphology of tissue-engineered capillaries. Tissue Eng. Part A. 16, 1457-1468 (2010).
- Liu, H., Collins, S. F., Suggs, L. J. Three-dimensional culture for expansion and differentiation of mouse embryonic stem cells. Biomaterials. 27, 6004-6014 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены