A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הנדסת Hydrogel Bilayered לשלוט בידול ASC
In This Article
Summary
פרוטוקול זה מתמקד ניצול היכולת הטמונה בתאי גזע כדי לקחת את המקל מ מטריקס הסובבת אותם תאי ו להיגרם להתמיין פנוטיפים רבים. זה כתב היד שיטות משתרע תיאור שלנו ואפיון של המודל ניצול הידרוג bilayered, המורכבת PEG-הפיברין וכן קולגן, בו זמנית לשתף להבדיל השומן שמקורם בתאי גזע 1.
Abstract
פולימרים טבעיים לאורך השנים זכו חשיבות גדולה יותר בגלל biocompatibility המארח שלהם ואת היכולת לתקשר עם תאים במבחנה in vivo. תחום מחקר זה טומן בחובו הבטחה ברפואה רגנרטיבית הוא השימוש קומבינטורית של biomaterials הרומן ותאי גזע. האסטרטגיה הבסיסית בתחום של הנדסת רקמות הוא השימוש תלת ממדי הפיגום (למשל, decellularized תאי מטריקס, הידרוג, מיקרו / ננו חלקיקים) על בימוי תפקוד התא. טכנולוגיה זו התפתחה מן הגילוי כי תאים צריך המצע שעליו הם יכולים להתאים, מתרבים, ומבטאים פנוטיפ מובחן הסלולר שלהם פונקציה 2-3. לאחרונה, הוכח גם קבע כי התאים לא רק להשתמש אלה מצעים של דבקות, אלא גם לתקשר ולקבל רמזים מן המצע מטריקס (Matrix למשל, תאית, ECM) 4. לכן, התאים ופיגומים יש קשר גומלין זהמשמש לשלוט בפיתוח רקמות, ארגון ותפקוד האולטימטיבי. השומן שמקורם בתאי גזע (ASCs) הם mesenchymal, לא hematopoetic בתאי גזע הנמצאים ברקמות השומן שניתן להציג רב שושלת דיפרנציאציה לשמש מקור וזמין של תאים (כלומר מראש כלי דם endothelia ו pericytes). ההשערה שלנו היא כי השומן שמקורם בתאי גזע יכולה להיות מופנית כלפי פנוטיפים שונים בו זמנית, פשוט על ידי שיתוף culturing אותם מטריצות bilayered 1. המעבדה שלנו מתמקדת בריפוי פצעים עורי. לצורך כך, יצרנו מטריצה מורכב אחד מן biomaterials טבעיים, הפיברין, קולגן, ו chitosan שיכולים לחקות את המאפיינים והפונקציות של הסביבה עורי ספציפי ריפוי הפצע ECM.
Protocol
1. בידוד השומן שמקורם בתאי גזע (ASCs) 1, 5
הערה: כל הנהלים בוצעו בטמפרטורת החדר אלא אם צוין אחרת.
- לבודד את השומן עכברוש perirenal ו epididymal ולשטוף עם פתרון שנאגרו האנק של מלח סטרילית (HBSS) המכיל 1% בסרום שור עוברית (FBS) כפי שתואר קודם לכן 5. מחקר זה נערך בהתאם לחוק לרווחת בעלי חיים, רווחה תקנות ליישום בעלי חיים ועל פי עקרונות מדריך לטיפול ושימוש בחיות מעבדה.
- לרכך את הרקמה ולהעביר 1-2 גרם בתוך 25 מ"ל של HBSS המכילים FBS 1% אל תוך צינור 50 מ"ל ו - 500 גרם צנטריפוגות ב 8 דקות בטמפרטורת החדר.
- איסוף הספונטנית רקמת שומן שכבת והעברה Erlenmeyer בקבוק 125 מ"ל, ולטפל עם 25 מ"ל של collagenase מסוג II (200 יח' / מ"ל) ב HBSS 45 דקות ב 37 מעלות צלזיוס על שייקר מסלולית (125 סל"ד).
- מוציאים בזהירות את החלק היחסי נוזלי (להלן נפט שכבת השומן) על ידי pipeting ולסנן אותו ברצף עד 100 - מסנן ניילון מיקרומטר רשת - מיקרומטר ו 70. בצנטריפוגה תסנין ב 500 גרם 10 דקות בטמפרטורת החדר, לשאוב supernatant, ולשטוף גלולה פעמיים עם 25 מ"ל של HBSS.
- Resuspend תא גלולה ב 50 מ"ל של מדיום הגידול (MesenPRO בינוני RS בסל) השלימו עם תוספת RS צמיחה MesenPRO, אנטיביוטיקה antimycotic (100 U / mL של פניצילין G, 100 מיקרוגרם / מ"ל של סולפט סטרפטומיצין, ו 0.25 מיקרוגרם / מ"ל של amphotericin B), ו 2 מ"מ של גלוטמין-L ותאי פיפטה לשתי צלוחיות T75 (25 מ"ל / בקבוק).
- תרבות ASC ב 5% 2-CO humidified החממה ב 37 ° C (המעבר 2-4 ASCs משמשים לניסויים בכלל).
2. הכנת Chitosan microspheres (CSMs)
הערה: כל הנהלים בוצעו בטמפרטורת החדר אלא אם צוין אחרת.
- CSMs מוכנים בתהליך תחליב מים בתוך שמן יחד עם הטכניקה coacervation יוניים באמצעות פרוטוקול הקודמת שלנו 5. Emulsify בתמיסה מימית של chitosan (6 מ"ל של chitosan 3% w / v ב 0.5 M של חומצה אצטית) ל -100 מ"ל של תערובת שמן השלב המורכב שמן סויה, N-octanol (01:02 v / v) ו - 5 sorbitan-מונו oleate% (טווח 80) מתחלב, באמצעות תקורה (1,700 סל"ד) ו בחישה מגנטי (1000 סל"ד) בו זמנית בכיוונים מנוגדים. בשיטה הכפולה של ערבוב מבטיח כי micelles נוצרו בשלב מוקדם לפני cross-linking מתרחשת יכול להישאר פתרון ולא להסתפק לתחתית. יתר על כן, מערבבים המגנטי בר מסייע דה צבירה chitosan במהלך היווצרות micelle ו rigidization.
- המהומה עוררה תערובת ברציפות במשך שעה כ 1 עד האמולסיה יציבה מים על שמן מתקבל. ליזום צלב יונית קישור עם תוספת של 1.5 מ"ל של הידרוקסיד W / V 1% אשלגן דקות N-octanol 15 עבור כל 4 שעות (24 בסך הכל מ"ל)
- לאחר השלמת התגובה הצלב קישור, למזוג לאט את השלב הנפט של CSM תערובת המכילה ומיד להוסיף 100 מ"ל של אצטון, הפתרון יהיה מעונן, עקב שאריות שמן. לאחר 5 דקות, למזוג, מוסיפים 100 מ"ל נוספת של אצטון דגירה הלילה בטמפרטורת החדר. למחרת, מחדש לשטוף את החרוזים עם אצטון במשך חמש דקות. לאחר ביצוע סדרתי אלה שוטף הפתרון צריך הפכה ברורה, אם לא להמשיך כביסה עד שכל השמן מוסר והפתרון אצטון ברור.
- לייבש את התחומים התאוששה תא ייבוש ואקום וניתוח ללא עיבוד נוסף. אתה יכול לקבוע את גודל החלקיקים הממוצע CSM, שטח הפנים מיליגרם, והיקף יחידת מעוקב באמצעות Analyzer גודל החלקיקים.
- ניסויים שבאו לאחר מכן, לשטוף את CSM שלוש פעמים עם מים סטריליים כדי להסיר מלחים שיורית לעקר על ידי שטיפה לילה עם 5 מ"ל של אתנול מוחלט.
3. קביעתמספר קבוצות אמינו חופשיות ב CSMs
הערה: כל הנהלים בוצעו בטמפרטורת החדר אלא אם צוין אחרת.
- לקבוע את מספר קבוצות אמינו חופשיות הנמצאים CSMs לאחר צלב יונית קישור באמצעות benzenesulfonic trinitro (TNBS) assay של חומצה Bubnis ו Ofner 6. דגירה של 5 מ"ג microspheres עם 1 מ"ל של תמיסת TNBS 0.5% בצינור 50 מ"ל כוס של 4 שעות ב 40 מעלות צלזיוס, hydrolyze עם תוספת של 3 מ"ל של HCl 6N על 60 מעלות צלזיוס למשך 2 שעות.
- לקרר את דגימות לטמפרטורת החדר ולחלץ את TNBS בחינם על ידי הוספת 5 מ"ל מים deionized ו 10 מ"ל של אתיל אתר.
- לחמם aliquot 5 מ"ל של שלב מימית עד 40 מעלות צלזיוס באמבט מים במשך 15 דקות להתאדות בכל האתר שיורית, מצננים לטמפרטורת החדר, לדלל עם 15 מ"ל מים.
- למדוד את ספיגת ב 345 ננומטר עם ספקטרופוטומטר באמצעות פתרון TNBS ללא chitosan כמו ריק chitosan המשמש CSM עמ 'פיצוי על מנת לקבוע את המספר הכולל של קבוצות אמינו. להעריך את מספר קבוצות אמינו חופשיות של CSM ביחס chitosan.
4. טוען ASC ב CSM
הערה: כל הנהלים בוצעו בטמפרטורת החדר אלא אם צוין אחרת.
- לאזן 5 מ"ג CSMs מעוקרות של סעיף 2.5 ב HBSS סטריליים לילה ולהוסיף 8 - נקבוביות מיקרומטר בגודל הממברנה התרבות להוסיף צלחת (24 גם צלחת).
- לאחר CSMs את התיישבו על הממברנה, בזהירות לשאוב את HBSS ולהוסיף 300 μL של מדיום הגידול הפנימי של הכנס ו 700 μL של התקשורת הצמיחה החיצוני של הכנס.
- ASCs Resuspend בריכוז המתאים (1 × 4-04 אוקטובר 10 × 4) 200 μL של המדיום צמיחה זרע על CSM בתוך להוסיף את הצלחת התרבות. היקף הסופי של המדיום תוך הוספה התרבות, לאחר זריעה, הוא 500 μL.
- Incubאכלו seeded ASC על CSMs עבור H 24 ב 5% CO 2 באינקובטור humidified ב 37 ° C.
5. קביעת אחוז טוען ASC ו כדאיות התא ב CSMs
הערה: כל הנהלים בוצעו בטמפרטורת החדר אלא אם צוין אחרת.
- לאחר מכן, הדגירה CSM pipet ASC טעונים בצינור 1.5-מ"ל סטרילי microcentrifuge מבלי להפריע את התאים אשר היגרו אל קרום הוספה.
- להסיר את שאריות בינוני ומוסיפים 250 μL של מדיום הגידול טרי הצינור.
- אל צינור זה, להוסיף 25 μL של MTT [3 - (4,5-dimethylthiozole-2-י.ל.) -2,5-diphenyltetrazolium ברומיד] פתרון (5 מ"ג / מ"ל) ו - דגירה של 4 שעות ב CO 5% 2 humidified חממה ב 37 ° C.
- לאחר הדגירה, הסר בינוני, מוסיפים 250 μL של sulfoxide דימתיל, ואת המערבולת התערובת במשך 2-5 דקות כדי solubilize מורכבת formazan.
- בצנטריפוגה CSM על 2700 גרםבמשך 5 דקות, pipet את supernatant ולקבוע ספיגת אורך הגל שלה ב 570 ננומטר ו 630 ננומטר באמצעות קורא צלחת רגילה, על פי מפרט היצרן של MTT.
- לקבוע את מספר הסלולרי הקשורים CSMs יחסית לערכים שהתקבלו מוגדרים מספרי עולה בתרבית לפתח עקומת סטנדרטי.
6. הכנה ואפיון של ASC-CSM משובץ ב-PEG הפיברין ג'ל
הערה: כל הנהלים בוצעו בטמפרטורת החדר אלא אם צוין אחרת.
- פוליאתילן גליקול (PEG) הפיברין (PEG-הפיברין) הידרוג שהוכן על ידי Suggs ואח' 7 על ידי המסת glutarate succinimidyl פוליאתילן גליקול שונה (PEG, 3400 דה). באמצעות 4 מ"ל של לעקר טריס שנאגרו מלוחים (TBS, pH 7.8) ו פילטר עם מסנן 0.22 מיקרומטר, ממש לפני תחילת הניסוי. PEG מומס יעיל רק יישום זה על 3-4 שעות הראשונות.
- מערבבים 500 &MU, אני המניות פיברינוגן (40 מ"ג / מ"ל ב TBS, pH 7.8) ו 250μl מלאי PEG בתרבות גם צלחת 6-גם וגם דגירה של 20 דקות 5% CO 2 באינקובטור humidified ב 37 ° C. תערובת זו מהווה יחס ריכוז טוחנת של 1:10, SG-PEG-SG: פיברינוגן.
- קח 250 μl של ASC-CSM בריכוז של 5 מ"ג של CSM, (≈ 2 × 10 4 תאים) ומערבבים עם פתרון פיברינוגן pegylated.
- מיד להוסיף 1 מ"ל של תרומבין המניות (25U/mL) ובמהירות triturate פעם או פעמיים עם טפטפת. לאחר ערבוב thrombin עם פיברינוגן-PEG, מיד להניח את התערובת תאים ג'ל בצלחת 12-טוב ו מודגרות ב 5% CO 2 באינקובטור humidified על 37 מעלות צלזיוס במשך 10 דקות, כדי לאפשר gelation מלאה. מאז הפעם gelation הוא מהיר, לא ניסו לקיים את הפתרון ג'ל בתוך קצה פיפטה במשך יותר מ 5 שניות. פיברינוגן pegylated הוא ביקע ידי תרומבין ויוצר הידרוג הפיברין pegylated. כמו ה כזה,המוצר הסופי דואר ג'ל המכונה PEG-הפיברין.
- לשטוף את PEG-הפיברין ג'ל פעמיים עם HBSS ו דגירה עם התקשורת אלפא חיוניים מינימליים (α-MEM) השלימו עם FBS של 10% 5% CO 2 באינקובטור humidified ב 37 מעלות ג
- שימו לב נדידת תאים CSM לתוך הג'ל על פני תקופה של 11 יום באמצעות תקן שיטות מיקרוסקופיה אור.
7. הכנה ואפיון של ASC-CSM משובץ ג'ל קולגן
הערה: כל הנהלים בוצעו בטמפרטורת החדר אלא אם צוין אחרת.
- מערבבים ASC-CSM (5 מ"ג המכיל ≈ 2 × 10 4 תאים) עם קולגן סוג 1 (7.5 מ"ג / מ"ל) המופק גידים זנב עכברוש לפי השיטה של בורנשטיין 8 ו לרעוד לאחר התאמת נתוני pH 6.8 כדי שימוש 2N NaOH.
- מוסיפים את תערובת פירפר קולגן-ASC-CSM לצלחת 12-טוב ו דגירה של 30 דק 'ב 5% 2 CO humidified החממה ב 37 ° C.
- לאחר פרפור מלאה, דגירה של קולגן-ASC-CSM ג'ל של עד 11 יום ב 5% CO 2 באינקובטור humidified ב 37 ° C.
- שימו לב נדידת תאים CSM לתוך הג'ל על פני תקופה של 11 יום באמצעות שיטות מיקרוסקופיה רגילות.
8. פיתוח Bilayered PEG-הפיברין-(ASC-CSM), בונה קולגן ג'ל
הערה: כל הנהלים בוצעו בטמפרטורת החדר אלא אם צוין אחרת.
- לפתח bilayer לבנות, להכין הן את הקולגן ואת PEG-הפיברין ג'ל כפי שתואר לעיל, בשינויים קלים. בקצרה, כדי ללמוד את המאפיינים נודדות ושיתוף אינדוקציה של מקור יחיד בתאי גזע באמצעות שני bioscaffolds, "כריך" ASC-CSMs בין הקולגן ואת PEG-הפיברין פיגומים על ידי שימוש בתהליך ארבעה שלבים: 1) טען ASC על CSM, 2) להטיל ג'ל קולגן פירפר את שכבת ASC-CSM חרוזים על collagen ג'ל, 3) PEG-הפיברין יצוקה ג'ל על ג'ל ASC-CSM-קולגן ולאפשר ג'ל לחזק, ו 4) להוסיף בינוני עד טוב להכניס ללמוד תאים במבחנה או להסיר הוספה של יישומים ב vivo (ראה איור 1 ).
- להכין סוג 1-1 מ"ל קולגן (7.5 מ"ג / מ"ל) תערובת כמתואר לעיל 7.1, מבלי להוסיף ASC-CSM לתערובת. מניחים את התערובת להוסיף 6-גם רקמת תרבות (8-מיקרומטר גודל הנקבוביות) ו דגירה של 30 דק 'ב 5% CO 2 באינקובטור humidified ב 37 ° C.
- אחר שכבה שלמה פרפור, על פני 5 מ"ג של קולגן ASC-CSM (10, 000 תאים / מ"ג) תלויה בתקשורת תרבות (200 μl). לאחר microspheres התיישבו על ג'ל, להכין ג'ל PEG-הפיברין כאמור בסעיף 6.0, מבלי להוסיף ASC-CSM לתערובת, שכבת פתרון pegylated פיברינוגן / thrombin על ASC-CSM-קולגן שכבות. בעת הכנת ג'ל PEG-הפיברין, השתמש 250 μl של המדיום תרבית תאים במקום tהוא 250 μl של המדיום שבו נמצאים התאים.
- לאחר השלמת, דגירה המבנים למשך 30 דקות ב 5% CO 2 באינקובטור humidified להשיג gelation שלם לפני האכילה מבנה בינוני עם התרבות.
- לאחר gelation מלאה, מקום 1 מ"ל של מדיום בחדר העליון על מבנה ו 3 מ"ל של מדיום בתא התחתון.
9. ביצוע פתרונות מניות
הערה: כל הנהלים בוצעו בטמפרטורת החדר אלא אם צוין אחרת.
- סידן כלוריד המניות (40 מ"מ): השתמש רק CaCl 2 0.2 H 2 O. ממיסים 588.4 מ"ג של CaCl 2 0.2 H 2 O עם 100 מ"ל מים deionized. לעקר באמצעות מסנן 0.22-מיקרומטר.
- פוליאתילן גליקול: PEG הוא תגובתי עם חמצן יכול להיות מחומצן כאשר נחשף לאוויר החדר. ככזה, PEG יש לאחסן מתחת חנקן (N 2) אווירה. ACCurately שוקל 32 מ"ג בצינור 2-ml צנטריפוגות (לוודא לטהר את הצינורות עם N 2 לפני השימוש) ולאחסן ב -80 ° C עד מוכן לשימוש. להמיס 32 מ"ג של PEG ב 4 מ"ל של תמיסת כפות לפני השימוש.
הפתרונות הבאים חייב להיות טרי לפני כל ניסוי. - כפות פתרון: (pH 7.75-7.77 במהירות של 25 ° C, ה-pH של 25 ° C חיוני מאוד). להכין 15 מ"ל של תמיסת TBS, בזהירות לפזר טבליה אחת למאגר מים, מסנן עיקור deionized ולהתאים את ה-pH הנדרש. אין לאחסן את מלאי פתרון להכין אותו טרי בכל פעם.
- פתרון פיברינוגן: (40 מ"ג / מ"ל). לפזר אבקת פיברינוגן ב TBS לעשות ריכוז פיברינוגן 40 מ"ג / מ"ל. לפזר אותו בין לילה באמצעות stirrer מגנטי ב 4 ° C. קל יותר לפרק את כל כמות 1-g עם הסכום הנדרש של TBS. למחרת, הסר פיברינוגן מ 4 ° C (בדרך כלל מעונן) ולאפשר לולחמם באמבט מים עד פתרון אחיד מתקבל. לבסוף, לסנן לעקר פיברינוגן באמצעות מסנן 0.45-מיקרומטר.
- פתרון תרומבין (25 יחידות למ"ל): כדי להפוך את הפתרון תרומבין, לשקול את הסכום הנדרש לפרק 40 מ"מ מוכן CaCl 2 0.2 H 2 O. זה תמיד מומלץ להשתמש בקבוקון שלם של תרומבין לעשות המניות. דוגמה: להמיס בקבוק 5 KU thrombin עם 200 מ"מ של CaCl 2 0.2 H 2 O, aliquot וחנות ב -20 ° C.
10. נציג תוצאות
המטרה הכללית של הטכניקה המוצגת כאן היא להדגים את הפוטנציאל של בידול מטריקס מונחה סימולטני של ASC אל פנוטיפים מרובים באמצעות CSM ככלי משלוח. אנחנו מדגימים אסטרטגיה במבחנה לספק בתאי גזע CSMs אל bilayered קולגן-PEG-הפיברין הפיגום. אפיון ASC מוטבע בתוך זה reveale פיגוםד כי ASC טעונים CSMs ניתן "דחוקה" בין שכבת קולגן PEG-הפיברין בו זמנית באופן דיפרנציאלי את האות משני סביבות תאיים לשגשג בתנאים החדשים. אנחנו הראשונים שאפיינו את היכולת של מערכת מודל לשמור על יכולת הקיום של תאים יכולות הנדידה. קולגן נתמך היכולת של ASCs לשמור על "stemness," שלהם כפי שהודגם על ידי הביטוי שלהם Stro-1 ומורפולוגיה פיברובלסטים כמו שלהם (איור 2 ד ו 2F). לעומת זאת, גרמו PEG-הפיברין את ASCs להבדיל כלפי פנוטיפ כלי הדם, כפי שעולה ידי המורפולוגיה שלהם, מבנה דמוי צינור, תא ספציפי ביטוי האנדותל שלהם גורם Willebrand פון (2E איור ו 2G), ו pericyte ספציפי ביטוי של NG2 ו-derived טסיות גורם הגדילה לקולטן בטא (PDGFRβ) (מידע לא מוצג). יתר על כן, אלו פנוטיפים הנצפות נראה להתרחש בשלב מוקדם של התרבות נשמרו על 11 ימים, כמו demonstrated באיור 3.
טבלאות ומספרים
היתרונות של בניית bilayer:
- לבד פיגום ללא תאים יכולים לבצע כמו פיגום ביו.
- PEG-הפיברין יכול לגרום לתאי גזע להבחין ללא תוספת של גורמי גדילה.
- קולגן יכול לסייע בשמירה על תא גזע הפנוטיפ של ASCs.
- מבנה bilayer יכול לשמש מצע פעיל סוגי תאים אחרים כדי להעביר מתרבים (למשל לתאי אנדותל, פיברובלסטים, קרטינוציטים, לתאי שריר חלק, pericytes).
- ניתן להשתמש בו עם רקמה קשה כמו עצם פיגומים הנדסה hydroxyaptite או demineralized כדי לחדש רקמות רך וקשה.
- זה יכול לשמש לפיתוח רב שכבתית, לבנות רקמות מגוון מהונדסים (כמו עורי, כלי דם, כלי דם, אפיתל, עורי, כלי דם, hypodermal וכו ').
- היא משתמשת מקור יחיד תאים בו זמנית לפתחמדורים תאיים.
- יש לו את הפוטנציאל לשלב עם רקמת המארח שכן הוא מקור טבעי.
- CSM בתוך מבנה ג'ל מספק פלטפורמה עבור תאים לעבור מ.
- Chitosan, נהגה להכין את CSM, הוא ידוע פעיל הכימותרפיה attractant.
- הרעיון הכללי ליישם פרוטוקול זה של "בידול מטריקס מונע בתאי גזע" ניתן להחיל סוגי תאים אחרים גזע. עם זאת, מחקר נוסף מתבקשת לקבוע את הכדאיות של בידול מטריקס מונחה. Bilayered ג'ל הפיגום יכול לשמש כמאגר כדי לספק את התאים בצורה מתמשכת ומבוקרת.
- לאחר השיקום, הג'לים עדיין יכול להפריד למרכיבים בודדים.
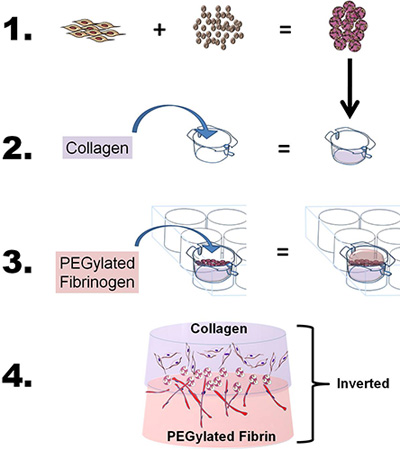
באיור 1. סכמטי המתאר את המטרה הכללית תהליך של הטכניקה. 1) השומן שמקורם בתאי גזע (ASCs) הם loaded על chitosan microspheres. 2) קולגן הוא שפך לתוך הוספת 6-היטב, pH מותאם לרעוד קולגן, וכן הוספה להציב לתוך חדר 6-גם צלחת. ASC טעונים התחומים CSM בשכבות אז על קולגן. 3) פיברינוגן pegylated ואז הוא שפך על קולגן (ASC-CSM) ו בג'ל על ידי תוספת של תרומבין. 4) מבנה bilayer הסופי לאחר מכן ניתן להסיר את הכנס תרבות להשתמש במבחנה או ניתוח vivo.
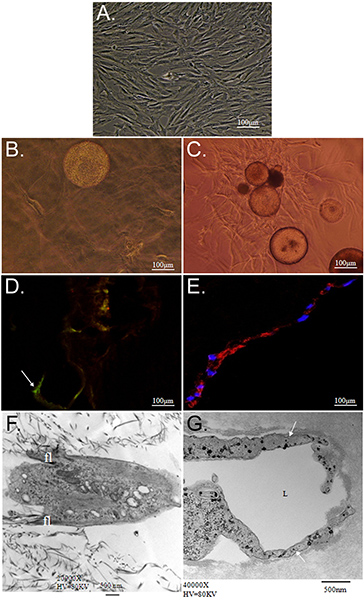
איור 2. אפיון ASC בתרבית בתוך קולגן PEG-הפיברין מטריצות 3D. א) שלב, לעומת זאת photomicrograph של מבודד ASC passaged ומתוחזק באמצעות שגרת 2 ממדי תרבות טכניקות סלולריים. Photomicrographs B, D, ו-F מתארים ASC-CSM בתרבית בתוך ג'ל 3 מימדי הקולגן, ואילו C, E, ו-G Show ASC-CSM בתרבית בתוך 3 מימדי PEG-הפיברין ג'ל, הן ביום 12. ב B ו-C), ASCs מוצגים נודדות הרחק מתחום CSM בשני סוגי הפיגום. ASCs נראה כי שטוח, ציר כמו המורפולוגיה של קולגן (ב '), תוך שמירה על הביטוי שלהם סמן לתאי גזע Stro-1 (D, חץ). כאשר בתרבית PEG-הפיברין ASCs להפגין יותר מבנים דמויי צינור והם גרמו להביע כאלה סמנים סלולריים כלי דם כגורם Willebrand פון (ה). במיקרוסקופ אלקטרונים הילוכים מתאר מורפולוגיה טיפוסית שמפגינים ASCs בתוך כל הפיגום. ASCs ב ג'ל קולגן נראה כי filopodia קטן יותר (פלורידה) המשתרעת הגוף של התא (F), ואילו ASCs נוצר בדרך כלל lumenal (שכותרתו L) מבנים (G; החץ).
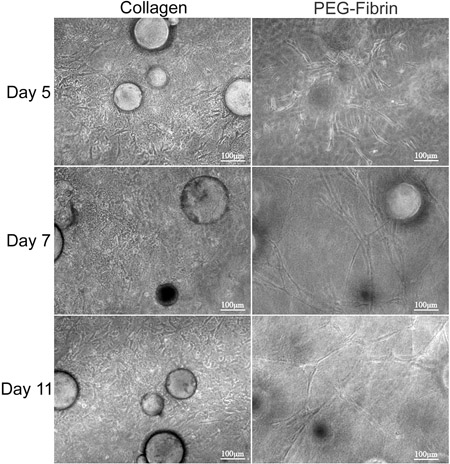
איור 3. ניתוח מורפולוגי של ASC-CSMs בין bilayers הקולגן PEG-הפיברין ג'לים. ASC-CSMs היו "דחוקה" בין קולגן PEG-הפיברין ג'ל ומתוחזק בתרבות במשך 11 ימים. שמאל column מתאר ASCs נודדות, מתרבים בתוך מטריצת הקולגן ומופיעים לקחת על מורפולוגיה ציר דמוי. העמודה הימנית מתארת ASCs נודדות הרחק CSMs את ויוצרים צינור כמו מבנים ברחבי ג'ל PEG-הפיברין.
Discussion
ASCs ידועים, כדי להקל על הבידוד שלהם היכולת להבדיל כלפי סוגי תאים שונים. עם הטכניקות המתוארות בכתב היד הזה, אנו יכולים לנצל את הגמישות של ASCs ידי חשיפת תאים אלה כדי biomatrices מרובים בו זמנית. כמו תאים נודדים הרחק מבסיס CSM שלהם ולהיכנס סביבתו שלהם תאיים, התאים את הרמז מן הפיגום...
Disclosures
אין אינטרסים כלכליים מתחרים קיימים.
הבהרה
חוות הדעת או וטיעונים הכלולות במסמך זה הן את הדעות הפרטיות של הכותבים ואינם להתפרש הרשמי או משקף את הדעות של משרד הביטחון או ממשלת ארה"ב. הכותבים הם עובדי ממשלת ארה"ב, ואת העבודה הזאת הוכנה במסגרת תפקידיהם הרשמיים. כל עבודה נתמך על ידי הצבא האמריקני למחקר רפואי ו פיקוד אמצעי. המחקר נערך תחת פרוטוקול נבדקה ואושרה על ידי הצבא האמריקני למחקר רפואי ו פיקוד אמצעי ביקורת מוסדי ראשי ועל פי פרוטוקול שאושר.
Acknowledgements
SN נתמך על ידי מענק מלגה דוקטורים מן היוזמה הנדסת רקמות פיטסבורג. Doz נתמך על ידי מענק הוענק מטעם קרן ז'נבה.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב / ציוד | חברה | מספר קטלוגי | תגובות |
| הנקס תמיסת מלח מאוזנת (HBSS) | Gibco | 14175 | מתכלים |
| בסרום שור עוברית | Hyclone | SH30071.03 | מתכלים |
| Collagenase Type II | Sigma-Aldrich | C6685 | מתכלים |
| 70 מיקרומטר קווי ניילון מסנן | BD Biosciences | 352350 | מתכלים |
| 100 מיקרומטר קווי ניילון מסנן | BD Biosciences | 352360 | מתכלים |
| בינוני MesenPRO צמיחה מערכת | Invitrogen | 12746-012 | מתכלים |
| L-גלוטמין | Gibco | 25030 | מתכלים |
| CaCl 2 0.2 H 2 O | סיגמא | C8106 | מתכלים |
| T75 בתרבית רקמה Flask | BD Biosciences | 137787 | מתכלים |
| Chitosan | Sigma-Aldrich | 448869 | מתכלים |
| חומצה אצטית | Sigma-Aldrich | 320099 | מתכלים |
| N-Octanol | Acros Organics | 150630025 | מתכלים |
| Sorbitan-Mono-Oleate | Sigma-Aldrich | S6760 | מתכלים |
| אשלגן הידרוקסיד | Sigma-Aldrich | P1767 | מתכלים |
| אצטון | פישר סיינטיפיק | L-4859 | מתכלים |
| אתנול | Sigma-Aldrich | 270741 | מתכלים |
| Trinitro Benzenesulfonic חומצה | Sigma-Aldrich | P2297 | מתכלים |
| מימן כלורי | Sigma-Aldrich | 320331 | מתכלים |
| אתיל Ether | Sigma-Aldrich | 472-484 | מתכלים |
| 8-מיקרומטר בתרבית רקמה הוספת פלייט | BD Biosciences | 353097 | מתכלים |
| 1.5-מ"ל Microcentrifuge צינורות | דיג | 05-408-129 | מתכלים |
| MTT מגיב | Invitrogen | M6494 | מתכלים |
| דימתיל Sulfoxide | Sigma-Aldrich | D8779 | מתכלים |
| תא Qtracker סימון Kit (שגשש 655) | בדיקות מולקולריות | Q2502PMP | מתכלים |
| הקלד 1 קולגן | Travigen | 3447-020-01 | מתכלים |
| סודיום הידרוקסיד | Sigma-Aldrich | S8045 | מתכלים |
| 12 ובכן בתרבית רקמה צלחות | BD Biosciences | 353043 | מתכלים |
| פיברינוגן | סיגמא | F3879 | מתכלים |
| תרומבין | סיגמא | T6884 | מתכלים |
| נגזרת Benztriazole של פוליאתילן | Sunbio | DE-034GS | מתכלים |
| טריס מאגר Tablet (pH 7.6) | סיגמא | T5030 | מתכלים |
| סרכזת | Eppendorf | 5417R | שוהpment |
| Orbital שאכר | ניו ברונסוויק Scienctific | C24 | ציוד |
| החממה Humidified עם האוויר CO-5% 2 | Thermo Scientific | דגם 370 | ציוד |
| תקורה stirrer | איקא | Visc6000 | ציוד |
| מגנטית stirrer | קורנינג | PC-210 | ציוד |
| אבק תא ייבוש | - | - | ציוד |
| גודל החלקיקים Analyzer | Malvern | STP2000 Spraytec | ציוד |
| מי האמבט | פישר סיינטיפיק | Isotemp210 | ציוד |
| ספקטרופוטומטר | Beckman | Beckman Coulter DU ספקטרופוטומטר 800UV/Visible | ציוד |
| מערבולת | Diagger | 3030a | ציוד |
| Microplate Reader | התקנים מולקולריים | SpectraMax M2 | ציוד |
| אור / מיקרוסקופ פלואורסצנטי | אולימפוס | IX71 | ציוד |
| Confocal מיקרוסקופ | אולימפוס | FV-500 סריקת לייזר מיקרוסקופ Confocal | ציוד |
| סריקת מיקרוסקופ אלקטרונים | Carl Zeiss MicroImaging | ליאו 435 סמנכ"ל | ציוד |
| מיקרוסקופ אלקטרונים הילוכים | JEOL | JEOL 1230 | ציוד |
References
- Natesan, S. A bilayer construct controls adipose-derived stem cell differentiation into endothelial cells and pericytes without growth factor stimulation. Tissue Eng. Part A. 17, 941-953 (2011).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J Biomed Mater Res A. 81, 259-268 (2007).
- Willerth, S. M., Sakiyama-Elbert, S. E. Combining stem cells and biomaterial scaffolds for constructing tissues and cell delivery. , (2008).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, M. C. The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Zhang, G. A PEGylated fibrin patch for mesenchymal stem cell delivery. Tissue Eng. 12, 9-19 (2006).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Zhang, G. Vascular differentiation of bone marrow stem cells is directed by a tunable three-dimensional matrix. Acta Biomater. 6, 3395-3403 (2010).
- Rochon, M. H. Normal human epithelial cells regulate the size and morphology of tissue-engineered capillaries. Tissue Eng. Part A. 16, 1457-1468 (2010).
- Liu, H., Collins, S. F., Suggs, L. J. Three-dimensional culture for expansion and differentiation of mouse embryonic stem cells. Biomaterials. 27, 6004-6014 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved